Современные принципы и методики ирригации корневых каналов
Анализ причин неудач эндодонтического лечения привел к некоторому переосмыслению значения отдельных его этапов. Биологические предпосылки, такие как сложность внутренней морфологии зуба, а также внутриканальная биопленка заставляют вести поиск новых эффективных методов очистки корневых каналов. И в связи с этим на первый план выходит проблема качественной ирригации корневых каналов, как залога успешной эндодонтии. В статье приведены классификация и краткое описание основных методик ирригации в эндодонтии, даны практические рекомендации по применению наиболее популярных из них.
О борьбе с инфекцией в сложных корневых каналах на вебинаре Ирригация системы корневых каналов.
Очистка системы корневых каналов
Если проанализировать научную эндодонтическую литературу за последние несколько лет, становится совершенно очевидно, что в процессе эндодонтического лечения этапу ирригации уделяется огромное значение. Очистка системы корневых каналов от остатков пульпы, микроорганизмов и их токсинов является ключевым моментом лечения, без которого невозможно надеяться на успешный результат.
Начало клинического применения вращающихся NiTi инструментов сопровождалось некой «эйфорией», обусловленной «практически неограниченными возможностями» этих инструментов. Действительно, большая часть работ указывает на значительную разницу в качестве препарирования корневого канала, выполненного ручными инструментами и вращающимися NiTi системами. Тем не менее использование современных методов исследования, таких как электронная микроскопия, микрокомпьютерная томография, микробиологические пробы и т.д. показали, что качественно очистить систему корневых каналов только за счет механического удаления инфицированного дентина и остатков пульпы ручными или машинными эндодонтическими инструментами не представляется возможным. (Dalton et al., 1998; Peters, 2001; Nair et al., 2005).
Строение системы корневых каналов
На сегодняшний день, эндодонтическая наука располагает обширными сведениями о строении системы корневых каналов. Известно, что внутренняя морфология зуба чрезвычайно сложна и разнообразна. Идеально круглый в поперечном сечении, конусовидный корневой канал с одним апикальным отверстием является, пожалуй, редким исключением, нежели правилом. В подавляющем большинстве случаев каналы имеют неправильную форму, различный диаметр в букколингвальном и мезиодистальном направлении, многочисленные поднутрения, так называемые «плавники» (Рис.1, 2). Часто встречаются овальные или с-образные каналы. Кроме того, от основного канала на разных уровнях отходит множество латеральных канальцев. Латеральные канальцы встречаются и в области бифуркаций и трифуркаций многокорневых зубов. Между корневыми каналами имеются многочисленные анастомозы и перешейки, которые особенно часто встречаются, например, между мезиальными каналами моляров нижней челюсти. Очень сложна морфология апикальной трети корня. Известно, что основной канал в апикальной части образует дельту и открывается на верхушке корня не одним, а несколькими апикальными отверстиями. Исходя из вышесказанного, становится очевидным, что такую сложную систему не представляется возможным очистить только механическим способом. В связи с этим, огромное значение приобретает качественная и эффективная ирригация корневых каналов.
Рисунок 1. Проксимальный отдел овального канала премоляра нижней челюсти (так называемый «плавник»).

Рисунок 2. Перешеек, соединяющий щечный и небный каналы премоляра верхней челюсти.
Внутриканальная биопленка
Другой важнейшей проблемой в дезинфекции корневых каналов является внутриканальная биопленка. Ее роль в прогнозе эндодонтического лечения сложно переоценить. Согласно современной концепции, микроорганизмы в корневых каналах присутствуют в виде бактериальной биопленки, что существенно изменяет их свойства и затрудняет их элиминацию из системы корневых каналов. Биопленка представляет собой сообщество микроорганизмов, окруженных внеклеточным полисахаридным матриксом и прикрепленных к влажной поверхности. Биопленка защищает присутствующие в ней микроорганизмы от воздействия неблагоприятных факторов, создает благоприятные условия для размножения, полисахаридный матрикс препятствует проникновению внутрь биопленки антибактериальных агентов, тем самым, повышая резистентность микробов к антисептикам и антибиотикам. Поэтому для элиминации биопленки необходимо сочетание как механического фактора, способного разрушить структуру биопленки, так и дезинфицирующего агента, уничтожающего входящие в ее состав микроорганизмы.
Таким образом, ирригация преследует две важнейшие цели:
- очищение системы корневых каналов за счет химического растворения органических и неорганических остатков, а также механического их вымывания струей жидкости;
- дезинфекция системы корневых каналов.
В связи с этим очистку системы корневых каналов следует рассматривать как важнейший этап эндодонтического лечения, оказывающий существенное влияние на его прогноз. В свою очередь качественное препарирование и формирование корневого канала способствует созданию необходимого резервуара для ирригационного раствора и возможностей для его активации.
Все ирригационные техники можно разделить на 5 групп (Van der Sluis, 2007):
- ручная;
- ультразвуковая;
- звуковая (EndoActivator);
- лазерная (раствор активизируется лазером);
- гидродинамическая (RinsEndo, EndoVac).
Традиционные методы ирригации с помощью шприца и эндодонтической иглы обеспечивают удовлетворительную обработку корональной и средней трети корневого канала, но не обладают достаточной эффективностью с точки зрения очистки его стенок в области апекса (O’Connel, 2000). Для успешной ирригации необходимо, чтобы дезинфицирующий раствор доставлялся на всю рабочую длину корневого канала. Этого не всегда удается добиться с помощью классических эндодонтических шприцов и игл, так как в узких корневых каналах благодаря поверхностному натяжению ирригационный раствор не доходит до апекса, оставляя так называемый «воздушный пузырь». В результате этого апикальная часть корневого канала остается недостаточно обработанной.
Существует ряд простых правил и приемов, которые позволяют сделать ирригацию с помощью шприца более эффективной и предсказуемой.
Эффективность данного вида ирригации ограничивается расстоянием 3-4мм от кончика иглы (Sedgley et al., 2005). Следовательно, чем ближе игла продвинута к апексу, тем выше качество очистки канала. С другой стороны вероятность выведения ирригационного раствора за пределы апекса при этом также возрастает. С целью профилактики данного осложнения, очень важно иметь некоторое расстояние между кончиком иглы и стенкой корневого канала (Рис.3а, б).
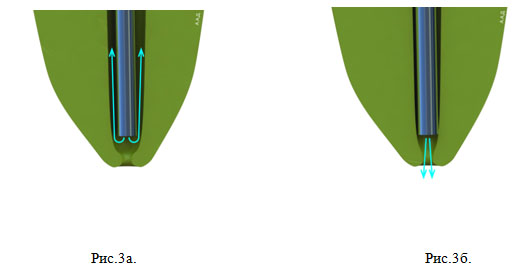
Рисунок 3. Движение ирригационного раствора в корневом канале: а – в широком корневом канале раствор распространяется вдоль стенок по направлению к устью канала; б – в узком корневом канале отсутствует пространство между стенкой канала и кончиком иглы и раствор под давлением выводится в периапикальные ткани.
Следующим важным моментом являются движения иглы во время введения ирригационного раствора, а также положение шприца. Ирригационный раствор должен выводиться медленно, аккуратно, при этом игла должна совершать возвратно-поступательные движения. Давить на поршень шприца рекомендуется не большим, а указательным пальцем, так как тактильный контроль при этом значительно улучшается (Рис. 4а, б).
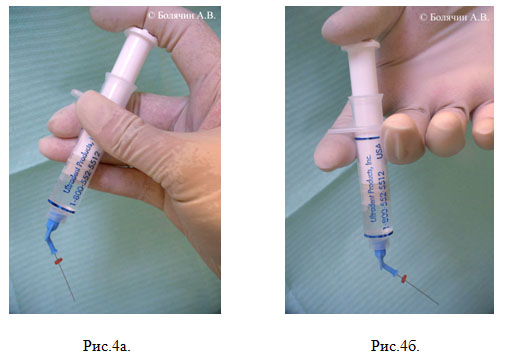
Рисунок 4. Положение пальцев и шприца при выполнении ирригации ручным способом: а – правильное; б – неправильное.
Глубина проникновения иглы, в свою очередь, обуславливается следующими факторами:
- Величиной апикального препарирования.
- Конусностью канала.
- Диаметром иглы.
Оптимальная величина апикального препарирования для выполнения эффективной ирригации должна составлять 30-40 по ISO (Hsieh et al., 2007). Схематично соотношение апикального размера и конусности можно представить следующим образом (Рис.5).
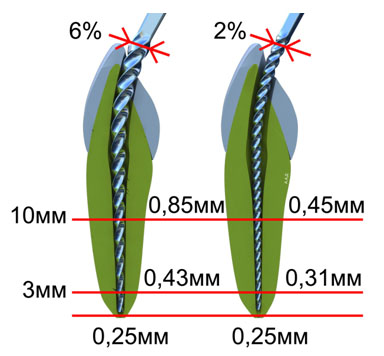
Рисунок 5. Зависимость диаметра корневого канала на различных уровнях от конусности применяемого инструмента (пояснение в тексте).
После завершения препарирования канала ручным файлом №25 (конусность 2%) можно предположить, что его диаметр на расстоянии 3мм от верхушки будет 0,31мм (0,25+0,02×3). При использовании же вращающегося никель-титанового инструмента с таким же размером верхушки, но конусностью 6%, диаметр канала на этом же уровне будет составлять уже 0,43мм (0,25+0,06×3). На расстоянии 10мм от верхушки, разница будет еще более значительной – 0,45 и 0,85мм соответственно. Таким образом, выраженная конусность значительно улучшает эффективность ирригации, создавая дополнительное депо для раствора и позволяя ему действовать на всем протяжении канала (Рис.6).
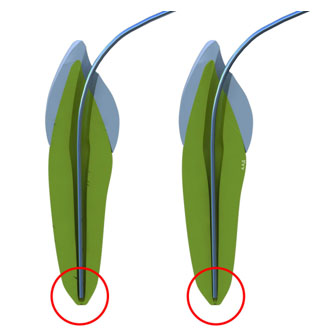
Рисунок 6. Применение конусных инструментов для обработки корневого канала повышает эффективность ирригации за счет создания резервуара для ирригационного раствора.
Следующим важным фактором является диаметр иглы. Диаметр игл принято измерять в единицах, называемых gauge. Наиболее часто используются эндодонтические иглы диаметром 27 gauge. Следует помнить, что при определении размера игл, наблюдается обратная зависимость. Чем больше цифра в gauge, тем меньше диаметр иглы (Таблица 1). Тонкие иглы Endo-Eze Tips и NaviTip (Ultradent) имеют диаметр 29 gauge (0,28мм), что позволяет продвинуть ее максимально к апексу (Рис.7).
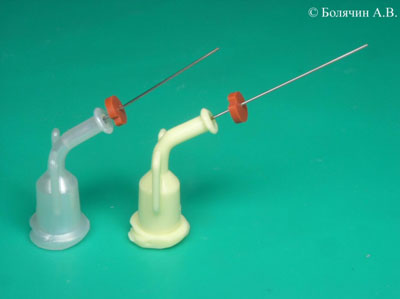
Рисунок 7. Ирригационные иглы NaviTip (Ultradent).
Очень важной характеристикой является гибкость иглы и возможность предварительно согнуть ее при работе в канале с выраженной кривизной.
Таблица 1. Соотношение диаметра эндодонтических игл в gauge и миллиметрах.
| gauge | мм |
| 23 | 0,57 |
| 25 | 0,45 |
| 27 | 0,36 |
| 29 | 0,28 |
| 30 | 0,25 |
Для повышения эффективности ручной (выполняемой с помощью шприца) ирригации, может использоваться гуттаперчевый штифт, при помощи которого производится механическая активация ирриганта в пульпарной полости и корневых каналах (Machtou, 1980) (Рис.8а, б).
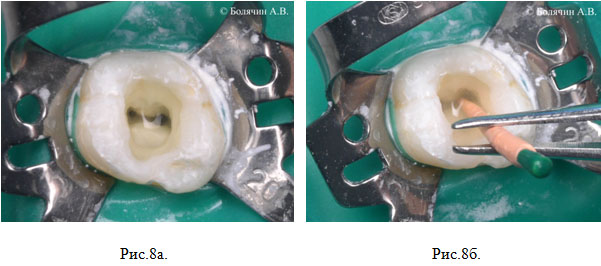
Рисунок 8. Активация ирригационного раствора с помощью гуттаперчевого штифта (по П. Машту): а – прозрачный раствор заполняет корневые каналы и пульпарную камеру; б – помутнение раствора свидетельствует о его активности.
Компания Ultradent предлагает эндодонтическую насадку NaviTip FX, представляющую собой одновременно и иглу, и щеточку для механической активации раствора. Используя NaviTip FX можно одновременно проводить этап ирригации и механического очищения канала от опилок, старого пломбировочного материала или гидроокиси кальция (Рис.9, 10).
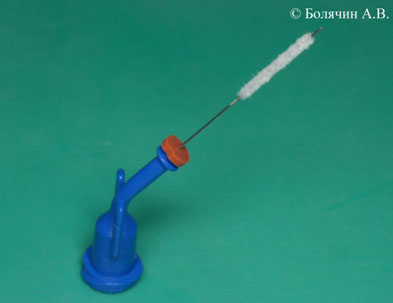
Рисунок 9. Эндодонтическая насадка NaviTip FX (Ultradent) одновременно представляет собой иглу для промывания и щеточку для механической активации ирригационного раствора.
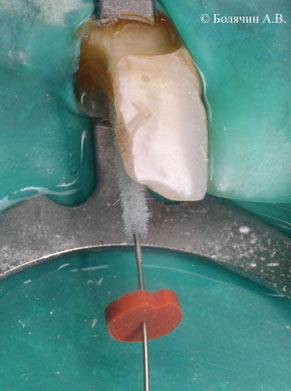
Рисунок 10. Удаление временного пломбировочного материала из корневого канала при помощи насадки NaviTip FX (Ultradent).
Ультразвуковая ирригация
Очень эффективным методом активации ирригационного раствора является применение пассивного ультрасонирования. При пассивной ультразвуковой ирригации в наполненный раствором корневой канал вводится тонкая проволока или файл небольшого размера, например №15 или 20 (Рис.11).

Рисунок 11. Ультразвуковая насадка для проведения пассивного ультрасонирования.
Ультразвуковые колебания и энергия файла передаются на жидкость, что вызывает возникновение так называемой акустической кавитации. В момент разрежения в интенсивной звуковой волне возникают кавитационные пузырьки, которые резко схлопываются при переходе в область повышенного давления. В кавитационной области возникают мощные гидродинамические микроударные волны и микропотоки. Кроме того, схлопывание пузырьков сопровождается сильным локальным разогревом жидкости и выделением газа. Такое воздействие приводит к разрушению даже таких прочных веществ, как сталь и кварц. Если в качестве раствора при проведении пассивной ультразвуковой ирригации применяется гипохлорит натрия, то его антибактериальный эффект значительно усиливается. Помимо этого играет важную роль и локальное повышение температуры. Благодаря этим эффектам происходит удаление дентинных опилок, тканей пульпы и внутриканальной биопленки (в том числе, благодаря растворяющему действию NaOCl). Для того чтобы удалить из канала эту взвесь, необходимо 2 мл свежего раствора, который вводится из шприца.
Практические рекомендации для выполнения ультразвуковой ирригации:
- размер ультразвукового файла не должен быть более 15, 20 по ISO;
- используемые файлы не должны иметь режущую поверхность для профилактики транспортации канала (Рис.12);
- файл должен вводиться в канал на 1,5 — 2мм не достигая рабочей длины (Рис.13);
- важно ограничивать возвратно-поступательные движения инструмента в канале и всегда предварительно изгибать файл при работе в искривленных корневых каналах с целью профилактики апикальной перфорации и образования ступенек;
- раствор озвучивается 3 раза по 20 секунд, с обязательным обновлением ирриганта в объеме 1,5 -2 мл.
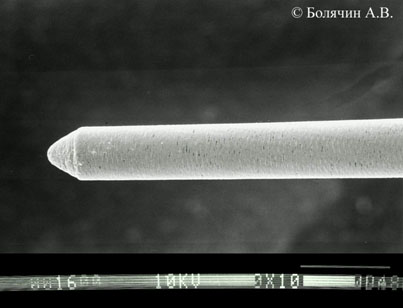
Рисунок 12. Электронограмма ультразвукового файла для проведения пассивного ультрасонирования. Обратите внимание на отсутствие режущих граней и неагрессивный кончик инструмента.

Рисунок 13. Методика проведения пассивной ультразвуковой ирригации. Файл введен в канал на 2мм короче рабочей длины.
Помимо ультразвуковой энергии для активации раствора ирриганта в корневом канале применяются также звуковые колебания. Звуковые приборы по сравнению с ультразвуковыми генерируют колебания меньшей частоты, но большей амплитуды. Как результат, точечный контакт звуковой насадки со стенкой корневого канала фактически не влияет на эффективность ее работы в отличие от ультразвуковых насадок. Ряд исследователей показали, что звуковая активация раствора улучшает качество ирригации корневых каналов по сравнению с ручной методикой (Walmsley et al., 1989; Jensen et al.,1999; Pitt, 2005; Caron, 2007). Примером звуковой системы для использования в эндодонтии является EndoActivator (Advanced Endodontics). Интересной конструкционной особенностью данной системы является то, что в ней используются специальные полимерные насадки, которые не обладают режущими свойствами и как следствие, позволяют избежать таких осложнений, как формирование ступеньки, транспортации, перфорации стенок корневого канала (Ruddle, 2008). Кроме того, насадки являются одноразовыми и могут быть легко подобраны и обрезаны в зависимости от длины и диаметра корневого канала. С другой стороны, качество обработки апикальной части корневых каналов с помощью звуковой активации все же значительно уступает таковой при использовании пассивного ультрасонирования (Sabins, 2003).
Для повышения качества обработки апикальной трети корня также была разработана система RinsEndo (Dürr Dental, Germany). RinsEndo представляет собой наконечник, накручивающийся на турбинный привод стоматологической установки и использующий давление сжатого воздуха для продвижения ирригационного раствора в апикальную часть корневого канала. Исследование, проведенное V.Hauser и коллегами, продемонстрировало высокую эффективность очистки стенок корневого канала с помощью данной системы по сравнению с традиционными ручными шприцами (Hauser et al., 2007). Но в то же время, данная работа показала, что использование наконечника RinsEndo значительно увеличивает вероятность выведения ирригационного раствора за пределы апекса (80% против 13% при использовании обычного шприца), что особенно опасно при применении в качестве ирриганта раствора гипохлорита натрия в связи с возможностью возникновения серьезных осложнений.
EndoVac
Другим вариантом решения проблемы недостаточной очистки апикальной трети корневого канала является применение систем, основанных на создании в канале отрицательного давления. Примером такой системы может служить EndoVac (Discus Dental). Основой традиционных методов ирригации является пассивное введение раствора ирриганта в корневой канал под действием позитивного давления, прикладываемого к поршню шприца. Принцип действия системы EndoVac основан на движении ирригационного раствора за счет создания отрицательного давления в корневом канале. Одна из насадок, подающая ирригационный раствор, вводится в полость зуба на небольшую глубину, в то время как другая канюля, осуществляющая аспирацию, вводится в корневой канал на всю рабочую длину. В результате подаваемый раствор за счет отрицательного давления проникает в корневой канал на всю рабочую длину без риска выведения за пределы апекса. Преимущества данной методики по сравнению с традиционным методом ирригации подтверждены рядом научных исследований (Fukumoto et al., 2006; Nielson et. al., 2007).
Относительно новым и интересным направлением в ирригации корневых каналов является фотоактивируемая дезинфекция (PAD или PDT). Суть метода заключается во введении в корневой канал специального красителя – фотосенситайзера с последующим облучением с помощью лазерного излучения малой мощности с определенной длиной волны. Светочувствительные молекулы красителя (чаще всего для этих целей используется толониум хлорид или TBO) прикрепляются к мембране бактериальной клетки или даже проникают внутрь нее. Затем под действием лазерного излучения с определенной длиной волны (для толония хлорида она составляет 633 нм) запускается цепь химических реакций, результатом которых является образование свободных радикалов, а именно синглетного кислорода. Эти активные радикалы вызывают нарушение целостности клеточной стенки бактерий, инактивацию бактериальных токсинов, деградацию важнейших протеинов и молекул ДНК, следствием чего является гибель бактериальной клетки (Bergmans L., 2006). Высокая антибактериальная активность PAD как в отношении взвешенных культур, так и в отношении бактериальной биопленки продемонстрирована в ряде работ (Bonsor et.al., 2006; Williams et al., 2006; Soukos et al., 2006). Ключевым моментом данной методики является непосредственный контакт молекул фотосенситайзера с бактериальной клеткой, его проникновение внутрь бактериальной биопленки. Следовательно, как и в случае применения традиционных методов ирригации, актуальной остается проблема доставки ирриганта (красителя) в труднодоступные уголки системы корневых каналов.
В заключение хотелось бы еще раз отметить, что на сегодняшний день стратегия эндодонтического лечения все больше склоняется к использованию концепции биологической целесообразности проводимого вмешательства. Такой подход, в свою очередь, привел к необходимости совершенствования методов борьбы с внутриканальной биопленкой, как основной причиной неудач эндодонтического лечения. И ключевым моментом в этой борьбе является именно качественная ирригация системы корневого канала.
Сочетания растворов с различными инструментальными системами подробно рассмотрено на вебинаре Новейший подход в ирригации: инструменты и протоколы.
Используемая литература:
- Bonsor S.J., Nichol R., Reid T.M., Pearson G.J. Microbiological evaluation of photo-activated disinfection in endodontics (an in vivo study). Br Dent J, 2006; 200 (6): 337-241.
- Caron G. Cleaning efficiency of the apical millimeters of curved canals using three different modalities of irrigant activation: an SEM study. Paris VII University, Paris, France: Masters thesis; 2007.
- DaltonC., Orstavik D., Phillips C., Pettiette M., Trope M. Bacterial reduction with nickel-titanium rotary instrumentation. J Endod, 1998; 24 (11): 763-767.
- Fukumoto Y., Kikuchi , Yoshioka T., Kobayashi C., Suda H. An ex vivo evaluation of a new root canal irrigation technique with intracanal aspiration. Int Endod J, 2006; 39(2): 93-99.
- Hauser V., Braun A., Frentzen M. penetration depth of a dye marker into dentine using a novel hydrodynamic system (RinsEndo). Int Endod J, 2007; 40 (8): 644-652.
- Hsieh Y.D., Gau C.H., Kung Wu S.F., Shen E.C., Hsu P.W., Fu E. Dynamic recording of irrigation fluid distribution in root canals using thermal image analysis. Int Endod J, 2007; 40 (1): 11-17.
- Jensen S.A., Walker T.L., Hutter J.W., Nicoll B.K. Comparison of the cleaning efficacy of passive sonic activation and passive ultrasonic activation after hand instrumentation in molar root canals. J Endod, 1999; 25 (11): 735-738.
- Bergmans L., Moisiadis P., Teughels W., Van Meerbeek B., Quirynen M., Lambrechts P. Bactericidal effect of Nd:YAG laser irradiation on some endodontic pathogens ex vivo. Int Endod J, 2006; 39 (7): 547-557.
- Machtou P. Irrigation in endodontics. Actual Odontostomatol, 1980; 34 (131): 387-394.
- Nair P.N., Henry S., Cano V., Vera J. Microbial status of apical root canal system of human mandibular first molars with primary apical periodontitis after “one-visit” endodontic treatment. Oral Surg, Oral Med, Oral Pathol, Oral Radiol, Endod, 2005; 99 (2): 231-252.
- Nielsen B.A., Craig Baumgartner J. Comparison of the EndoVac system to needle irrigation of root canals. J Endod, 2007; 33 (5): 611-615.
- O’Connell M.S., Morgan A., Beeler W.J., Baumgartner J. A comparative study of smear layer removal using different salts of EDTA. J Endod, 2000; 263 (12): 739-743.
- Peters O.A., Schonenberger K., Laib A. Effects of four Ni-Ti preparation techniques on root canal geometry assessed by micro computer tomography. Int Endod J, 2001; 34 (3): 221-230.
- Pitt W.G. Removal of oral biofilm by sonic phenomena. Am J Dent, 2005; 18 (5): 345-352.
- Ruddle C.J. Hydrodinamic disinfection: tsunami endodontics. Dent Today, 2008; 26 (5): 110, 112, 114-117.
- Sabins R.A., Johnson J.D., Hellstein J.W. A comparison of the cleaning efficacy of short-term sonic and ultrasonic passive irrigation after hand instrumentation in molar root canals. J Endod, 2003; 29 (10): 674-678.
- Sedgley C.M., Nagel A.C., Hall D., Applegate B. Influence of irrigant needle depth in removing bioluminescent bacteria inoculated into instrumented root canals using real-time imaging in vitro. Int Endod J, 2005; 38 (2): 97-104.
- Soukos S., Chen P.S., Morris J.T., Ruggiero K., Abernethy D., Som S., Foschi F., Doucette S., Bammann L.L., Fontana C.R., doukas A.G., Stashenko P.P. Photodynamic therapy for endodontic disinfection. J Endod, 2006; 32 (10): 979-984.
- Van der Sluis L.W., Versluis M., Wu M.K., Wesselink P.R. Passive ultrasonic irrigation of the root canal: a review of the literature. Int Endod J, 2007; 40 (6): 415-426.
- Walmsley A.D., Lumley P.J., Laird W.R. Oscillatory pattern of sonically powered endodontics files. Int Endod J, 1989; 22 (3): 125-132.
- Williams J.A., Pearson G.J., Colles M.J. Antibacterial action of photoactivated disinfection (PAD) used on endodontic bacteria in planktinic suspension and artificial and human root canals. J Dent, 2006; 34 (6): 363-371.

/public-service/media/default/364/sXxcF_6659c892c4665.jpg)
/public-service/media/default/461/R93Ot_671a20c1af915.png)