Микроорганизмы зубного налета
На сегодняшний день микробиологи добились существенного успеха в изучении роли бактериальной флоры зубного налета в развитии заболеваний пародонта.
Об исследовании микрофлоры полости рта подробно описано на вебинаре Кариесология: диагностика, оценка риска, неинвазивное и минимально-инвазивное лечение в детской стоматологии.
Зубной налёт: определение, стадии формирования и микрофлора
Спустя несколько часов после тщательной чистки зубов зубной налет вновь начинает образовываться на зубах вследствие определённых физико-химических процессов между поверхностью эмали и компонентами слюны, что вызывает формирование тончайшей пленки — пелликулы.
Процесс ее образования претерпевает следующие стадии:
- миграция бактерий,
- адгезия,
- прикрепление,
- колонизация.
Микробные ассоциации на фоне недостатка гигиенического ухода постоянно растут. Спустя 36 часов визуально при клиническом осмотре определяется зубной налет, представляющий собой структурированное, мягкое, прикрепленное к зубу образование, которое невозможно смыть водой.
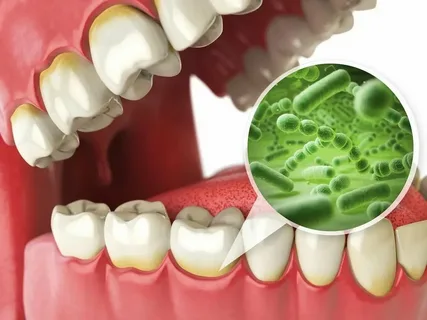
Рисунок 1. Микроорганизмы зубного налета.
Интенсивность формирования зубного налета обусловлена рядом факторов, среди которых можно выделить:
- ежедневные привычки (частота приема пищи, курение, качество гигиены, применение фторидов, антибактериальных препаратов),
- биохимические и биофизические показатели ротовой жидкости,
- особенности строения зубов,
- факторы ретенции,
- особенности прикуса.
Длительно находящийся на поверхности зуба налет постепенно минерализуется, формируется зубной камень. Кальцификация – это результат комплексного влияния бактериальных, биологических и физико-химических факторов. В результате проникновения из слюны кристаллов кальция фосфата последние в виде минеральных солей начинают откладываться на коллоидной основе. Это происходит в наддесневом налете, а в поддесневом налете минералы поступают из сыворотки крови. Минерализация зубного налета может наступить в течение 12 дней. Полностью зубной камень образовывается спустя месяц.
Прирост камня на поверхности зуба осуществляется за счет накопления слоя зубного налета. Зубной камень, имея шероховатую поверхность, предрасполагает к адгезии микроорганизмов. С увеличением толщины налета меняется его видовой микробиологический состав.
Рисунок 2. Зубная бляшка под микроскопом.
Установлено порядка 600 разновидностей бактерий, которые обитают в над- и поддесневом налете. На вторые-третьи сутки налет включает преимущественно грамположительных аэробов, главным образом это стрептококки и актиномицеты.
Употребление кислорода аэробными микроорганизмами уменьшает местный окислительно-восстановительный потенциал, что создает предпосылки для появления на третьи-четвертые сутки представителей грамотрицательных анаэробов.
Микробная биоплёнка и коагрегация бактерий зубного налёта
Наряду с изменениями микрофлоры наблюдается сложное взаимодействие между разными видами. К примеру, St. Actinomyces осуществляют ферментацию сахаров, увеличивая концентрацию молочной кислоты, которая необходима для жизнедеятельности анаэробных грамотрицательных кокков Veillonella, а их продукт метаболизма – менадион необходим для жизни Prevotella intermedia и Porphyramonas gingivalis.
Продукты метаболизма грамотрицательных анаэробов создают благоприятные условия для дальнейшей активации анаэробной колонизации. Fusobacterium nucleatum вызывает накопление катиона аммония; представители рода Capnocytophaga вырабатывают анион янтарной кислоты; Campylobacter — органический красный пигмент, в состав которого входит железо. Описанные метаболиты обеспечивают жизнедеятельность иных более агрессивных бактерий, которые были отнесены учеными к группе потенциально пародонтопатогенных. Этот факт подчеркивает их существенную роль в патогенезе пародонтита, образовании пародонтального кармана, резорбции альвеолярного отростка и разрушении соединительной ткани.

Рисунок 3. Микробная биопленка.
Для определения живущих в пародонтальной области микроогранизмов в данную группу были предложены следующие критерии:
- ассоциация с болезнью – численность штамма увеличивается в месте поражения при прогрессировании болезни;
- численность штамма уменьшается в области очага поражения при проведении эффективного лечения;
- инвазия представителей вида в ткани пародонта вызывает гуморальный и клеточный иммунный ответ;
- наличие механизмов вирулентности, которые способны вызывать разрушение тканей пародонта;
- способность штамма стать этиологическим фактором заболевания пародонта.
Вирулентность бактерий зубного налета
Вирулентность – это способность микроорганизма заразить данный организм. Не стоит путать с патогенностью – способностью вызывать развитие болезни, поскольку инфекционный агент после заражения может стать симбионтом хозяина. Зависит вирулентность от свойств непосредственно инфекционного агента – это факторы вирулентности и от восприимчивости, чувствительности организма хозяина.
Факторы вирулентности микроорганизмов зубного налета делятся на две большие группы:
- факторы, которые позволяют бактериям колонизировать на тканях полости рта и проникать вглубь (прикрепление, колонизация, инвазивность);
- факторы, которые позволяют микроорганизмам опосредованно или напрямую вызывать разрушение тканей хозяина (антигенность, токсигенность, незаметность для иммунной системы).
Адгезия и колонизация
Умение инфекционного агента прикрепляться в пародонтальной среде является вирулентным фактором. Пародонтальный карман, как и десневая борозда, содержат десневую жидкость, которая движется от основания кармана или борозды наружу. Представители бактерий, колонизирующих данную область, крепятся к окружающим поверхностям (корень или коронка зуба, существующий налет, мягкие ткани) так, чтобы избежать смывания током жидкости.

Рисунок 4. Колонизация поверхности зуба.
Первыми прикрепляются к расположенной на поверхности зуба пелликуле Streptococcus sanguis, oralis, mitis, они обладают поверхностными рецепторами, облегчающими другим видам бактерий последующее присоединение (коагрегация). В литературе имеется наиболее полно описанное подобное взаимодействие — Actinomyces viscosus прикрепляются поверхностными фимбриями Streptococcus sanguis благодаря полисахаридным рецепторам последних. Porphyromonas gingivalis при помощи фимбрий крепятся к фибробластам и клеткам эпителия. P. gingivalis обладает способностью соединяться к другими бактериями, клетками эпителия и структурами соединительной ткани, что является фактором вирулентности этого микроорганизма.
В основе бактериальной колонизации лежит умение бактерий прикрепляться к тканям полости рта и эффективно взаимодействовать между собой, что рассматривается как начальный этап успешного бактериального вторжения.
Инвазивность
Описанные в литературе гистологические исследования подтверждают присутствие микроорганизмов в пародонтальных тканях пациентов с прогрессирующим пародонтитом и язвенным гингивитом. В этих исследованиях бактерии грамположительные и грамотрицательные, в том числе кокки, палочки, спирохеты, филоменты обнаруживаются в тканях десны, а также в непосредственной близости от костной ткани. Способность бактерий проникать вглубь ткани обусловлена определенными бактериальными ферментами, которые обладают повышенной активностью и разнонаправленным действием, среди них:
- гиалуронидаза,
- нейраминидаза,
- коллагеназа,
- лецитиназа.
Микроорганизмы проникают в организм хозяина через участки изъязвления в эпителии прикрепления, наблюдаются в межклеточном пространстве десны. Другой способ вторжения — прямое проникновение инфекционного агента в эпителиальные клетки хозяина или соединительнотканные клетки. Второй способ проникновения характерен для следующих микроорганизмов: P. gingivalis, A. actinomycetemcomitans, Treponema denticola и F. nucleatum.
Рисунок 5. Удаление зубного налета.
Исследователи считают, что обострение хронического воспаления тканей пародонта напрямую зависит от очередной фазы бактериальной пенетрации тканей пародонта. Пародонтальный карман представляет собой резервуар микроорганизмов, реколонизация которых провоцирует резкий всплеск активности болезни. Данная гипотеза нашла клиническое подтверждение. В процессе лечения пациентов, у которых диагностирован прогрессирующий пародонтит, одной механической чистки пародонтального кармана не хватает, чтобы стабилизировать воспалительный процесс. В участках поражения не удается уменьшить колонизацию A. Actinomycetemcomitans, дополнительно назначают прием системных антибиотиков, часто в совокупности с хирургическим лечением.
Микробные механизмы проникновения в ткани хозяина включают прямое разрушение тканей, также опосредованное, обусловленное действием биологических медиаторов вследствие воспалительного процесса в тканях пародонта.
Информацию о важных анатомических аспектах тканей пародонта можно найти на вебинаре Продвинутое лечение заболеваний пародонта.
