Сравнительная гистологическая оценка биосовместимости материалов, используемых в апикальной хирургии
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Цель: Оценить биологические свойства различных материалов, которые могут быть использованы в апикальной хирургии.
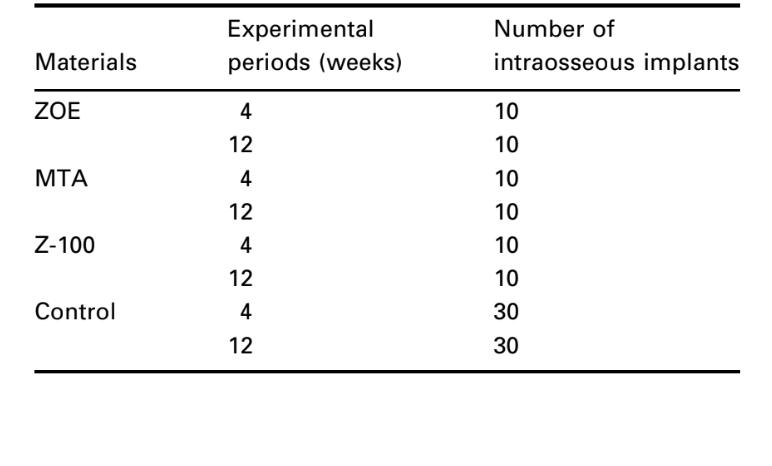
Методология: Для тестирования следующих материалов использовалась техника внутрикостной имплантации, рекомендованная FDI (1980) и ADA (1982): оксид цинка-эвгенол (ZOE), минеральный триоксидный агрегат (MTA) и светотвердеющая композитная смола Z-100. Тридцать морских свинок, по 10 для каждого материала, были разделены на экспериментальные периоды в 4 и 12 недель и получили по одному имплантату с каждой стороны симфиза нижней челюсти. Реакция соединительной ткани вдоль боковой стенки вне чаши служила негативным контролем для техники. В конце наблюдательных периодов животные были убиты, и образцы подготовлены для рутинного гистологического исследования с целью оценки их биосовместимости.
Результаты: Реакция ткани на материалы уменьшалась с течением времени. Цемент ZOE был высокотоксичным в течение 4-недельного экспериментального периода, но этот профиль значительно изменился после 12 недель, когда он показал биосовместимые характеристики. MTA и Z-100 продемонстрировали биосовместимость в этой тестовой модели в оба временных периода.
Выводы: MTA и композит Z-100 были биосовместимы на 4 и 12 неделях в этой экспериментальной модели.
Введение
Успех лечения корневых каналов зависит от удаления инфицированного содержимого канала, за которым следует заполнение канала материалом с адекватной совместимостью, чтобы избежать раздражения перiapical тканей. Несмотря на постоянную эволюцию концепций, новые эндодонтические техники и разработку более эффективных материалов и инструментов, разрешение перiapical патозов иногда достигается только через хирургические процедуры (Tassery и др. 1999).
Апикальная хирургия, однако, должна проводиться только в том случае, если традиционное лечение корневых каналов не дало результатов. Идеальный материал для апикального заполнения корневого конца должен обладать биосовместимыми характеристиками, размерной стабильностью, адгезивностью, низкой растворимостью и способностью создавать герметичность апикальной трети канала, чтобы изолировать систему корневых каналов от перiapical области (Gartner & Dorn 1992). Биосовместимость была продемонстрирована как один из самых важных факторов (Pascon и др. 2001).
При рассмотрении биологических свойств эндодонтических материалов следует учитывать широкий спектр характеристик. Методологии для оценки этих параметров включают первоначальные тесты, вторичные тесты и исследования использования. Первоначальная оценка должна включать основные in vitro методы оценки биологических свойств. Вторичные оценки должны проводиться in vivo на лабораторных животных и могут включать эксперименты по имплантации. Исследования использования проводятся на приматах или людях (Spångberg 1969, Stanley 1985).
Большое количество материалов было рекомендовано для апикального заполнения корневого канала. Целью этого исследования было оценить реакцию тканей на различные потенциально полезные материалы, используемые в качестве заполнителя корневого канала, с использованием экспериментальной модели, рекомендованной FDI (1980) и ADA (1982).
Материалы и методы
Оцененные материалы включали оксид цинка-эвгенол (ZOE) (S.S.White, Рио-де-Жанейро, Бразилия), минеральный триоксидный агрегат (MTA) (ProRootTM MTA; Dentsply Endodontics, Талса, ОК, США) и светотвердеющую композитную смолу Z-100 (3M, Сент-Пол, МН, США). Все материалы были подготовлены в соответствии с рекомендациями производителя для их клинического использования и загружены в тефлоновые® носители (политетрафторэтилен; DuPont, HABIA, Книвста, Швеция), обеспечивая отсутствие захваченного воздуха.
Внутрикостный имплантат в mandibula морской свинки (Spångberg 1969) и стандартизированные методы оценки биологических реакций, рекомендованные FDI (1980) и ADA (1982), были использованы. Тридцать морских свинок (весом ~800 г) были отобраны, и каждое животное получило два имплантата из одного и того же материала. Десять образцов использовались для каждого материала и периода наблюдения (Таблица 1). Кроме того, реакция соединительной ткани вдоль боковой стенки вне чашки из Тефлона® служила негативным контролем для техники.
Животные были анестезированы интраперионеально с использованием 0.6 мл кетамина (100 мг мл–1), содержащего ацеPROMAZINE (0.5 мг мл–1). В мукобуккальной складке области нижних резцов было введено 0.6 мл ксилокаина 2% с эпинефрином (1 : 100 000), чтобы предотвратить местный дискомфорт. Морские свинки были побриты в области поднижнечелюстной области, а кожа продезинфицирована 5% настойкой йода. Дистальная вентральная симфизарная область нижней челюсти была хирургически вскрыта в асептических условиях через разрез в коже и мышечной ткани. Кость нижней челюсти с обеих сторон симфиза была обнажена, и цилиндрические отверстия диаметром 2 мм и глубиной 2 мм были подготовлены с помощью бор под стерильным физиологическим раствором. Стерилизованные цилиндрические чашки из тефлона®, открытые с одного конца и с нарезанными внешними поверхностями для обеспечения удерживающих канавок, были заполнены в стерильных условиях материалами и вставлены в костные полости таким образом, чтобы заполняющие материалы контактировали с костной тканью. Цилиндры были
Длина 2,0 мм, внутренний диаметр 1,3 мм и внешний диаметр 2,0 мм. Когда чашки были установлены, мягкие ткани были восстановлены и зашиты независимо с использованием рассасывающего материала 3-0. Наблюдательные периоды составили 4 и 12 недель, когда морских свинок убивали, нижняя челюсть была выделена, а кость, прилегающая к чашкам in situ, была нарезана на блоки по 10 мм. Образцы были погружены в 10% буферный раствор формалина и подготовлены для рутинного гистологического исследования. Серийные срезы (толщиной 5 лм) были нарезаны и окрашены гематоксилин-эозином (H & E) для клеточной идентификации.
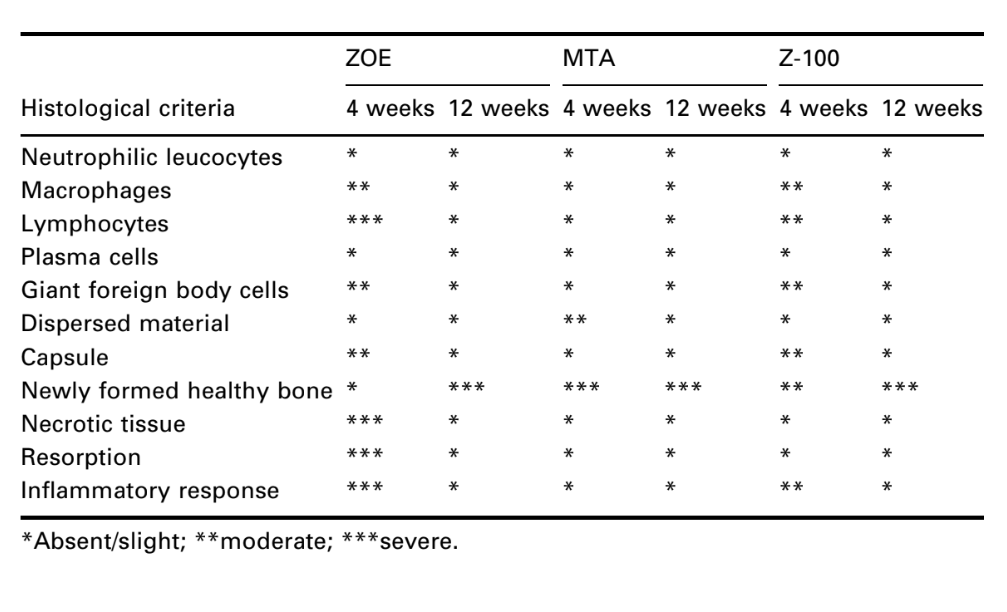
Интерфейс на открытии чашки, между материалом и костью, был исследован и оценен по интенсивности воспаления. Для определения уровней воспаления использовались десять гистологических критериев – наличие или отсутствие нейтрофильных лейкоцитов, макрофагов, лимфоцитов, плазматических клеток, гигантских клеток инородного тела, дисперсного материала, капсулы, вновь образованной здоровой кости, некротической ткани и резорбции.
Два независимых наблюдателя были использованы для оценки реакций тканей. Общий уровень реакции тканей был оценен как отсутствующий или незначительный, умеренный и тяжелый в соответствии с гистологическими критериями, определенными ранее. Считалось биологически приемлемым, что материал не показал или показал незначительную реакцию в оба экспериментальных периода в 4 и 12 недель, или умеренную реакцию на 4 неделе, которая уменьшилась на 12 неделе.
Результаты
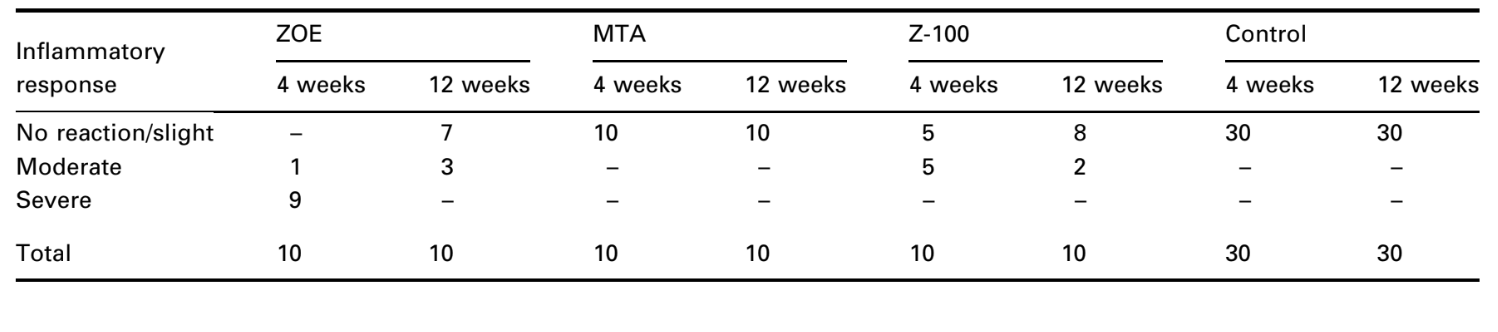
Количество интраоссальных имплантатов и интенсивность воспалительной реакции представлены в Таблице 2. Гистологические оценки материалов на 4 и 12 неделях суммированы в Таблице 3.
Наблюдения через четыре недели
Отрицательный контроль
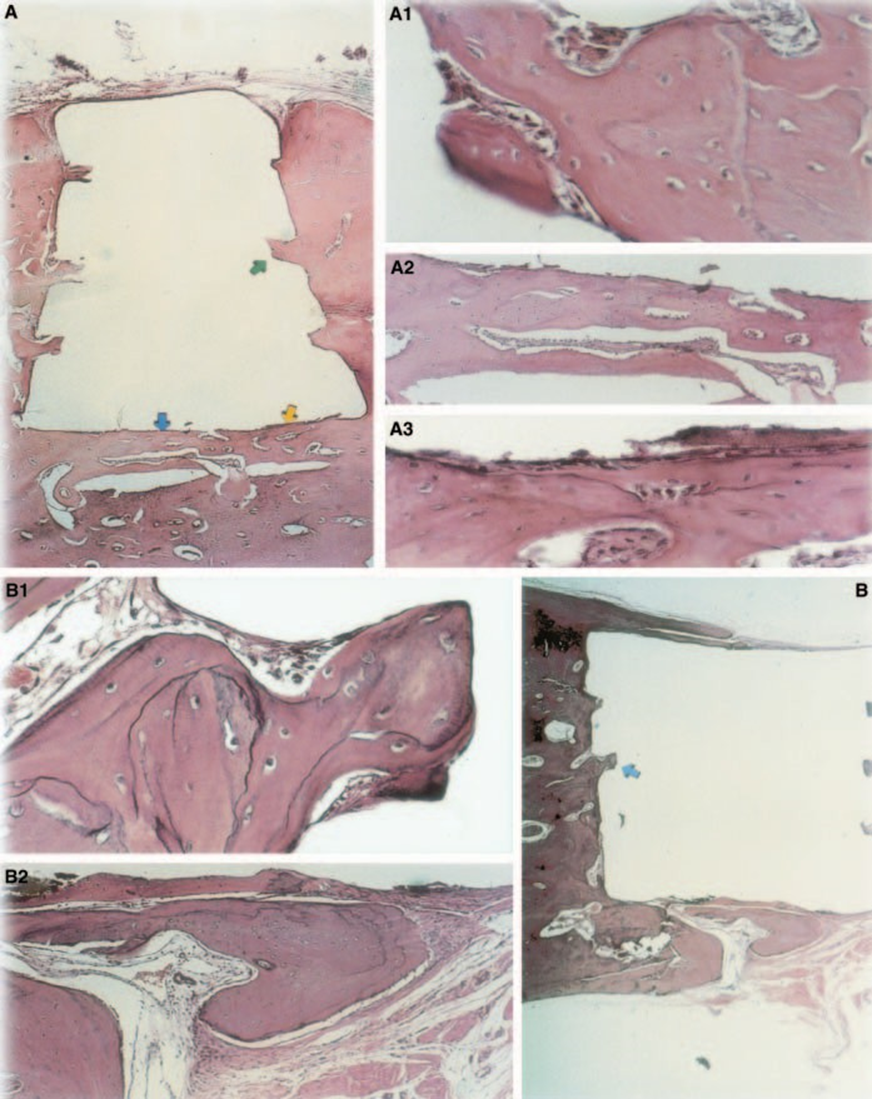
Ответ соединительной ткани вдоль боковой стенки снаружи чашек из Тефлона® всех образцов служил отрицательным контролем для техники. Пазы на внешней поверхности чашек были заполнены новой костной тканью, и тонкие слои соединительной ткани без воспалительной реакции можно было увидеть между чашкой и костью на всех периодах наблюдения во всех образцах (Рис. 6A1,A2).
Оксид цинка-эвгенол
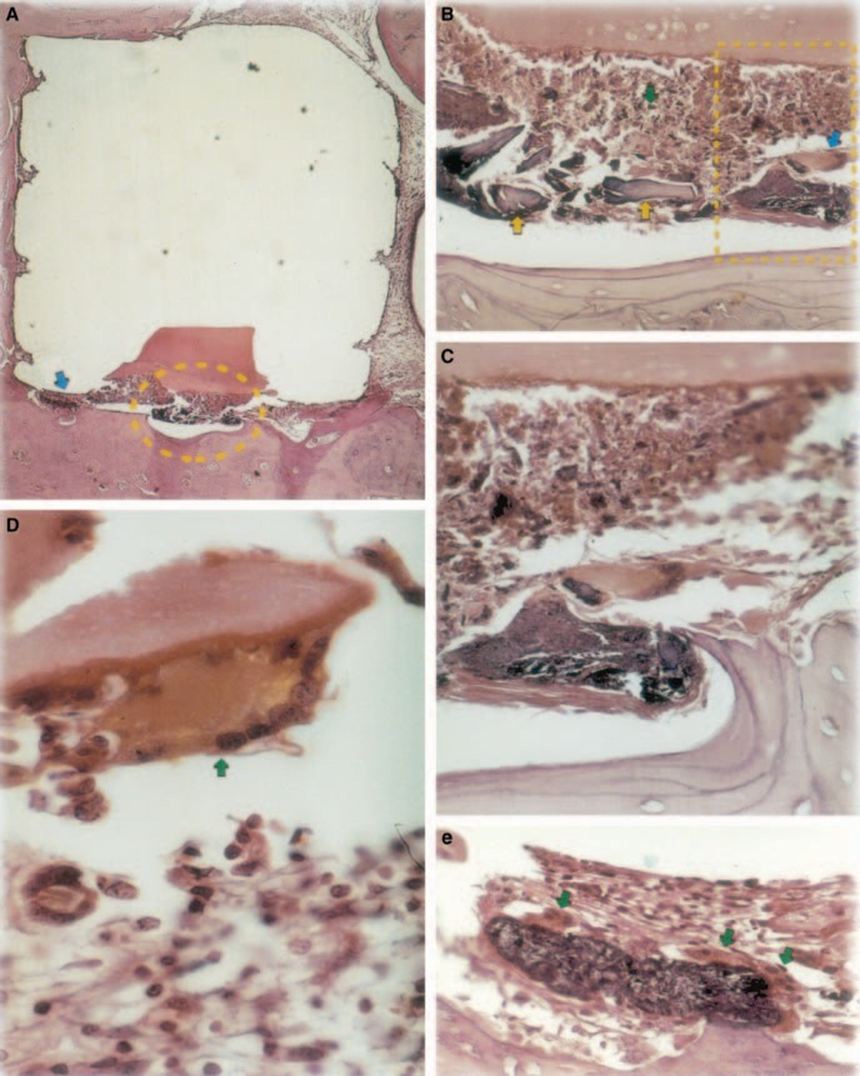
Реакция была тяжелой с некрозом кости, резорбцией, мононуклеарным воспалительным инфильтратом, что подтверждается наличием лимфоцитов, макрофагов и гигантских клеток инородного тела (Рис. 1C). Наличие агломератов гигантских клеток инородного тела, содержащих материал в цитоплазме, и некротической ткани было распространено (Рис. 1D). Была большая депозиция коллагеновых волокон ближе к костной ткани, чем к материалу, и низкое присутствие воспалительных клеток (Рис. 1B).
Минеральный триоксидный агрегат
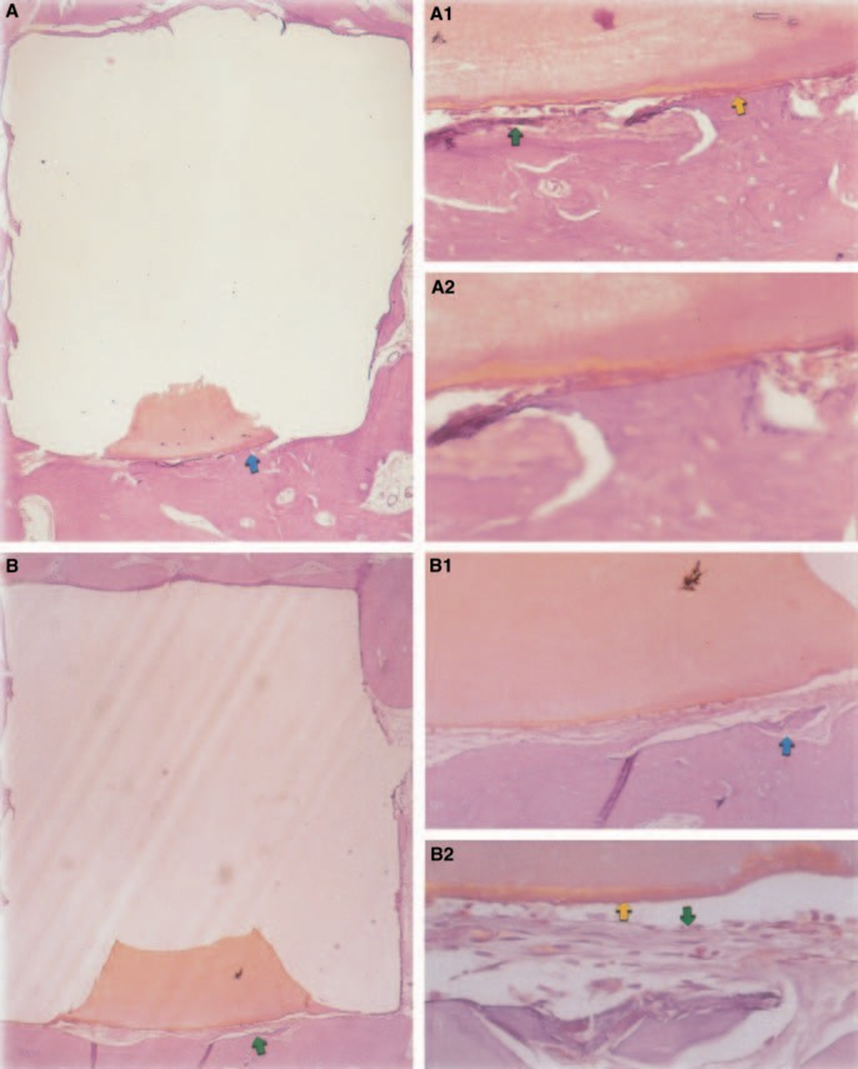
Воспалительная реакция была классифицирована как отсутствующая или незначительная. Образование здоровой кости в непосредственном контакте с материалом (Рис. 3).
Z-100
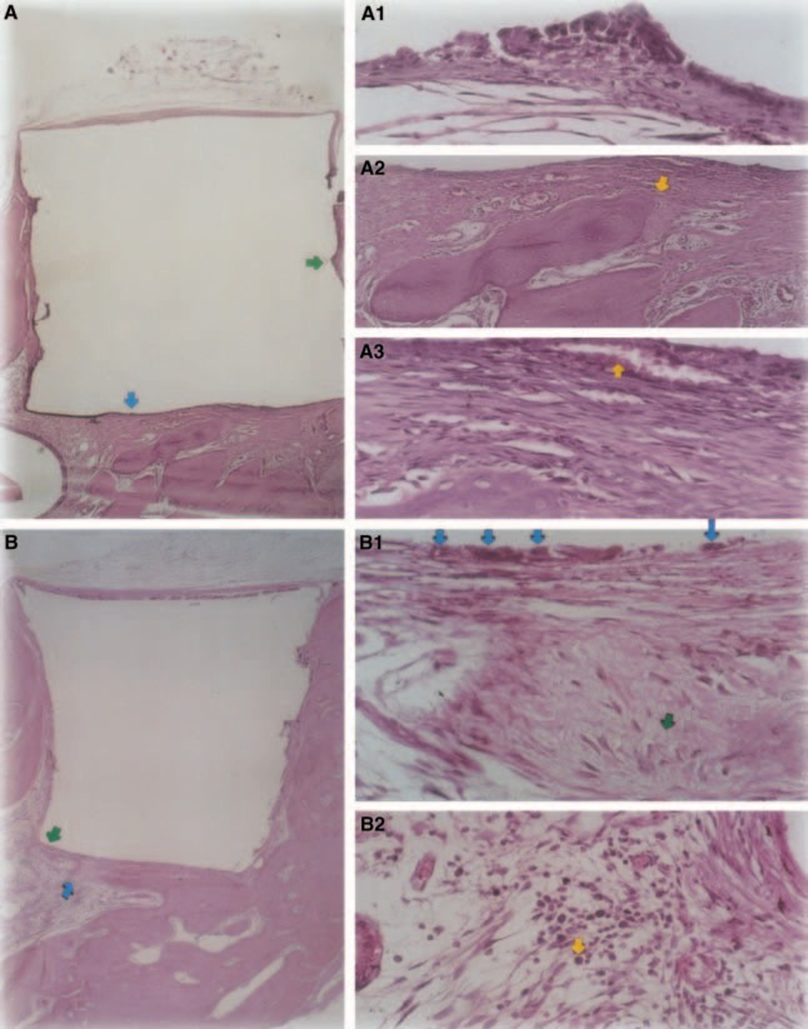
Легкая до умеренной воспалительная реакция была наблюдаема с образованием плотной соединительной ткани на интерфейсе материала и костной ткани (Рис. 5A2,B1). Эта волокнистая соединительная ткань была богата фибробластами; сосуды, воспалительного инфильтрата не наблюдалось, и была зафиксирована минерализация ткани, что свидетельствует о формировании кости (Рис. 5A3). Наличие макрофагов и гигантских клеток инородного тела рядом с материалом было постоянной находкой (Рис. 5A1,B1). Умеренный хронический воспалительный инфильтрат рядом с материалом был наблюдаем (Рис. 5B2).
Двенадцатинедельные наблюдения
Отрицательный контроль
Ответ соединительной ткани вдоль боковой стенки вне чашек из тефлона® всех образцов служил отрицательным контролем для техники. Можно было наблюдать, что бороздки на внешней поверхности чашек были заполнены новой костной тканью, и между чашкой и костью на всех периодах наблюдения во всех образцах можно было увидеть тонкий слой соединительной ткани без воспалительной реакции (Рис. 6A1,A2).
Оксид цинка-эвгенол
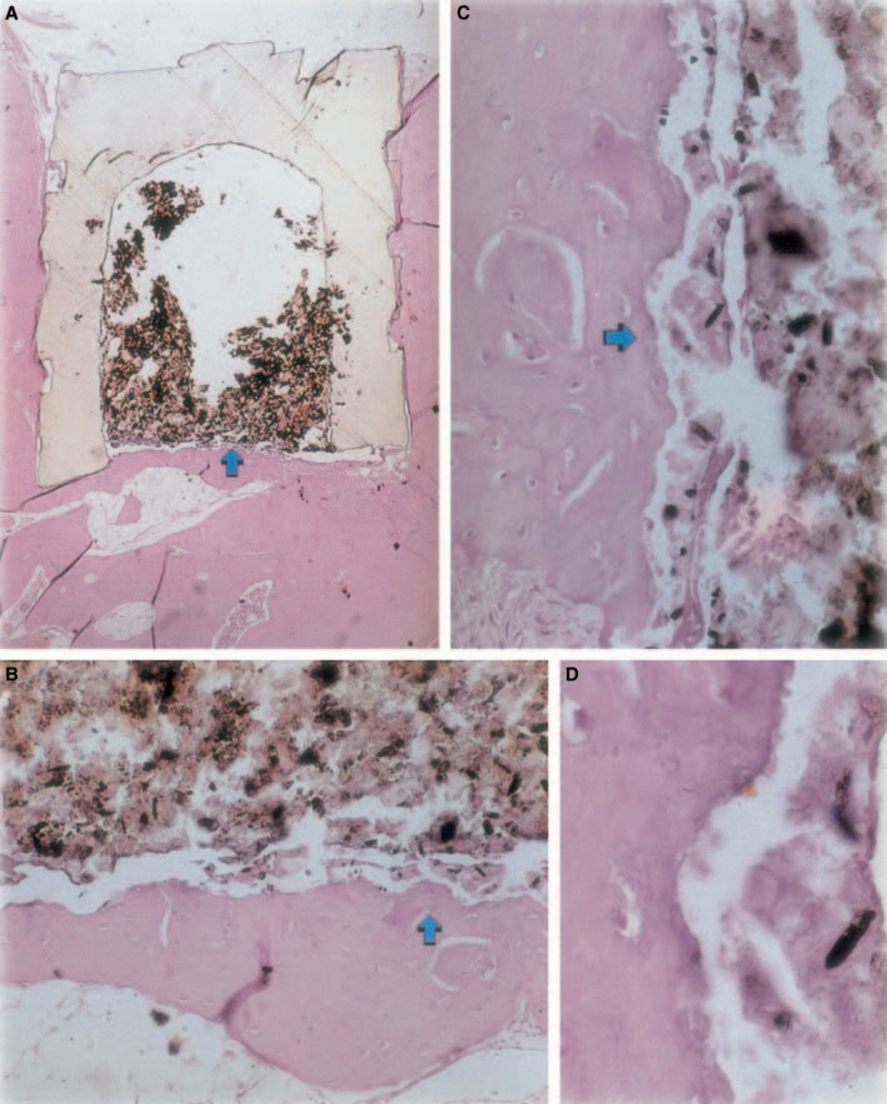
Воспалительная реакция варьировала от отсутствия до легкой в экспериментальный период. В интерфейсе происходило образование кости (Рис. 2A,B). Кость вокруг чашки была здоровой и полностью покрывала её. В некоторых случаях между имплантированным материалом и новой костной тканью был узкий слой соединительной ткани (Рис. 2A1,A2,B1). Однако некоторое резорбция всё ещё присутствовала (Рис. 2B2).
Минеральный триоксидный агрегат
Новая костная ткань образовалась на интерфейсе материал/ткань. Значительной воспалительной реакции не наблюдалось, и когда она имела место, макрофаги и гигантские клетки инородного тела находились в периферической области, в непосредственном контакте с чашкой из тефлона®. Также была обнаружена здоровая кость, содержащая остеобласты, находящиеся в непосредственном контакте с материалом (Рис. 4C).
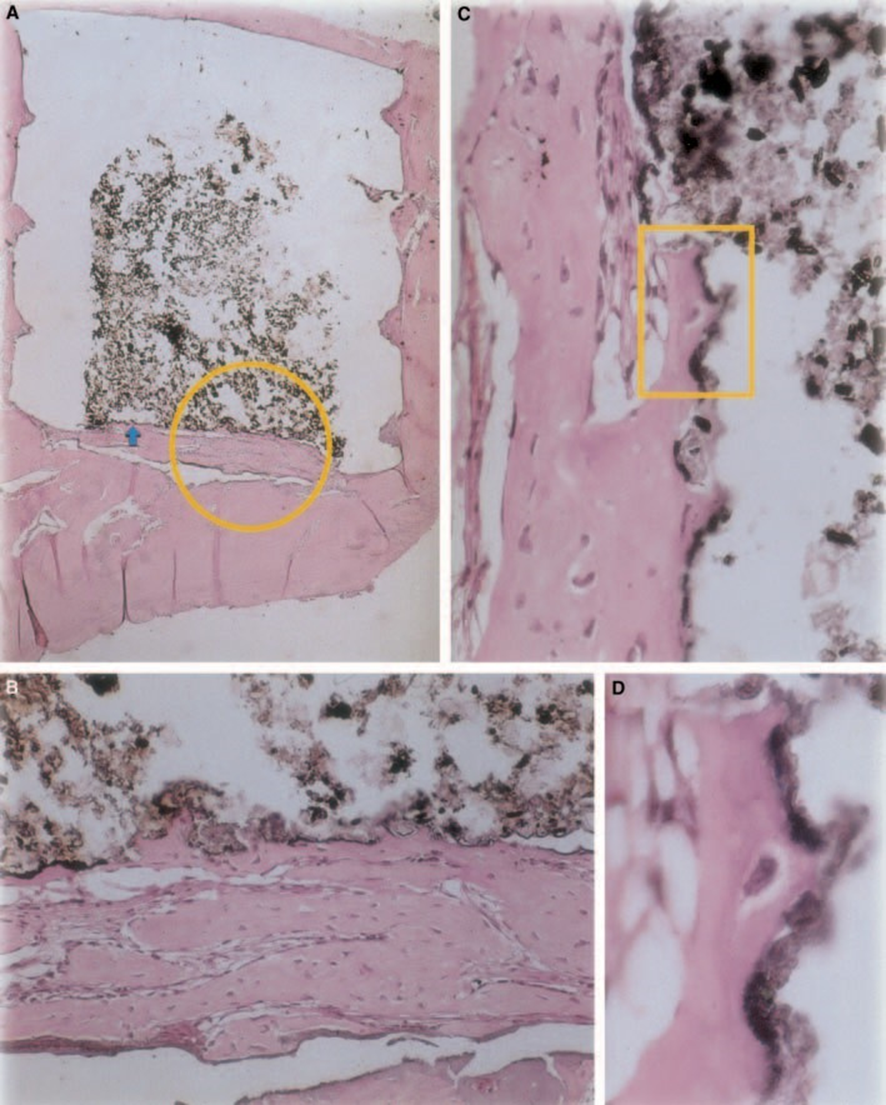
Z-100
Толщина соединительной ткани была значительно уменьшена на интерфейсе (Рис. 6A,B). Присутствие воспалительных клеток было низким, за исключением гигантских клеток инородного тела (Рис. 6A3).
Обсуждение
Биосовместимость является одним из самых важных свойств материала, используемого для запечатывания корневого канала, поскольку он будет постоянно контактировать с живыми тканями в перипикальной области. Одна из целей перирадикулярной хирургии заключается в создании барьера между перипикальной областью и любыми физическими и/или бактериальными агентами в системе корневого канала. Использование несовместимого материала для запечатывания корневого канала будет мешать заживлению в этой области. Материалы, используемые для запечатывания корневого канала, помимо необходимых предварительных испытаний, должны иметь исследованные характеристики биосовместимости (Торабинаджад и Питт Форд 1996).
Тест на имплант в костной ткани морской свинки, рекомендованный FDI (1980), позволяет тестировать материал так, как он используется в клинической среде, подготовленный в соответствии с рекомендациями производителя. Хотя результаты не могут быть напрямую экстраполированы на людей, тест стандартизирован и позволяет проводить прямое сравнение между материалами. Литература в этой области предоставляет результаты из различных лабораторий, использующих одни и те же материалы, чтобы данные могли быть сопоставлены (Паскон и др. 1987, Андреана и др. 1989, Паскон и Лангеланд 1989, Барбоза и др. 1993). Результаты, полученные в этом исследовании, подтвердили выводы других о том, что любой материал, помещенный в контакт с тканями, вызывает реакцию инородного тела (Рис. 1D, 5B1 и 6A3).
Реакции вдоль внешней периферии чашки из Тефлона® отражают травму, вызванную хирургическими процедурами, необходимыми для введения Тефлона® и его содержимого. Сам Тефлон® вызывает незначительное раздражение в тканях (Stanley 1985), и он использовался в качестве носителя из-за своей биосовместимости (Spångberg 1969, ADA 1982). Это было подтверждено отсутствием воспалительных реакций на боковой стенке носителей в оба периода наблюдения.
Воспалительная реакция на ZOE была значительно выше, чем на другие материалы в оба периода наблюдения (Рис. 1 и 2). Эта сильная реакция на ZOE была описана в литературе (Pascon & Langeland 1989, Gulati и др. 1991, Guigand и др. 1999). Также было продемонстрировано, что любой материал, содержащий эвгенол, вызывает сильную реакцию тканей из-за угнетения клеточного дыхания (Hume 1984). Serene и др. (1988) обнаружили, что герметики ZOE активируют комплементную систему и, таким образом, вызывают воспалительную реакцию. Пролонгированная воспалительная реакция на ZOE происходит, потому что реакция между материалом и тканевыми жидкостями в конечном итоге освобождает эвгенол из материала.
Представленные результаты подтвердили выводы, сообщенные Торабинеjad и др. (1997, 1998) относительно воспалительной реакции на MTA (Рис. 3 и 4). Эти авторы тестировали этот материал на большеберцовых и нижнечелюстных костях морских свинок, а также в качестве апикального корневого пломбировочного материала у обезьян и сообщили о его биосовместимости. Значительной воспалительной реакции не наблюдалось.
Стабхольц и др. (1985) ввели композитные смолы в качестве материалов для апикального корневого пломбирования и сравнили их физические свойства с серебряной амальгамой, Кавитом и фосфатом цинка. Однако в их работе не было никаких опасений по поводу реакции тканей. Когда смолы использовались в качестве апикальных корневых материалов, результаты варьировались от тяжелого воспаления (Брюс и др. 1993) до высокой степени заживления (Руд и др. 1991).
Результаты настоящего исследования аналогичны результатам Руда и др. (1991), которые предположили, что композиты обладают многообещающей биосовместимостью. Хотя это было обычное наблюдение, рост костной ткани в непосредственном контакте с Z-100 произошел, вероятно, в результате его низкой токсичности (Рис. 6A2,B2).
Выводы
- Уровень токсичности протестированных материалов уменьшался с течением времени.
- Цемент на основе ZOE был высоко токсичным в течение 4-недельного экспериментального периода, но этот профиль значительно изменился через 12 недель, когда он показал биосовместимые характеристики.
- Все изученные материалы, за исключением ZOE, продемонстрировали приемлемые уровни биосовместимости в течение двух проанализированных периодов.
- MTA продемонстрировала отличные биологические качества с ростом костной ткани в непосредственном контакте с материалом и без промежуточной соединительной ткани.
- MTA и Z-100 показали биосовместимость в этом вторичном тесте.
Авторы: C. J. A. Sousa, A. M. Loyola, M. A. Versiani, J. C. G. Biffi, R. P. Oliveira, E. A. Pascon
Ссылки
- ADA (1982) Биологическая оценка стоматологических материалов. Американская стоматологическая ассоциация, Нью-Йорк, Документ № 41.
- Andreana S, Pascon EA, Langeland K (1989) Ответ костной ткани на гемофибрин [Аннотация]. Журнал стоматологических исследований 68, 381.
- Barbosa SV, Araki K, Spångberg LS (1993) Цитотоксичность некоторых модифицированных герметиков для корневых каналов и их выщелачиваемых компонентов. Оральная хирургия, оральная медицина и оральная патология 75, 357–61.
- Bruce GR, McDonald NJ, Sydiskis RJ (1993) Цитотоксичность материалов для ретроградного заполнения. Журнал эндодонтии 19, 288–92.
- FDI (1980) Рекомендуемые стандартные практики для биологической оценки стоматологических материалов. Международная стоматологическая федерация, Лондон, Технический отчет № 9.
- Gartner AH, Dorn, SO (1992) Достижения в эндодонтической хирургии. Стоматологические клиники Северной Америки 36, 357–78.
- Guigand M, Pellen-Mussi P, LeGolff A, Vulcain J-M, Bonnaure-Mallet M (1999) Оценка цитосовместимости трех эндодонтических материалов. Журнал эндодонтии 25, 419–23.
- Gulati N, Chandra S, Aggarwal PK, Jaiswal JN, Singh M (1991) Цитотоксичность эвгенола в герметике, содержащем оксид цинка. Эндодонтия и стоматологическая травматология 7, 181–5.
- Hume WR (1984) Влияние эвгенола на дыхание и деление человеческой пульпы, фибробластов мыши и клеток печени in vitro. Журнал стоматологических исследований 63, 1262–5.
- Pascon EA, Langeland K (1989) Цитотоксичность нового эндодонтического герметика [Аннотация]. Журнал стоматологических исследований 68, 244.
- Pascon EA, Spångberg L, Langeland K (1987) Цитотоксичность эндодонтических герметиков [Аннотация]. Журнал стоматологических исследований 66, 200.
- Pascon EA, Sousa CJA, Langeland K (2001) Биосовместимость эндодонтических материалов: цитотоксичность полиуретановой смолы, полученной из касторового масла. Бразильский эндодонтический журнал 5, 5–12.
- Rud J, Munksgaard EC, Andreasen JO, Rud V, Asmussen E (1991) Ретроградное заполнение корня композитом и адгезивом для дентин. Часть 1. Эндодонтия и стоматологическая травматология 7, 118–25.
- Serene TP, Vesely J, Boackle RJ (1988) Активация комплемента как возможный in vitro индикатор воспалительного потенциала эндодонтических материалов. Оральная хирургия, оральная медицина и оральная патология 65, 354–7.
- Spångberg L (1969) Биологические эффекты материалов для заполнения корневых каналов. Часть 7. Реакция костной ткани на имплантированный материал для заполнения корневых каналов у морских свинок. Стоматологический журнал 77, 133–59.
- Stabholz A, Friedman S, Abed J (1985) Пограничная адаптация ретроградных заполнений и ее корреляция с герметичностью. Журнал эндодонтии 11, 218–23.
- Stanley HR (1985) Тестирование токсичности стоматологических материалов, 1-е изд. Майами, Флорида, США: CRC Press.
- Tassery H, Pertot WJ, Camps J, Proust JP, Déjou J (1999) Сравнение двух мест имплантации для тестирования интраоссальной биосовместимости. Журнал эндодонтии 25, 615–8.
- Torabinejad M, Pitt Ford TR (1996) Материалы для заполнения корня: обзор. Эндодонтия и стоматологическая травматология 12, 161–78.
- Torabinejad M, Pitt Ford TR, McKendry DJ, Abedi HR, Miller DA, Kariyawasam SP (1997) Гистологическая оценка минерального триоксидного агрегата как материала для заполнения корня у обезьян. Журнал эндодонтии 23, 225–8.
- Torabinejad M, Pitt Ford TR, Abedi, HR, Kariyawasam SP, Tang HM (1998) Реакция ткани на имплантированные материалы для заполнения корня в большеберцовой кости и челюсти морских свинок. Журнал эндодонтии 24, 468–71.
