Эффективность длительной низкодозовой терапии макролидами в предотвращении раннего рецидива носовых полипов после эндоскопической синусовой хирургии
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Фон: Это исследование оценивало эффективность "долгосрочной" терапии макролидами с использованием кларитромицина в качестве дополнения к поддерживающей терапии назальными кортикостероидами для предотвращения рецидива носовых полипов (NP) после функциональной эндоскопической синусовой хирургии (FESS).
Методы: Всего 66 пациентов с хроническим риносинуситом и двусторонними NP были рандомизированы на 3 группы исследования, по 22 пациента в каждой группе. После FESS пациенты в первой и второй группах получали кларитромицин 250 мг/день в течение 12 и 24 недель соответственно, в то время как пациенты в третьей группе не получали кларитромицин. Пациенты во всех 3 группах получали поддерживающую терапию мометазона фуроата 400 мкг/день. Оценка состояния пациентов проводилась до операции и через 6, 12 и 24 недели после операции с использованием визуальной аналоговой шкалы (VAS), 20-пунктового теста результатов синусита (SNOT-20), акустической ринометрии, ринометрии, времени транзита сахарина, назальной эндоскопии, компьютерной томографии (КТ) придаточных пазух носа и измерения уровня катионного белка эозинофилов (ECP) в их назальных секретах.
Результаты: Исследование подтвердило эффективность "долгосрочной" терапии макролидами, что привело к значительному улучшению всех параметров, кроме акустической ринометрии и VAS в обеих группах кларитромицина по сравнению с контролем. Концентрация ECP в носовых секретах резко увеличилась после операции, затем вернулась к исходным уровням после 12 и 24 недель лечения кларитромицином. В контрольной группе уровень ECP продолжал увеличиваться и был значительно выше на конечном этапе. Обе группы с кларитромицином показали значительно лучшие эндоскопические и КТ оценки, чем контрольная группа на конечном этапе.
Заключение: "Долгосрочный" низкодозированный кларитромицин 250 мг/день способен контролировать эозинофильное воспаление и предотвращать ранний рецидив НП после FESS 2014 ARS-AAOA, LLC.
Хронический риносинусит (ХРС) часто возникает в сочетании с носовыми полипами (НП). В одном исследовании ХРС с НП (ХРС-НП) был диагностирован у 4% всей популяции и ассоциирован с бронхиальной астмой (БА) в 7% до 13% случаев. Кроме того, аспирин-усугубляющее респираторное заболевание (АУРЗ) и НП присутствуют у большого числа пациентов (в диапазоне от 36% до 96%). В ХРС-НП преобладающей воспалительной клеткой является эозинофил, который обнаруживается как в ткани, так и в слизистом секретe дыхательных путей почти у всех пациентов с ХРС-НП. Хотя роль инфекции (нейтрофильное воспаление) была исследована, она, похоже, не является первичным фактором в развитии ХРС-НП, хотя ХРС-НП ассоциирован с БА. Аллергия, похоже, является сопутствующим состоянием, а не первичным фактором в развитии ХРС-НП. В настоящее время ни медицинское, ни хирургическое лечение не могут обеспечить постоянный контроль или стойкое излечение. В настоящее время единственным доказанным методом лечения для эффективного контроля ХРС-НП являются местные назальные стероидные спреи с или без системных глюкокортикостероидов (ГКС). Рецидивирующий ХРС-НП не всегда предотвращается даже при использовании системных ГКС, и побочные эффекты могут быть серьезными, включая катаракту и компрессию позвонков. Поскольку контроль заболевания может быть затруднительным даже при использовании системных ГКС, мы решили изучить лечение с помощью "долгосрочной" терапии (3-6 месяцев и более) с использованием низкодозированных макролидных антибиотиков. Очевидно, что неантибактериальные свойства макролидов (эритромицин, рокситромицин, кларитромицин) способствуют их противовоспалительным эффектам, которые включают ингибирование как нейтрофильного, так и эозинофильного воспаления. Макролиды способны модулировать иммунный ответ, ингибировать рост полипов, разрушать биопленки и усиливать защитные свойства слизистой оболочки дыхательных путей.
Эффективность макролидов у пациентов с ХРС без НП была подтверждена; однако их эффективность у пациентов с ХРС и НП не была тщательно исследована. Поэтому наше проспективное рандомизированное контролируемое исследование было разработано для оценки эффективности и безопасности длительного курса (3 и 6 месяцев) терапии низкими дозами кларитромицина у пациентов с ХРС и НП после функциональной эндоскопической синусовой хирургии (ФЭСХ).
Пациенты и методы
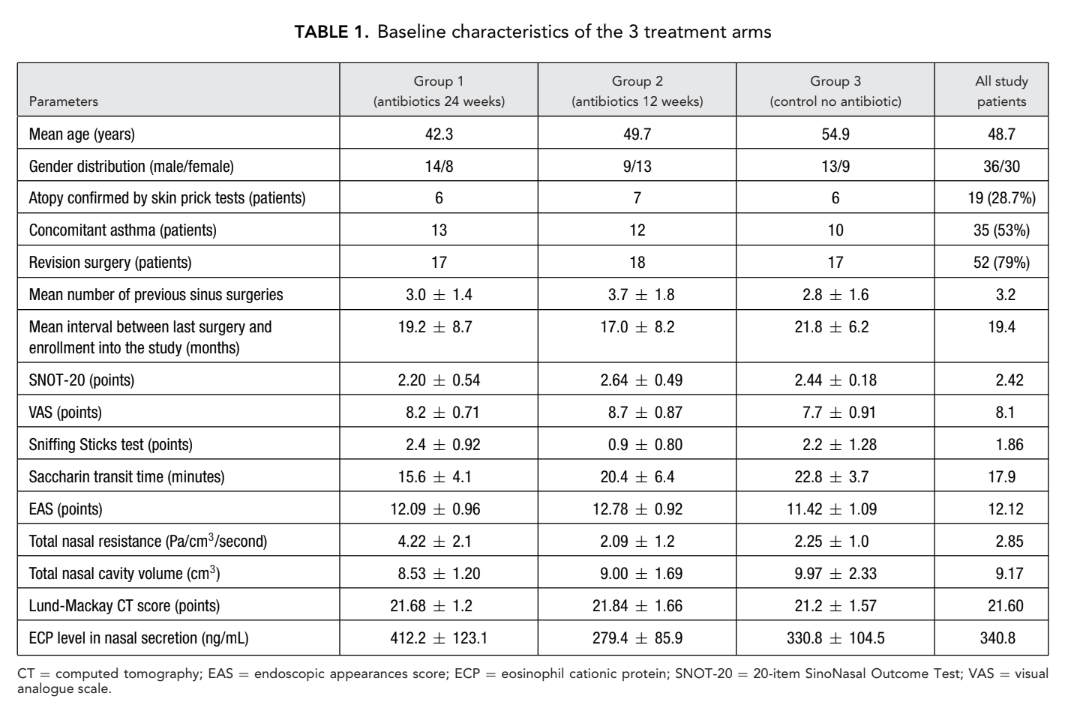
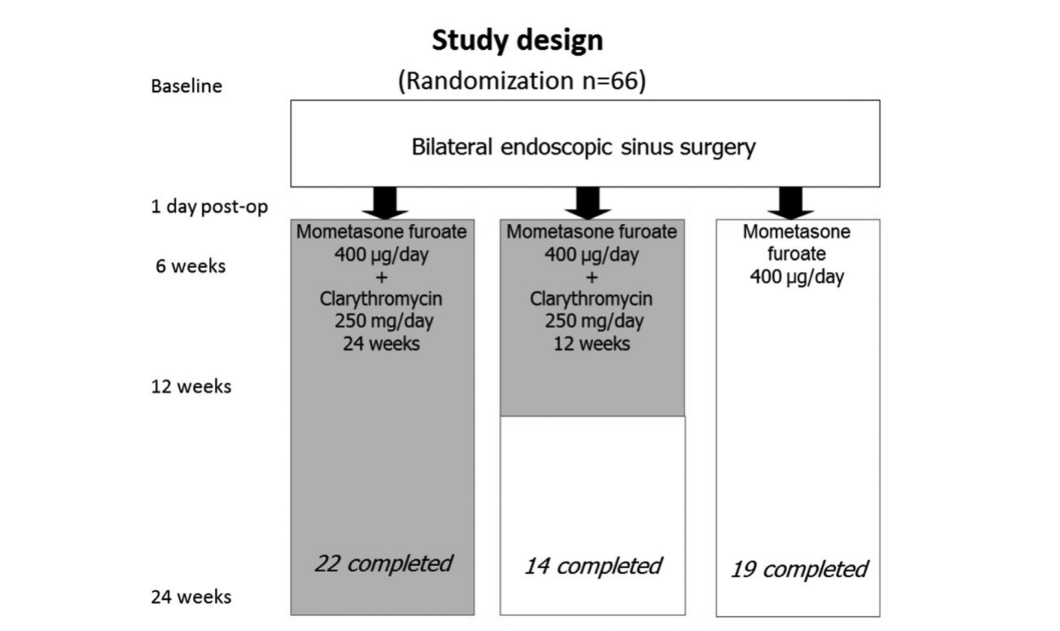
Всего было набрано 66 пациентов (36 мужчин и 30 женщин) в возрасте от 18 до 77 (в среднем 48,7) лет с двусторонним ХРС и НП, подтвержденным эндоскопией. Период исследования составил с января 2008 года по март 2011 года. Все 66 пациентов были случайным образом распределены (система запечатанных конвертов) в 1 из 3 исследовательских групп (по 22 пациента в группе) следующим образом: группа 1 (антибиотики в течение 24 недель); группа 2 (антибиотики в течение 12 недель); и группа 3 (контроль, без антибиотиков).
Все 3 группы получали местный назальный стероидный спрей (флутиказон фуроат), 400 мкг/день в течение 24 недель после ФЭСХ. Макролидный антибиотик, использованный в группах 1 и 2, был кларитромицин 250 мг/день (Клацид; Abbott Laboratories, Abbott Park, Illinois, USA). Большинство пациентов (79%) имели как минимум 1 предыдущую синусовую операцию без долгосрочного успеха; среднее количество предыдущих операций у всех 66 пациентов составило 3,2 (Таблица 1).
Критерии исключения включали следующее: односторонний CR-SwNP, непереносимость макролидов, использование системных стероидов, беременность, лактация и тяжелые соматические заболевания. Мы исключили всех пациентов, которые принимали системные стероиды, потому что в России системная стероида терапия предназначена только для пациентов с тяжелой БА. Было бы неэтично прекращать применение системных стероидов у этих пациентов с БА; кроме того, системные стероиды могли бы негативно повлиять на надежность результатов нашего исследования. Этический комитет Первого Московского государственного медицинского университета имени И.М. Сеченова потребовал, чтобы все пациенты во всех 3 группах продолжали использовать топические назальные стероиды после FESS, иначе НП может быстро повториться.
После набора участников все 66 пациентов прошли двустороннюю FESS, выполненную одним и тем же хирургом (старший автор Лопатин А.). Пациенты группы 1 (антибиотики в течение 24 недель) и группы 2 (антибиотики в течение 12 недель) начали длительную терапию кларитромицином 250 мг/день в первый послеоперационный день и в течение 24 недель (6 месяцев) или 12 недель (3 месяца) соответственно. На 7-й день после операции все пациенты начали поддерживающую терапию назальным спреем мометазона фуроата (Назонекс, MSD, Merck & Co., Inc., NJ, США) 400 мкг/день в течение полных 6 месяцев, включая пациентов группы 3 (контроль без антибиотиков). Этический комитет одобрил окончательный протокол исследования, и все 66 участников подписали формы согласия.
Пациенты тщательно наблюдались и проходили осмотр через 6 недель, 12 недель и 24 недели после FESS (Рис. 1). Результаты лечения основывались на оценке следующих тестов.
20-пунктовый тест результатов синусита (SNOT-20) 20-пунктовый тест результатов синусита (SNOT-20) представляет собой анкету для оценки качества жизни (QoL) у пациентов с риносинуситом.
Визуальная аналоговая шкала
Тяжесть заболевания оценивалась по субъективной оценке пациентов на 10-сантиметровой визуальной аналоговой шкале (VAS); 1 см на шкале соответствовал 1 баллу оценки пациента; 0-3 балла соответствовали легкому заболеванию, 3-7 баллов соответствовали умеренному заболеванию, а 7-10 баллов соответствовали тяжелому заболеванию.
Обонятельный тест
Для каждого пациента использовался тест "Sniffin Sticks", расширенная версия (Burghart Messtechnik GmbH, Ведель, Германия). Идентификация запахов оценивалась с помощью 16 пробирок с различными запахами. Количество правильных ответов было связано с степенью обонятельного расстройства, максимальный возможный балл составлял 16. Балл от 0 до 6 отражает аносмию, балл от 7 до 12 называется гипосмией, в то время как балл от 13 до 16 является нормальным.
Тест времени транзита сахарина
Этот тест измеряет время транзита частицы сахарина от передней части нижней носовой раковины до глотки, когда пациент впервые испытывает ощущение сладкого вкуса.
Назальная эндоскопия
Эндоскопия проводилась с помощью жесткого эндоскопа диаметром 2,7 мм (Karl Storz, Тютлинген, Германия) без деконгестии. Полуколичественные оценки записывались для полипов, отека, выделений, корки и рубцевания на начальном этапе, через 6 недель, через 12 недель и на финальной оценке через 24 недели после FESS. Эти результаты оценивались с использованием шкалы эндоскопического внешнего вида (EAS). Полипы оценивались по размеру от 0 до 3 баллов; отсутствие полипов оценивалось как 0, полипы, появляющиеся только в среднем носовом ходе, оценивались как 1; полипы, выходящие за пределы среднего носового хода, но не obstructing нос, оценивались как 2; и полипы, полностью obstructing нос, оценивались как 3. Выделения оценивались следующим образом: 0 = без выделений; 1 = прозрачные, тонкие выделения; и 2 = густые, гнойные выделения. Мукозный отек оценивался следующим образом: 0 = отсутствует; 1 = легкий; 2 = тяжелый. Корка и рубцевание в послеоперационной полости оценивались следующим образом: 0 = отсутствует; 1 = легкий; и 2 = тяжелый; эти данные оценивались для правой и левой носовой полости отдельно.
Активная передняя ринометрия и акустическая ринометрия
Активная передняя ринометрия (AAR) и акустическая ринометрия (AR) проводились с использованием устройства SRE 2000 (Rhinometrics, Lynge, Дания), которое позволяло выполнять оба теста: AAR объективно оценивала как носовое сопротивление, так и носовой поток, в то время как AR отражала геометрию и объем всей носовой полости.
Мультиспиральная компьютерная томография Мультиспиральная компьютерная томография (КТ) носа и околоносовых пазух проводилась до и через 6 месяцев после FESS у всех пациентов. Были получены срезы толщиной полсантиметра (5 мм) как в аксиальной, так и в корональной плоскостях. Степень затемнения конкретной пазухи (0-2) и остеомеатального комплекса (0 = целостный, 2 = закрытый) рассчитывались с использованием системы оценки Лунд-Маккей.
Эозинофильный катионный белок
Содержание эозинофильного катионного белка (ECP) в носовом отделяемом измерялось с использованием набора для сбора с данными, полученными с помощью автоматического хемилюминесцентного анализатора IMMULITE 1000 (Siemens Healthcare Diagnostics Inc, NY, США). Для сбора слизи в средний носовой ход на 20 минут вводился кусок стерильной поролоновой губки размером 20 × 20 × 5 мм. После удаления губка помещалась в пробирку объемом 10 мл и центрифугировалась в течение 3 минут при скорости 4000 об/мин, что позволяло собрать от 0.2 до 1.0 мл слизи для дальнейшего анализа. Чувствительность теста составила 0.2 нг/мл.
Микробиологическое тестирование
Носовой мазок для микробиологического тестирования был собран из среднего носового хода перед FESS и на всех послеоперационных визитах. Культивирование и тестирование чувствительности (резистентности) проводились с использованием бактериологического анализатора Walk Away-40 (Dade Behring, Марбург, Германия) и метода диффузии в агаре (диски Becton Dickinson с кларитромицином, США). Результаты оценивались в соответствии с рекомендациями CLSI (институт клинических и лабораторных стандартов).
Кожные пробы на аллергены
Кожные пробы на аллергены в помещении и на улице проводились у всех пациентов с использованием стандартных методов.
Итоговая оценка результатов лечения
Итоговая оценка результатов лечения проводилась с использованием изменений EAS и баллов CT по Лунд-Маккаю через 24 недели после FESS.
Статистический анализ
После консультации с медицинским статистиком полученные результаты были внесены в компьютеризированную базу данных и обработаны с использованием статистического программного пакета SPSS версии 17.0 для Windows. Были проведены тесты знаков Уилкоксона для оценки эффектов лечения в различные моменты времени. Значения представлены как средние ± стандартные отклонения. Изменения внутри и между группами считались статистически значимыми, когда p значения были <0.05.
Результаты
Одиннадцать пациентов были исключены из исследования по различным причинам: 8 пациентов из группы 2 (антибиотики в течение 12 недель) были выведены. Один пациент испытал abdominal боль после начала терапии кларитромицином; второй пациент был выведен из-за кошмаров, начавшихся через 3 дня после начала лечения кларитромицином. Одна женщина из той же группы испытала обострение эрозивного дуоденита через 2 месяца после включения и была выведена, в то время как 5 других были выведены из-за несоответствия. Одна женщина из группы 3 (контроль без антибиотиков) была исключена из-за беременности, и 2 других в этой группе были выведены из-за несоответствия. Таким образом, 55 пациентов завершили исследование, и на последнем визите все 22 пациента в группе 1 (антибиотики в течение 24 недель) завершили исследование, 14 пациентов остались в группе 2 (антибиотики в течение 12 недель), и 19 пациентов остались в группе 3 (контроль без антибиотиков).
Тридцать пять пациентов имели БА, и 27 из этих 35 пациентов представили AERD. Атопия была подтверждена с помощью кожных проб в 19 из 66 первоначальных пациентов. Не было значительных различий между 3 группами по возрасту, полу, наличию атопии, тяжести заболевания и количеству предыдущих операций, а также по всем другим первоначальным параметрам, которые мы исследовали. Исходные характеристики каждой из 3 групп лечения: группа 1 (антибиотики в течение 24 недель), группа 2 (антибиотики в течение 12 недель) и группа 3 (контроль без антибиотиков) представлены в Таблице 1.
Результаты лечения были лучше для пациентов, завершивших курс длительного лечения кларитромицином в группе 1 (антибиотики в течение 24 недель) и группе 2 (антибиотики в течение 12 недель) по сравнению с пациентами в группе 3 (контроль, без антибиотиков).
Статистически значимые различия (p < 0.05) были получены для всех параметров (но не на каждом визите) между группами исследуемых препаратов 1 и 2 и группой 3 (контроль, без антибиотиков), единственным исключением были VAS и AR, где статистически значимые данные не были достигнуты.
SNOT-20
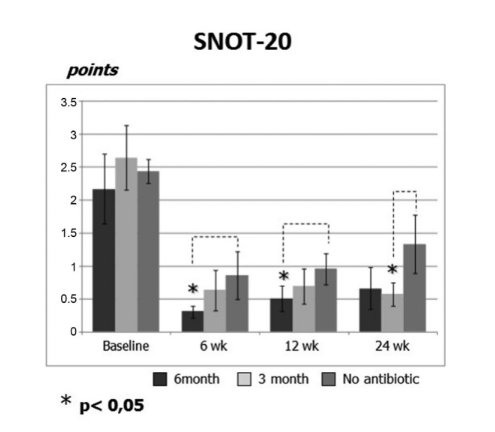
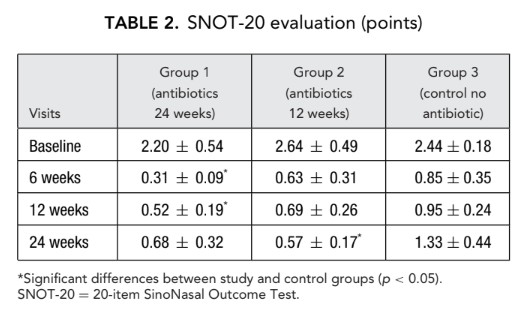
Начальные баллы SNOT-20 составили 2.20 ± 0.54 в группе 1 (антибиотики в течение 24 недель), 2.64 ± 0.49 в группе 2 (антибиотики в течение 12 недель) и 2.44 ± 0.18 в группе 3 (контроль, без антибиотиков). После FESS качество жизни улучшилось, и тяжесть симптомов риносинусита была облегчена у всех участников исследования. Однако баллы SNOT-20 пациентов в группе 1 (антибиотики в течение 24 недель) на визитах через 6 недель и 12 недель после FESS (0.31 ± 0.09 и 0.52 ± 0.19 соответственно), а также баллы SNOT-20 пациентов в группе 2 (антибиотики в течение 12 недель) на финальном визите (0.57 ± 0.17) были значительно лучше, чем у пациентов в группе 3 (контроль, без антибиотиков) на тех же визитах; 0.85 ± 0.35, 0.95 ± 0.24 и 1.33 ± 0.44 соответственно (p < 0.05), (Рис. 2, Таблица 2).
Оценки VAS
Различия в изменениях оценок VAS между исследуемыми группами (группы 1 и 2) и контрольной группой (группа 3 без антибиотиков) не достигли статистической значимости (Таблица 3).
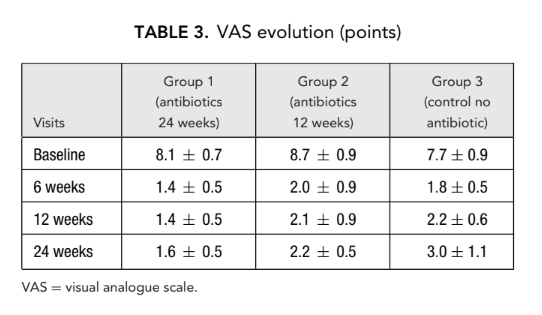
Обонятельный тест
Тяжелая обонятельная дисфункция была обнаружена у всех участников исследования до FESS. Полная или почти полная утрата способности различать запахи (аносмия) была отмечена, когда нос был полностью заблокирован диффузными носовыми полипами. Ни один из этих 66 пациентов не получал системные стероиды до FESS. На втором и третьем визите обоняние значительно улучшилось у всех 3 групп пациентов, хотя ни один из пациентов не достиг нормальных значений. Статистически значимая разница в среднем количестве правильных ответов (p < 0.05) была выявлена только между группой 1 (антибиотики в течение 24 недель) (9.5 ± 1.3) и группой 3 (контроль без антибиотиков) (4.4 ± 0.5) на втором визите через 6 недель после операции (Таблица 4).
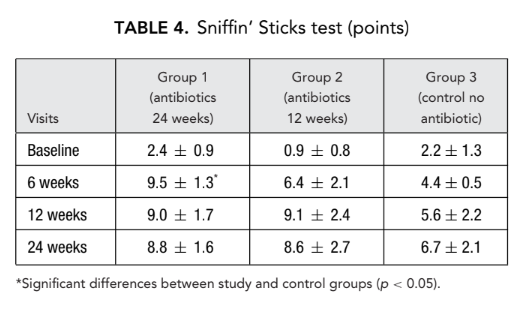
Время транзита сахарина
Аналогично, через 12 недель после операции было отмечено значительное снижение (улучшение) времени транзита сахарина в группе 1 (антибиотики в течение 24 недель) (13.6 ± 3.0 минуты) по сравнению с группой 3 (контроль без антибиотиков) (21.0 ± 4.1 минуты) (Таблица 5).
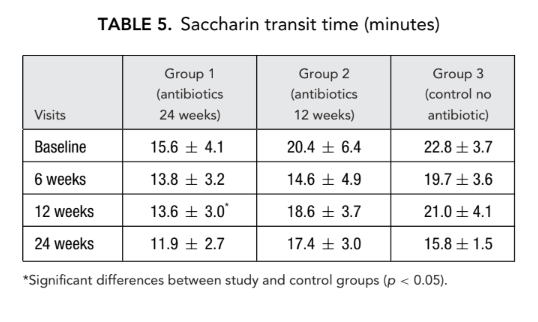
АР и ААР
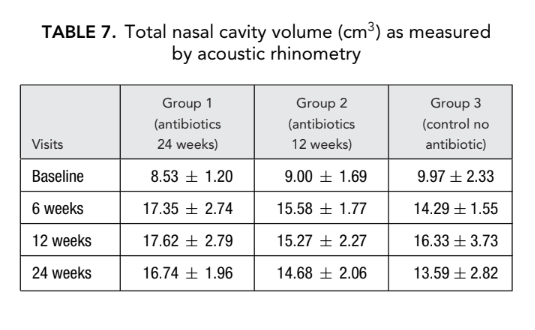
Не было значительной разницы в параметрах акустической ринометрии (объем носовой полости, минимальная поперечная площадь) между всеми группами. Однако носовое сопротивление, измеренное с помощью передней риноманометрии в группе 1 (антибиотики в течение 24 недель) и группе 2 (антибиотики в течение 12 недель), было значительно ниже (лучшее дыхание) (0.23 ± 0.02 и 0.19 ± 0.02 Па/см3/секунду соответственно) по сравнению с группой 3 (контроль без антибиотиков) (1.94 ± 1.50 Па/см3/секунду) на конечном этапе (Таблицы 6 и 7).
КТ-сканирования
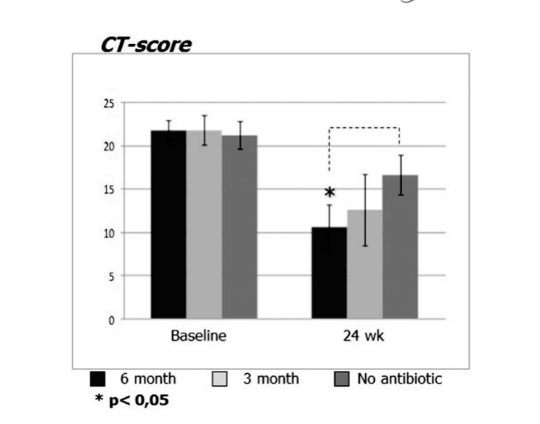
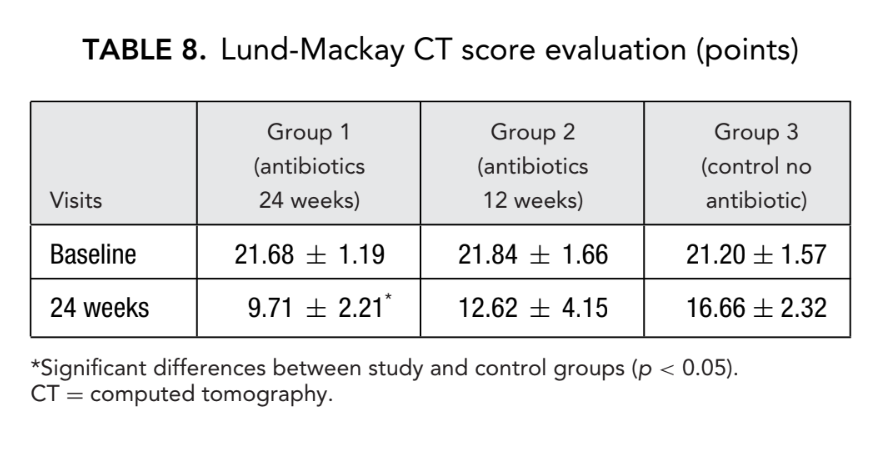
Перед началом лечения средние значения по шкале Лунд-Маккай в первой, второй и третьей группах пациентов не отличались значительно и составили 21.68 ± 1.20, 21.84 ± 1.66 и 21.2 ± 1.57 соответственно. Средний балл обсемененности околоносовых пазух на КТ-сканированиях значительно снизился (улучшился) во всех 3 группах через 6 месяцев после FESS. Однако значительная разница была наблюдаема только между группой 1 (антибиотики в течение 24 недель) со средним баллом 9.71 ± 2.21 и группой 3 (контроль без антибиотиков) со средним баллом 16.66 ± 2.32 (p < 0.05). В группе 2 (антибиотики в течение 12 недель) средний балл составил 12.62 ± 4.15, но эта разница не достигла статистической значимости (Рис. 3, Таблица 8).
Назальная эндоскопия
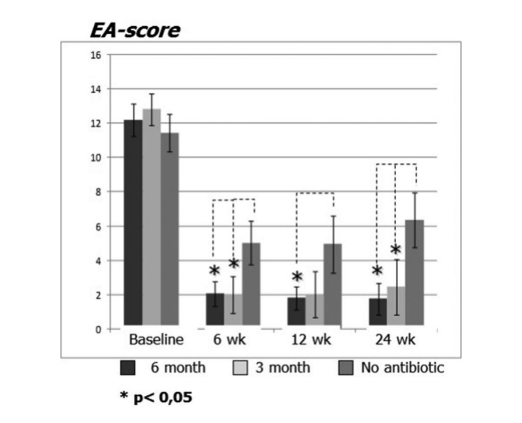
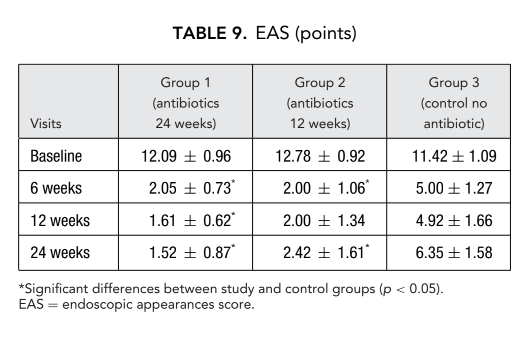
Пациенты, получавшие терапию кларитромицином в группе 1 (антибиотики в течение 24 недель) и группе 2 (антибиотики в течение 12 недель), показали лучшие результаты EAS на каждом визите по сравнению с пациентами в группе 3, которые не принимали антибиотики (Рис. 4, Таблица 9). Двадцать четыре недели после операции средние значения EAS составили: 1.52 ± 0.87 в группе 1 (антибиотики в течение 24 недель) и 2.42 ± 1.61 в группе 2 (антибиотики в течение 12 недель), и эти результаты были значительно лучше, чем в группе 3 (контроль без антибиотиков) 6.35 ± 1.58 (p < 0.05) (Рис. 4, Таблица 9). Один из самых впечатляющих случаев, демонстрирующих эффективность послеоперационной длительной терапии макролидами, представлен на рисунке 5.
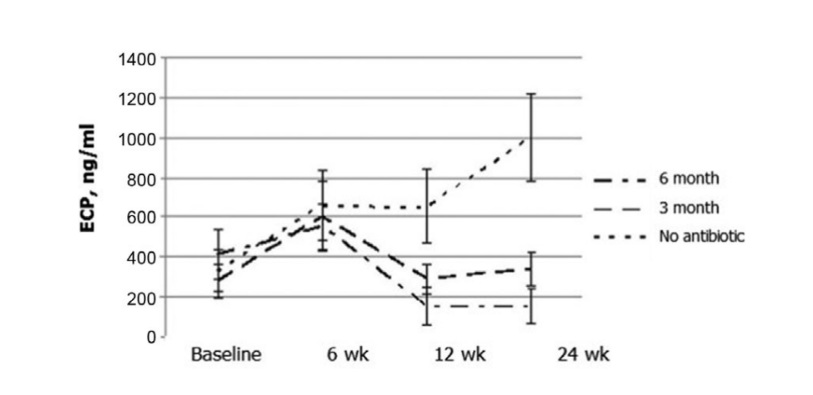
Наиболее примечательные результаты были получены при оценке концентрации ECP после операции. Перед операцией медианные значения концентрации ECP во всех 3 группах пациентов не отличались значительно, составив 412.2 ± 123.1, 279.4 ± 85.9 и 330.8 ± 104.5 соответственно. Шесть недель после операции уровень ECP в носовых выделениях увеличился у всех пациентов исследования, составив 553.2 ± 115.5, 604.0 ± 173.2 и 660.0 ± 171.6 нг/мл в группах 1, 2 и 3 соответственно. Двенадцать недель после FESS было явно отмечено значительное снижение уровня ECP в носовых выделениях в группе 1 (антибиотики в течение 24 недель): 153.6 ± 98.8 нг/мл (p = 0.028), и в группе 2 (антибиотики в течение 12 недель): 290.4 ± 77.2 нг/мл (p = 0.036). Уровень ECP в носовых выделениях у пациентов группы 3 (контроль, без антибиотиков) не изменился значительно и составил 654.0 ± 184.9 нг/мл (p = 0.25). Только в группе 1 (антибиотики в течение 24 недель) концентрация ECP оставалась на том же низком уровне (154.8 ± 89.8 нг/мл) на 24 неделе. В группе 2 (антибиотики в течение 12 недель) наблюдалось незначительное увеличение уровней ECP до 338.1 ± 83.1 нг/мл (p = 0.084), когда этих пациентов изучали на 24 неделе (3 месяца после прекращения антибиотиков); однако при значении p 0.084 разница не была статистически значимой. Средний уровень ECP в носовых выделениях в группе 3 (контроль, без антибиотиков) значительно увеличился до 1000.0 ± 222.7 нг/мл (p = 0.041) (Рис. 6, Таблица 10).
Важно отметить, что уровень ECP у пациентов, лечившихся макролидами в течение полного 6 месяцев (группа 1), был значительно ниже, чем у пациентов группы 2, которые прекратили антибиотикотерапию после 3 месяцев лечения.
Побочные эффекты были редкими, и прекращение антибиотикотерапии потребовалось только у 3 пациентов. Уровни печеночных ферментов (аланинаминотрансфераза [ALT], аспартатаминотрансфераза [AST] и щелочная фосфатаза [ALP]) оставались нормальными у всех пациентов.
Микробиологическое исследование мазков из среднего носового хода выявило широкий спектр бактерий. Наиболее распространенным организмом был Staphylococcus aureus (30% пациентов), за ним следовали Staphylococcus epidermidis (25%), Streptococcus haemolyticus (11%), Escherichia coli (9%), Pseudomonas aeruginosa (6%) и Enterobacter aerogenes (6%). Бактериальный спектр значительно изменился после операции, но соотношение между штаммами, устойчивыми к кларитромицину (13%), и штаммами, чувствительными к кларитромицину (87%), осталось прежним. По завершении исследования некоторые штаммы бактерий, чувствительных к макролидам, приобрели устойчивость к кларитромицину. Интересно, что произошло и противоположное явление; изначально некоторые штаммы бактерий, устойчивые к макролидам, были заменены на некоторые штаммы бактерий, чувствительные к макролидам. В общем, количество штаммов, устойчивых к кларитромицину (13%), оставалось постоянным на протяжении всего курса длительного лечения кларитромицином.
Обсуждение
Текущие данные подтверждают идею о том, что длительное лечение макролидами в низких дозах эффективно, когда оно предназначено для упорных неатопических пациентов с ХРС, у которых местные назальные стероиды и солевые промывания не смогли контролировать симптомы. У пациентов с атопическим ХРС с полипами носа терапия макролидами не была полезной.
В более недавней литературе сообщается, что длительная терапия макролидами в низких дозах эффективна при ХРС, включая тех пациентов, у которых повышены уровни иммуноглобулина E (IgE) и БА. Недавнее проспективное исследование показало, что 8-недельный курс терапии кларитромицином был одинаково эффективен как у атопических, так и у неатопических пациентов с полипозом носа. В ретроспективном исследовании пациенты с ХРС и атопией хорошо реагировали на длительное лечение макролидами, в то время как пациенты, которые курили, имели наихудшие результаты лечения.
Результаты нашего исследования показали, что длительная терапия макролидами в низких дозах предотвращает раннее рецидивирование полипов носа после ФЭС, включая пациентов с атопией и БА. Существовала четкая корреляция между атопией и тяжестью заболевания, поскольку у наших атопических пациентов были более высокие оценки по шкале VAS (коэффициент ранговой корреляции Спирмена 0.332; p = 0.01). Наличие атопии коррелировало с более высокими уровнями ECP в носовом отделяемом (0.834; p = 0.01). Эти данные предполагают, что тяжесть симптомов напрямую связана с интенсивностью эозинофильного воспаления. К сожалению, мы не исследовали общий уровень IgE у большинства пациентов; поэтому анализ подгруппы тех пациентов с низкими уровнями IgE не был возможен.
Одним из самых замечательных результатов исследования стало изменение уровней ECP в носовых секретах после FESS и в послеоперационный период при терапии макролидами. В группе 3 (контроль без антибиотиков) мы отметили почти трехкратное увеличение среднего уровня ECP через 6 недель после операции. Этот результат, показывающий повышенный уровень ECP после FESS у пациентов группы 3, отражает обострение эозинофильного воспаления, вызванного операцией, которое не могло быть адекватно контролируемо только местными интраназальными стероидами. С другой стороны, в лечебных группах 1 (антибиотики в течение 24 недель) и 2 (антибиотики в течение 12 недель) наблюдалось постепенное снижение уровней ECP при длительном лечении низкими дозами кларитромицина, что отражает контроль и снижение эозинофильного воспаления.
Одной из целей этой работы было изучить эффективность более длительного (6 месяцев) курса лечения по сравнению с относительно коротким (3 месяца) курсом терапии низкими дозами макролидов. Данные показали некоторую пользу от более длительного курса антибиотиков, но разница между группой 1 (антибиотик 24 недели) и группой 2 (антибиотик в течение 12 недель) не достигла статистической значимости у большинства пациентов. Тем не менее, есть некоторые доказательства того, что более длительный курс лечения в группе 1 (антибиотики 24 недели) кажется более эффективным, чем более короткий курс, наблюдаемый в группе 2 (антибиотики в течение 12 недель).
Оценки КТ для группы 1 (антибиотики 24 недели) составили 9.71 ± 2.21, что было значительно ниже, чем в группе 3 (контроль без антибиотиков), с показателями 16.66 ± 2.32 на конечном этапе. Разница между группой 2 (антибиотики в течение 12 недель) и группой 3 (контроль без антибиотиков) не достигла статистической значимости (Таблица 8). Были значительные различия в средних уровнях ECP в группах
1 и 2 на конечном этапе, что косвенно подтверждает, что 6-месячный курс антибиотиков снижает эозинофильное воспаление, тем самым предотвращая раннее рецидивирование носовых полипов. Очевидно, что использование пероральных стероидов, безусловно, будет считаться стандартом лечения в Соединенных Штатах и некоторых других западных странах, особенно в условиях послеоперационного обострения эозинофильного воспаления. Однако в таких странах, как Россия, где системная терапия кортикостероидами при CRSwNP крайне редка, длительная терапия макролидами может быть альтернативным вариантом, поскольку она несет меньший риск системных побочных эффектов.
Мы не обнаружили увеличение количества бактериальных культур, устойчивых к макролидам, из среднего носового хода после длительного курса терапии кларитромицином в низкой дозе 250 мг/день, что согласуется с предыдущими исследованиями, которые также не нашли устойчивых микроорганизмов после длительного лечения азитромицином и эритромицином. Конечно, риск развития устойчивых к антибиотикам штаммов бактерий, вызванный длительной терапией макролидами, всегда возможен.
Хотя в наш протокол не была включена группа плацебо и пациенты не были ослеплены при получении дополнительной терапии, мы оценили 6 различных объективных методов во всех 3 группах исследования. Все исследователи были ослеплены при оценке и градации результатов назальной эндоскопии, КТ-сканирования и всех других тестов. В будущем потребуется рандомизированное двойное слепое плацебо-контролируемое исследование с большой выборкой, чтобы определить эффективность длительной терапии макролидами, особенно в предотвращении рецидива носовых полипов после FESS. Кроме того, такое исследование могло бы, надеемся, предсказать, какие пациенты с CRSwNP получат пользу от длительного антибиотикотерапии и увеличивает ли это лечение риск возникновения значительной бактериальной устойчивости.
Заключение
Результаты данного исследования продемонстрировали эффективность и относительную безопасность длительной (6 месяцев) низкодозной (250 мг/день) терапии макролидами (кларитромицином) для предотвращения раннего рецидива носовых полипов у пациентов с CRSwNP после FESS. Несмотря на ограниченные клинические данные, наши доказательства предполагают, что пациенты с рецидивирующим CRSwNP (хирургические неудачи) заслуживают попытки лечения кларитромицином в низкой дозе (250 мг ежедневно в течение 3-6 месяцев), которое может быть начато сразу после FESS вместе с поддерживающей терапией с использованием топических назальных стероидов.
Ссылки
- Хедман Дж., Каприо Дж., Пусса Т., Ниеминен М.М. Распространенность астмы, непереносимости аспирина, носовой полипоз и хронической обструктивной болезни легких в популяционном исследовании. Int J Epidemiol. 1999;28:717–722.
- Сеттипане Г. Эпидемиология носовых полипов. В: Сеттипане Г., Лунд В. Дж., Бернштейн Дж. М., Тос М., ред. Носовые полипы: эпидемиология, патогенез и лечение. Провиденс, РИ: Oceanside Publications; 1997:17–24.
- Огино С., Харада Т., Окавачи И., Ирифуне М., Мацунага Т., Нагано Т. Астма, вызванная аспирином, и носовые полипы. Acta Otolaryngol Suppl. 1986;430:21–27.
- Фоккенс В., Лунд В., Муллол Дж. Европейская позиционная бумага по риносинуситу и носовым полипам. Европейская позиционная бумага по риносинуситу и носовым полипам 2007. Rhinol Suppl. 2007;(20):1–136.
- Десрозье М.Й., Килти С. Дж. Альтернативы лечения хронического риносинусита, сохраняющегося после ESS: что делать, когда антибиотики, стероиды и хирургия не помогают. Rhinology. 2008;46:3–14.
- Кудо С., Уэтаке Т., Хагивара К. и др. Клинический эффект низкодозной, длительной химиотерапии эритромицином при диффузном панброниолитисе (английский аннотат). Jpn J Thorac Dis. 1984;25:632–642.
- Кудо С., Асуму А., Ямамото М., Изуми Т., Андо М. Улучшение выживаемости у пациентов с диффузным панброниолитисом, леченных низкодозным эритромицином. Am J Respir Crit Care Med. 1998;157:1829–1832.
- Сервин А., Уоллворк Б. Терапия макролидами хронического риносинусита. Rhinology. 2007;45:259–267.
- Сервин А., Уоллворк Б., Макай-Сим А., Коман В.Б., Грейфф Л. Эффекты длительного лечения кларитромицином на маркеры воспаления в промывной жидкости при хроническом риносинусите. Clin Physiol Funct Imaging. 2009;29:136–142.
- Стьярне П., Оллсон П., Алениус М. Использование мометазона фуроата для предотвращения рецидива полипов после эндоскопической синусовой хирургии. Arch Otolaryngol Head Neck Surg. 2009;135:296–302.
- Пиккирилло Дж., Мерритт М., Ричардс М. Психометрическая и клинеметрическая валидность 20-пунктового теста исходов синуса-носа (SNOT-20). Otolaryngol Head Neck Surg. 2001;126:41–47.
- Хуммель Т., Кобаль Г., Гудзиол Х., Макай-Сим А. Нормативные данные для "Sniffin’ Sticks", включая тесты на идентификацию запахов, различение запахов и обонятельные пороги: обновление на основе группы из более чем 3000 субъектов. Eur Arch Otorhinolaryngol. 2007;264:237–243.
- Лунд В. Дж., Макай И. С. Стадирование при риносинусите. Rhinology. 1993;31:183–184.
- Фоккенс В. Дж., Лунд В. Дж., Муллол Дж. и др. Европейская позиционная бумага по риносинуситу и носовым полипам 2012.
- Rhinol Suppl. 2012;(23):3 стр. перед оглавлением, 1–298.
- Уоллворк Б., Коман В., Макай-Сим А., Грейфф Л., Сервин А. Двойное слепое, рандомизированное, плацебо-контролируемое исследование макролида в лечении хронического риносинусита. Laryngoscope. 2006;116:189–193.
- Харуна С., Симада Ч., Озава М., Фуками С., Морияма Х. Исследование плохих ответчиков на длительное, низкодозное применение макролидов при хроническом синусите. Rhinology. 2009;47:66–71.
- Виделер В. Дж., Бадия Л., Харви Р. Дж. и др. Отсутствие эффективности длительного, низкодозного азитромицина при хроническом риносинусите: рандомизированное контролируемое исследование. Allergy. 2011;66:1457–1468.
- Перич А., Войводич Д., Балетич Н., Перич А., Мильянович О. Влияние аллергии на иммуномодулирующие и клинические эффекты длительного низкодозного лечения макролидами носового полипоза. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2010;154:327–334.
- Виделер В. Дж., ван Хи С. М., Рейнартц С., Георгала Ф. В., Мейлен К., Фоккенс В. Дж. Длительные, низкодозные антибиотики при упорном хроническом риносинусите: ретроспективный анализ. Rhinology. 2012;50:45–55.
- Сервин А., Калм О., Сандкулл П., Линдберг С. Однолетнее низкодозное лечение эритромицином при стойком хроническом синусите после синусовой хирургии: клинические результаты и влияние на мукоцилиарные параметры и назальный оксид азота. Otolaryngol Head Neck Surg. 2002;126:481–489.
