Генетическая вариация в гавайских дрозофилах. IV. Аллозимная схожесть между D. silvestris и D. heteroneura с острова Гавайи
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Виды являются эндемиками самого нового острова в архипелаге и широко симпатричны. Они легко различимы морфологически у обоих полов. С использованием стандартных электрофоретических процедур мы исследовали 25 локусов, кодирующих структурные белки, из 539 silvestris и 325 heteroneura , собранных в трех широко удаленных местностях, где два вида симпатричны. Парные сравнения внутри и между видами показывают следующие коэффициенты генетической идентичности (I Нэя): внутри silvestris 0.961 ± 0.01; внутри heteroneura 0.949 ± 0.02; между silvestris и heteroneura, 0.939 ± 0.01. Ни различия внутри, ни между видами не являются значительными. Нет фиксированных аллельных различий ни внутри, ни между видами. В трех областях симпатии виды показывают различия в частоте генов P < 0.05) на 9, 11 и 13 локусах соответственно. Это не сильно отличается от вариации внутри каждого из видов по трем местностям. У двух видов схожие уровни гетерозиготности (H) (silvestris, 0.083; heteroneura, 0.089) и процент полиморфных локусов (оба 0.37). Предполагается, что, несмотря на их морфологическое расхождение, эти виды гораздо новее, чем классические родственные виды. Значительные аллозимные различия могли не успеть накопиться.
DROSOPHILA silvestris и D. heteroneura являются парой тесно связанных гигантских видов, эндемичных только для тропических лесов острова Гавайи, самого нового в архипелаге. Они симпатричны в большинстве районов, за исключением более высоких высот, где популяции, как правило, являются исключительно silvestris.
Виды легко различаются морфологически (Hardy 1965) не только благодаря необычайно широкой голове у обоих полов heteroneura, но и по цветовым узорам лица,thorax, плевры и живота, а также по различиям в узоре крыльев. D. silvestris имеет шесть уникальных инверсий в полиморфном состоянии; седьмая инверсия полиморфна в обоих видах (Carson и Stalker 1968; Craddock и Carson 1975). Между видами нет фиксированных инверсий, и оба имеют общий набор стандартных последовательностей, т.е. хромосомно гомосеквенциальны.
Хотя между видами существует сильная сексуальная изоляция в лабораторных скрещиваниях (Ahearn и др. 1974; Kaneshiro 1976), F1 гибриды были получены из обоих взаимных скрещиваний (Craddok 1974; Ahearn и Val 1975). Оба пола этих F1 гибридов полностью фертильны, и генетическая сегрегация морфологических различий между видами была наблюдаема в поколении F и в обратных скрещиваниях (Val 1976).
Предварительные исследования аллозимов показали необычайное сходство между двумя видами (S = 0.96; Johnson и др. 1975; Johnson и Carson 1975). Настоящая статья расширяет исследование генетической изменчивости внутри и между двумя видами на растворимые белки, закодированные 25 локусами. Данные получены из трех областей симпатри. Результаты подтверждают поразительное биохимическое сходство видов, несмотря на генетические различия между ними в морфологии, инверсиях и поведении.
Материалы и методы
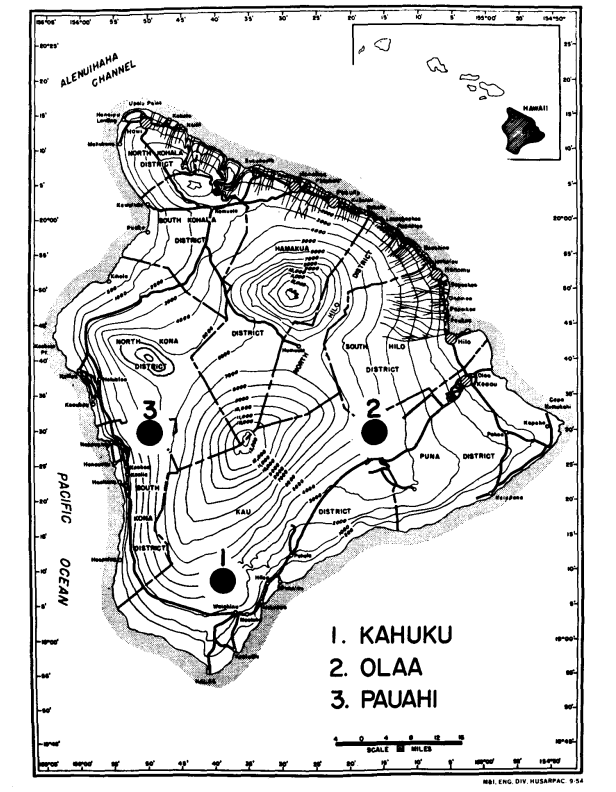
В 1974 и 1975 годах мы собрали два вида из трех районов с умеренной высотой на Гавайях (Большой Остров), где они симпатричны. Это (Рисунок 1): (1) ранчо Кахуку в южной части округа Кау, (высота 1158 м); (2) Олаа, лес рядом с Вулканической экспериментальной станцией на дороге Урайт, округ Пуна (высота 1238 м) и (3) Пауахи, округ Южный Кона (высота 1311 м). Новые самцы использовались для электрофореза как можно скорее после ловли. Самки были изолированы и позволены производить потомство F1 для использования в подготовках слюнных желез. После производства личинок матери использовались для электрофореза. Только брюшко мух подвергалось электрофорезу; остальная часть (голова, грудь и конечности) была смонтирована и помещена в коллекцию для использования в морфологических анализах.
После удаления живот был заморожен на ночь, а затем индивидуально гомогенизирован в 0,05 мл деионизированной дистиллированной воды, и каждый супернатант абсорбировался четырьмя фитилями фильтровальной бумаги Whatman No. I (1 X 0,2 см). Эти фитили были затем разделены и применены к четырем горизонтальным крахмальным гелям, комбинирующим различные буферные системы. После электрофореза каждый гель был нарезан горизонтально на четыре или пять частей, и эти части окрашивались отдельно для одного или нескольких из 25 ферментов. Вся работа проводилась с использованием Electrostarch партии 303 при концентрации 12%.
Три комбинации буферов, использованные в исследовании, следующие: Буферная система A = Гелевый буфер: pH 8.9, 0.0076 м Трис, 0.005 м цитрат; Буфер для электродов: pH 8.7, 0.269 м борная кислота, 0.1 м гидроксид натрия. Буферная система C = Гелевый буфер: pH 8.1, 0.074 м Трис, 0.008 м цитрат; Буфер для электродов: pH 8.1, катод = 0.343 м Трис, 0.079 м цитрат; анод = 0.458 м Трис, 0.0104 м цитрат. Буферная система JRP = Гелевый буфер: pH 7.0, 0.009 м Трис, 0.003 м цитрат; буфер для электродов: 0.135 м Трис, 0.040 м цитрат. Все эти буферы и методы окрашивания аналогичны тем, что описаны Штайнером и Джонсоном (1973) и Аяла и др. (1972; 1974a).
Аллели на определенном локусе были пронумерованы в соответствии с относительными подвижностями их аллозимов на указанных электрофоретических буферных системах. Аллель, производящий наиболее частый аллозим, был обозначен как l.00, а аллели, соответствующие более быстрым или более медленно мигрирующим полосам, были произвольно назначены значения, указывающие на их соответствующие подвижности.
Буфер, используемый для каждой фермента, и обозначения следующие: Буферная система A : Эстераза (EST, 1 локус) ; Щелочная фосфатаза (AP, 1 локус) ; Кислотная фосфатаза (ACPH, 1 локус) ; Глутамат-оксалоацетат трансфераза (GOT, 2 локуса) ; Альдегидоксидаза (AO, 1 локус) ; Октанолдегидрогеназа (ODH, I локус) ; Алкогольдегидрогеназа (ADH, 1 локус) ; Ксантиноксидаза (XDH, 1 локус) ; Лейцин амино пептидаза (LAP, 2 локуса) ; Глицеральдегид-3-фосфатдегидрогеназа (G-3-PDH, 1 локус). Буферная система C : Малатный фермент (ME, 1 локус) ; Малатдегидрогеназа (MDH, 2 локуса) ; α-Глицерофосфатдегидрогеназа (α-GPDH, 1 локус) ; Фосфоглюкомутаза (PGM, I локус) ; Фумараза (FUM, 1 локус) ; Сорбитолдегидрогеназа (SDH, 1 локус) ; Гексокиназа (HK, 2 локуса) ; Изоцитратдегидрогеназа (IDH, 1 локус). Буферная система JRP : 6-Фосфоглюконатдегидрогеназа (6-PGDH, 1 локус) ; Гидроксибутиратдегидрогеназа (HBDH, 1 локус) ; Фосфоглюкозоизомераза (PGI, 1 локус).
Результаты
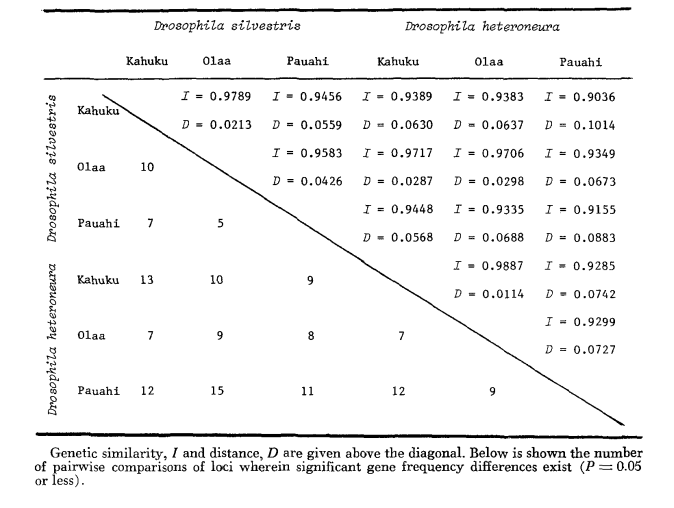
Основные данные аллозимов приведены в Таблице 1. Таблица 2 показывает результаты использования данных из Таблицы 1 для расчета коэффициентов генетического сходства, I, и расстояния, D (Nei 1972) в парном порядке внутри и между видами. В той же таблице (ниже диагонали) показано количество локусов, которые демонстрируют различия в частоте генов (P ≤ 0.05) в парных сравнениях. Расчет был выполнен с использованием χ2, используя частоту более распространенного аллеля против объединенной частоты других аллелей. Использовалась коррекция Йейтса.
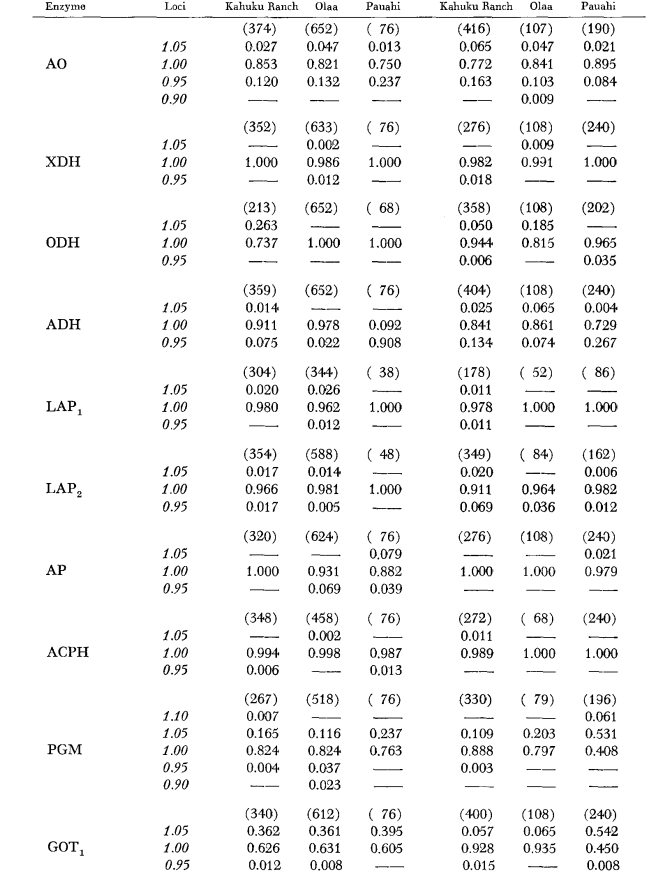
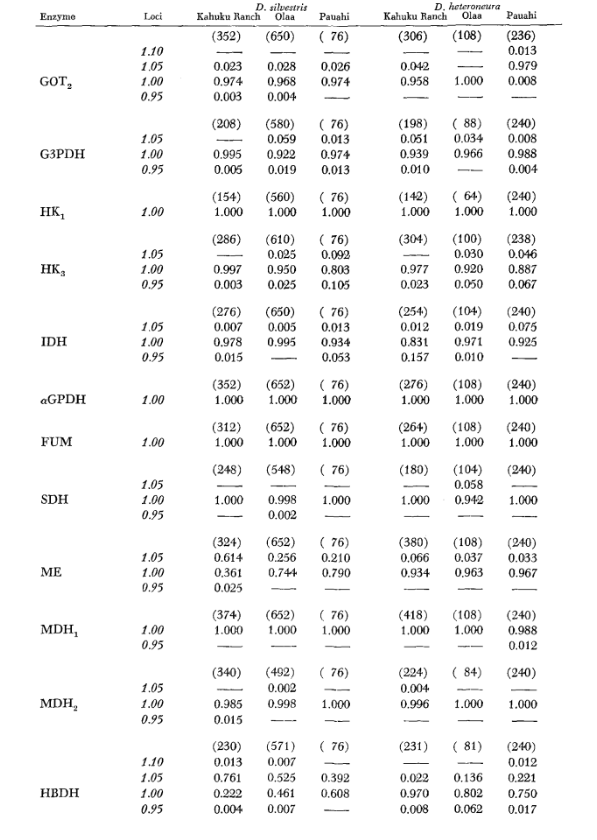
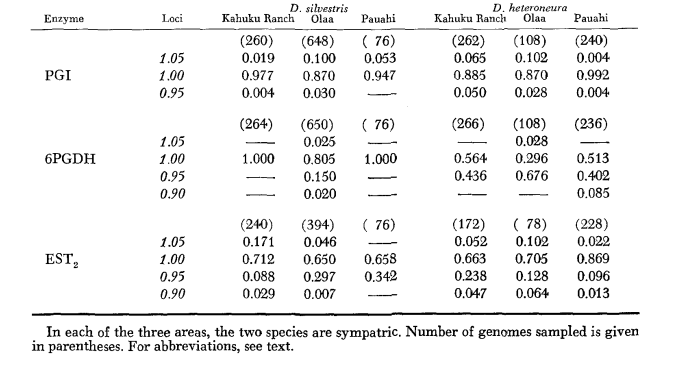
Средние уровни гетерозиготности и оценки частоты полиморфных локусов приведены в Таблице 3. Графическое представление частоты аллеля 1.0 для каждого аллозима в каждой популяции представлено на Рисунке 2.
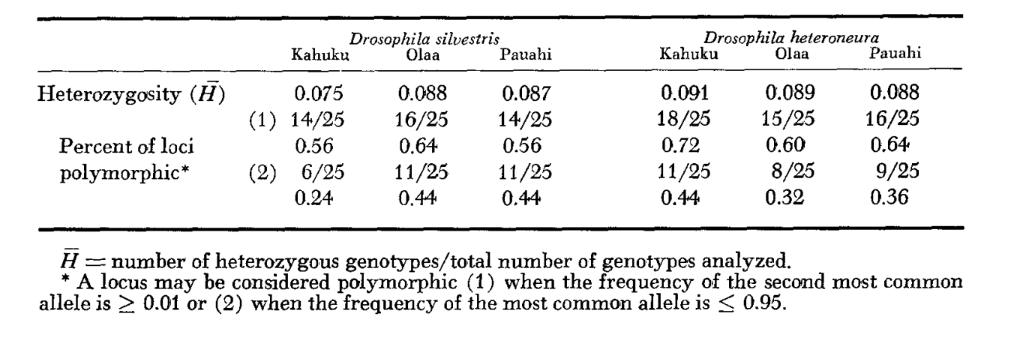
Аллозимная схожесть очень велика как внутри, так и между видами, независимо от того, измеряется ли она коэффициентами схожести или различиями в частоте генов (см. сводку в Таблице 4). Нет фиксированных аллельных различий ни внутри, ни между видами. В трех зонах симпатриии виды показывают различия в частоте генов (P = 0.05) на 9, 11 и 13 локусах соответственно. Это не сильно отличается от вариации внутри одного из видов по трем местам (silvestris: 5, 7, 10; heteroneura: 7, 9, 12). Оба вида имеют схожие уровни гетерозиготности (silvestris 0.083; heteroneura 0.089) и процент полиморфных локусов (оба 0.37).

Некоторые детали представляют интерес. Сходство между видами наименьшее в Пауахи (Таблица 2; Рисунок 2). Осмотр показывает, что это в основном связано с различиями в частоте на ADH и GOT2. Большие различия на этих локусах наблюдаются между видами только в этой области; то есть, 1.00 аллель GOT2 низок только у Pauahi heteroneura , а 1.00 аллель ADH низок только у Pauahi silvestris (Таблица 1; Рисунок 2).
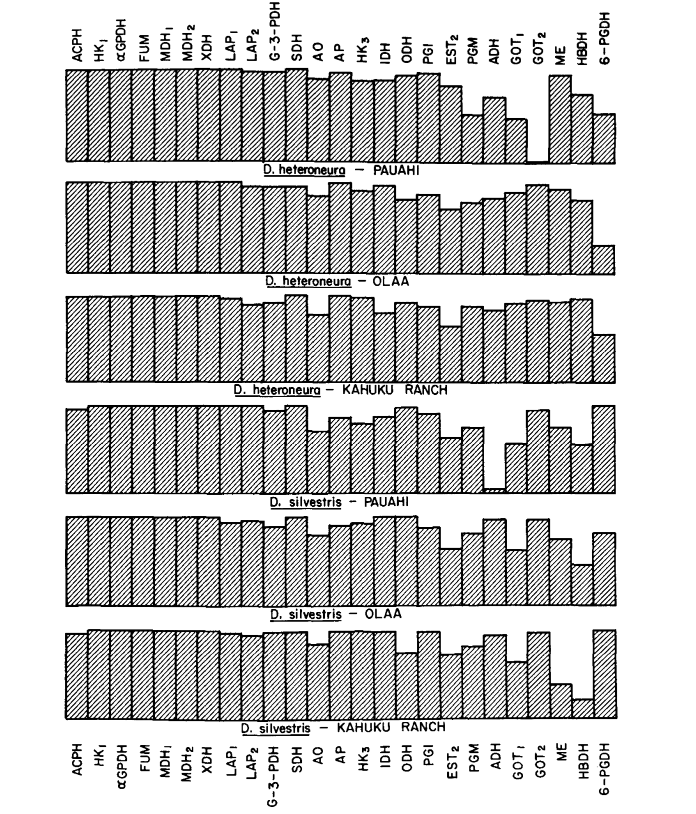
Сходство между видами несколько больше в районе Кахуку. Здесь различия касаются в основном GOT1, ME и HBDH. В Олаа сходство между видами наибольшее. GOT1 и HBDH снова показывают различия, хотя они не так велики, как между видами в Кахуку.
Обсуждение
Генетические сравнения популяций с использованием аллозимов заполнили литературу за последние десять лет (см. обзоры Айала 1975 и Пауэлла 1975). Поскольку как изученные белки, так и используемые электрофоретические методы в целом были схожи, результаты из совершенно различных таксонов могут быть полезно сопоставлены. Например, генетическое сходство между двумя видами ящериц, когда оно сведено к коэффициенту, такому как коэффициент Нэя, может быть напрямую сопоставлено с аналогичными данными от пар видов мышей, растений или дрозофил.
В своей основополагающей статье Левонтин и Хабби (1966) указали на ряд причин, почему стандартные электрофоретические методы будут предвзяты к недооценке генетической изменчивости и генетических различий. Это необходимо учитывать особенно сегодня из-за недавнего развития последовательного электрофоретического анализа. Таким образом, Сингх, Левонтин и Фелтон (1976) и Койн (1976) показали, что для локуса ксантиноксидазы D. pseudo-obscura и persimilis количество аллелей в довольно небольших естественных образцах этих видов как минимум в четыре раза больше, чем количество, выявленное стандартными методами. Что касается межпопуляционных сравнений, эти новые методы, похоже, определенно снизят наблюдаемые сходства на всех уровнях популяционной дифференциации (например, локальные популяции, подс Species, семи виды, виды).
Несмотря на эти новые разработки, сравнения, основанные на стандартных методах, продолжают быть ценными, если их ограничения осознаются. D. silvestris и heteroneura генетически гораздо ближе друг к другу, чем любые другие пары видов Drosophila, которые были изучены до сих пор, включая все пары «соседних» видов, подвидов и семиспеций (Ayala et al. 1974b). Действительно, коэффициенты сходства для популяций внутри либо silvestris, либо heteroneura находятся в том же порядке величины, что и для между этими двумя видами. Малые различия, которые существуют между парами популяций двух видов, кроме того, не одинаковы в трех изученных областях; то есть они не касаются одних и тех же локусов или аллелей.
Как обсуждалось во введении, мы продолжаем признавать эти две сущности как хорошие биологические виды. Они морфологически различны, широко симпатричны, поведенчески изолированы и различаются по своим хромосомным полиморфизмам. Морфологические различия зависят от примерно четырнадцати полигенов (Val 1976).
Однако поразительной и важной особенностью этих видов является тот факт, что взаимные гибриды, полученные в лаборатории, полностью фертильны в обоих полах (Craddock 1974; Ahearn и Val 1975). Соответственно, необходимо рассмотреть естественную гибридизацию. Хотя Craddock (1974) не нашел никаких доказательств этого, Kaneshiro и Val (1977) сообщили, что примерно два процента диких мух, пойманных на ранчо Кахуку, могут быть идентифицированы как гибриды по морфологическим признакам. Это тот же регион, где были найдены естественные гибриды между двумя другими видами (Carson, Nair и Sene 1975). Морфометрический анализ формы головы был успешно использован для определения точного взаимного родства определенных особей F, гибридов. В одном случае дикая самка D. silvestris произвела потомство, состоящее исключительно из гибридов F,. Поскольку каждая дикая самка была немедленно изолирована от всех самцов при поимке, очевидно, что соответствующие спаривания происходили в природе. Следует подчеркнуть, что фон обширных морфометрических исследований лабораторных гибридов (Val 1976) подготовил почву для этих новых естественных наблюдений, и, соответственно, диагностика этих случаев основывается на надежных сравнительных данных. Все естественные гибридные особи были исключены из электрофоретических данных, представленных в этой статье.
Еще один факт, который добавляет к необычной ситуации относительно этих видов, заключается в их близком экологическом сходстве. Оба вида были выведены из одних и тех же разлагающихся стеблей общего хозяина, Clermontia. Оба, кроме того, формируют свои лекки в очень похожих местах, так что самцы и самки обоих видов взаимодействуют в природе.
Какова причина очень большой аллозимной схожести этих видов? Две возможности приходят на ум. Во-первых, когда произошло расхождение между видами, это могло сопровождаться определенной степенью электрофоретического расхождения. Таким образом, наблюдаемые в настоящее время сходства потребуют, чтобы такие различия были стерты интрогрессивной гибридизацией после видообразования. Второй взгляд предполагает, что лишь незначительные электрофоретические изменения сопровождали события видообразования изначально. Это может быть связано с очень значительной экологической близостью.
Мы склоняемся ко второму взгляду по ряду причин. Два вида наиболее схожи в Олаа. Тем не менее, сильные доказательства недавней гибридизации были получены только для Кахуку, где виды наиболее удалены аллозимно. В Кахуку, кроме того, естественные популяции не дают никаких свидетельств о формировании "гибридного роя", напоминающего широкую генетическую рекомбинацию, наблюдаемую в лабораторных скрещиваниях. Действительно, интрогрессия между видами, вероятно, происходит, но она может быть ограничена узким генотипическим спектром естественным отбором. Таким образом, только гены биологически незначимого значения ( "открытая система", Карсон 1975) могут пересекать видовой барьер. Напротив, другие гены могут маркировать или быть функциональной частью закрытой системы эпистатических балансов, уникальных для одного или другого вида. Отбор, таким образом, может служить для предотвращения разрушения такой "закрытой системы" (Карсон 1975).
Из-за геологической новизны острова Гавайи, нам хочется предположить, что D, silvestris и D. heteroneura могут действительно быть новообразованными во времени. Это обстоятельство может быть основной причиной электрофоретического сходства двух видов. Действительно, они могут быть гораздо новее, чем классические пары «соседей по виду» (см. Карсон 1976b). Как и в других подобных очевидных неосpecies, (например, Готтлиб 1974; Тёрнер 1974; Авиз, Смит и Аяла 1975), аллозимное различие было относительно незначительным. Действительно, существует возможность, что аллозимное различие может просто коррелировать с временем, прошедшим с тех пор, как кладистическое событие отделило два сравниваемых объекта (Авиз, Смит и Аяла 1975; Карсон 1976a). Морфологические различия, с другой стороны, могут служить лучшими индикаторами основных эффектов регуляторных генов, характеризующих важные генетические различия между новообразованными видами.
Авторы: Ф. М. Сене, Х. Л. Карсон
Цитируемая литература:
- Ахерн, Дж. Н., Х. Л. Карсон, Т. Добжанский и К. Й. Канеширо, 1974 Этологическая изоляция между тремя видами подгруппы планитибия гавайской Drosophila. Proc. Natl. Acad. Sci. U.S. 71: 901—903.
- Ахерн, Дж. Н. и Ф. С. Валь, 1975 Плодородные межвидовые гибриды двух симпатрических гавайских Drosophila. Genetics 80: s9.
- Авиз, Дж. С., Дж. Дж. Смит и Ф. Дж. Аяла, 1975 Адаптивная дифференциация с небольшими генетическими изменениями между двумя местными миннообразными видами Калифорнии. Evolution '29: 411—426.
- АЯЛА, Ф. Дж., 1975 Генетическая дифференциация в процессе видообразования. Эволюционная биология 8: 1—78.
- Аяла, Ф. Дж., Дж. Р. Пауэлл, М. Л. Трейси, К. А. Моурен и С. Перес-Салас, 1972 Вариабельность ферментов в группе Drosophila willistoni. IY Генетическая вариация в естественных популяциях Drosophila willistoni. Genetics 70: 113—139.
- Аяла, Ф. Дж., М. Л. Трейси, Л. Г. Барр и Дж. Г. Эренфельд, 1974а Генетическая и репродуктивная дифференциация подсpecies, Drosophila equinoxialis caribbensis. Эволюция 28: 24—41.
- Аяла Ф. Дж., М. Л. Трейси, Д. Хеджкок и Р. С. Ричмонд, 1974б Генетическая дифференциация в процессе видообразования в Drosophila. Эволюция 28: 576—592.
- Карсон, Х. Л. 1975 Генетика видообразования на диплоидном уровне. Am. Naturalist 109: 83—92, 1976а Вывод о времени происхождения некоторых видов Drosophila. Природа 259: 395—396, 1976б Генетические различия между вновь образованными видами. Бионаука 26: 700—701.
- Карсон, Х. Л., П. С. Нейр и Ф. М. Сене, 1975 Гибриды Drosophila в природе: Доказательство обмена генами между симпатрическими видами. Наука 189: 806—807.
- Карсон, Х. Л. и Х. Д. Сталкер, 1968 Политетные хромосомные отношения в гавайских видах Drosophila. II. Подгруппа D. planitibia. Univ. Texas Publ. 6818: 355-365.
- Койн, Дж. А., 1976 Отсутствие генетического сходства между двумя родственными видами Drosophila, выявленное с помощью различных методов. Genetics 84: 593—607.
- Крэддок, Е. М., 1974 Репродуктивные отношения между гомосеквенциальными видами гавайской Drosophila. Эволюция 28: 593—606.
- Крэддок, Е. М. и Х. Л. Карсон, 1975 Вариабельность хромосом в эндемичном гавайском виде Drosophila. Genetics 80: s23.
- Готтлиб, Л. Д., 1974 Генетическое подтверждение происхождения Clarkia lingulata. Эволюция 2B: 244-250.
- Харди, Д. Е., 1965 Насекомые Гавайев, Т. 12. с. 814. Издательство Гавайского университета, Гонолулу.
- Джонсон, У. Е. и Х. Л. Карсон, 1975 Аллозимная вариация в Drosophila silvestris. Genetics 80: s46.
- Джонсон, У. Е., Х. Л. Карсон, К. Й. Канеширо, У. У. М. Стайнер и М. М. Купер, 1975 Генетическая вариация в гавайской Drosophila. II. Аллозимная дифференциация в подгруппе D. planitibia. стр. 563—584. В: Изоэнзимы IV. Генетика и эволюция. Под редакцией К. Л. Маркерта. Академическое издательство, Нью-Йорк.
- Канеширо, К. Й., 1976 Этологическая изоляция и филогения в подгруппе планитибия гавайской Drosophila. Эволюция 30: 740-745.
- Канеширо, К. Й. и Ф. С. Валь, 1977 Естественная гибридизация между симпатрической парой гавайской Drosophila. Am. Naturalist (в печати).
- Левонтин, Р. С. и Дж. Л. Хабби, 1966 Молекулярный подход к изучению генетической гетерозиготности в естественных популяциях. II. Количество вариации и степень гетерозиготности в естественных популяциях Drosophila pseudoobscura. Genetics 54: 595—609.
- Ней, М., 1972 Генетическое расстояние между популяциями. Am. Naturalist 106: 283—292.
- Пауэлл, И. Р., 1975 Вариация белков в естественных популяциях животных. Evol. Biol. 8: 79-113.
- Саймон, Р. С., Р. С. ЛЕВОНТИН и А. А. Фццоу, 1976 Генетическая гетерогенность внутри электрофоретических “аллелей” ксантиндегидрогеназы в Drosophila pseudoobscura. Genetics 84: 609—629.
- Стейнер, У. У. М. и У. Е. Джонсон, 1973 Техники электрофореза гавайской Drosophila. US/IBP Island Ecosystems IRP. Технический отчет 30: ii + 21 стр.
- Тернер Б. Дж., 1974 Генетическое расхождение видов пупфишей Долины Смерти: Биохимические против морфологических доказательств. Эволюция 18: 281-294.
- Валь, Ф. С., 1976 Генетика морфологических различий между двумя интерфертильными видами Drosophila. Genetics 83: s78.
