Гиалуроновая кислота при удалении зубов: систематический обзор и мета-анализ доклинических и клинических испытаний
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Цели Оценить, приводит ли применение гиалуроновой кислоты (ГК) у животных или пациентов с ≥ 1 удаленным зубом к лучшему заживлению и/или улучшенному управлению осложнениями по сравнению с любым другим лечением или без лечения.
Материалы и методы Три базы данных были исследованы до апреля 2022 года. Наиболее релевантные критерии отбора были (1) местное применение ГК в качестве дополнения к удалению зуба или в качестве лечения альвеолярного остеита, и (2) наличие клинических, рентгенографических, гистологических или данных, сообщаемых пациентами. Образование новой кости и/или ее качество рассматривались как основные параметры исхода в доклинических исследованиях, в то время как боль, отек и тризм определялись как основные параметры исхода в клинических исследованиях.
Результаты В исследование были включены пять доклинических и 22 клинических исследования (1062 пациента на финальной оценке). В доклинических испытаниях ГК применялась в лунке удаления зуба. Хотя положительный эффект ГК наблюдался во всех отдельных исследованиях по образованию кости, этот эффект не был подтвержден мета-анализом. В клинических исследованиях ГК применялась в лунке удаления зуба или использовалась в виде спрея или ополаскивателя для рта. Применение ГК после неоперативного удаления нормально прорезавшихся зубов может оказать положительное влияние на заживление мягких тканей. На основе мета-анализов применение ГК после хирургического удаления нижних третьих моляров (Н3М) привело к значительному снижению восприятия боли через 7 дней после операции по сравнению с отсутствием дополнительного манипулирования раной или применением плацебо/носителя. Ранняя послеоперационная боль, тризм и степень отека не изменились.
Выводы Применение HyA может оказать положительное влияние на снижение боли после удаления LM3, но не после экстракции нормально прорезавшихся зубов.
Клиническая значимость Применение HyA может оказать положительное влияние на снижение боли после хирургического удаления LM3, но, похоже, не влияет на другие осложнения или после экстракции нормально прорезавшихся зубов. Более того, кажется, что оно не снижает моделирование альвеолярного гребня после экстракции, хотя доклинические исследования показывают улучшенное образование кости.
Введение
Хотя процесс заживления после экстракции зуба обычно протекает без осложнений, любая последующая боль может негативно сказаться на благополучии пациентов, также могут возникнуть осложнения. Например, хирургическая экстракция полузакрытых/закрытых третьих моляров регулярно сопровождается значительной болью, отеком и тризмом, которые усугубляются в случае развития альвеолярного остеита (АО) — также называемого сухой лункой. АО считается одним из самых частых осложнений экстракции зубов, возникающим в 20-35% случаев хирургической экстракции нижних третьих моляров (LM3) и в 1,4-5% случаев (нехирургической) экстракции нормально прорезавшихся зубов. Кроме таких ранних осложнений, которые негативно влияют на качество жизни пациентов, нарушенное заживление лунки после экстракции также может привести к значительным дефектам твердых тканей, как на месте экстракции, так и на соседних зубах. Например, сообщалось, что глубокие пародонтальные дефекты, например, глубина зондирования карманов ≥ 7 мм, на дистальной стороне второго моляра возникают почти у каждого четвертого пациента после экстракции impacted LM3.
Чтобы снизить заболеваемость пациентов и улучшить заживление мягких и твердых тканей в лунках после экстракции, а также для лечения ранних осложнений (например, AO), были протестированы различные материалы и/или хирургические техники (например, применение коллагеновых губок, гелей, производных крови, различных материалов для пересадки). В последнее время все большее внимание уделяется гиалуроновой кислоте (HyA) из-за ее противовоспалительных и антибактериальных свойств, а также положительного влияния на заживление мягких и твердых тканей. В частности, доклинические исследования продемонстрировали положительный эффект, гистологически, на заживление костных и пародонтальных дефектов после применения HyA. На основе результатов мета-анализов систематического обзора клинических испытаний по хирургической экстракции третьих моляров было сообщено о значительном снижении боли на третий и седьмой послеоперационный день, но не на тризмус, в группах, получавших продукты на основе HyA. В этом контексте отсутствует комплексная оценка доступных доклинических и клинических данных о влиянии применения HyA в связи с экстракцией зубов в целом, включая распространенность, степень и/или управление осложнениями. Поэтому в настоящем систематическом обзоре был рассмотрен следующий вопрос PICOS (популяция (P), вмешательство (I), сравнение (C), результаты (O) и дизайн исследования (S)): “У животных/пациентов с экстракцией ≥ 1 зуба, приводит ли применение HyA в одиночку или в сочетании с другими продуктами/носителями к лучшему заживлению мягких/твердых тканей, снижению заболеваемости, снижению частоты осложнений и/или улучшению управления осложнениями по сравнению с любым другим лечением или без лечения?”.
Материалы и методы
Протокол исследования и регистрация исследования
Настоящая работа следовала доступным рекомендациям по проведению систематических обзоров предклинических и клинических исследований (Предпочтительные элементы для систематических обзоров и мета-анализов (PRISMA); Приложение 1). Оба протокола были зарегистрированы в международном проспективном регистре систематических обзоров (PROSPERO), т.е. один для предклинического (CRD42021266190) и один для клинических испытаний (CRD42021266183).
Источники информации, поиск литературы и критерии приемлемости
Поиск литературы был проведен в 3 базах данных (т.е. Ovid (MEDLINE и CENTRAL), EMBASE и Pubmed) 14 октября 2021 года и обновлен 7 апреля 2022 года. Подробности поиска, включая ключевые слова, представлены в Приложении 2. После удаления дубликатов заголовки и аннотации были отскринированы на предмет приемлемости двумя рецензентами (DD, TL), и значения каппы для отскринированных полных текстов и окончательно включенных публикаций были рассчитаны. Любая неясность была разрешена в обсуждении с третьим автором (KB). Независимо от типа исследования, исследования были включены, если (a) написаны на английском или немецком языке, (b) полный текст был доступен и (c) были предоставлены клинические, рентгенографические или гистологические данные. Дополнительные критерии включения для предклинических исследований были (a) рандомизированные и нерандомизированные контролируемые эксперименты и (b) местное применение продукта на основе гиалуроновой кислоты (HyA) самостоятельно или в сочетании с другим продуктом в ≥ 1 из групп после удаления ≥ 1 зуба. Дополнительные критерии включения для клинических исследований были (a) рандомизированное контролируемое испытание (RCT), контролируемое испытание (CT) или серия случаев с минимум 10 пациентами и (b) местное применение продукта на основе HyA самостоятельно или в сочетании с другим продуктом в ≥ 1 из групп либо после удаления ≥ 1 зуба, либо как лечение AO ≥ 1 зуба.
Сбор и извлечение данных
Два автора (DD, KB) независимо извлекали данные дважды, и любые разногласия разрешались в обсуждении с третьим автором (AS). Из доклинических исследований была извлечена следующая информация: (a) первый автор, (b) год публикации, (c) дизайн исследования, (d) модель лечения, (e) место лечения, (f) вид, (g) форма применения HyA, (h) группы лечения, (i) период наблюдения, (j) доступные параметры исхода и (k) детали финансирования. Аналогично, из клинических испытаний была извлечена следующая информация: (a) первый автор, (b) год публикации, (c) дизайн исследования, (d) характеристики пациентов (т.е. пол, возраст, состояние здоровья и курение), (e) специфические критерии включения для места, (f) количество мест на начальном этапе и последнем наблюдении, (g) группы лечения, (h) детали продукта, (i) форма применения, (j) период наблюдения, (k) послеоперационные медикаменты, (l) доступные параметры исхода, (m) клинические условия (т.е. частная практика или университетская обстановка) и (n) детали финансирования. Наконец, вся доступная информация о продуктах на основе HyA была обобщена, т.е. (a) торговое название, (b) производитель, (c) концентрация, (d) химическая форма и (e) форма применения.
Оценка риска смещения
Для доклинических испытаний использовался инструмент оценки риска смещения (RoB) SYRCLE. Как было предложено, следующие критерии оценивались как имеющие «низкий», «высокий» или «неясный» риск смещения: (1) генерация последовательности, (2) базовые характеристики, (3) сокрытие распределения, (4) случайное размещение, (5) слепое исследование для опекунов или исследователей, (6) случайная оценка результатов, (7) слепая оценка результатов, (8) неполные данные о результатах, (9) выборочная отчетность о результатах и (10) другие источники смещения. Для каждого исследования рассчитывались количество и процент положительно оцененных пунктов (т.е. «оценка качества»).
Для РКИ использовался инструмент RoB 2.0 от Корановского сотрудничества. Риск смещения оценивался как «низкий», «высокий» или «некоторые» проблемы для каждого из следующих критериев: (1) процесс рандомизации, (2) отклонения от запланированных вмешательств, (3) отсутствующие данные о результатах, (4) измерение результата, (5) выбор отчетного результата и (6) общий риск смещения. Для нерандомизированных испытаний использовался инструмент ROBINS-I. Риск смещения оценивался как «низкий», «умеренный», «серьезный», «критический» или «нет информации» для следующих критериев: (1) смешение, (2) выбор участников, (3) классификация вмешательств, (4) отклонения от запланированных вмешательств, (5) отсутствующие данные о результатах, (6) измерение результата, (7) выбор отчетного результата и (8) общий риск смещения.
Оценка была проведена двумя рецензентами (DD, KB), и в случае любой неясности консенсус был достигнут путем обсуждения с третьим автором (AS). Один автор повторил оценку (DD).
Синтез результатов и статистический анализ
Для доклинических исследований основными параметрами исхода были новые образования костной ткани и объем кости на объем ткани (BV/TV), в то время как для клинических исследований основными параметрами исхода были боль, тризм и отек. Данные были извлечены из текста, таблиц и рисунков, рассчитаны и/или были связаны с авторами оригинальных публикаций.
В случае, если были выявлены как минимум 2 рандомизированных исследования с сопоставимым дизайном исследования (т.е. показание к лечению, режим HyA, период наблюдения, оценка исходов), была проведена парная мета-анализа. Мета-анализы были ограничены РКИ, таким образом, включая исследования с более высоким методологическим качеством. Группы, применяющие HyA, сравнивались либо с негативной контрольной группой (т.е. без дополнительного этапа лечения), либо с контрольной группой, применяющей другое лечение, включая плацебо или носитель материала тестовой группы (“плацебо/носитель”). Парные мета-анализы проводились для каждого отдельного сравнения, а также в целом. Для расчета гетерогенности (τ2) использовалась ограниченная максимальная правдоподобие, и была применена корректировка стандартной ошибки по методу Knapp–Hartung для учета небольшого количества исследований. Средняя разница между контрольной и тестовой группой, стандартная ошибка средней разницы и 95% доверительный интервал (CI) были рассчитаны. В исследованиях с дизайном split-mouth данные рассматривались как зависимые при расчете стандартной ошибки средней разницы с установкой r = 0.5. Для оценки гетерогенности использовался тест хи-квадрат, и значение p < 0.1 считалось показателем значительной гетерогенности. Кроме того, был проведен тест I2 на однородность для количественной оценки степени гетерогенности, и в случае наличия как минимум 3 сопоставимых исследований дополнительно рассчитывался 95% предсказательный интервал. Статистический анализ проводился с помощью STATA/IC 17.0 для Mac.
Качество доказательств (GRADE)
Уверенность в мета-аналитических доказательствах предклинических и клинических испытаний, включенных в данный обзор, была обобщена с помощью системы оценки рекомендаций (GRADE). Для предклинических и клинических испытаний использовалось программное обеспечение GRADEpro GDT (Инструмент разработки рекомендаций, Университет Макмастера и Evidence Prime, 2022) для оценки качества доказательств результатов.
Результаты
Выбор и характеристики исследований
Поиск литературы представлен в Приложении 3; было идентифицировано 147 потенциальных ссылок, и после удаления дубликатов осталось 90 исследований для скрининга заголовков и аннотаций. В общей сложности 57 исследований было удалено по различным причинам, оставив 33 исследования для анализа полного текста. После исключения еще 6 исследований, в которых тип продукта не соответствовал критериям включения или был неверный дизайн исследования, в данный систематический обзор были включены 5 предклинических и 22 клинических исследования. Оба рецензента полностью согласились по выбранным исследованиям для скрининга полного текста (коэффициент Каппа Коэна = 1; 100% согласие), в то время как значительное согласие было достигнуто по окончательному включению исследований (коэффициент Каппа Коэна = 0.61; 84.9% согласие).
Во всех доклинических испытаниях HyA применялся в лунке зуба после удаления регулярно прорезавшихся зубов. Клинические испытания были разделены на 3 группы в зависимости от показаний к лечению: (1) хирургическое удаление LM3 (RCT (n = 10), CT (n = 1)), (2) удаление регулярно прорезавшихся зубов (RCT (n = 7), нерандомизированное исследование с разделением на челюсти (n = 1), проспективная серия случаев (n = 1)), и (3) лечение AO (RCT (n = 1), проспективная серия случаев (n = 1)).
Популяция исследования
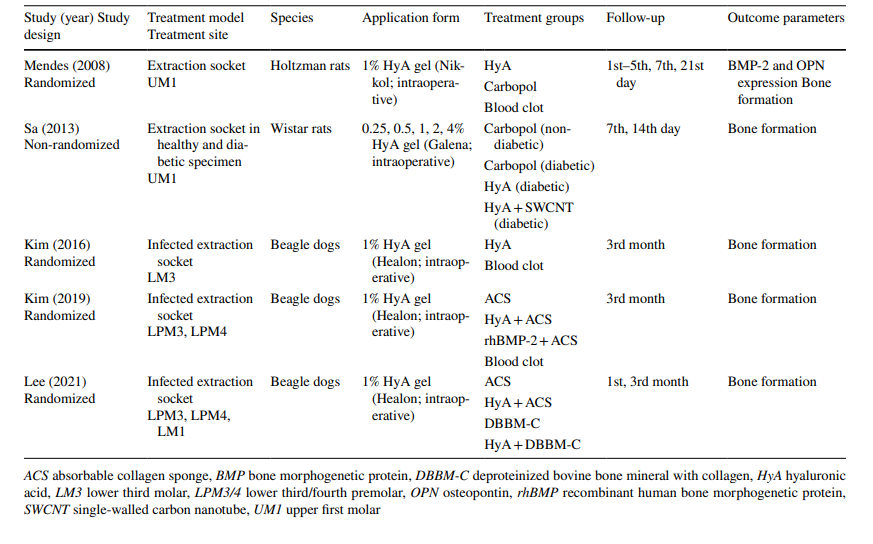
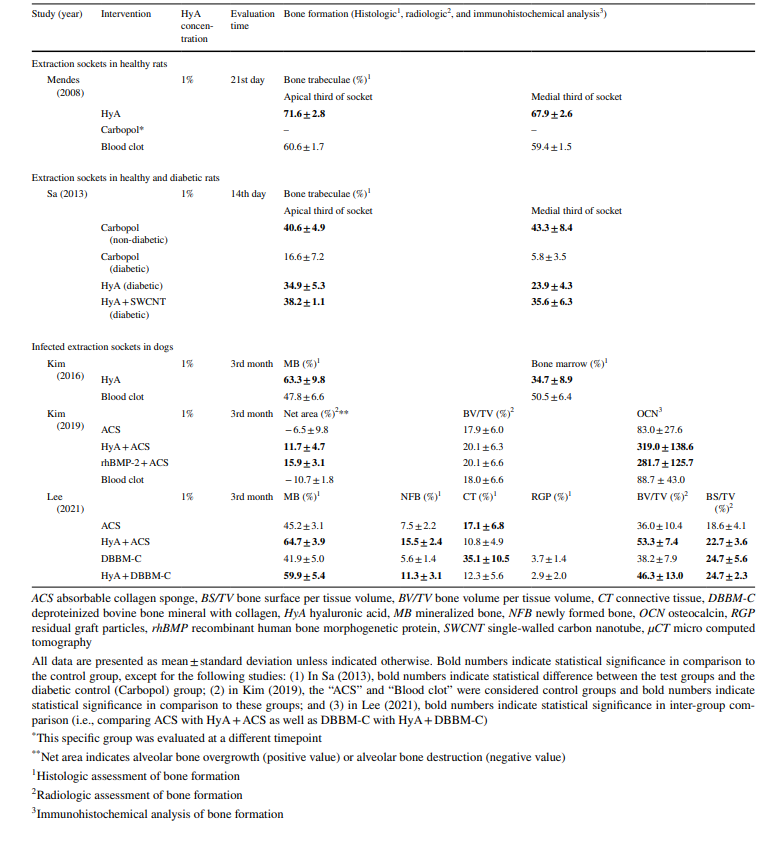
Что касается доклинических исследований, 2 исследования включали 5–11 крыс Холтцмана или 5–6 крыс Уистара в различных группах, в то время как 3 исследования использовали собак породы бигль (всего 20 собак). В исследованиях с крысами HyA применялся в лунке после удаления как у здоровых, так и у диабетических животных, тогда как в исследованиях с собаками HyA применялся в инфицированных лунках после удаления (Таблица 1).
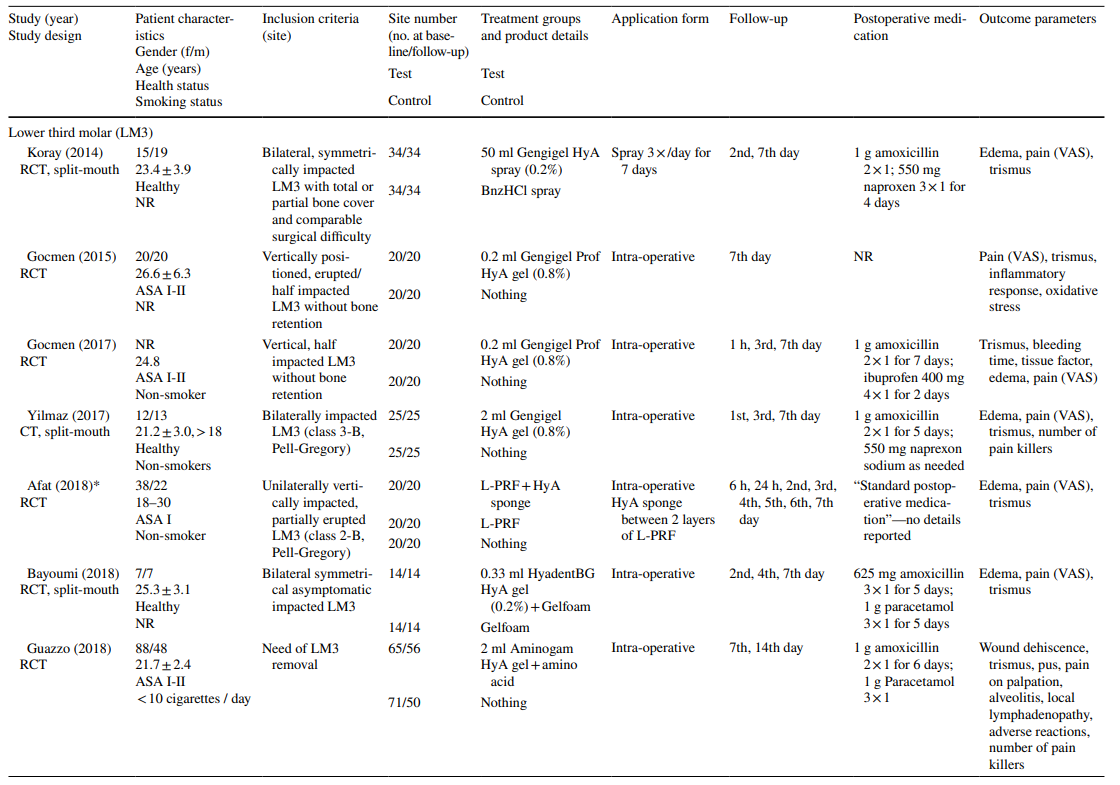
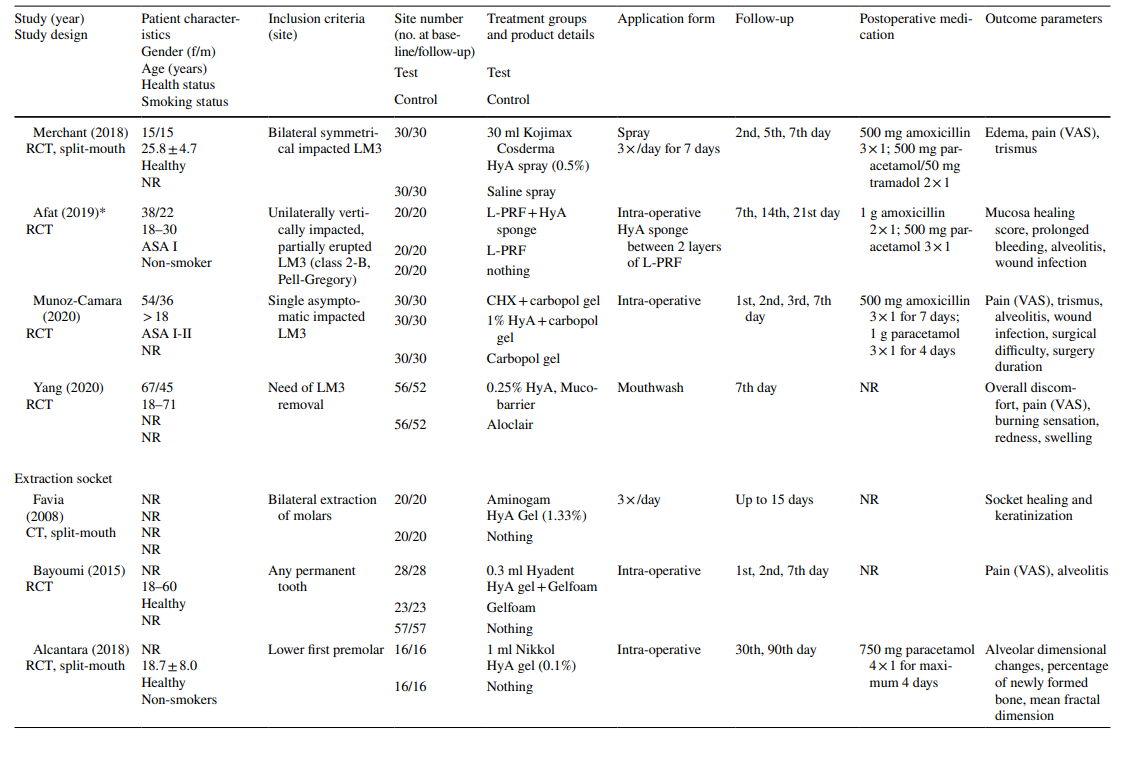
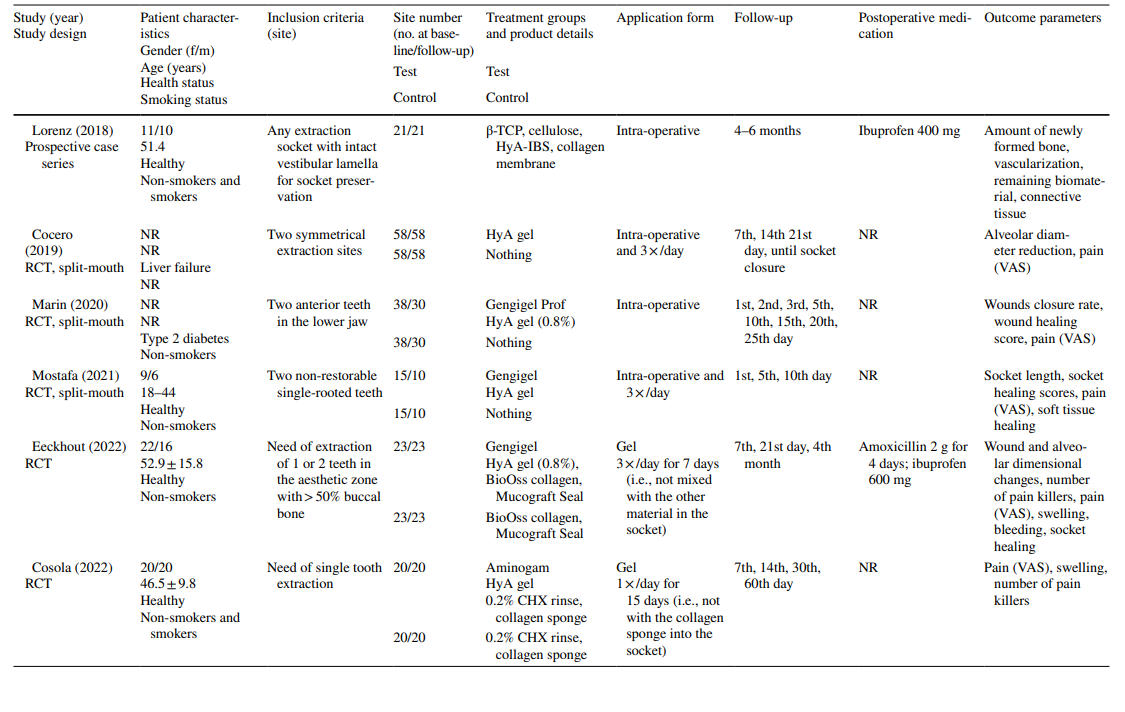
Клинические исследования по хирургическому удалению LM3, экстракции регулярно прорезавшихся зубов и лечению AO на финальной оценке включали 603, 349 и 110 пациентов соответственно, что составило 306, 226 и 90 участков, обработанных HyA, и 370, 257 и 20 контрольных/необработанных HyA участков соответственно (Таблица 2). В большинстве исследований пациенты были системно здоровыми, в то время как одно исследование касалось пациентов с хроническим заболеванием печени, а другое — диабетиков; 4 исследования не сообщали о состоянии здоровья пациентов. Статус курения был указан в 12 исследованиях; 8 исследований включали только некурящих, 2 исследования включали пациентов, курящих ≤ 10 сигарет в день, и 2 исследования включали как некурящих, так и курящих. Десять исследований не предоставили никакой информации о статусе курения.
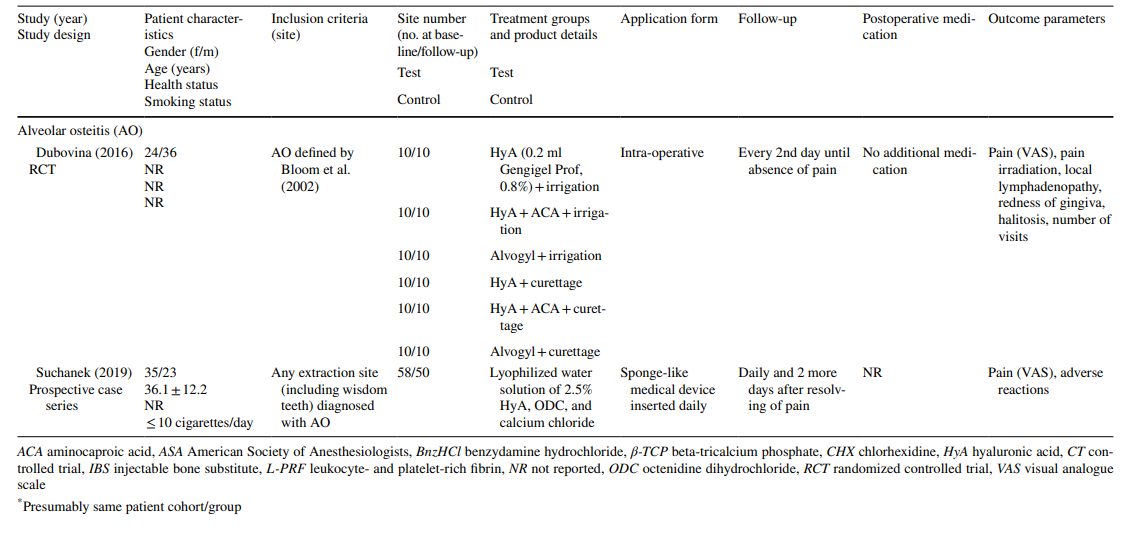
В исследованиях по экстракции LM3 зубы были асимптомными, преимущественно вертикально импактированными или полуподнятыми, что позволяло первичное закрытие раны после хирургического удаления. Половина исследований по экстракции регулярно прорезавшихся зубов включала только однокорневые зубы (либо передние зубы, либо премоляры), в то время как другая половина включала либо моляры, либо любые типы зубов. Оба исследования в группе лечения AO включали все типы зубов, соответствующие критериям AO согласно Блуму и др. (2002).
Интервенция исследования
Во всех доклинических испытаниях HyA применялся в виде геля в лунке экстракции непосредственно после удаления зуба либо самостоятельно (n = 3), либо в комбинации с абсорбируемой коллагеновой губкой (n = 2) (Таблица 1).
В большинстве клинических исследований (n = 19) (Таблица 2), HyA применялся в виде геля интраоперационно в лунке экстракции или послеоперационно на месте экстракции либо самостоятельно (n = 13), либо с некоторым носителем (т.е. абсорбируемой коллагеновой губкой (n = 3), фибрином, богатым лейкоцитами и тромбоцитами (n = 2), или заменителями кости (n = 1)). В оставшихся 3 клинических исследованиях HyA использовался либо в виде спрея 3 раза в день в течение 1 недели (n = 2), либо в виде ополаскивателя для рта (n = 1).
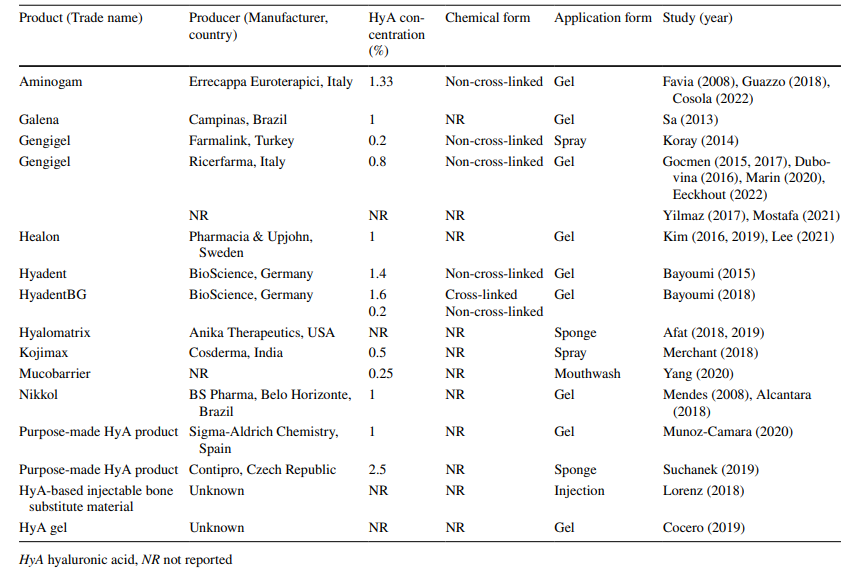
Информация о HyA
В 5 предклинических и 22 клинических исследованиях использовались 11 коммерческих, 2 самодельных и 2 продукта HyA неизвестного происхождения (Таблица 3). Во всех предклинических исследованиях (n = 5) HyA применялся в виде геля, в то время как в клинических исследованиях HyA применялся в виде геля (n = 15), спрея (n = 2), ополаскивателя для рта (n = 1) или в сочетании со спонжем (n = 3) или материалом замещения кости (n = 1) в процессе изготовления. Концентрация HyA варьировала от 0,2% в спреях, 0,25% в ополаскивателях для рта до 2,5% в самосозданном спонже HyA, в то время как в 5 исследованиях концентрация HyA не была указана. Химическая форма, т.е. не сшитая или сшитая, не была указана в большинстве исследований (n = 16), в то время как в 10 исследованиях использовался не сшитый HyA, а одно исследование сочетало не сшитый и сшитый HyA.
Клинические условия и детали финансирования
Все доклинические испытания финансировались независимыми единичными или многими исследовательскими грантами.
В одном клиническом исследовании был представлен многоцентровый дизайн исследования, включающий 8 медицинских центров, в то время как все остальные клинические исследования проводились в одном отделении в университетской обстановке. Одиннадцать клинических исследований не сообщили о источниках финансирования, в то время как в 9 клинических исследованиях финансирование было предоставлено отделением; однако в 3 из этих 9 исследований гель HyA был предоставлен производителем. В одном исследовании финансирование было предоставлено 3 различными исследовательскими фондами.
Сообщенные переменные исхода и наблюдение
В доклинических исследованиях образование кости оценивалось различными методами в течение 14 дней и 3 месяцев после операции. Одно исследование дополнительно исследовало уровень белка морфогенетического фактора кости-2 и остеопонтина (Таблица 1). Кроме того, 4 исследования не зафиксировали побочных эффектов после применения HyA, в то время как одно исследование не сообщило о наличии/отсутствии побочных эффектов.
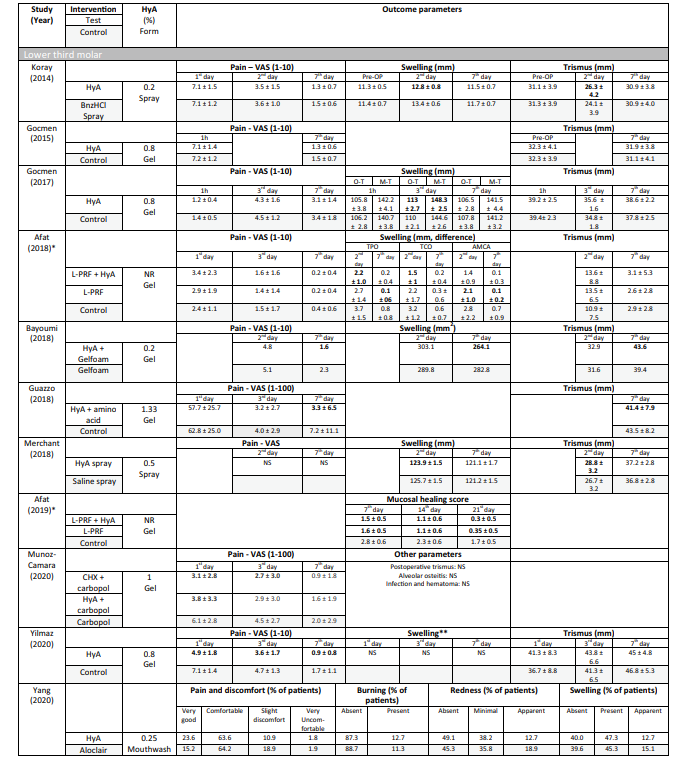
В клинических исследованиях оцениваемые параметры исхода варьировались в зависимости от показания к лечению (Таблица 2). В исследованиях по хирургическому удалению LM3 наиболее часто оценивались наличие боли, измеряемой по визуальной аналоговой шкале (VAS), отек и тризм. Другие, менее часто оцениваемые параметры, включали наличие/отсутствие продолжительного кровотечения, наличие/отсутствие расхождения мягких тканей, скорость заживления слизистой оболочки, частоту AO/инфекции раны и лабораторные маркеры воспаления, окислительного стресса и заживления раны. Среди исследований по экстракции регулярно прорезавшихся зубов 3 публикации использовали различные баллы заживления лунки/мягких тканей, 3 публикации оценивали количество новообразованной кости и/или изменения размеров альвеол, 3 публикации оценивали боль, и одно исследование оценивало частоту AO. Оба исследования по лечению AO сосредоточились на оценке боли и побочных реакций. Большинство клинических исследований не зафиксировали побочных эффектов после местного применения HyA, в то время как 6 исследований не упоминали об отсутствии/наличии побочных эффектов. Одно исследование, применяющее 0,8% гель HyA после удаления LM3, сообщило о значительно увеличенном времени кровотечения после закрытия раны по сравнению с контрольной группой; однако, поскольку гемостаз находился в пределах физиологического времени, это не считалось неблагоприятным событием.
Сводка результатов отдельных исследований
Во всех доклинических исследованиях (Таблица 4), основанных на гистологическом, радиологическом или иммуногистохимическом анализе, тестовые группы с HyA показали значительно лучшие результаты по сравнению с контрольной группой по крайней мере по одному из параметров, касающихся формирования кости; это было независимо от состояния лунки (здоровой или инфицированной) и типа контрольного лечения.
В 4 из 10 клинических исследований по хирургическому удалению LM3 (Таблица 5), в которых сообщалось о боли, были зарегистрированы значительные преимущества для тестовой группы, использующей HyA, по сравнению с контрольной группой, по крайней мере, в одной послеоперационной точке времени. Аналогично, в 4 из 7 исследований и в 3 из 9 исследований, сообщающих о отеке и тризме соответственно, были зарегистрированы значительные преимущества в пользу применения HyA по сравнению с контрольной группой. В 3 из 4 исследований, сообщающих о заживлении мягких тканей после удаления регулярно прорезавшихся зубов, было зафиксировано значительно улучшенное заживление мягких тканей после применения HyA по сравнению с контрольной группой. Более того, одно исследование сообщило о улучшении костной ткани через 30 дней, одно исследование сообщило о снижении уменьшения альвеолярного диаметра до 21 дня, в то время как 2 исследования сообщили либо о отсутствии разницы между группами, либо о значительных недостатках для тестовой группы, использующей HyA, в терминах изменений альвеолярных размеров. Наконец, восприятие боли было зарегистрировано в 6 исследованиях, но только 2 исследования сообщили о значительных различиях между группами в пользу применения HyA. Одно исследование, оценивающее лечение AO, сообщило о значительно меньшей послеоперационной боли после применения HyA по сравнению с применением алвогила; во втором исследовании не было контрольной группы.

Синтез результатов
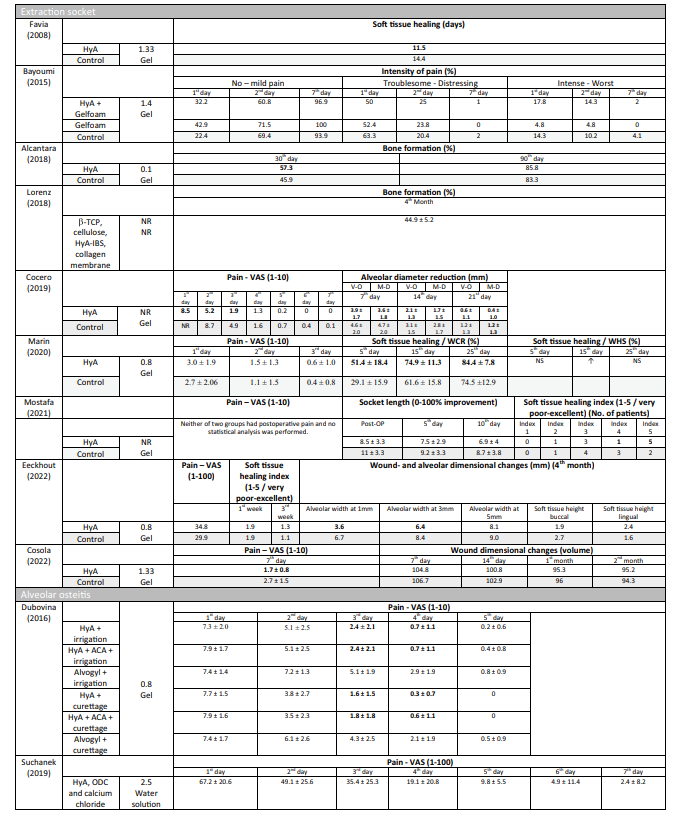
Предклинические исследования — объем кости на объем ткани в предклинических испытаниях
Два предклинических исследования предоставили данные для обобщения радиографически оцененного BV/TV через 3 месяца после операции (Рис. 1). Исследования сравнили применение HyA в комбинации с абсорбируемой коллагеновой губкой и абсорбируемой коллагеновой губкой. В целом, значительных различий между группами не было выявлено (размер эффекта: 9.57; 95% ДИ: − 86.22 до 105.36; p = 0.42), но статистическая гетерогенность между исследованиями была значительной (I2 = 89.89%; p < 0.01).
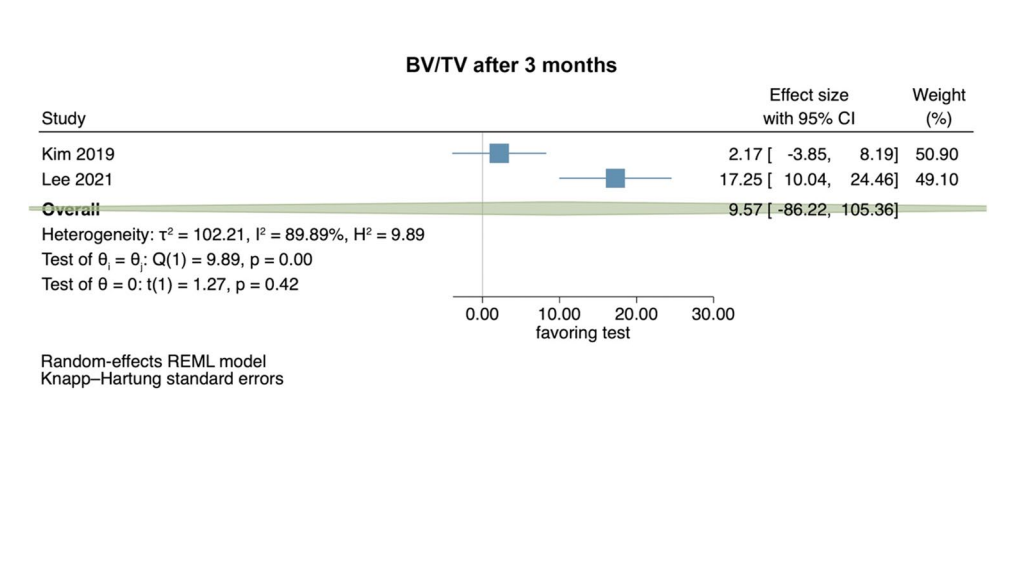
Клинические исследования — оценка боли через 2–3 и 7 дней после хирургического удаления LM3
На основе результатов 4 РКИ восприятие боли не показало статистически значимых различий между тестовой и контрольной группами через 2–3 дня после операции (размер эффекта: 0.52; 95% ДИ: − 0.34–1.38; p = 0.15), без статистической гетерогенности среди исследований (I2 = 0.00%; p = 0.37). Отдельные анализы с 2 исследованиями, сравнивающими HyA с негативной контрольной группой (размер эффекта: 0.44; 95% ДИ: − 3.24–4.12; p = 0.37) и HyA с плацебо/носителем (размер эффекта: 0.78; 95% ДИ: − 7.67–9.24; p = 0.45), также не имели статистической значимости (Рис. 2a).
На основе результатов 5 РКИ восприятие боли через 7 дней после операции было значительно ниже в тестовых группах, применяющих HyA (размер эффекта: 0.32; 95% ДИ: 0.12–0.51; p = 0.01), без статистической гетерогенности среди исследований (I2 = 0.00%; p = 0.84). Однако отдельные анализы не показали статистической значимости для сравнения HyA с негативной контрольной группой (3 исследования; размер эффекта: 0.27; 95% ДИ: − 0.05–0.60; p = 0.07) и для сравнения HyA с плацебо/носителем (2 исследования; размер эффекта: 0.53; 95% ДИ: − 0.48–1.54; p = 0.09; Рис. 2b).
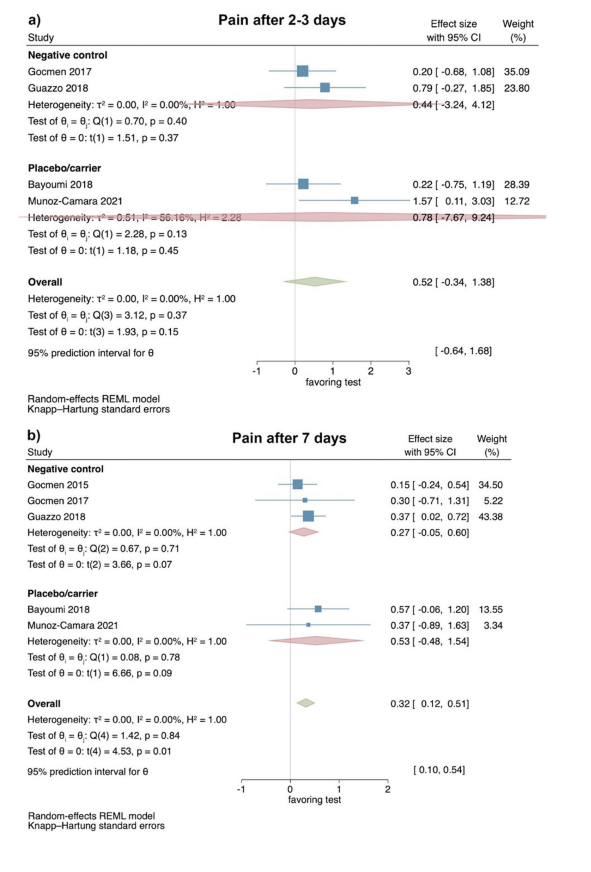
Клинические исследования — оценка отека через 2–3 и 7 дней после хирургического удаления LM3
На основе результатов 2 РКИ степень отека через 2–3 дня после операции не показала значительной разницы между тестовой и контрольной группами (размер эффекта: − 2.08; 95% ДИ: − 23.73–19.58; p = 0.44); однако статистическая гетерогенность среди исследований была значительной (I2 = 87.94%; p < 0.01; Рис. 3a).
Аналогично, степень отека через 7 дней после операции также не показала значительной разницы между тестовой и контрольной группами (размер эффекта: 1.75; 95% ДИ: − 14.38–17.89; p = 0.40), и статистическая гетерогенность среди исследований снова была значительной (I2 = 66.86%; p = 0.08; Рис. 3b). Отдельный анализ для сравнения HyA с любой негативной контрольной группой или группой плацебо/носителя не был возможен из-за ограниченного числа исследований.
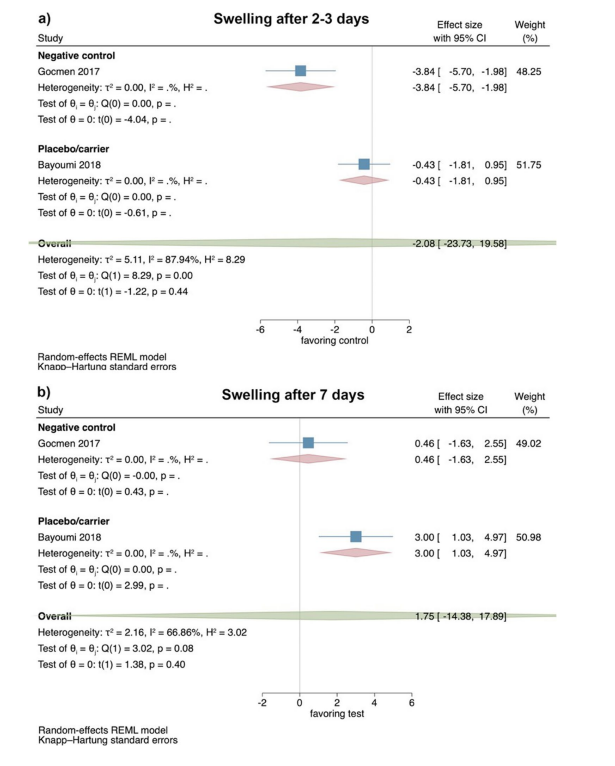
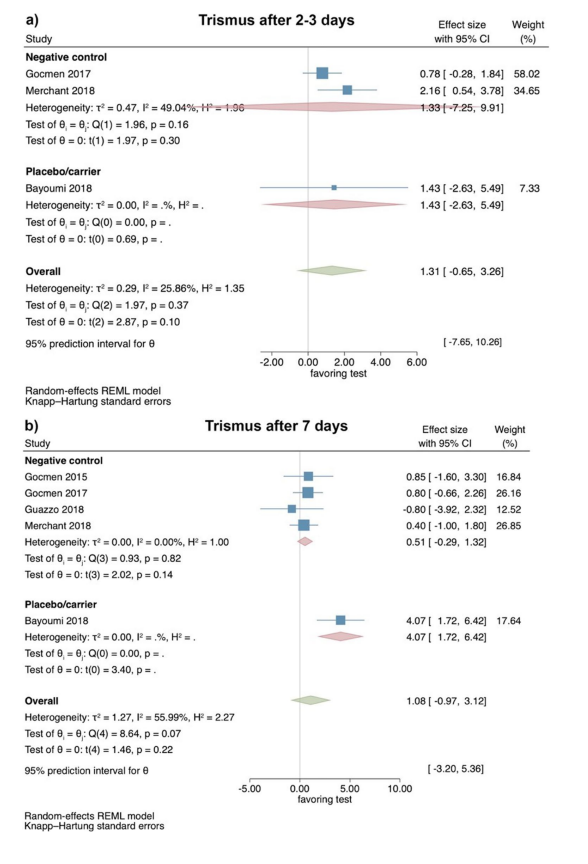
Клинические исследования — оценка тризмуса через 2–3 и 7 дней после хирургического удаления LM3
На основе результатов 3 РКИ тризмус не показал значительных различий между тестовой и контрольной группами через 2–3 дня после операции (размер эффекта: 1.31; 95% ДИ: − 0.65–3.26; p = 0.10), без статистической гетерогенности среди исследований (I2 = 25.86%; p = 0.37). Отдельные анализы также не показали статистической значимости для сравнения HyA с негативной контрольной группой (2 исследования; размер эффекта: 1.33; 95% ДИ: − 7.25–9.91; p = 0.30), в то время как только одно исследование было доступно для сравнения HyA с группой плацебо/носителя (Рис. 4a).
На основе результатов 5 РКИ тризмус не показал значительных различий между тестовой и контрольной группами через 7 дней после операции (размер эффекта: 1.08; 95% ДИ: − 0.97–3.12; p = 0.22); однако статистическая гетерогенность среди исследований была значительной (I2 = 55.99%; p = 0.07). Отдельные анализы также не показали значительных различий между HyA и негативной контрольной группой (4 исследования; размер эффекта: 0.51; 95% ДИ: − 0.29–1.32; p = 0.14), в то время как только одно исследование было доступно для сравнения HyA с группой плацебо/носителя (Рис. 4b).
Оценка риска смещения
Среди доклинических исследований качество оценивалось в диапазоне от 20 до 40% (Приложение 4); только отчетность о базовых характеристиках и других источниках смещения во всех исследованиях оценивалась как низкий риск смещения.
Включенные РКИ были оценены как имеющие некоторые опасения (n = 13) или низкий риск предвзятости (n = 5) (Приложение 5). Ни один из РКИ не отклонился от запланированного вмешательства, 5 РКИ были оценены как имеющие некоторые опасения в процессе рандомизации, и примерно половина исследований была оценена как имеющая некоторые опасения в их отчетности о пропущенных данных о результатах, измерении результата и выборе представленных результатов. Большинство нерандомизированных исследований были оценены как имеющие низкий риск предвзятости (n = 3), в то время как одно исследование было оценено как имеющее некоторые опасения (Приложение 6).
Качество доказательств (GRADE)
Для результатов мета-анализа, включающего 2 доклинических испытания, степень уверенности в доказательствах для параметра результата BV/TV через 3 месяца была оценена как низкая (Приложение 8a).
Степень уверенности в доказательствах, полученных из мета-анализов, включающих клинические испытания, была оценена как умеренная для восприятия боли и тризмуса и как низкая для оценки отека (Приложение 8b).
Обсуждение
HyA продемонстрировала противовоспалительные, противоотечные, остеоиндуктивные и проангиогенные свойства; таким образом, кажется, что HyA улучшает заживление ран.
Настоящий систематический обзор был направлен на предоставление всесторонней оценки всех доступных данных (т.е. доклинических и клинических) о влиянии применения HyA в связи с удалением зубов. В целом, кажется, что применение HyA в связи с хирургическим удалением LM3 может иметь положительный эффект на снижение боли в течение первой послеоперационной недели. В частности, мета-анализ 5 клинических исследований показал, что местное (внутрисurgical) применение геля HyA было связано со статистически значимым снижением восприятия боли через 7 дней после операции по сравнению с контрольной группой, в которой не было дополнительной манипуляции с раной или применялся плацебо/носитель. Применение HyA, похоже, не оказало никакого влияния на другие часто возникающие осложнения после удаления LM3 (т.е. отек и тризм) или в связи с неоперативным удалением нормально прорезавшихся зубов.
Этот положительный эффект интраоперационного применения гиалуроновой кислоты (HyA) на восприятие боли в течение первой послеоперационной недели удаления LM3 дополняет результаты предыдущего систематического обзора, который также оценивал возможную пользу HyA в том же показании. В частности, на основе другого выбора исследований применение HyA значительно снизило боль как на 3-й, так и на 7-й послеоперационный день. Очевидно, что положительный эффект HyA в самые ранние послеоперационные дни, наблюдаемый в том обзоре, не был замечен в настоящем мета-анализе, из-за увеличенной информации, предоставленной 2 дополнительными исследованиями, включенными сюда, и из-за исключения нерандомизированного исследования, которое сильно благоприятствовало тестовой группе HyA. Положительный эффект HyA в терминах снижения восприятия боли можно частично объяснить его модулирующим эффектом на воспалительный ответ в хирургической области. Ранее было продемонстрировано, что HyA может подавлять продукцию и экспрессию простагландина E2, брадикинина и субстанции P, которые все участвуют в передаче и восприятии боли. Тем не менее, любой потенциальный положительный эффект HyA на местный воспалительный ответ не обязательно приводит к меньшему отеку и/или тризмусу в клинике, поскольку как анализы, включенные сюда, так и те, что в вышеупомянутом обзоре, не показали никаких различий между тестовыми и контрольными группами по этим аспектам. Однако эти результаты следует интерпретировать с осторожностью из-за небольшого числа оригинальных исследований и отсутствия стандартизации в методах оценки отека лица, а также в самой интервенции. Например, включенные исследования редко предоставляли информацию о уровне хирургической сложности и/или примененном дизайне лоскута, аспекты, которые могут повлиять на параметры исхода. Более того, отсутствие какого-либо значительного положительного эффекта HyA на восприятие боли при несurgical удалении регулярно прорезавшихся зубов, наблюдаемое в большинстве исследований (4 из 5), включенных в этот обзор, не следует интерпретировать как отсутствие действия HyA как такового. Это может быть связано с различиями в режиме заживления, т.е. «закрытым» после хирургического удаления LM3 по сравнению с «открытым» после удаления регулярно прорезавшихся зубов, где отсутствие первичного закрытия и любого носителя могло привести к быстрому вымыванию HyA. Трудно оценить, улучшит ли применение HyA в носителе его действие, так как это использовалось только в одном исследовании, которое не показало никаких различий. Тем не менее, также следует помнить, что в большинстве случаев неосложненное удаление зуба связано с низким уровнем боли, и, следовательно, любой возможный положительный эффект HyA может быть трудно уловить. На самом деле, в единственном сравнительном исследовании по управлению AO, включенном в этот обзор, было сообщено о значительном снижении боли после операции в группах, получающих HyA (без первичного закрытия и без использования носителя).
Некоторые из исследований, посвященных заживлению после удаления регулярно прорезавшихся зубов, включенных в этот обзор, также оценивали возможное влияние применения гиалуроновой кислоты (HyA) на заживление мягких и твердых тканей. В 3 из 4 исследований, оценивающих заживление мягких тканей, был отмечен положительный эффект HyA на основе времени до и/или процента закрытия лунки, а также на основе оценок для оценки заживления мягких тканей. В то же время, в 3 сравнительных исследованиях, интра- или послеоперационное применение геля HyA не оказало положительного эффекта в терминах изменений альвеолярных размеров по сравнению с отсутствием применения HyA, после периода наблюдения от 3 до 4 месяцев. На самом деле, в одном из исследований, где после сохранения гребня с использованием графта из коллагеносного, депротеинизированного бычьего костного минерала и герметизации лунки с помощью коллагеновой матрицы хирургической терапии, гель HyA применялся на коллагеновую матрицу трижды в день в течение 1 недели, было отмечено значительно большее горизонтальное костное разрушение в корональной области лунок для удаления. Эти результаты о недостатке положительного эффекта HyA на кость могут показаться несколько противоречивыми с результатами, представленными в предклинических исследованиях, включенных в данный обзор. В 2 исследованиях, сообщающих о заживлении неинфицированных лунок для удаления как у здоровых, так и у диабетических крыс, применение HyA значительно улучшало заживление кости по сравнению с контрольной группой. Аналогично, в 3 из 3 исследований на собаках, сообщающих о заживлении инфицированных лунок для удаления, применение HyA либо само по себе, либо с коллагеновой губкой или депротеинизированным бычьим костным минералом с коллагеном в качестве носителя улучшало заживление кости. Однако важно отметить, что этот положительный эффект HyA на заживление кости не был продемонстрирован в единственном возможном здесь мета-анализе, касающемся BV/TV, вероятно, из-за того, что оба исследования использовали поздний срок заживления для этой конкретной модели животного; т.е. заживление кости внутри лунки для удаления у собаки довольно продвинуто после 3 месяцев, даже без какого-либо лечения. Примечательно, что BV/TV в группе HyA был аналогичен таковому в другой тестовой группе, обработанной рекомбинантным человеческим костным морфогенетическим белком-2 (rhBMP-2), известным очень мощным средством для улучшения костной ткани. Более того, такие положительные эффекты HyA на заживление кости также были продемонстрированы в других предклинических исследованиях, использующих модели критического размера дефекта. В перспективе ни одно исследование по хирургическому удалению LM3 не оценивало исход заживления в дистальной области нижнего второго моляра, месте, которое часто связано с глубоким пародонтальным дефектом после удаления импактированного LM3.
В этом обзоре также пытались определить, может ли применение гиалуроновой кислоты (HyA) снизить частоту альвеолярного остеита (AO) после удаления зуба; однако в исследованиях было ограниченное количество данных о данном осложнении. В этом контексте применение HyA в целом считается безопасным и без побочных эффектов; однако следует упомянуть, что HyA может привести к значительным неблагоприятным событиям в случае, если она применяется (инъецируется) в ткани. В данном случае только одно исследование сообщило о продолжительном времени кровотечения после закрытия раны по сравнению с контрольной группой; однако гемостаз был оценен как находящийся в физиологическом временном интервале и, следовательно, не считался неблагоприятным событием. Все остальные исследования, включенные в этот обзор, не упоминали о каких-либо побочных эффектах или осложнениях после применения HyA. Кроме того, что HyA безопасна для применения в связи с хирургическим удалением зуба LM3 или нехирургическим удалением зуба, нельзя сделать выводы о наиболее эффективной формуле HyA (например, низкая против высокой концентрации, не сшитая против сшитой, гель против спрея) или способе применения (например, с носителем против без носителя, частота), и, следовательно, нельзя предоставить четкие рекомендации.
В целом, здесь удалось идентифицировать лишь ограниченное количество хорошо спроектированных, рандомизированных доклинических и клинических испытаний, которые можно было объединить в мета-анализ. Более того, как было указано выше, существует недостаток согласия и информации о деталях продуктов HyA, а также о хирургических деталях (например, уровень хирургической сложности или дизайн лоскута). Эти ограничения привели к общей низкой или умеренной степени уверенности в доказательствах. В будущих исследованиях следует внедрить более качественную и стандартизированную отчетность о деталях продуктов HyA, дозировке и применении, а также более длительные сроки наблюдения, чтобы обеспечить более полную оценку потенциала использования HyA в связи с удалением зубов. Кроме того, будущие обновленные систематические обзоры, включающие большее количество исследований, также должны учитывать в мета-анализах сравнение между исследованиями с параллельными группами и исследованиями с дизайном split-mouth. Это было бы особенно интересно для таких параметров, как восприятие боли, что невозможно сделать здесь из-за очень ограниченного количества исследований с дизайном split-mouth.
Заключение
Результаты данного систематического обзора и мета-анализов показали, что интраоперационное применение гиалуроновой кислоты (HyA) в связи с удалением хирургическим путем третьих моляров привело к значительному снижению восприятия боли через 7 дней после операции, в то время как ранняя послеоперационная боль, тризм и степень отека не изменились. Более того, кажется, что применение HyA может положительно влиять на заживление мягких тканей после неоперативного удаления нормально прорезавшихся зубов, но, похоже, не снижает моделирование альвеолярного гребня после экстракции, хотя данные из доклинических исследований указывают на то, что HyA может способствовать образованию костной ткани.
Авторы: Даниэль Домич, Кристина Бертл, Тобиас Ланг, Николаос Пандис, Кристиан Ульм, Андреас Ставропулос
Ссылки:
- Упадхйая С, Хумагейн Х (2010) Распространенность сухого альвеолита после экстракции постоянных зубов в Катманду Университетской клинической больнице (KUTH), Дхуликхел, Кавре, Непал: исследование. Kathmandu Univ Med J (KUMJ) 8(29):18–24
- Акинбами БО, Годспауэр Т (2014) Сухой альвеолит: заболеваемость, клинические признаки и предрасполагающие факторы. Int J Dent 2014:796102
- Дуарте-Родригес Л и др. (2018) Удаление третьих моляров и его влияние на качество жизни: систематический обзор и мета-анализ. Qual Life Res 27(10):2477–2489
- Халаби Д и др. (2018) Хлоргексидин для профилактики альвеолярного остеита: рандомизированное клиническое испытание. J Appl Oral Sci 26:e20170245
- Кан КВ и др. (2002) Остаточные пародонтальные дефекты дистально от нижнего второго моляра через 6–36 месяцев после удаления импактированного третьего моляра. J Clin Periodontol 29(11):1004–1011
- Пенг КY и др. (2001) Пародонтальный статус нижнего второго моляра после удаления третьего моляра. J Periodontol 72(12):1647–1651
- Макбет Н и др. (2017) Изменения жестких и мягких тканей после сохранения альвеолярного гребня: систематический обзор. Clin Oral Implants Res 28(8):982–1004
- Табернер-Вальверду М и др. (2015) Эффективность различных методов управления сухим альвеолитом: систематический обзор. Med Oral Patol Oral Cir Bucal 20(5):e633–e639
- Табернер-Вальверду М, Санчес-Гарсес М, Гей-Эскода С (2017) Эффективность различных методов профилактики сухого альвеолита и анализ факторов риска: систематический обзор. Med Oral Patol Oral Cir Bucal 22(6):e750–e758
- Хан В и др. (2022) Противовоспалительная активность олигосахаридов гиалуроновой кислоты определенного размера. Carbohydr Polym 276:118699
- Харрис ЛГ, Ричардс РГ (2004) Адгезия Staphylococcus aureus к различным обработанным титановым поверхностям. J Mater Sci Mater Med 15(4):311–314
- Романо КЛ и др. (2017) Гиалуроновая кислота и ее композиты как местный антимикробный/антиадгезивный барьер. J Bone Jt Infect 2(1):63–72
- Матейуш ХР и др. (2021) Ассоциация гиалуроновой кислоты с депротеинизированным бычьим графтом улучшает костное восстановление и увеличивает образование костной ткани в дефектах критического размера. J Periodontol 92(11):1646–1658
- Юн Дж, Ли Дж, Ха ЧВ и др. (2021) Влияние 3D-печатного каркаса из полилактидной кислоты с гиалуроновой кислотой и без нее на регенерацию костной ткани. J Periodontol 1–11. https://doi.org/10.1002/JPER.21-0428
- Шираката Й и др. (2021) Заживление пародонтальных ран/регенерация двухстенных внутрикостных дефектов после реконструктивной хирургии с использованием кросс-связанного геля гиалуроновой кислоты с или без коллагеновой матрицы: доклиническое исследование на собаках. Quintessence Int 0(0):308–316
- Шираката Й и др. (2021) Заживление бугристых десневых рецессий после лечения с использованием коронально продвинутого лоскута или в сочетании с кросс-связанным гелем гиалуроновой кислоты. Экспериментальное исследование на собаках. J Clin Periodontol 48(4):570–580
- Мария де Соуза Г и др. (2020) Эффективность гиалуроновой кислоты в контроле боли, отека и тризма после удаления третьих моляров: систематический обзор и мета-анализ. J Oral Maxillofac Surg 14:14
- де Врис Р и др. (2015) Протокол для подготовки, регистрации и публикации систематических обзоров исследований вмешательства на животных. Evid-Based Preclin Med 2:e00007
- Пейдж МД и др. (2021) Заявление PRISMA 2020: обновленные рекомендации по отчетности систематических обзоров. Syst Rev 10(1):89
- Хуijманс КР и др. (2014) Инструмент SYRCLE для оценки риска смещения в исследованиях на животных. BMC Med Res Methodol 14:43
- Стерн ДЖК и др. (2019) RoB 2: пересмотренный инструмент для оценки риска смещения в рандомизированных испытаниях. BMJ 366:l4898
- Стерн ДЖ и др. (2016) ROBINS-I: инструмент для оценки риска смещения в нерандомизированных исследованиях вмешательства. BMJ 355:i4919
- Хиггинс ДжПТ, Томпсон СГ, Спигелхалтер ДЖ (2009) Переоценка мета-анализа с случайными эффектами. J R Stat Soc A Stat Soc 172(1):137–159
- Вэй Д и др. (2016) Использование подхода GRADE в систематических обзорах исследований на животных. J Evid Based Med 9(2):98–104
- Чен Х и др. (2015) Как использовать gradepro gdt для оценки качества доказательств в систематических обзорах исследований вмешательства: Введение. Chin J Evid Based Med 15:600–606
- Мендес РМ и др. (2010) Влияние однослойных углеродных нанотрубок и их функционализации натриевой гиалуронатой на восстановление костной ткани. Life Sci 87(7–8):215–222
- Капитан М и др. (2021) Первоначальное наблюдение факторов, мешающих лечению альвеолярного остеита с использованием гиалуроновой кислоты с оксетидином - серия клинических случаев. Biomolecules 11(8):04
- Мартинс-Юниор ПА и др. (2016) Оценка углеродных нанотрубок, функционализированных натриевой гиалуронатой, в воспалительных процессах для применения в регенеративной медицине. Clin Oral Invest 20(7):1607–1616
- Катанцано О и др. (2018) Композитные спонжи альгината-гиалуронана для доставки транексамовой кислоты в постэкстракционные альвеолярные раны. J Pharm Sci 107(2):654–661
- Мендес РМ и др. (2008) Натриевая гиалуронат ускоряет процесс заживления в лунках зубов у крыс. Arch Oral Biol 53(12):1155–1162
- Са МА и др. (2013) Углеродные нанотрубки, функционализированные натриевой гиалуронатой, восстанавливают костное заживление в лунках у диабетических крыс. Oral Dis 19(5):484–493
- Ким ДжД и др. (2016) Гиалуроновая кислота улучшает образование костной ткани в лунках экстракции с хронической патологией: пилотное исследование на собаках. J Periodontol 87(7):790–795
- Ким ДжД и др. (2019) Биомодификация компрометированных лунок экстракции с использованием гиалуроновой кислоты и rhBMP-2: экспериментальное исследование на собаках. J Periodontol 90(4):416–424
- Ли ДжБ и др. (2021) Влияние гиалуроновой кислоты и депротеинизированного бычьего костного минерала с 10% коллагеном на сохранение гребня в компрометированных лунках экстракции. J Periodontol 23:23
- Корай М и др. (2014) Эффективность спрея гиалуроновой кислоты на отек, боль и тризм после хирургической экстракции импактированных нижних третьих моляров. Int J Oral Maxillofac Surg 43(11):1399–1403
- Гокмен Г и др. (2015) Антиоксидантная и противовоспалительная эффективность гиалуроновой кислоты после удаления третьего моляра. J Craniomaxillofac Surg 43(7):1033–1037
- Гокмен Г и др. (2017) Влияние гиалуроновой кислоты на кровотечение после удаления третьего моляра. J Appl Oral Sci 25(2):211–216
- Афат ИМ, Акдоган ЕТ, Гёнюль О (2018) Влияние фибрина, богатого лейкоцитами и тромбоцитами, в одиночку и в сочетании с гиалуроновой кислотой на боль, отек и тризм после хирургической экстракции импактированных нижних третьих моляров. J Oral Maxillofac Surg 76(5):926–932
- Баюм А, Надершах М, Альбандар А, Альсулаимани Б, Санкур И и др. (2018) Влияние кросс-связанной гиалуроновой кислоты на хирургическую экстракцию импактированных нижних третьих моляров. Int J Dent Oral Health 4(2). https://doi.org/10.16966/2378-7090.254
- Гуаззо Р и др. (2018) Влияние на заживление раны топического геля, содержащего аминокислоты и натриевую гиалуронат, применяемого к альвеолярной лунке после удаления нижнего третьего моляра: двойное слепое рандомизированное контролируемое испытание. Quintessence Int 49(10):831–840
- Мерчант Р и др. (2018) Сравнительная оценка клинической эффективности спрея гиалуроновой кислоты и спрея нормального физиологического раствора на отек, боль и тризм после хирургической экстракции импактированного нижнего третьего моляра – рандомизированное контролируемое исследование с разделением рта. Int J Sci Res 7:152
- Афат ИМ, Акдоган ЕТ, Гёнюль О (2019) Влияние фибрина, богатого лейкоцитами и тромбоцитами, в одиночку и в сочетании с гиалуроновой кислотой на раннее заживление мягких тканей после хирургической экстракции импактированных нижних третьих моляров: проспективное клиническое исследование. J Craniomaxillofac Surg 47(2):280–286
- Муньос-Камара Д, Пардо-Самора Г, Камачо-Алонсо Ф (2020) Послеоперационные эффекты интраальвеолярного применения 0,2% хлоргексидина или 1% гиалуроновой кислоты биоадгезивных гелей после удаления нижнего третьего моляра: двойное слепое рандомизированное контролируемое клиническое испытание. Clin Oral Investig 24:24
- Йилмаз Н и др. (2017) Эффективность гиалуроновой кислоты в лунках после экстракции импактированных третьих моляров: пилотное исследование. Niger J Clin Pract 20(12):1626–1631
- Ян Х и др. (2020) Исследование неустойчивости эффективности двух продуктов гиалуроновой кислоты в лунках после экстракции импактированных третьих моляров. Maxillofac Plast Reconstr Surg 42(1):40
- Фавиа Г и др. (2008) Ускоренное заживление ран мягких тканей полости рта и ангиогенный эффект, вызванный пулом аминокислот, комбинированным с натриевой гиалуронатой (AMINOGAM®). J Biol Regul Homeost Agents 22(2):109–116
- Баюми АМ, Джан А, Амуди ВА, Шакир М (2015) Влияние использования гиалуроновой кислоты на лунки экстракции. Int J Dent Oral Health 2(1). https://doi.org/10.16966/2378-7090.157
- Алкантара СЕП и др. (2018) Гиалуроновая кислота ускоряет восстановление костной ткани в человеческих зубных лунках: рандомизированное тройное слепое клиническое испытание. Braz Oral Res 32:e84
- Лоренц Дж и др. (2018) Инъекционный материал замещения кости на основе бета-TCP и гиалуронана достигает полного восстановления костной ткани при почти полном разрушении. Int J Oral Maxillofac Implants 33(3):636–644
- Марин С и др. (2020) Результаты лечения гиалуроновой кислотой на заживление после экстракции у пациентов с плохо контролируемым диабетом 2 типа: рандомизированное контролируемое исследование с разделением рта. Med Oral Patol Oral Cir Bucal 25(2):e154–e160
- Мостафа Д и др. (2021) Влияние геля гиалуроновой кислоты на заживление простых лунок экстракции зубов: пилотное исследование. Open Access Maced J Med Sci 9(D):190–195
- Экхут С и др. (2022) Рандомизированное контролируемое испытание, оценивающее гель гиалуроновой кислоты как агента заживления раны при сохранении альвеолярного гребня. J Clin Periodontol 49(3):280–291
- Косола С, Олдойни Г, Боккудзи М, Джаммаринаро Е, Геновези А, Ковани У, Маркончини С (2022) Формула, обогащенная аминокислотами, для послеоперационного ухода за лунками экстракции, оцененная с помощью 3D-интраорального сканирования. Int J Environ Res Public Health 19(6):3302. https://doi.org/10.3390/ijerph19063302
- Кочеро Н и др. (2019) Эффективность натриевой гиалуронат и синтетических аминокислот в постэкстракционных лунках у пациентов с печеночной недостаточностью: исследование с разделением рта. J Biol Regul Homeost Agents 33(6):1913–1919
- Дубовина Д и др. (2016) Использование гиалуроновой и аминокапроновой кислоты в лечении альвеолярного остеита. Войносанитарный Прегл 73(11):1010–1015
- Сучанек Й, Иванчакова РК, Моттл Р, Браун КЗ, Пилнейова КС, Пилбаурова Н, Шмидт Й, Сучанкова Клеплова Т (2019) Медицинское устройство на основе гиалуроновой кислоты для лечения альвеолярного остеита - клиническое исследование. Int J Environ Res Public Health 16:3698. https://doi.org/10.3390/ijerph16193698
- Блум ИР (2002) Современные взгляды на сухой альвеолит (альвеолярный остеит): клиническая оценка стандартизации, этиопатогенеза и лечения: критический обзор. Int J Oral Maxillofac Surg 31(3):309–317
- Ли Дж-Б, Чу С, Амара ХБ и др. (2021) Влияние гиалуроновой кислоты и депротеинизированного бычьего костного минерала с 10% коллагеном на сохранение гребня в компрометированных лунках экстракции. J Periodontol 1–12. https://doi.org/10.1002/JPER. 20-0832
- Са МА и др. (2013) Углеродные нанотрубки, функционализированные натриевой гиалуронатой, восстанавливают костное заживление в лунках у диабетических крыс. Oral Dis 19(5):484–493
- Марин С и др. (2020) Результаты лечения гиалуроновой кислотой на заживление после экстракции у пациентов с плохо контролируемым диабетом 2 типа: рандомизированное контролируемое исследование с разделением рта. Medicina Oral, Patologia Oral y Cirugia Bucal 25(2):e154–e160
