Повторная местная доставка геля гиалуроновой кислоты как дополнительное лечение остаточных карманов у пациентов с пародонтитом, получающих поддерживающую пародонтологическую помощь. Рандомизированное контролируемое клиническое исследование.
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Цели Оценить влияние применения гиалуроновой кислоты (HyA) в качестве дополнения к повторной инструментализации остаточных карманов у пациентов, проходящих регулярную поддерживающую пародонтальную терапию (SPC).
Методы Пациенты с хроническим пародонтитом (стадии III и IV, градации B и C) с 4 межзубными остаточными карманами были случайным образом распределены на тестовую (гель HyA) или контрольную (физиологический раствор) группу. После субгингивальной инструментализации тестовое или контрольное вещество применялось субгингивально, затем ежедневно супрагингивально в течение 3 месяцев, и при необходимости второй раз после субгингивальной повторной инструментализации через 3 месяца. Клинические и параметры, сообщаемые пациентами, регистрировались каждые 3 месяца в течение 12 месяцев. Закрытие кармана [глубина зондирования кармана (PPD) ≤ 4 мм с отсутствием кровотечения при зондировании (BoP) на PPD = 4 мм] было основным параметром результата.
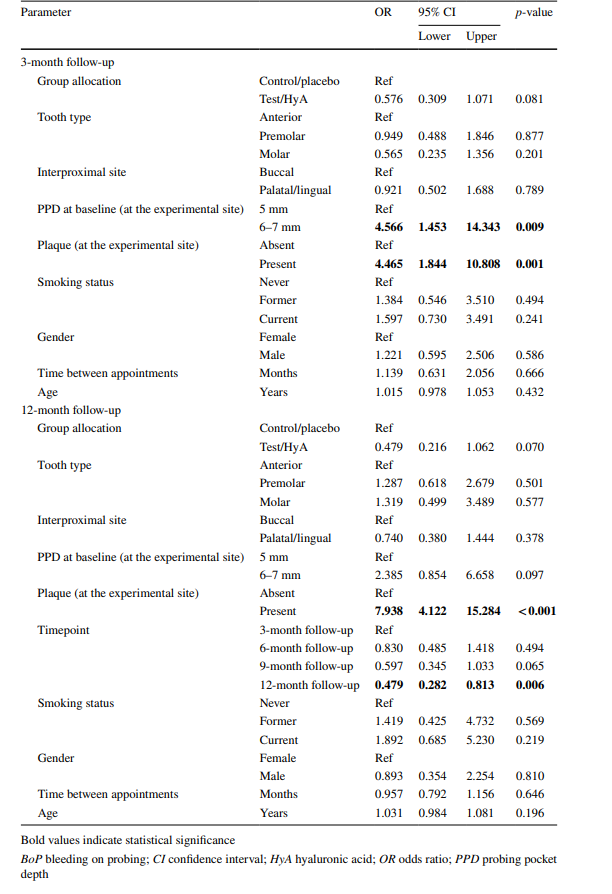
Результаты Было проанализировано пятьдесят шесть пациентов (221 экспериментальный участок). Закрытие кармана было достигнуто в 56.8 и 46.6% экспериментальных участков в тестовой и контрольной группах соответственно (p > 0.05), в то время как медиана PPD и распределение PPD (< 5мм/5мм/ > 5мм) значительно различались между группами в пользу тестовой группы на 12 месяцах. Кроме того, значительно меньше участков в группе HyA требовали повторной инструментализации через 3 месяца, и участки в группе HyA показали тенденцию к меньшей вероятности оставаться больными по сравнению с контрольной группой (OR 0.48, 95%CI 0.22–1.06). Вероятность того, что участок останется больным через 12 месяцев, значительно увеличилась в присутствии налета (OR 7.94, 95%CI 4.12–15.28), но в целом значительно снизилась со временем (OR 0.48, 95%CI 0.28–0.81).
Заключение Повторная инструментальная обработка остаточных карманов у пациентов с поддерживающей периодонтальной терапией (СПТ) сама по себе, приводит к значительному увеличению закрытия карманов со временем; это было затруднено плохим контролем налета. Повторное местное применение гиалуроновой кислоты (HyA) приводит к меньшему количеству участков, требующих повторной инструментальной обработки, и может немного улучшить скорость закрытия карманов. (регистрация clinicaltrials.gov nr. NCT04792541).
Клиническая значимость Гель HyA легко наносится, хорошо воспринимается пациентами и может иметь положительный эффект в плане меньшего количества участков, требующих повторной инструментальной обработки через 3 месяца, и более высокой скорости закрытия карманов через 12 месяцев.
Введение
Первоначальная не хирургическая субгингивальная инструментальная обработка (т.е. второй этап терапии), выполненная вручную или с помощью (ультразвуковых) инструментов (или их комбинации), является очень успешным подходом к лечению пациентов с пародонтитом; в среднем, можно достичь небольшой глубины зондирования кармана (ГЗК) в 3 из 4 карманов. Недавно Всемирная рабочая группа по классификации пародонтальных и периимплантных заболеваний и состояний и Клинические практические рекомендации EFP уровня S3 определили цель пародонтального лечения. На уровне участков закрытие кармана определяется как ГЗК ≤ 4 мм и отсутствие кровотечения при зондировании (КЗ), в то время как на уровне пациента успешно леченный стабильный пациент с пародонтитом характеризуется наличием 1) ГЗК ≤ 4 мм, 2) отсутствием ГЗК = 4 мм с КЗ, и 3) кровотечением изо рта < 10%. Хотя достичь этой цели сложно для каждого пациента, было показано, что пациенты, достигшие этих клинических конечных точек, имеют сниженный уровень прогрессирования/рецидива заболевания и потери зубов из-за пародонтита в ходе долгосрочной поддерживающей периодонтальной терапии (СПТ). Следовательно, использование вспомогательных продуктов (местно или системно) на втором этапе терапии часто обсуждается с целью 1) дальнейшего улучшения скорости закрытия карманов, 2) снижения необходимости в дополнительной хирургической терапии и/или 3) улучшения скорости достижения успешно леченного стабильного пациента с пародонтитом. Это, в свою очередь, должно не только улучшить долгосрочную стабильность лечения и снизить потерю зубов, но и минимизировать заболеваемость пациентов и, в конечном итоге, затраты на лечение. Различные варианты и эффективность местно применяемых вспомогательных средств (т.е. модификаторов хозяев или антимикробных средств) на втором этапе терапии были широко оценены в рамках Клинических практических рекомендаций EFP уровня S3. В конечном итоге было предложено рассматривать только местно применяемый хлоргексидин с контролируемым высвобождением и антибиотики как действительные варианты. В этом контексте имеется ограниченная информация о «лучшей» точке доставки местно применяемых вспомогательных средств с точки зрения (стоимостной) эффективности, т.е. следует ли их применять на втором этапе терапии или на третьем или четвертом этапе терапии при повторной инструментальной обработке остаточных/рецидивирующих карманов соответственно. Учитывая влияние на пациента, общество и/или возможные биологические последствия ненужного использования любых вспомогательных мер, последний подход позволит ограничить их использование только для тех пациентов/участков, которые не заживают после первоначальной субгингивальной инструментальной обработки. Два недавних систематических обзора охватили эффективность вспомогательных средств для пациентов с пародонтитом с остаточными/рецидивирующими карманами в ходе СПТ. В частности, среди местно применяемых антимикробных средств хлоргексидин с контролируемым высвобождением и волокна тетрациклина заняли первое место с статистически и клинически значимым дополнительным снижением ГЗК примерно на 0,6 до 0,7 мм, в то время как недостаточно данных для других вариантов вспомогательного лечения (т.е. кроме антимикробных средств).
Однако еще одним местно вводимым дополнением, которое не было включено ни в одно из вышеупомянутых систематических обзоров, ни в Клинические практические рекомендации EFP уровня S3, является гиалуроновая кислота (HyA). Различные гели, содержащие HyA в разных концентрациях, на протяжении нескольких лет тестировались как дополнения к не хирургической механической субгингивальной инструментализации, и их эффективность даже была обобщена в нескольких систематических обзорах. Эти обзоры имели хорошо сопоставимые выводы, т.е. большинство включенных клинических испытаний сообщали о положительном, хотя и умеренном, эффекте в пользу HyA в терминах снижения PPD и BoP. Однако в оригинальных исследованиях наблюдалось большое разнообразие в режимах и частоте применения, и все обзоры подчеркивали необходимость дальнейших хорошо спроектированных рандомизированных контролируемых клинических испытаний (RCT), включая достаточное освещение деталей продукта. В этом контексте в настоящее время неясно, является ли повторное применение местно вводимого дополнения в целом более выгодным по сравнению с однократным применением, т.е. только сразу после инструментализации. Тем не менее, 2 недавних RCT оценили применение HyA в офисе, специально в повторной инструментализации остаточных/рецидивирующих карманов. Каждое исследование тестировало различный продукт HyA и частоту применения; в одном из исследований HyA применялся субгингивально один раз, в то время как в другом исследовании HyA применялся субгингивально на 2 последовательных приемах, но оба показали тенденцию в пользу применения HyA.
Таким образом, разумно оценить, имеет ли комбинированное местное применение гиалуроновой кислоты, т.е. субгингивально в кабинете после механической обработки и повторно супрагингивально пациентом один раз в день в течение 3 месяцев, потенциал для улучшения скорости закрытия карманов по сравнению с повторной инструментализацией только в лечении остаточных карманов у пациентов с пародонтитом, проходящих регулярную SPC.
Материалы и методы
Дизайн исследования и участники
Настоящее исследование было рандомизированным, двойным слепым (пациент и наблюдатель), контролируемым плацебо, параллельным клиническим испытанием с 12-месячным наблюдением и представлено в соответствии со стандартами отчетности клинических испытаний (Заявление CONSORT; Приложение 1). Протокол был одобрен региональной этической комиссией (Dnr. 2016/468) и зарегистрирован на clinicaltrials.gov (NCT04792541); любые изменения в протоколе после его публикации перечислены в Приложении 2. Набор пациентов проводился с декабря 2016 года по январь 2020 года, т.е. набор пациентов начался до Всемирного семинара по классификации пародонтальных и периимплантационных заболеваний и состояний в 2017 году. Все пациенты с пародонтитом, которые завершили активную фазу лечения не менее 6 месяцев и были зачислены в программу регулярной SPC (т.е. этап 4 лечения) в Специальной клинике по пародонтологии (Общественная стоматологическая служба, Вермланд, Швеция), соответствующие следующим критериям включения, были последовательно включены: (i) 35-75 лет, (ii) диагноз хронического пародонтита, (iii) не менее 10 оставшихся зубов и (iv) 4-8 интерпроксимальных участков с PPD от ≥ 5 до < 8 мм и наличием BoP на момент включения. Кроме того, были определены следующие критерии исключения: (i) моляры с вовлечением разветвления класса II или III, (ii) подвижность зубов класса II или III, (iii) > 2 мм более глубокий PPD на другом участке в том же интерпроксимальном пространстве (iv) антибиотикотерапия в предшествующие 6 месяцев или во время участия в исследовании, (v) необходимость в антибиотикопрофилактике перед пародонтальным обследованием и/или лечением, (vi) длительное применение противовоспалительных и иммунодепрессивных препаратов, (vii) неконтролируемый или недавно диагностированный диабет до или во время участия в исследовании, (viii) беременность или лактация, (ix) тяжелая окклюзионная дисфункция, (x) продолжающееся ортодонтическое лечение и (xi) эндодонтические поражения. Возраст, пол, статус курения (т.е. никогда / бывший / текущий курильщик) и наличие/отсутствие хорошо контролируемого диабета были зарегистрированы для каждого участника.
Тестовый и плацебо продукт
Продукт, использованный в группе "тест/HyA" для суб- и супрагингивального применения, представлял собой гель, содержащий гиалуроновую кислоту (0,3%, некроссссшированный, средней молекулярной массы; Afta Clear™ Gel; Sunstar Europe SA, Этой, Швейцария), в то время как группа "контроль/плацебо" получила маленькую бутылку физиологического раствора. Оба продукта были замаскированы белой лентой, чтобы пациент не знал о распределении по группам.
Интервенция, рандомизация и слепота
Перед началом исследования был сгенерирован случайный список для распределения по группам (соотношение 1:1 для группы тест/HyA и контроль/плацебо) периодонтологом, не участвовавшим в процессе набора участников (KB). Все участники были набраны одним из 3 опытных стоматологических гигиенистов (LG, AS, MSS). Четыре интерпроксимальных участка каждого участника были определены как экспериментальные участки (т.е. мезио-буккальный, мезио-палатальный/-язычный, дисто-буккальный или дисто-палатальный/-язычный); если возможно, выбирался 1 участок на квадрант, в противном случае экспериментальные участки должны были находиться в разных интерпроксимальных пространствах. Все участники на начальном этапе получили стандартную сессию SPC, включая повторную инструментализацию с помощью ультразвукового устройства (E.M.S. Electro Medical Systems S.A., Ньон, Швейцария) и/или ручных инструментов (HuFriedyGroup, Чикаго, США) всех остаточных карманов одним из вышеупомянутых 3 стоматологических гигиенистов; каждый пациент лечился одним и тем же стоматологическим гигиенистом на протяжении всего периода исследования. Распределение по группам было скрыто до повторной инструментализации остаточных карманов. После повторной инструментализации к сессии лечения присоединился периодонтолог (AZ), который раскрыл распределение по группам только для себя, открыв скрытую записку в конверте с формой отчета о случае пациента, и применил либо тестовый, либо плацебо продукт субгингивально на всех экспериментальных участках. Для субгингивального применения тестовый и плацебо продукты были перенесены в стерильный шприц с тупой иглой, и экспериментальные участки были заполнены до тех пор, пока продукт не начал переливаться из кармана (Рис. 1). Тот же периодонтолог выполнял эту процедуру для всех участников, в то время как стоматологические гигиенисты и пациенты оставались слепыми к распределению по группам. Каждый пациент получил листовку с кратким изложением соответствующих инструкций и рисунком, указывающим 4 экспериментальных участка, включая правильный размер межзубных щеток (TePe Munhygienprodukter AB, Мальмё, Швеция) для конкретного интерпроксимального пространства и либо тестовый, либо плацебо продукт. Пациенты должны были применять продукт один раз в день супрагингивально с межзубной щеткой после чистки зубов, только на экспериментальных участках, и в течение следующих 3 месяцев до второго визита SPC (т.е. 3-месячный контроль). Кроме того, пациентам было рекомендовано избегать чистки зубов или еды в течение 3 часов после применения и не использовать никакие растворы для полоскания рта или другие гели во время участия в данном исследовании. Сессии SPC повторялись через 3, 6, 9 и 12 месяцев, однако пациент прекратил применение тестового или плацебо продукта после первых 3 месяцев. Наконец, все экспериментальные участки с PPD = 5 мм и BoP или PPD > 5 мм на 3-месячном контроле снова получили повторную инструментализацию и вторичное субгингивальное применение выделенного продукта, как описано выше. В общем, все участки с PPD= 5 мм и BoP или PPD>5 мм на любой из сессий SPC получили в качестве стандартного ухода субгингивальную повторную инструментализацию.
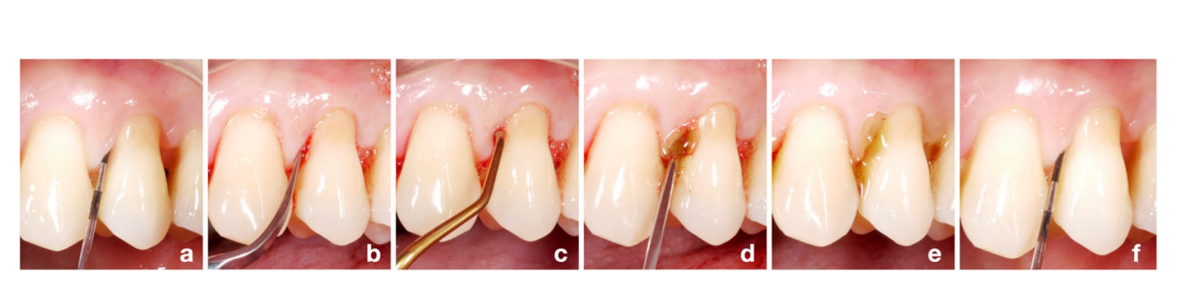
Оценка результатов и слепое исследование
Субгингивальная микробиологическая выборка из 4 экспериментальных участков была проведена на начальном этапе и через 3, 6 и 12 месяцев. Результаты микробиологической выборки будут сообщены в другом месте. Кроме того, после микробиологической выборки и на каждом SPC (т.е. на начальном этапе, а также через 3, 6, 9 и 12 месяцев) тот же слепой и откалиброванный стоматолог-гигиенист (LG, AS, MSS) записывал PPD, уровень клинической прикрепленности (CAL), наличие/отсутствие BoP и наличие/отсутствие налета на каждом экспериментальном участке. В качестве стандарта ухода пародонтолог (AZ) этой конкретной специализированной клиники контролирует измерения PPD каждого гигиениста примерно 2-3 раза в год, что считалось калибровкой. Кроме того, на каждом последующем визите пациентов спрашивали о любых изменениях в их медицинской истории и о приеме антибиотиков за предыдущие 3 месяца. На втором SPC (т.е. через 3 месяца) пациенты дополнительно получили короткий опросник о своем мнении о тестируемом продукте. Опросник спрашивал о наличии и интенсивности боли во время применения, а также о мнении пациентов о консистенции и вкусе продукта во время домашнего использования, используя шкалу от 1 до 10. Успешный результат лечения (т.е. закрытие кармана) определялся как PPD≤ 4 мм с отсутствием BoP при PPD = 4 мм; если эти критерии не выполнялись, экспериментальный участок оставался классифицированным как "болезненный". Этот составной результат был определен как первичный параметр результата и оценивался на каждом SPC.
Критерии допуска для последующего наблюдения
Пациенты планировались каждые 3 месяца для SPC, однако был разрешен диапазон от 2.5 до 5 месяцев между 2 сессиями SPC; если время между 2 сессиями SPC превышало 5 месяцев, назначение SPC считалось пропущенным. Кроме того, общий период с первого до пятого назначения SPC не должен был превышать 18 месяцев, в противном случае пациент исключался. Поскольку несколько пациентов были включены до вспышки пандемии Covid-19, пациентам было разрешено пропустить либо 6-, либо 9-месячное назначение без исключения из исследования. Однако пациенты, пропустившие 2 сессии SPC или 3- или 12-месячное назначение, также были исключены.
Расчет размера выборки
Для расчета размера выборки предполагалось, что 75 и 25% участков в тестовой/HyA и контрольной/плацебо группе соответственно достигнут закрытия кармана, т.е. PPD ≤ 4 мм при отсутствии BoP при PPD = 4 мм. При наличии этих клинических параметров риск прогрессирования заболевания считается низким, а лечение считается успешным. На основе набора данных предыдущей публикации предполагается внутриперсональный коэффициент корреляции 0.42 для наличия BoP. Исходя из этого коэффициента корреляции, мощности 0.80 и альфа-значения 0.05, был рассчитан размер выборки в 30 участников на группу (т.е. общая численность исследуемой популяции 60). Для компенсации выбытия было последовательно набрано всего 80 пациентов (40 пациентов на группу).
Статистический анализ
Частотное распределение для категориальных переменных (таких как пол, статус курения, распределение PPD и т.д.) и средние значения (стандартные отклонения) или медианы и интерквартильные диапазоны для непрерывных переменных (таких как возраст, PPD и т.д.) представлены отдельно для группы тест/HyA и контрольной/плацебо группы. Для проверки различий между группами тест/HyA и контрольной/плацебо применялись либо точный тест Фишера, либо тест хи-квадрат для категориальных параметров (т.е. тест хи-квадрат применялся, если каждая ячейка имела частоту > 5), а для непрерывных переменных использовался либо независимый t-тест (для нормально распределенных данных), либо тест Манна-Уитни (для ненормально распределенных данных). Нормальность данных контролировалась с помощью теста Шапиро-Уилка. «Состояние здоровья экспериментального участка» было определено как основной параметр исхода [дихотомический; «болезненный» (т.е. PPD > 4 мм или PPD = 4 мм с BoP) против «успешно лечен/закрытие кармана» (т.е. PPD ≤4 мм при отсутствии BoP при PPD = 4 мм). Были рассчитаны две многофакторные модели логистической регрессии с смешанными эффектами, где распределение по группам было основным предиктором, а следующие заранее определенные сопутствующие факторы: 1) тип зуба (антериорный / премолярный / молярный), 2) интерпроксимальный участок (буккальный / небный/язычный), 3) PPD на начальном этапе на экспериментальном участке (5 мм / 6–7 мм), 4) налет на экспериментальном участке на каждом приеме (отсутствует / присутствует), 5) статус курения (никогда / бывший / текущий), 6) пол (женский / мужской), 7) время, прошедшее между приемами (месяцы), и 8) возраст (годы). Первая модель включала только данные за 3 месяца, в то время как вторая модель включала все данные, собранные за 12-месячный период; в последней модели был добавлен дополнительный сопутствующий фактор, т.е. временной момент (3- / 6- / 9- / 12-месячное наблюдение). Статистический анализ проводился с помощью STATA/IC 17.0 для Mac (Lakeway Drive, Texas, USA), и p-значение ≤ 0.05 считалось статистически значимым.
Результаты
Характеристики популяции на начальном этапе (уровень пациента)
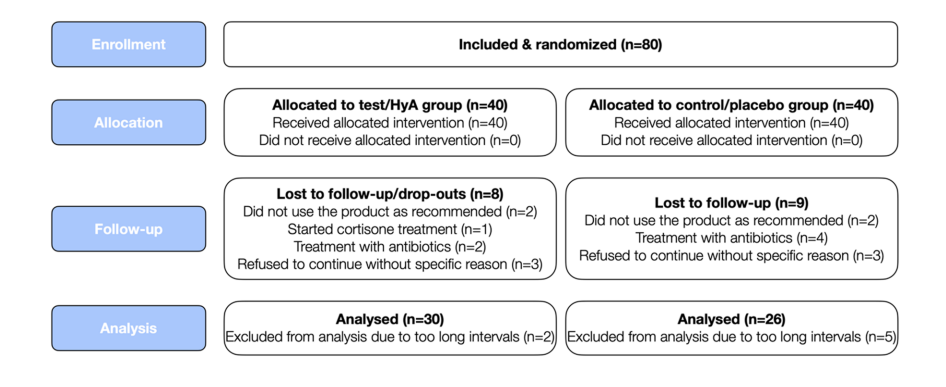
В исследование были включены восемьдесят пациентов с хроническим пародонтитом (соответствующие пациентам с пародонтитом III и IV стадии и градации B и C), проходящих регулярную SPC, которые были набраны и рандомизированы. В общей сложности 24 участника выбыло или не могли быть включены в анализ по различным причинам (подробности см. на рис. 2). Характеристики 56 пациентов (т.е. 30 и 26 пациентов в группе теста/HyA и контрольной/плацебо соответственно), участвующих в анализе, представлены в таблице 1; ни одна из характеристик на уровне пациента не имела значительных различий между 2 группами. Вкратце, выборка 1) состояла примерно из 66% женщин, 2) имела средний возраст 58 лет, 3) включала примерно 46% текущих курильщиков и 4) имела 3 хорошо контролируемых диабетика.
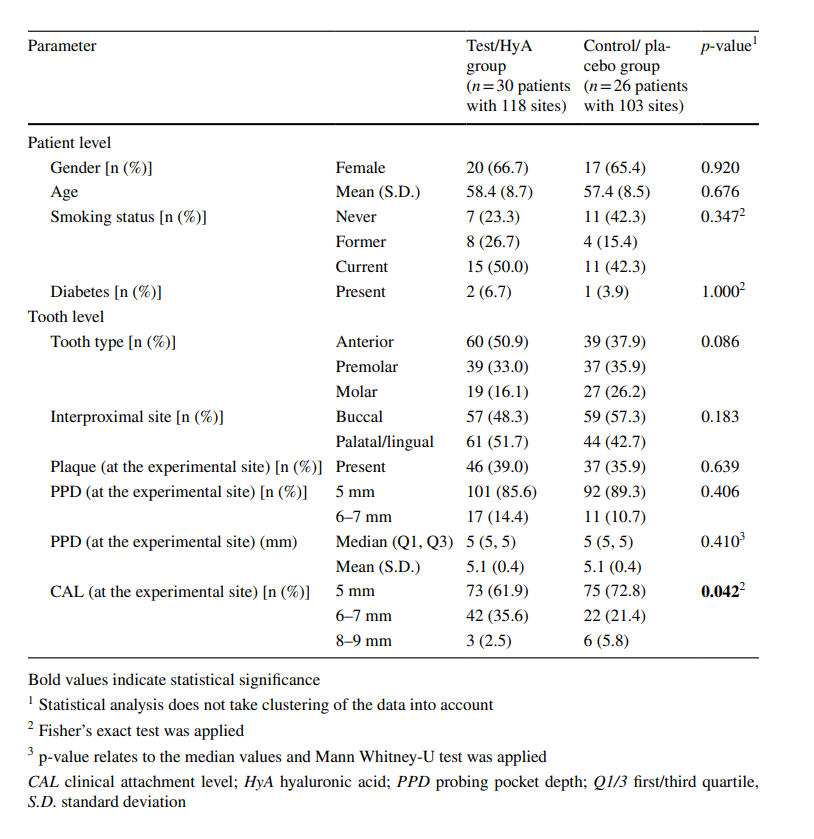
Характеристики экспериментальных участков на начальном этапе (на уровне зуба)
В выборку вошли 221 экспериментальный участок, которые по критериям соответствия были оценены как «болезненные» с наличием BoP на начальном этапе. За исключением 3 пациентов, каждый пациент внес 4 экспериментальных участка. Три экспериментальных участка (по одному участку от 2 пациентов тестовой группы/HyA и 1 пациента контрольной группы/плацебо) пришлось исключить из-за реабилитации с новой протезной реставрацией на экспериментальном или соседнем зубе (n = 2) и из-за того, что один пациент по ошибке применил продукт на противоположном зубе, т.е. на неправильном (n = 1). Начальные характеристики экспериментальных участков тестовой группы/HyA и контрольной группы/плацебо представлены в Таблице 1. Тип зуба, интерпроксимальные участки, налет и PPD были хорошо распределены между 2 группами, в то время как тестовая группа/HyA внесла значительно больше участков с CAL ≥ 6 мм по сравнению с контрольной группой/плацебо (p = 0.042). Большинство участков имели PPD = 5 мм на начальном этапе, в то время как 14.4% и 10.7% тестовой группы/HyA и контрольной группы/плацебо соответственно имели PPD от 6 до 7 мм на начальном этапе.
Характеристики экспериментальных участков через 3 месяца (уровень зуба)
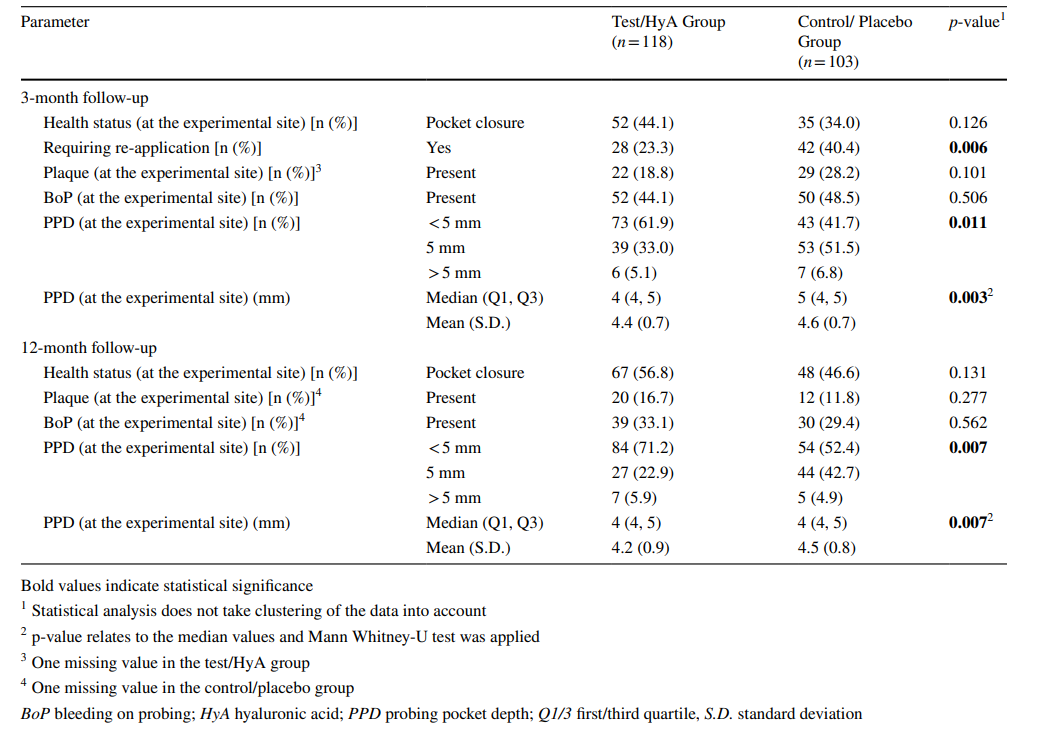
Характеристики экспериментальных участков через 3 месяца представлены в таблице 2. Через 3 месяца 44,1 и 34,0% экспериментальных участков группы тест/HyA и контрольной/плацебо соответственно достигли закрытия карманов без значительной разницы между группами. Аналогично, наличие налета и BoP было сопоставимо между 2 группами. Тем не менее, медиана PPD (p = 0.003) и распределение PPD (< 5 мм / 5 мм / > 5 мм; p = 0.011) значительно различались между группами в пользу группы тест/HyA. В частности, 61,9 и 41,7% экспериментальных участков группы тест/HyA и контрольной/плацебо соответственно имели PPD < 5 мм. Более того, значительно меньше участков в группе тест/HyA (p = 0.006) по сравнению с контрольной/плацебо группой, 23,3 и 40,4% соответственно, требовали субгингивального повторного применения на 3-месячном контроле.
Оценка результата лечения через 3 месяца
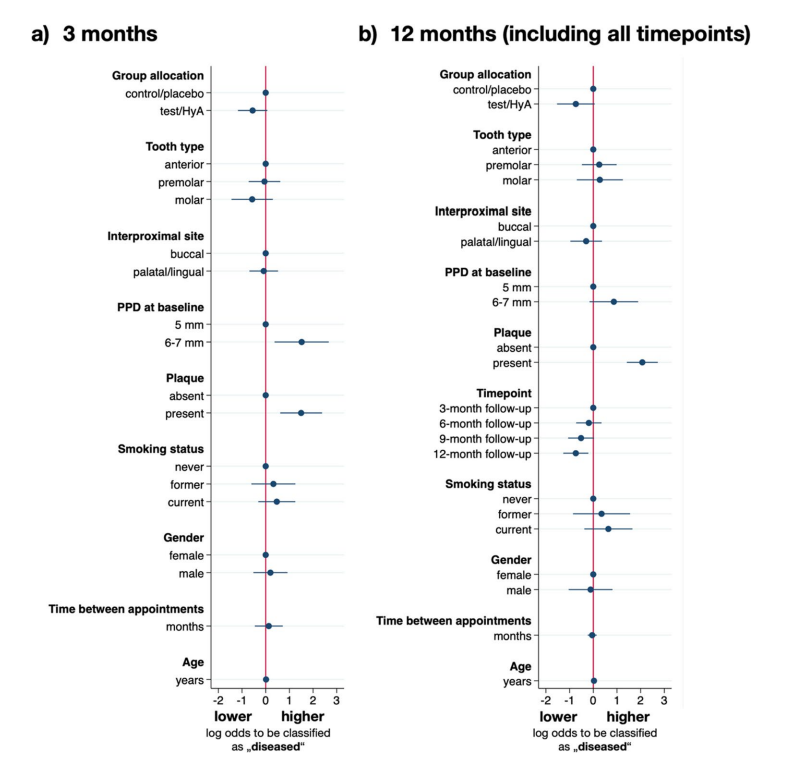
Результаты многомерного анализа логистической регрессии с смешанными эффектами после 3 месяцев SPC представлены на рис. 3a и в таблице 3. Экспериментальные участки в группе тест/HyA имели немного, но статистически незначительно более низкие шансы по сравнению с контрольной/плацебо группой остаться "больными" (т.е. PPD > 4 мм или PPD = 4 мм с BoP) (OR 0.58, 95% CI 0.31–1.07; p = 0.081). Из включенных факторов только налет и PPD на начальном этапе оказали значительное влияние на результат. В частности, наличие налета (OR 4.47, 95% CI 1.84–10.81; p = 0.001) и более высокий PPD на начальном этапе (OR 4.57, 95% CI 1.45–14.34; p = 0.009) значительно увеличили шансы остаться "больными" на 3-месячном контроле.
Характеристики экспериментальных участков через 12 месяцев (уровень зуба)
Характеристики экспериментальных участков на финальной оценке (12-месячное наблюдение) представлены в таблице 2. На финальной оценке 56.8 и 46.6% экспериментальных участков группы тест/HyA и контрольной/плацебо соответственно достигли закрытия карманов без значительной разницы между группами. Аналогично, наличие налета и BoP было сопоставимо между 2 группами. Тем не менее, медиана PPD (p = 0.007) и распределение PPD (< 5mm / 5 mm / > 5mm; p = 0.007) значительно различались между группами в пользу группы тест/HyA. В частности, 71.2 и 52.4% участков тест/HyA и контрольной/плацебо соответственно имели PPD < 5 мм, и медиана PPD была ниже в группе тест/HyA. В группе тест/HyA из 28 экспериментальных участков, получивших повторное применение через 3 месяца, 28.6% больше не имели заболеваний через 12 месяцев, в то время как из 90 экспериментальных участков, не получивших повторное применение через 3 месяца, 34.4% снова были классифицированы как «заболевшие». В контрольной/плацебо группе из 42 экспериментальных участков, получивших повторное применение через 3 месяца, 33.3% больше не имели заболеваний через 12 месяцев, в то время как из 61 экспериментального участка, не получившего повторное применение через 3 месяца, 44.3% снова были классифицированы как «заболевшие».
Оценка результатов лечения через 12 месяцев
Результаты многовариантного анализа логистической регрессии с смешанными эффектами представлены на рис. 3b и в таблице 3. Экспериментальные участки группы тест/HyA имели немного, но статистически незначительно более низкие шансы остаться "больными" (т.е. PPD > 4 мм или PPD = 4 мм с BoP) по сравнению с контрольной/плацебо группой (OR 0.48, 95% CI 0.22–1.06; p = 0.070). Из включенных сопутствующих факторов только налет и временной момент оказали значительное влияние на результат. В частности, наличие налета значительно увеличивало шансы остаться "больными" примерно в 8 раз (OR 7.94, 95% CI 4.12–15.28; p < 0.001), и, в общем, шансы остаться "больными" снижались в течение периода исследования, достигая значимости на финальной оценке (OR 0.48, 95% CI 0.28–0.81; p = 0.006).
Мнение пациентов
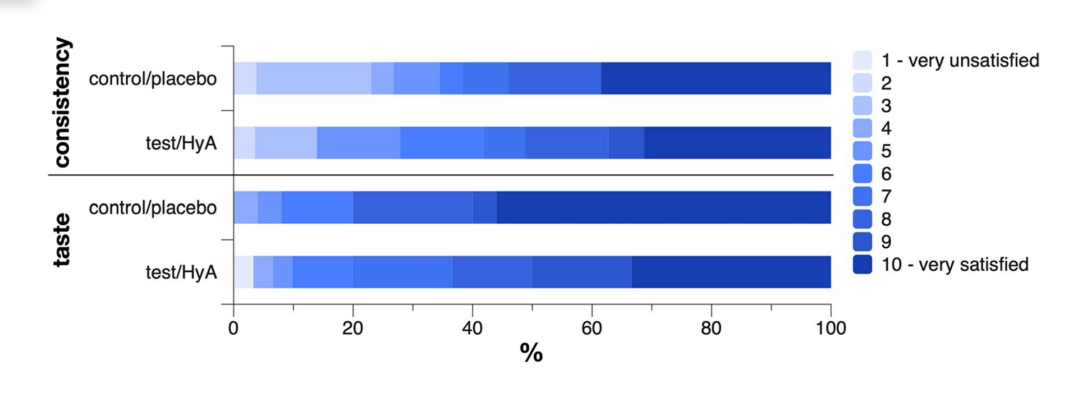
Один пациент из каждой группы сообщил о том, что испытывал боль в деснах во время применения продукта с интенсивностью 3-4 из 10, где 10 представляет максимальную боль. Один пациент из группы тест/HyA не ответил на вопрос о консистенции, а один пациент из контрольной/плацебо группы не ответил на вопрос о вкусе. Группы не продемонстрировали значительной разницы в своем мнении о консистенции и вкусе продукта (Рис. 4). В частности, средние значения (стандартное отклонение) по шкале для консистенции составили 7.2 (2.6) и 7.0 (3.0) в группе тест/HyA и контрольной/плацебо группе соответственно (p = 0.822), а медианные значения (первый, третий квартиль) по шкале для вкуса составили 8.5 (7, 10) и 10 (8, 10) в группе тест/HyA и контрольной/плацебо группе соответственно (p = 0.184); для обоих параметров значение 10 означало очень высокую степень удовлетворенности.
Безопасность
Ни один из пациентов не сообщил о каких-либо побочных эффектах/осложнениях, связанных с применением продукта, и никаких неблагоприятных событий не было клинически наблюдено.
Обсуждение
Локально доставляемые химиотерапевтические средства часто используются в качестве дополнения к нехирургическому лечению у пациентов с пародонтитом, как на начальном этапе лечения, так и при остаточных/рецидивирующих карманах на более позднем этапе лечения. Однако, поскольку начальная нехирургическая субгингивальная инструментальная обработка является довольно успешным лечением сама по себе, более специфический подход к карманам, которые не зажили на втором этапе терапии, и/или к рецидивирующим карманам во время SPC может быть более актуальным. В данном случае гель, содержащий гиалуроновую кислоту, многократно применяемый (ежедневно) в течение 3 месяцев в качестве дополнения к повторной инструментальной обработке остаточных/рецидивирующих карманов у пациентов, проходящих регулярный SPC, показал некоторую тенденцию к улучшению результата, т.е. была отмечена на 10% более высокая степень закрытия карманов для участков, получавших гиалуроновую кислоту, по сравнению с контрольной группой, получавшей физиологический раствор (т.е. 57 против 47% участков соответственно) через 12 месяцев. Кроме того, процент экспериментальных участков с PPD < 5 мм был примерно в 1,4 раза выше в тестовой/гиалуроновой группе по сравнению с контрольной/плацебо группой (т.е. 71 и 52% участков соответственно).
Эти результаты согласуются с теми, которые были представлены в 2 недавних РКИ, оценивающих гель, содержащий гиалуроновую кислоту (HyA), в качестве дополнения к повторной инструментализации остаточных/рецидивирующих карманов и показывающих, что использование геля, содержащего HyA, привело к тенденции к более высоким результатам по сравнению с только повторной инструментализацией. Более того, обе исследования сообщили в своей тестовой группе о схожей частоте участков с ППД < 5 мм через 12 месяцев, а именно 76-77% в 2 предыдущих исследованиях и 71% в данном исследовании. Кроме того, в одном из РКИ, сообщающем о закрытии карманов (т.е. ППД ≤ 4 мм без БлП), была наблюдаема сопоставимая частота в группе HyA, как и здесь, а именно 59% и 57% соответственно. Однако значительное различие между этими 2 РКИ и текущим исследованием касается характеристик продукта применяемого геля HyA. В частности, в этом исследовании использовался не сшитый, средне молекулярный HyA с относительно низкой концентрацией (0,3%), в то время как в других исследованиях использовался продукт с сшитым, высокомолекулярным HyA в более высокой концентрации или комбинированный продукт с полинуклеотидами и высокомолекулярным HyA в более высокой концентрации. Лабораторные исследования на периодонтальных клетках или патогенах, связанных с пародонтитом, сравнивали эффекты либо не сшитого и сшитого HyA, либо HyA различной молекулярной массы; ни одна из протестированных формул не показала негативного эффекта в отношении заживления периодонтальных ран. В этом контексте, из-за отсутствия сравнительных клинических испытаний до настоящего времени, остается неясным, действительно ли различные характеристики HyA приводят к клинически значимым различиям. Еще одно различие между этими 2 РКИ и данным исследованием касается режима/частоты применения HyA. В этом исследовании гель, содержащий HyA, многократно (ежедневно) применялся супрагингивально в течение 3 месяцев пациентами в дополнение к субгингивальным офисным применениям. Одно из предыдущих исследований оценивало эффект повторного офисного применения через 3 месяца, но не смогло показать никакого дополнительного положительного эффекта HyA после повторного применения; однако перед повторным применением в этом конкретном исследовании не проводилась дополнительная субгингивальная инструментализация. Здесь только участки с оставшимися признаками патологии получили повторное применение в сочетании с субгингивальной повторной инструментализацией. В обеих группах (т.е. тестовой и контрольной) примерно 30% участков, требующих повторной инструментализации и повторного применения, были признаны успешно обработанными в конце испытания. Тем не менее, хотя повторное лечение улучшило ситуацию в 1 из 3 случаев и никакого явного положительного эффекта HyA не было отмечено, количество участков, требующих повторной инструментализации (повторного лечения) через 3 месяца, было значительно ниже в группе HyA по сравнению с группой, получающей NaCl. Наконец, текущие данные также не позволяют сделать какие-либо выводы о потенциальном дополнительном эффекте повторного супрагингивального применения пациентами в течение 3 месяцев, так как третья группа с субгингивальным офисным введением отсутствовала в данном исследовании.
В общем, уменьшение количества остаточных карманов после активного пародонтального лечения (т.е. этапы 1-3) показало свою пользу в отношении рецидива/прогрессирования заболевания и потери зубов в различных исследованиях, сосредоточенных на долгосрочных результатах SPC после активного пародонтального лечения. Таким образом, разумно предположить, что любое лечебное мероприятие, такое как использование местно применяемых адъювантов, которое улучшает скорость закрытия карманов – независимо от стадии лечения – может положительно сказаться и на долгосрочном результате. В этом контексте гели, содержащие гиалуроновую кислоту, как адъювант к субгингивальной инструментализации на втором этапе терапии, продемонстрировали некоторый потенциал в снижении PPD и BoP, что было вновь подтверждено более недавними РКИ. По сравнению с другими исследованиями с аналогичным дизайном, но оценивающими различные продукты в качестве адъювантов к повторной инструментализации остаточных карманов у пациентов с SPC, частота закрытия карманов здесь оказалась немного ниже. Например, 2 недавних РКИ, оценивающих адъювантный эффект безфлапной аппликации производных эмалевой матрицы, геля гипохлорита натрия и геля хлоргексидина, сообщили о закрытии карманов (т.е. PPD ≤ 4 мм без BoP) в 80, 78 и 63% участков по сравнению с 57% здесь. Следовательно, учитывая отсутствие РКИ, напрямую сравнивающих эти продукты, гиалуроновая кислота оказалась столь же эффективной, как гель хлоргексидина, но немного уступала производным эмалевой матрицы и гелю гипохлорита натрия. Последний может представлять особый интерес, поскольку комбинация геля гипохлорита натрия с перекрестно связанной гиалуроновой кислотой недавно привлекла внимание как комбинированное адъювантное лечение у пациентов с пародонтитом. Однако недавняя ретроспективная серия случаев, включающая 29 пациентов с SPC с остаточными/рецидивирующими карманами, сообщила о несколько более низкой частоте закрытия карманов для этого комбинированного подхода – 25%.
Среди факторов, использованных для корректировки настоящего анализа, два оказали значительное влияние на результат при финальной оценке, а именно контроль налета и соблюдение/время, что полностью согласуется с литературой. В частности, наличие налета, которое оценивалось на каждом экспериментальном участке на каждой сессии SPC, значительно снижало вероятность достижения закрытия кармана. Успешная мотивация пациентов к поддержанию высоких уровней контроля налета во время SPC является известной клинической проблемой, и недавние долгосрочные исследования SPC вновь подтвердили клиническую значимость этого вопроса. Оба исследования, включая 100 и более 200 участников соответственно, проходивших примерно 10 лет SPC после активного пародонтального лечения, показали повышенный риск рецидива заболевания и потери зубов из-за пародонтита при плохом контроле налета. Более того, пациенты настоящего RCT в целом и независимо от групповой принадлежности показали значительное улучшение со временем, которое стало значимым после 12 месяцев. В частности, также в контрольной/плацебо группе почти 50% экспериментальных участков достигли закрытия кармана в конце испытания. Этот эффект достижения закрытия кармана только за счет механической реинструментации хорошо сопоставим с предыдущими исследованиями, сообщающими о показателях от 42 до 60%. Кроме того, участие в исследовании само по себе, вероятно, оказывает благоприятное влияние на соблюдение со стороны пациента, а также с точки зрения лечащего стоматолога/гигиениста, который может более настойчиво настаивать на соблюдении 3-месячного интервала. В этом контексте было показано, что более короткий промежуток времени между последовательными сессиями SPC может со временем привести к снижению PPD и пародонтальной стабильности, в то время как более длительный промежуток может привести к пародонтальной нестабильности и, соответственно, потере зубов.
Настоящее исследование, проведенное в условиях "реальной жизни", имеет некоторые ограничения, такие как относительно высокая степень отказа от участия в 30%, что не позволило нам достичь запланированного размера выборки в контрольной/плацебо группе, т.е. было проанализировано 26 вместо 30 участников. Высокая степень отказа от участия отчасти объясняется тем, что участники пропускали свои запланированные встречи во время пандемии Covid-19, т.е. хотя был принят диапазон от 2,5 до 5 месяцев между 2 сессиями SPC, почти 10% участников (т.е. 2 и 5 из тестовой/HyA и контрольной/плацебо группы соответственно) были исключены из анализа из-за слишком длинных интервалов. Тем не менее, поскольку время между 2 сессиями SPC является важным фактором, этот параметр был включен в регрессионные анализы, чтобы скорректировать в модели небольшие вариации в интервалах SPC. Однако, поскольку настоящее испытание было проведено в дизайне параллельных групп, пациенты не получали оба продукта, что, в свою очередь, должно ограничить любую предвзятость из-за недостаточной слепоты пациентов. В этом контексте было интересно, что группы не продемонстрировали значительной разницы в отношении мнения пациентов о консистенции и вкусе продукта; оба продукта были хорошо приняты пациентами, что, в свою очередь, может указывать на хорошую приверженность.
Заключение
Повторная инструментализация остаточных карманов у пациентов с SPC, сама по себе, приводит к значительному увеличению закрытия карманов с течением времени. Это улучшение зависело от гигиены полости рта пациента, т.е. наличие налета увеличивало вероятность оставаться больным примерно в 8 раз. Дополнительное суб- и супрагингивальное повторное применение геля, содержащего гиалуроновую кислоту, привело к значительно меньшему количеству участков, требующих повторной инструментализации через 3 месяца, и к некоторым клинически значимым различиям через 12 месяцев SPC по сравнению с контрольной/плацебо группой, такими как 71 против 52% экспериментальных участков, достигнувших PPD < 5 мм, соответственно. Однако статистическая значимость этого эффекта была едва достигнута в скорректированном анализе по достижению закрытия карманов. Следовательно, необходимы дальнейшие клинические испытания для подтверждения превосходства этого дополнения по сравнению с субгингивальной повторной инструментализацией.
Авторы: Кристина Бертл, Стефания Влаху, Николаос Пандис, Антониос Зампелис, Андреас Ставропулос
Ссылки:
- Санц М, Эррера Д, Кебшулл М и др. (2020) Лечение периодонтита I-III стадии - клинические рекомендации EFP уровня S3. J Clin Periodontol 47(Suppl 22):4–60. https://doi.org/10.1111/jcpe.13290
- Суван Дж, Лейра Й, Морено Санчо ФМ, Грациани Ф, Деркс Дж, Томаси С (2020) Субгингивальная инструментальная обработка для лечения периодонтита. Систематический обзор. J Clin Periodontol 47(Suppl 22):155–175. https://doi.org/10.1111/jcpe.13245
- Чаппл ИЛК, Мили БЛ, Ван Дайк ТЕ и др. (2018) Периодическое здоровье и заболевания десен и состояния на неповрежденном и уменьшенном периодонте: консенсусный отчет рабочей группы 1 Всемирного семинара по классификации периодонтальных и периимплантных заболеваний и состояний 2017 года. J Clin Periodontol 45(Suppl 20):S68–S77. https://doi.org/10.1111/jcpe.12940
- Бертл К, Пандис Н, Стопфер Н, Харириан Х, Брукманн С, Ставропулос А (2022) Влияние статуса «успешно леченного стабильного пациента с периодонтитом» на параметры, связанные с результатами для пациента, в ходе долгосрочной поддерживающей периодонтальной терапии. J Clin Periodontol 49:101–110. https://doi.org/10.1111/jcpe.13582
- Ратту В, Райнди Д, Антоноглу Г, Нибали Л (2023) Распространенность стабильных и успешно леченных пациентов с периодонтитом и частота последующей потери зубов в рамках поддерживающей периодонтальной терапии: систематический обзор с мета-анализом. J Clin Periodontol. https://doi.org/10.1111/jcpe.13835
- Доноса Н, Кальчиолари Е, Брусселарс Н, Голдони М, Бостанджи Н, Белибасакис ГН (2020) Дополнительное использование модулаторов хозяев в не хирургической периодонтальной терапии. Систематический обзор рандомизированных, контролируемых плацебо клинических исследований. J Clin Periodontol 47(Suppl 22):199–238. https://doi.org/10.1111/jcpe.13232
- Эррера Д, Матесанц П, Мартин С, Уд В, Ферес М, Тегелс В (2020) Дополнительный эффект местно доставляемых антимикробных средств в терапии периодонтита: систематический обзор и мета-анализ. J Clin Periodontol 47(Suppl 22):239–256. https://doi.org/10.1111/jcpe.13230
- Кальчиолари Е, Эркал П, Дуроу М, Аккали А, Таглиаферри С, Доноса Н (2022) Эффективность дополнительных периодонтальных терапий во время поддерживающей периодонтальной терапии у пациентов с остаточными карманами. Систематический обзор и мета-анализ. J Periodontal Res 57:671–689. https://doi.org/10.1111/jre.13001
- Ван ЧЖ, Ян ЙХ, Ли Х и др. (2020) Дополнительные местные лечения для пациентов с остаточными карманами во время поддерживающей периодонтальной терапии: систематический обзор и сетевой мета-анализ. J Clin Peri- odontol 47:1496–1510. https://doi.org/10.1111/jcpe.13379
- Бертл К, Брукманн С, Исберг ПЕ, Клинге Б, Готфредсен К, Ставропулос А (2015) Гиалуронан в не хирургической и хирургической периодонтальной терапии: систематический обзор. J Clin Periodontol 42:236–246. https://doi.org/10.1111/jcpe.12371
- Элиезер М, Имбер ДжК, Скулен А, Пандис Н, Тейх С (2019) Гиалуроновая кислота как дополнение к не хирургической и хирургической периодонтальной терапии: систематический обзор и мета-анализ. Clin Oral Investig 23:3423–3435. https://doi.org/10.1007/s00784-019-03012-w
- Каракостас П, Давидопулу С, Кальфас С (2022) Использование гиалуроновой кислоты в лечении периодонтальных заболеваний: систематический обзор. J Contemp Dent Pract 23:355–370
- Тан ОЛ, Сафии ШХ, Разали М (2021) Клиническая эффективность повторных применений местной доставки лекарств и дополнительных агентов в не хирургической периодонтальной терапии: систематический обзор. Antibiotics (Basel) 10:1178. https://doi.org/10.3390/antibiotics10101178
- Пиллони А, Рохас МА, Трезза Ч и др. (2023) Клинические эффекты дополнительного использования полинуклеотидного и гиалуронатного геля в субгингивальной повторной инструментальной обработке остаточных периодонтальных карманов: рандомизированное, клиническое испытание с разделением на половины. J Periodontol 94:354–363. https://doi.org/10.1002/JPER.22-0225
- Пиллони А, Зеза Б, Куис Д и др. (2021) Лечение остаточных периодонтальных карманов с использованием гиалуронатного геля: 12-месячное многоцентровое рандомизированное тройное слепое клиническое испытание. Antibiotics (Basel) 10:924. https://doi.org/10.3390/antibiotics10080924
- Шульц КФ, Алтман ДГ, Мохер Д, CONSORT Г (2010) Заявление CONSORT 2010: обновленные рекомендации по отчетности о параллельных групповых рандомизированных испытаниях. PLoS Med 7:e1000251. https://doi.org/ 10.1371/journal.pmed.1000251
- Папапаноу ПН, Санц М, Будунели Н и др. (2018) Периодонтит: консенсусный отчет рабочей группы 2 Всемирного семинара по классификации периодонтальных и периимплантных заболеваний и состояний 2017 года. J Clin Periodontol 45(Suppl 20):S162–S170. https:// doi.org/10.1111/jcpe.12946
- Тонетти МС, Гринвелл Х, Корнман КС (2018) Стадирование и градация периодонтита: структура и предложение новой классификации и определения случая. J Clin Periodontol 45(Suppl 20):S149– S161. https://doi.org/10.1111/jcpe.12945
- Армитидж ГС (2000) Разработка системы классификации для периодонтальных заболеваний и состояний. Northwest Dent 79:31–35
- Хэмп СЕ, Ниман С, Линдхе Дж (1975) Периодонтальное лечение многокорневых зубов. Результаты через 5 лет. J Clin Periodontol 2:126–135. https://doi.org/10.1111/j.1600-051x.1975.tb01734.x
- Аспарухова МБ, Киряк Д, Элиезер М, Михов Д, Скулен А (2019) Активность двух препаратов гиалуронана на первичных человеческих оральных фибробластах. J Periodontal Res 54:33–45. https://doi.org/10. 1111/jre.12602
- Фудзииока-Кобаяши М, Мюллер ХД, Мюллер А и др. (2017) Влияние гиалуроновой кислоты на клетки периодонтальной связки человека in vitro. BMC Oral Health 17:44. https://doi.org/10.1186/ s12903-017-0341-1
- Мюллер А, Фудзииока-Кобаяши М, Мюллер ХД и др. (2017) Влияние гиалуроновой кислоты на морфологические изменения поверхностей дентинов и последующее влияние на выживание, прикрепление и распространение клеток периодонтальной связки. Clin Oral Investig 21:1013–1019. https://doi.org/10.1007/s00784-016-1856-6
- Чен М, Ли Л, Ван З, Ли П, Фэн Ф, Чжэн Х (2019) Гиалуроновая кислота высокой молекулярной массы регулирует воспаление и миграцию, индуцированные P. gingivalis, в человеческих десневых фибробластах через сигнальный путь MAPK и NF-κB. Arch Oral Biol 98:75–80. https:// doi.org/10.1016/j.archoralbio.2018.10.027
- Данневиц Б, Зейдлер А, Хюсинг Дж и др. (2016) Потеря моляров у пациентов, прошедших периодонтальное лечение: результаты через 10 лет и более после активной периодонтальной терапии. J Clin Periodontol 43:53–62. https:// doi.org/10.1111/jcpe.12488
- Граец Ц, Шютцхольд С, Плауманн А и др. (2015) Прогностические факторы потери моляров - 18-летнее ретроспективное когортное исследование. J Clin Periodontol 42:943–950. https://doi.org/10.1111/jcpe.12460
- Граец Ц, Плауманн А, Шлаттманн П и др. (2017) Долгосрочное сохранение зубов при хроническом периодонтите - результаты через 18 лет консервативного периодонтального лечения в университетских условиях. J Clin Periodontol 44:169–177. https://doi.org/10.1111/jcpe.12680
- Матулиене Г, Пьетурссон БЕ, Сальви ГЕ и др. (2008) Влияние остаточных карманов на прогрессирование периодонтита и потерю зубов: результаты через 11 лет поддерживающей терапии. J Clin Periodontol 35:685– 695. https://doi.org/10.1111/j.1600-051X.2008.01245.x
- Сальви ГЕ, Мишлер ДС, Шмидлин К и др. (2014) Факторы риска, связанные с долговечностью многокорневых зубов. Долгосрочные результаты после активной и поддерживающей периодонтальной терапии. J Clin Periodontol 41:701–707. https://doi.org/10.1111/jcpe.12266
- Ариэль Х, Кахн А, Хила ЗО, Антон С, Натан Г, Колерман Р (2022) Термосенсорный гель с активным ингредиентом гиалуроновой кислоты, содержащий систему сохранения оксенида, как дополнение к чистке и планированию корней: рандомизированное проспективное клиническое исследование. Clin Oral Investig 26:3721–3733. https://doi.org/10.1007/s00784-021-04344-2
- Мохаммад CA, Мирза БА, Махмуд ЗС, Зардави ФМ (2023) Влияние геля гиалуроновой кислоты на периодонтальные параметры, провоспалительные цитокины и биохимические маркеры у пациентов с периодонтитом. Gels 9:325. https://doi.org/10.3390/gels9040325
- Олшевска-Чиж И, Кралик К, Прпич Дж (2021) Биомолекулы в стоматологических приложениях: рандомизированное контролируемое клиническое испытание, оценивающее влияние дополнительной терапии гиалуроновой кислотой на клинические параметры умеренного периодонтита. Biomolecules 11:1491. https://doi.org/10.3390/biom11101491
- Раманаускайте Е, Мачюльскиене В, Шираката Й, Двилиене УМ, Неджельскиене И, Скулен А (2023) Клиническая оценка гипохлорита натрия/аминокислот и перекрестно-связанной гиалуроновой кислоты в дополнение к не хирургическому периодонтальному лечению: рандомизированное контролируемое клиническое испытание. Clin Oral Investig. https://doi.org/10.1007/ s00784-023-05271-0
- Йентш ХФР, Рокуззо М, Пиллони А, Касай А, Фиммерс Р, Йепсен С (2021) Безразрезное применение производного матрицы эмали в периодонтальном повторном лечении: многоцентровое рандомизированное исследование. J Clin Periodontol 48:659–667. https://doi.org/10.1111/jcpe.13438
- Радулеску В, Боариу МИ, Русу Д и др. (2022) Клинические и микробиологические эффекты однократного применения геля гипохлорита натрия во время субгингивальной повторной инструментальной обработки: тройное слепое рандомизированное контролируемое клиническое испытание. Clin Oral Investig 26:6639–6652. https://doi.org/10.1007/s00784-022-04618-3
- Дайхл Д, Фридман А, Лидлофф П, Юнг РМ, Скулен А, Билхан Х (2022) Дополнительное применение гиалуроновой кислоты в сочетании с гелем гипохлорита натрия для не хирургического лечения остаточных карманов снижает необходимость в периодонтальной хирургии - ретроспективный анализ клинической серии случаев. Materials (Basel) 15:6508. https://doi.org/10.3390/ma15196508
- Коста ФО, Коста АМ, Кортелли ДжР и др. (2023) Влияние контроля над наддесневыми налетами на рецидивирующий периодонтит и клиническую стабильность среди лиц, находящихся на поддерживающей периодонтальной терапии: 10-летнее наблюдение. J Periodontol 94:55–65. https://doi.org/10. 1002/JPER.22-0301
- Томаси С, Кутузис Т, Венстром JL (2008) Местно доставляемый доксициклин как дополнение к механической депурации при повторном лечении периодонтальных карманов. J Periodontol 79:431–439. https:// doi.org/10.1902/jop.2008.070383
- Рамсейер КА, Нидеггер М, Уолтер С и др. (2019) Время между визитами на контроль и остаточные глубины зондирования предсказывают долгосрочную стабильность у пациентов, участвующих в поддерживающей периодонтальной терапии. J Clin Periodontol 46:218–230. https://doi.org/10.1111/jcpe.13041
