Эффективность силиконового тромбоцитарного фибрина и аутологичной кости при регенерации костной ткани в черепных дефектах кроликов: радиологическое и гистологическое исследование.
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация: Восстановление костных дефектов в челюстно-лицевой хирургии часто требует использования техник регенерации костной ткани. Кремний является элементом, который использовался в качестве регенерационного материала в нескольких исследованиях. В нашем исследовании кремний был комбинирован с аутологичной костью и мембранами, обогащенными тромбоцитами (PRF), чтобы проанализировать поведение этого элемента в регенерации костной ткани. Четыре окружных дефекта были созданы в черепной коробке 5 кроликов породы Новой Зеландии. Для регенерации дефектов были применены следующие элементы: (P): PRF; (S): кремний и (B): аутологичная кость, с следующими распределениями исследовательских групп: Группа 1 (PSB); Группа 2 (PS); Группа 3 (SB) и Группа 4 (КОНТРОЛЬ): группа без регенерации. Животные были умерщвлены через 3 недели. Были проведены исследования с использованием компьютерной микротомографии (μ-CT), а также гистоморфометрические исследования. Для сравнения результатов использовался статистический тест ANOVA с пост-хок тестом Бонферрони (p≤ 0.05). Радиологически группы PSB и SB показали лучшие результаты по количеству и проценту здоровой кости, но не значительно по сравнению с контрольной группой. Группа PS показала значительно худшие результаты. Гистологическое исследование показало, что группа PSB имела наибольшую площадь, процент и периметр минерализованной кости. При оценке формирующейся кости (остеоид) различий между группами не наблюдалось, за исключением периметра кости, где группа SB была значительно лучше. Переменная высоты кости не показала значительных различий. В заключение можно утверждать, что комбинация PRF, аутологичной кости и кремния дает хорошие результаты через 3 недели, в то время как группа PS показывает худшие результаты. Это подчеркивает важность аутологичной кости как части материала трансплантата для минерализации кости.
Введение
Костные дефекты в челюстно-лицевой хирургии распространены и иногда трудно поддаются ремонту, требуя техник регенерации костной ткани для обеспечения успеха восстановительного лечения. Научные исследования продолжают делать успехи в понимании биологических и физиологических процессов, связанных с заживлением, регенерацией и ремоделированием костной ткани. In vivo тканевая инженерия охватывает регенерацию и реконструкцию тканей и органов в самом организме. Основная идея заключается в том, что контролируемое манипулирование внеклеточной микроокружением может привести к контролю способности клеток организовываться, расти, дифференцироваться и формировать функционирующую внеклеточную матрицу, а в конечном итоге и новую функциональную ткань.
Регенеративные техники стали рутинными процедурами и с доказанными клиническими результатами, но их предсказуемость и время ожидания все еще являются одними из факторов, способствующих продолжению исследований по разработке новых и улучшенных материалов для регенерации костной ткани. Автологичная кость и обогащенная тромбоцитами плазма являются двумя широко используемыми материалами в области имплантологии для регенерации мягких и твердых тканей. Однако материал, который объединяет все преимущества каждого из них по отдельности, еще не был разработан.
Использование аутологичной кости широко описано в литературе, так как она считается золотым стандартом для регенерации кости. Тем не менее, несмотря на то, что она обладает отличными биологическими свойствами остеоиндукции, остеокондукции и остеогенеза, аутогенный трансплантат имеет значительную заболеваемость и высокий и непредсказуемый уровень резорбции, но показал, что его поведение улучшается в сочетании с другими костными заменителями, что приводит к более обильному и стабильному объему с течением времени и более быстрому заживлению кости.
Вместе с аутологичной костью, производные крови, богатые тромбоцитами, также часто используются в регенерации тканей. Среди этих производных находится фибрин, богатый тромбоцитами [PRF]. Это регенеративный биоматериал, широко используемый в различных медицинских приложениях. Более того, он приобрел большую популярность по сравнению с плазмой, богатой тромбоцитами [PRP], потому что это одноступенчатая техника, к которой не нужно добавлять химические вещества. Еще одним преимуществом является более постепенное высвобождение факторов роста с течением времени. Одна фибринная мембрана содержит большое количество факторов роста и цитокинов, участвующих в регенерации кости и созревании мягких тканей. Это легко манипулируемый биоматериал, который в Оральной Хирургии применяется в периодонтальной терапии, сохранении альвеол, хирургических процедурах по увеличению кости и, в сочетании с костными трансплантатами, в хирургии поднятия верхнечелюстной пазухи. Его последнее применение, еще не клинически протестированное, заключается в использовании в качестве дезинфицирующего средства для шероховатых титановыми поверхностями благодаря его антимикробным свойствам.
Наконец, существует несколько публикаций, которые утверждают, что биоорганические ионы, такие как цинк, марганец, магний или кремний, необходимы для метаболизма костей. Кремний является вторым по распространенности элементом в земной коре, а в человеческом организме он в основном находится в областях минерализации и роста костей. Он играет жизненно важную роль в биологии костной и соединительной ткани, и хотя его механизм действия не совсем понятен, благодаря исследованиям Карлайла и Шварца известно, что он действует, вызывая большую минерализацию на костной матрице через синтез и стабилизацию перекрестного связывания коллагеновых волокон. Кремний является инициирующим фактором в минерализации костей, поскольку он присутствует в повышенных концентрациях в остеоидной матрице незрелой кости, и по мере созревания кости концентрация кремния уменьшается за счет концентрации кальция. На протяжении многих лет он использовался как регенеративный материал для костей в виде покрытия для зубных имплантатов, а также был включен в керамические биоматериалы [гидроксиапатит, трикальцийфосфат или стеклянные керамики], обеспечивая хорошие результаты в отношении регенерации костей в in vitro и in vivo исследованиях. Это хорошее поведение связано с его прочной связью. Кремний использовался вместе с другими биоматериалами, такими как стеклянные керамики или апатит, или с трикальцийфосфатом [TCP], чтобы улучшить биологические свойства материалов, с которыми он связывается. Однако, насколько нам известно, не проводилось исследований с костями из-за образования биологически активного слоя, аналогичного апатиту, на его поверхности.
Силикон использовался вместе с другими биоматериалами, такими как стеклянные керамики или апатит, или с трикальцийфосфатом [TCP], чтобы улучшить биологические свойства материалов, с которыми он связывается. Однако, насколько нам известно, не было найдено исследований по использованию силикона в сочетании с аутологичной костью или с мембранами, обогащенными тромбоцитами, для использования в регенерации кости.
В нашем исследовании силикон был комбинирован с аутологичной костью и мембранами PRF для анализа роли этого элемента в регенерации кости при сочетании с другими широко используемыми биоматериалами. Основная цель заключалась в оценке регенерации кости, полученной в различных анализируемых группах (это (P): PRF; (S): силикон и (B): аутологичная кость, с распределением исследовательских групп следующим образом: Группа 1 (PSB); Группа 2 (PS); Группа 3 (SB) и Группа 4 (КОНТРОЛЬ): нерегенерированная группа) в течение 3 недель в модели испытаний на животных.
Материалы и методы
Испытуемые образцы животных
Экспериментальное исследование проводилось на теменной кости 5 лабораторных кроликов породы Новой Зеландии в возрасте 6 месяцев и весом от 3.5 до 4 кг. Животные ежедневно кормились (ad libitum) лабораторным кормом для животных марки Harlan-Teklad (2030). Животные подвергались хирургическому вмешательству под общим наркозом в Минимально Инвазивном Хирургическом Центре Хесуса Усона, [Касерес, Экстремадура, Испания]. Эксперимент проводился в соответствии с рекомендациями Испанского Национального Института Здравоохранения (NIH) и Европейской Директивы 86/609/EEC о заботе и использовании экспериментальных животных. Исследование также соответствовало Европейской Директиве 2010/63/EU о защите животных, используемых в экспериментальных целях, и всем местным законам и нормативам. Исследователи получили одобрение Этического Комитета Учреждения (CCMI-Ref 028/16). Идентификация животных, входящих в группы для оценки, проводилась с использованием чипа. В течение экспериментального периода образцы содержались в индивидуальных клетках.
Хирургическая процедура
Перед началом хирургической процедуры была проведена иммобилизация кроликов, и были зафиксированы их жизненные показатели. Используемыми анестетиками были внутривенный мидазолам (0.25 мг / кг) и пропофол (5 мг / кг), а также ингалируемый газ севофлуран 2.8%. Использовались два анальгетика: трамадол (3 мг / кг) и кеторолак (1.5 мг / кг). После седатации была взята ретроорбитальная кровь от каждого кролика с использованием бабочки. Указанные образцы были помещены в пробирки без антикоагулянта и центрифугированы в течение 12 минут на скорости 2700 об/мин при комнатной температуре для получения мембран PRF. После получения мембран они были нарезаны на небольшие части диаметром примерно 2 мм, чтобы разделить их на три части, которые впоследствии использовались для трех экспериментальных групп. Использовалось 0.01 мг на куб. см силиконового версената. (Лаборатория естественной энергии Венесуэлы, Каракас, Венесуэла).
Четыре несамовосстанавливающихся костных дефекта были созданы (диаметр: 9 мм; глубина: примерно 3 мм, до достижения твердой мозговой оболочки) на теменной кости, с каждой стороны средней линии черепа, с использованием трепанатора (Helmut-Zepf Medical GmbH, Зайтинген, Германия), установленного на хирургическом микромоторе на 2000 об/мин под орошением физиологическим раствором. Пьезоэлектрические инструменты использовались для удаления внутренней таблицы и мозговой кости каждого дефекта. Глубина контролировалась с помощью пародонтального зонда. После выполнения дефектов полученная кость была измельчена, и полученный материал был разделен на две равные части. Конфигурация групп была следующей: Группа 1 (PSB): смесь мембраны, богатой тромбоцитами (P) + силикон (S) + аутологичная кость (B); Группа 2 (PS): мембрана, богатая тромбоцитами (P) + силикон (S); Группа 3 (SB): силикон (S) + аутологичная кость (B) и, наконец, Группа 4 (КОНТРОЛЬ), в которой не было размещено регенеративного материала. Распределение групп на теменной кости можно увидеть в Таблице 1.
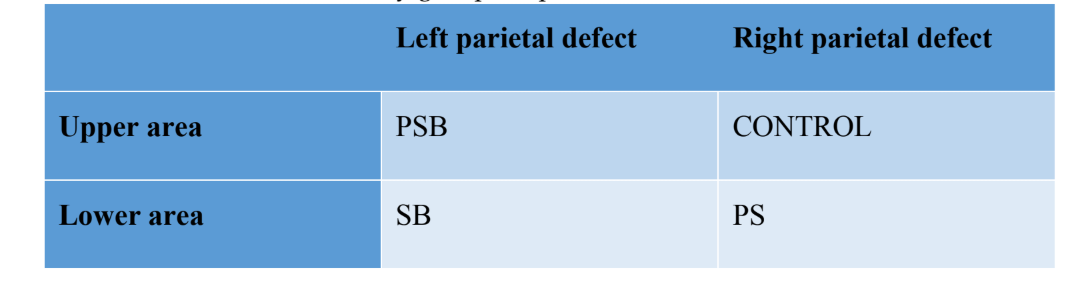
После наложения швов были введены противовоспалительные и анальгезирующие препараты (карпрофен 1 мл / 12,5 кг и бупренорфин 0,05 мг / кг). Наконец, животные были умерщвлены с использованием внутривенной передозировки хлорида калия через 3 недели. Хирургическую процедуру можно увидеть на рисунке 1.
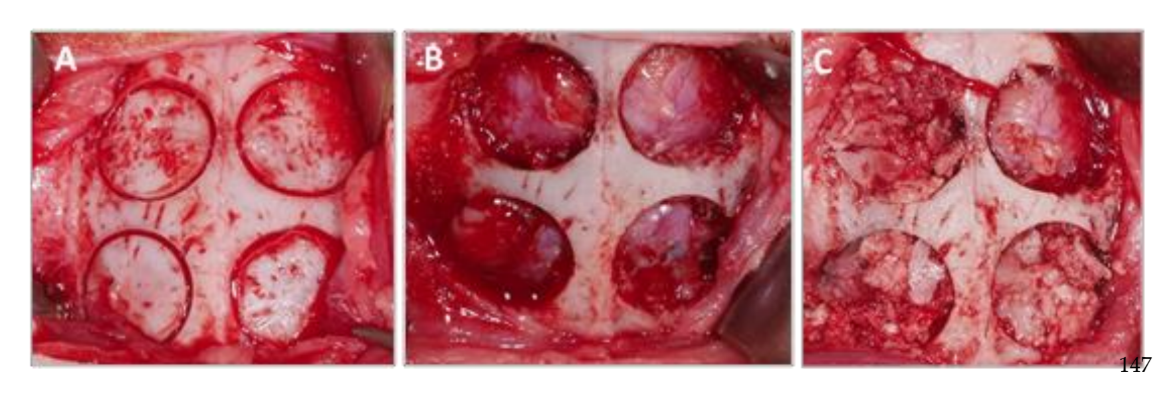
Образцы, полученные из черепной коробки каждого экземпляра, были нарезаны по анатомической сагиттальной плоскости, и после отделения от мозговой массы и промывания в физиологическом растворе, кусочки были нарезаны и помечены индивидуально. Каждый из образцов был погружен в 10% раствор формалина для томографического и гистоморфометрического анализа.
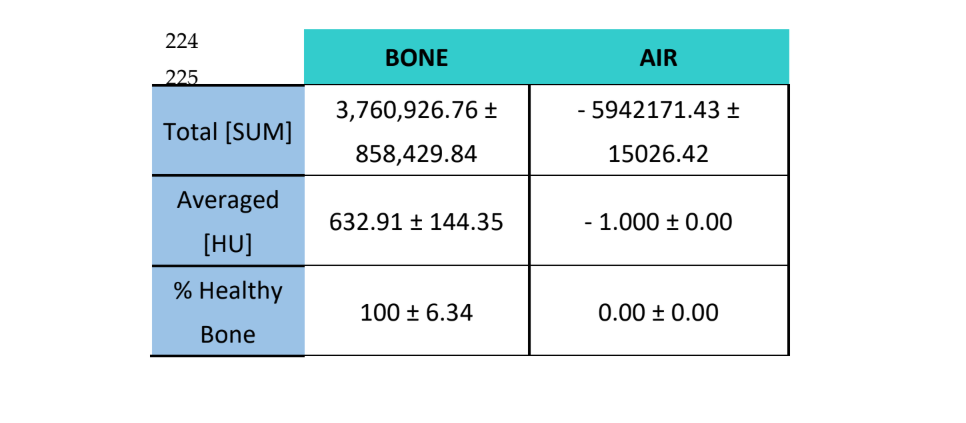
Микрокомпьютерная томография (микро-КТ)
Образцы были проанализированы с использованием компьютерной томографии (КТ) с помощью сканера CT Bruker Albira (Bruker Co., Billerica, MA, USA). Съемки проводились с использованием следующих параметров: 1000 изображений, в 360° рентгенографической проекции, при 45 кВ и времени захвата 30 минут. Томографическая реконструкция была выполнена с использованием программного обеспечения Albira Suite (Bruker Co., Billerica, MA, USA) и стандартных параметров реконструкции для генерации 2D и 3D объемов с разрешением 8.3 вокселей/мм. Средняя плотность кости, измеренная в единицах Хаунсфилда (HU), была оценена с использованием программного обеспечения PMOD (Bruker Co., Billerica, MA, USA), размещая сферические объемы интереса [VOI] диаметром 2 мм в розеточной форме внутри каждойLesion. Высококачественные реконструкции объема 10 мм3 были выполнены в каждойLesion с использованием программного обеспечения Albira Suite, что привело к объемам с разрешением 20 вокселей/мм. Для каждого из объемов были оценены следующие переменные: (1) Общая сумма значений Хаунсфилда всех вокселей (TOTAL SUM), (2) среднее значение всех значений Хаунсфилда вокселей (Averaged) в единицах Хаунсфилда и (3) процент здоровой кости (%).
Те же переменные были оценены для воздуха ̶ как измерение для установления фонового шума изображений ̶ и для окружающей кости, в которой процент ожидаемой здоровой кости составляет 100%.
Гистологическая обработка образца
Образцы были получены из черепа каждого экземпляра, срезая вдоль анатомической сагиттальной плоскости. Высушенные образцы были немедленно погружены в раствор 4% формальдегида и 1% кальция, заключенного в акриловую смолу, и они были обработаны для резки по методу Доната и Бреунера для получения гистологических срезов толщиной 5 мкм. Образцы были окрашены по методу Вона Коссa (VK) 5% нитратом серебра (Sigma-Aldrich Chemical Co., Poole, Великобритания), чтобы увидеть минерализованную кость через 3 недели, и они были исследованы с использованием оптического микроскопа Olympus BXB61 (Olympus, Токио, Япония) с объективами 1.5 и 20x. Изображения были сделаны с использованием цифрового сигнального процессора DSP DS-Fi1 (Nikon, Токио, Япония) в сочетании с программным обеспечением NIS-Elements 4.0 BR (Nikon, Токио, Япония). Было сделано изображение каждого костного дефекта. За неделю до жертвоприношения образцов (на 2-й неделе) кроликам был введен флуоресцентный маркер для наблюдения за осаждением кальцеина на недавно отложенной костной матрице. Флуоресцентные изображения были сделаны с использованием камеры DSP DS-Fi1 [Nikon, Токио, Япония] в сочетании с программным обеспечением NIS-Elements 4.0 BR [Nikon, Токио, Япония].
Для обоих видов окраски (VK и иммунофлуоресценция) были проанализированы четыре переменные: высота кости (только на VK) (мм) (BH), площадь кости (мкм2) (BA), процент площади кости (%) (BA) и периметр кости (мкм) (BP).
Статистический анализ
Для статистического анализа полученных результатов был применен t-тест ANOVA с последующим тестом Бонферрони для сравнения результатов, полученных в обеих группах исследования, с использованием программного обеспечения STATVIEW F-4.5. Результаты были выражены как медиана ± стандартное отклонение для всех проанализированных переменных. Уровень значимости был установлен на уровне p ≤ 0.05.
Результаты
Результаты для радиологических переменных
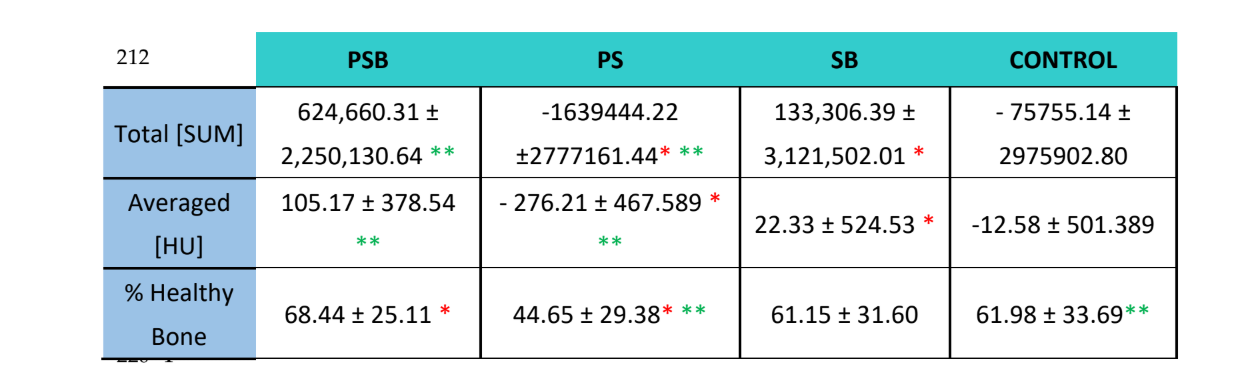
С использованием программного обеспечения Albira Suite были получены высококачественные 2D и 3D реконструкции (Рисунок 2), и были измерены переменные количественной оценки кости, по которым через 3 недели не было статистически значимых различий между группами PSB, SB и CONTROL в переменных Общая СУММА, Средняя и % Здоровая Кость. Группа PS показала наименьшие значимые значения для этих трех переменных (Таблицы 2 и 3).
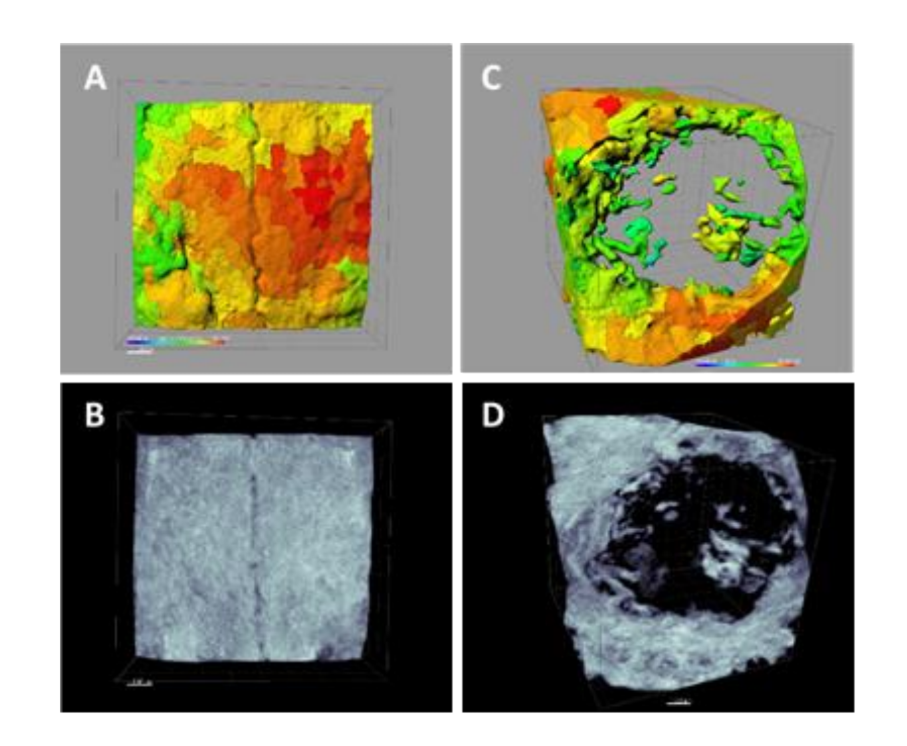
Через три недели были проведены гистологические оценки четырех групп (Таблица 4). Переменная высоты кости не показала статистически значимых различий между группами после 3 недель заживления.
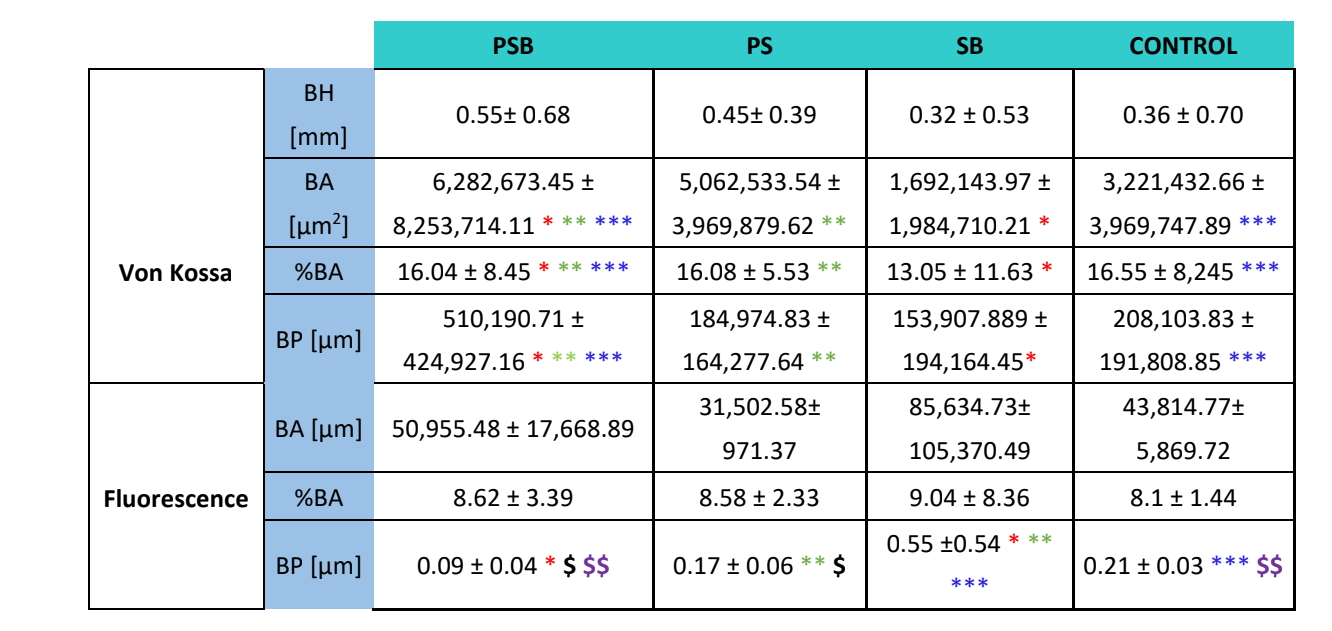
Были проведены два гистологических окрашивания: Вон Косс и флуоресценция (Рисунок 4). Первое использовалось для наблюдения за минерализованной костью. Были исследованы площадь кости [BA], процентная площадь [%BA] и периметр кости [BP]. Окрашивание Вон Косс показало, что группа PSB имела статистически более высокие значения BA и BP по сравнению с другими группами. Процентная площадь [%BA] была выше в группе КОНТРОЛЬ, хотя и незначительно по сравнению со всеми группами, так как размер выборки был очень мал.
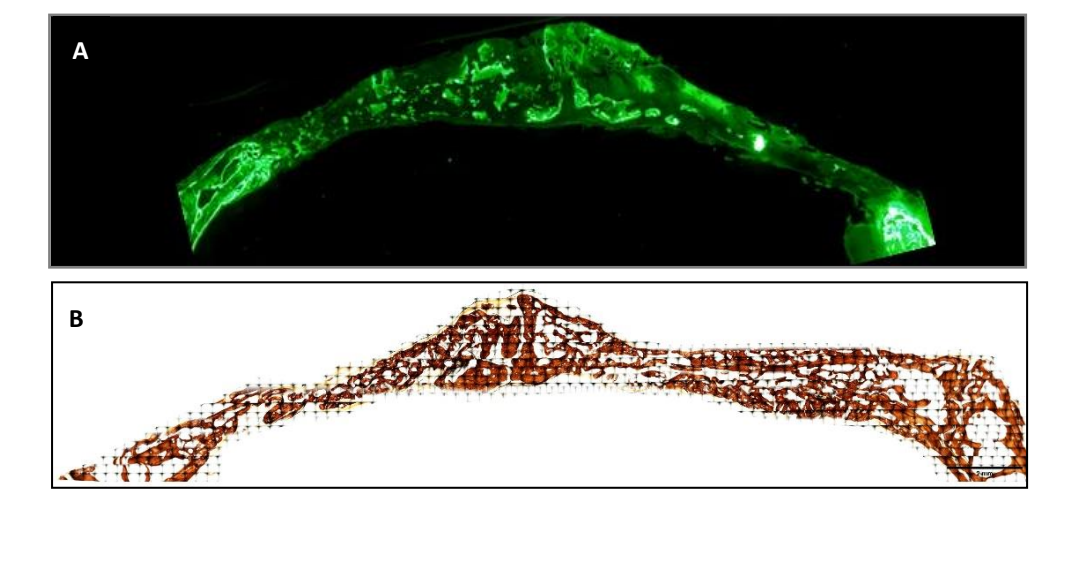
Флуоресцентное окрашивание использовалось для измерения вышеупомянутых переменных в недавно отложенной кости. Статистически значимых различий между группами по переменным BA и %BA не было обнаружено через 3 недели. В группе SB периметр кости был значительно выше, в то время как группа PSB показала значительно более низкое значение.
Обсуждение
В этом радиологическом и гистологическом исследовании мы наблюдали за образованием кости после размещения различных материалов для регенерации кости, к которым был добавлен кремний, чтобы оценить его роль в качестве стимулятора образования кости.
В радиологическом исследовании (Таблица 2) было отмечено, что группы PSB и SB показали более высокие значения как по количеству, так и по проценту здоровой кости. Однако эти различия не были статистически значимыми по сравнению с контрольной группой. С другой стороны, группа PS действительно показала значительно более низкие значения по сравнению с остальными группами.
Гистологическое исследование (Таблица 4) показало, что группа PSB имела наибольшую площадь, процент и периметр минерализованной кости по сравнению с другими группами. Напротив, при оценке осаждения кальцеина на костной матрице различий между группами по площади кости и проценту площади не наблюдалось. Группа SB показала значительно больший периметр кости. Переменная высоты кости не показала различий между группами.
Силикон является биоорганическим ионом, который использовался в качестве регенеративного материала в нескольких исследованиях, обычно с другими неорганическими биоматериалами, такими как фосфат кальция или гидроксиапатит. Преимущества, которые они предлагают, заключаются в низкой стоимости и более длительном сроке службы. Биологическая активность силикона будет зависеть от накопления ионов силикона при его воздействии на жидкости организма, такие как кровь, как в случае данного исследования. Этот феномен должен был привести к образованию слоя, подобного биологически активному апатиту.
Насколько нам известно, в литературе нет доказательств использования кремниевого версената в качестве регенеративного материала, поэтому сравнение с другими исследованиями должно проводиться с осторожностью.
Обычно применяемый метод заключается в замене гидроксиапатита или кальцийфосфата на кремний с помощью методов осаждения, что позволяет получить регенеративные биоматериалы с лучшими свойствами. Несколько in vitro исследований показали, что кремний является биосовместимым и биоинертным элементом. Более того, он способствует ангиогенезу, остеобластической дифференциации и увеличивает минеральную плотность кости, ускоряя ее формирование. В недавнем исследовании дефекты были регенерированы на черепных сводах крыс, и через 4 недели было отмечено, что образовалось значительно больше костной ткани по сравнению с аналогичной смесью, в которую кремний не был добавлен.
Аналогичным образом были проведены смешанные in vitro и in vivo исследования, в которых удалось сравнить поведение кремния в обеих ситуациях. Мао и др. провели исследование, в котором кремний был добавлен в смесь кальцийфосфата и стеклокерамики для регенерации дефектов черепной коробки у кроликов. Жизнеспособность клеток была аналогична той, что наблюдалась в губчатой бычьей кости, но с более высокой скоростью клеточной пролиферации. Все это было связано с включением ионов кремния, которые также способствовали другим клеточным функциям, таким как клеточная адгезия. В проведенном гистологическом исследовании было отмечено увеличение образования новой кости в экспериментальной группе.
В соответствии с рассмотренной литературой, ожидается, что в группах, содержащих кремний, будет обнаружено большее количество минерализованной кости. В нашем исследовании группы PS и SB не показали различий по сравнению с контрольной группой, тогда как комбинация кремния, фибрина, богатого тромбоцитами, и аутологичной кости [группа PSB] продемонстрировала значительно более высокий уровень минерализованной кости по сравнению с остальными.
Аутологичная кость по-прежнему считается золотым стандартом материала для регенерации, поскольку она является единственной с остеогенными, остеоиндуктивными и остеокондуктивными свойствами, что дает ей преимущество по сравнению с остальными доступными материалами. Тем не менее, ее ограниченная доступность, заболеваемость и более высокая скорость резорбции побудили к поиску новых биоматериалов.
В нашем исследовании аутологичная кость в комбинации с кремнием [SB] не показала значительных различий по сравнению с группами PS и контрольной группой в отношении кальцифицированной кости. Однако, после группы PSB, она была той, которая представила большее количество кости и большую периметрию остеоидной кости. Нет публикаций, в которых какая-либо из исследуемых групп использовала аутологичную кость с кремнием; и наши предварительные результаты предполагают, что нам нужно будет посмотреть, как аутологичная кость ведет себя в течение более длительных периодов.
Плазма, богатая фибрином, ранее использовалась в регенерации костей как единственный наполнитель или в сочетании с аутологичной костью, ксенографтами или аллопластическими графтами, обеспечивая лучшие результаты в отношении регенерации костей и более быстрое заживление по сравнению с негативными контрольными группами. Однако существует ограниченное количество доказательств по сочетанию кремния и концентратов, богатых тромбоцитами. В литературе было найдено всего два исследования, которые комбинируют оба материала. Их результаты различаются, как и наши. В первом исследовании комбинация PRP/кремний была затем гелирована с помощью хлорида кальция. Она была применена на клеточной культуре остеобластов, и в экспериментальной группе была наблюдаема большая пролиферация, большая жизнеспособность клеток и большее отложение кальция по сравнению с группой без кремния. Напротив, во втором исследовании фактор, генерирующий клетки (CGF), был комбинирован с натриевым орфосиликатом на человеческих остеобластах. Статистически значимых различий в отношении клеточной пролиферации или роста по сравнению с группами, в которых был введен только орфосиликат или только концентрат тромбоцитов, не было обнаружено. Напротив, было наблюдено большее производство коллагена типа I. В обоих исследованиях было сделано заключение, что остеокондуктивные свойства кремния будут усилены факторами роста в CGF. Оба результата различались в нашем исследовании, в котором группа PS показала значительно более низкие радиологические значения, хотя гистологически не показала различий по сравнению с контрольной группой. Сравнение с обеими публикациями должно проводиться с осторожностью, поскольку это были in vitro исследования с другим материалом. Тем не менее, наши результаты соответствуют двум испытаниям, проведенным на костях кроликов, в которых было наблюдено, что PRF не значительно улучшает регенерацию костей по сравнению с негативной контрольной группой.
В нашем исследовании было отмечено большее образование минерализованной кости в группе PSB, и это может быть связано с двумя факторами: первый из них заключается в том, что кремний и PRF могут повысить свою остеокондуктивную способность, сочетаясь друг с другом, и одновременно ускорить минерализацию кости. Это может объяснить лучшее выполнение группы PSB в нашем исследовании. Второй фактор - это добавление аутологичной кости к биоматериалу, который, как уже упоминалось, считается эталонным материалом в регенерации кости.
Среди ограничений исследования стоит отметить малое количество образцов в выборке, а также оцененный временной период. Группы исследования PSB и SB продемонстрировали хорошие результаты регенерации, однако радиологически они не показали значительной разницы по сравнению с контрольной группой. Способом улучшения исследования могло бы стать оценивание более длительных временных периодов, что, возможно, дало бы более информативные результаты о поведении этих регенеративных материалов. Кроме того, использование положительной контрольной группы (заполнение дефекта аутологичной костью без кремния или смесью только аутологичной и гетерологичной кости) могло бы быть рассмотрено. Еще одним ограничением исследования является сложность сравнения из-за типа используемого материала (кремний версенат). Кремний - это элемент, который используется в очень различных формах в литературе, таких как диоксид кремния, ацетат кремния и силикат натрия, и до сих пор нет валидированного протокола. В нашем исследовании использовался гранулированный кремний. В физиологических условиях биодоступный кремний находится в форме орто-силикатной кислоты, в то время как в исследованиях, в которых использовался гидроксиапатит, замещенный кремнием, кремний использовался в форме SiO4, хотя, с другой стороны, недавно было показано, что кремний в своей физиологической форме не может концентрироваться на неорганической минеральной стадии кости без предварительной метаболизации в орто-силикат.
В радиологическом исследовании не было обнаружено статистически значимых различий между группами исследования по сравнению с контрольной группой, и это может быть связано с отсутствием использования мембран или фиксирующих агентов для покрытия дефекта, чтобы стабилизировать коагуляцию и предотвратить задержку в полной оссификации области, хотя изучаемый период (3 недели) был бы недостаточным для ее наблюдения.
Заключения
Силикон является многообещающим элементом в качестве материала, который можно включить с другими материалами для регенерации костей из-за его низкой стоимости и хороших свойств, наблюдаемых in vitro и in vivo, хотя определение его свойств и оптимальных условий использования все еще исследуется. Комбинация фибрина, обогащенного тромбоцитами, аутологичной кости и силикона дает хорошие результаты через 3 недели. Группы PSB и SB показывают хорошие результаты, при этом группа PSB демонстрирует большую скорость минерализации кости по сравнению с SB, и это может быть связано с включением плазмы, обогащенной тромбоцитами, и силикона. Полученные в этом исследовании результаты подчеркивают важность аутологичной кости как части материала трансплантата для минерализации кости.
В рамках данного исследования гистологический анализ регенерированных тканей может предоставить полезную информацию о природе и количестве образованной кости с использованием кремния, обогащенной тромбоцитами фибрины и аутологичной кости. Необходимы дальнейшие исследования для получения знаний о истинном регенеративном потенциале биоорганических ионов, таких как кремний.
Авторы: Аргимиро Эрнандес-Суарес, Мария Ризо-Горритта, Дубраска Суарес-Вега, Гладис Веласко, Иван Родригес Гельфенштейн, Мария-Ангелес Серрера-Фигалло и Даниэль Торрес-Лагарес
Ссылки:
- Феррес Э. Исследование эффекта добавления кремния к бета-фосфату трикальция и гидроксиапатиту в неоформлении костной ткани при критических дефектах на черепах и кроликах. Докторская диссертация. Университет Мурсии. 2017.
- Моралес Д. Инженерия тканей как опора регенеративной медицины в стоматологии. Кубинский журнал стоматологии 2014;51(3):288-304
- Оппенгеймер А. Дж., Тонг Л., Бухман С. Р. Краниофациальная костная трансплантация: закон Вольфа в новом свете. Травмы черепно-лицевой области и реконструкция. 2008;1(1):49-61.
- Хенкель Дж., Вудрафф М. А., Эпари Д. Р., Штек Р., Глатт В., Дикинсон И. С., Чунг П. Ф., Шютц М. А., Хутмахер Д. В. Регенерация костей на основе концепций тканевой инженерии - перспектива XXI века. Исследования костей. 2013 25 сентября;1(3):216-48.
- Морденфельд А., Йоханссон К. Б., Альбректссон Т., Халльман М. Рандомизированное контролируемое клиническое испытание двух различных составов депротеинизированной бычьей кости и аутогенной кости, использованных для увеличения бокового гребня. Клинические исследования имплантатов. 2014 март;25(3):310-320.
- Масуди Э., Рибас Ж., Каушик Г., Лейтен Дж., Хадемхоссеини А. Производные крови, обогащенные тромбоцитами, для тканевой инженерии и регенерации на основе стволовых клеток. Текущие отчеты по стволовым клеткам. 2016 март;2(1):33-42.
- Анитуа Э., Санчес М., Нурден А. Т., Нурден П., Ориве Г., Андия И. Новые идеи и новые применения для терапий с обогащенной тромбоцитами фибриной. Тенденции в биотехнологии. 2006 май;24(5):227-34.
- Амарал Валладао С. А. мл., Фрейтас Монтейро М., Жоли Ж. К. Направленная регенерация костей в поэтапном вертикальном и горизонтальном увеличении костной ткани с использованием обогащенной тромбоцитами фибрины в сочетании с костными трансплантатами: ретроспективное клиническое исследование. Международный журнал имплантологии. 2020 17 октября;6(1):72.
- Чо Й. С., Хванг К. Г., Чун Ш. Х., Талларико М., Квон А. М., Парк Ч. Дж. Радиологический сравнительный анализ между солевым и обогащенным тромбоцитами фибринами заполнением после гидравлического транс-крестцового поднятия синуса без дополнительного костного трансплантата: рандомизированное контролируемое испытание. Клинические исследования имплантатов. 2020 ноябрь;31(11):1087-1093.
- Ареевонг К., Чантарамунгкорн М., Хонгкхунтхиан П. Обогащенная тромбоцитами фибрина для сохранения альвеолярных костных лунок после удаления зуба: рандомизированное контролируемое испытание. Клинические исследования имплантатов и связанных исследований. 2019 декабрь;21(6):1156-1163.
- де Алмейда Баррос Мораун CF, де Мелло-Мачадо Р. С., Джаид К., Морасчини В. Использование лейкоцитарной и обогащенной тромбоцитами фибрины в управлении заживлением мягких тканей и болями в лунках после удаления: рандомизированное клиническое испытание. Журнал черепно-лицевой хирургии. 2020 апрель;48(4):452-457.
- Кастро А. Б., Эрреро Е. Р., Сломка В., Пинто Н., Тегелс В., Квиринен М. Антимикробная способность лейкоцитарной и обогащенной тромбоцитами фибрины против периодонтальных патогенов. Научные отчеты. 2019 3 июня;9(1):8188.
- Шульдт Л., Би Дж., Оуэн Г., Шен Й., Хаапасало М., Хаккинен Л., Ларява Х. Деконтаминация шероховатых поверхностей имплантатов, колонизированных многими видами орального биопленки, с помощью применения лейкоцитарной и обогащенной тромбоцитами фибрины. Журнал периодонтологии. 2020 27 августа.
- Зофкова И., Немчикова П., Матуча П. Микроэлементы и здоровье костей. Клиническая химия и лабораторная медицина. 2013 август;51(8):1555-61.
- Чжан Д., Вонг С. Ч., Вэнь Ц., Ли Й. Клеточные реакции остеобластоподобных клеток на 17 элементарных металлов. Журнал биомедицинских материалов. 2017 январь;105(1):148-158.
- Арора М., Арора Е. Обещание кремния: регенерация костей и увеличение плотности костей. Журнал артроскопии и суставной хирургии 2017;4(3):103-105.
- Карлайл Э. М. Кремний. Возможный фактор в кальцификации костей. Наука 1970;167:279–280.
- Карлайл Э. М. Кремний как необходимый микроэлемент в питании животных. Симпозиум Фонда Сиба. 1986;121:123-39.
- Шварц К., Милн Д. Б. Эффекты, способствующие росту, кремния у крыс. Природа. 1972 6 октября;239(5371):333-4.
- Донг М., Цзяо Г., Лю Х., У В., Ли С., Ван Ц., Сюй Д., Ли Х., Лю Х., Чен Й. Биологический кремний стимулирует синтез коллагена типа 1 и остеокальцина в остеобластоподобных клетках человека через сигнальный путь BMP-2/Smad/RUNX2. Биологические исследования следов элементов. 2016 октябрь;173(2):306-15.
- Прайс К. Т., Ковал К. Дж., Лангфорд Дж. Р. Кремний: обзор его потенциальной роли в профилактике и лечении постменопаузального остеопороза. Международный журнал эндокринологии. 2013;2013:316783.
- Зоу С., Ирланд Д., Брукс Р. А., Раштон Н., Бест С. Эффекты силикатных ионов на адгезию, пролиферацию и дифференцировку остеобластов человека. Журнал биомедицинских материалов. 2009 июль;90(1):123-30. Урibe П., Йоханссон А., Джугдаохсинг Р., Пауэлл Дж. Дж., Магнуссон С., Давила М., Вестерлунд А., Рансё М. Растворимый кремний стимулирует остеогенную дифференцировку и связь через щелевые соединения в клетках зубного фолликула человека. Научные отчеты. 2020 18 июня;10(1):9923.
- Ким, Е. Дж., Бу, С. Й., Сунг, М. К. & Чой, М. К. Эффекты кремния на активность остеобластов и минерализацию костей клеток MC3T3-E1. Биологические исследования следов элементов. 2013; 152(1):105–12.
- Хенч Л. Л., Ксиноса И. Д., Полак Дж. М. Биологически активные стекла для in situ регенерации тканей. Журнал науки о материалах. 2004;15(4):543-62.
- Чоудхури М. Кремниевые формулы для доставки лекарств, лечения костей и регенерации костей. ChemBioEng Rev 2016; 3(5):229-246.
- Бюн И. С., Саркар С. К., Анибан Джйоти М., Мин Й. К., Сео Х. С., Ли Б. Т., Сонг Х. Й. Первоначальная биосовместимость и улучшенный ответ остеобластов при легировании Si в пористом заменителе костного графта BCP. Журнал материалов. 2010 июнь;21(6):1937-47.
- Мао З., Гу Й., Чжан Дж., Шу В. В., Цуй Й. Превосходная биологическая производительность и остеоиндуктивная активность частиц биоактивного восстановления костей, содержащих Si, для реконструкции альвеолярной кости. Церам. Инт. 2020. 46(2020):353-364.
- Ван Х., Ито А., Сого Й., Ли Х., Ояне А. Силикатно-апатитные композитные слои на внешних фиксирующих стержнях и in vitro оценка с использованием фибробластов и остеобластов. Журнал биомедицинских материалов. 2010 1 марта;92(3):1181-9.
- Рох Дж., Ким Дж. Й., Чой Й. М., Ха С. М., Ким К. Н., Ким К. М. Регенерация костей с использованием смеси кораллового HA и β-TCP, замещенного кремнием, в модели дефекта костной черепной кости у крыс. Материалы (Базель). 2016 6 февраля;9(2):97.
- Толедано М., Толедано-Осорио М., Осорио Р., Карраско-Кармоно А., Гутьеррес-Перес Х. Л., Гутьеррес-Корралес А., Серрера-Фигалло М. А., Линч К. Д., Торрес-Лагарес Д. Доксилицин и полимеры на основе кремния с загруженными нанофибрами как биоматериалы для регенерации костей. Полимеры (Базель). 2020 25 мая;12(5):1201.
- Санчес Ф., Ореро А., Сориано А., Коррехер С., Конде П., Гонсалес А., Эрнандес Л., Молинер Л., Родригес-Альварес М. Дж., Видал Л. Ф., Бенльох Дж. М., Чапман С. Е., Ливи У. М. ALBIRA: система ПЭТ∕SPECT∕CT для мелких животных. Медицинская физика. 2013 май;40(5):051906.
- Донат К., Брюнер Г. Метод для изучения недекальцинированных костей и зубов с прикрепленными мягкими тканями. Техника Säge-Schliff (пила и шлифовка). Журнал оральной патологии. 1982 август;11(4):318-26.
- Гарбо К., Локс Дж., Д'Эсте М., Демазо Г., Мокану А., Роман К., Хоровиц О., Томоаия-Котисел М. Продвинутые многосубstituted гидроксиапатиты Mg, Zn, Sr, Si для регенерации костей. Международный журнал наномедицины. 2020 13 февраля;15:1037-1058.
- Ван В., Йеунг К. В. Костные графты и заменители биоматериалов для ремонта костных дефектов: обзор. Bioact Mater. 2017 июнь 466 7;2(4):224-247.
- Гётц В., Тобиасч Е., Витцлебен С., Шульце М. Эффекты кремниевых соединений на биоминерализацию, остеогенез и образование твердых тканей. Фармацевтика. 2019 12 марта;11(3):117.
- Гибсон И. Р., Бест С. М., Бонфилд В. Влияние замещения кремнием на спекание и микроструктуру гидроксиапатита. Журнал Американского керамического общества. 2002;85(11):2771–2777
- Портер А. Е., Ботелхо К. М., Лопес М. А., Сантос Дж. Д., Бест С. М., Бонфилд В. Ультраструктурное сравнение растворения и осаждения апатита на гидроксиапатите и гидроксиапатите, замещенном кремнием, in vitro и in vivo. Журнал биомедицинских материалов. 2004 15 июня;69(4):670-9.
- Ли Х., Чанг Дж. Биологически активные силикатные материалы стимулируют ангиогенез в системе ко-культуры фибробластов и эндотелиальных клеток через паракринный эффект. Acta Biomater. 2013 июнь;9(6):6981-91.
- Ши М. Й., Динг С. Дж., Чанг Х. Ц. Роль кремния в пролиферации и апоптозе остеобластоподобных клеток. Acta Biomater. 2011 477 июнь;7(6):2604-14.
- Тиан Е. С., Хуан Дж., Бест С. М., и др., Ответ остеобластов на нанокристаллический гидроксиапатит, замещенный кремнием, тонкая пленка. Биоматериалы 2006; 27(13):2692–2698
- Ли, С. Х., Ким, С. В., Ли, Дж. И., Юн, Х. Дж. Влияние обогащенной тромбоцитами фибрины на регенерацию костей и ангиогенез в дефектах черепа кроликов. Тканевая инженерия и регенеративная медицина 2015. 12(5):362-370.
- Джон Й. Р., Ким М. Дж., Ким Ё. О., Рох Т. С., Ли В. Дж., Кан Э. Х., Юн И. С. Регенерация костей без каркаса с использованием обогащенной тромбоцитами фибрины в модели дефекта черепа. Журнал черепно-лицевой хирургии. 2018 январь;29(1):251-254.
- Синдел А., Деречи Ö, Тору Х. С., Тозоглу С. Гистоморфометрическое сравнение регенерации костей в критически больших костных дефектах с использованием деминерализованной костной матрицы, обогащенной тромбоцитами фибрины и гиалуроновой кислоты в качестве заменителей костей. Журнал черепно-лицевой хирургии. 2017 октябрь;28(7):1865-1868.
- Көкдере Н. Н., Байкул Т., Фындык Й. Использование обогащенной тромбоцитами фибрины (PRF) и PRF-смешанного частицами аутогенного костного графта в лечении костных дефектов: экспериментальное и гистоморфометрическое исследование. Журнал стоматологических исследований (Исфахан). 2015 сентябрь-октябрь;12(5):418-24.
- Караюрэк Ф., Кадироглу Е. Т., Нергиз Й., Кошкун Акчай Н., Туник С., Эрсёз Канай Б., Уйсал Е. Сочетание обогащенной тромбоцитами фибрины с различными материалами костного графта: экспериментальное исследование гистопатологических и иммуногистохимических аспектов заживления костей. Журнал черепно-лицевой хирургии. 2019 май;47(5):815-825.
- Кнапен М., Гельдоф Д., Дрион П., Лайроль П., Ромпен Е., Ламбер Ф. Влияние лейкоцитарной и обогащенной тромбоцитами фибрины (L-PRF) на регенерацию костей: исследование на кроликах. Клинические исследования имплантатов и связанных исследований. 2015 январь;17 Дополнение 1:e143-52.
- Сани Ф., Мехдипур Ф., Талаеи-Хозани Т., Сани М., и Разбан В. Изготовление каркасов из плазмы, обогащенной тромбоцитами/кремнием для инженерии костной ткани. Биовдохновленные, биомиметические и нанобиоматериалы 2018 7:2, 74-81.
- Бонацца В., Борсани Э., Буффоли Б., Паролини С., Инчинголо Ф., Реззани Р., Роделла Л. Ф. Внутриклеточное лечение с концентрированными факторами роста (CGF) и натриевым орфосиликатом положительно влияет на обновление клеток в трех различных человеческих клеточных линиях. Международная клеточная биология. 2018 март;42(3):353-364.
- Фаот Ф., Депрез С., Вандамме К., Камаргос Г. В., Пинто Н., Вутерс Дж., ван ден Оорд Дж., Квиринен М., Дуйк Дж. Влияние мембран L-PRF на заживление костей в дефектах костей тибии кроликов: результаты микрокомпьютерной томографии и биомаркеров. Научные отчеты. 2017 12 апреля;7:46452.
- Филдинг Г. А., Смут В., Бос С. Эффекты SiO2, SrO, MgO и ZnO добавок в трикальцийфосфатах на экспрессию остеобластов Runx2. Журнал биомедицинских материалов. 2014 июль;102(7):2417-26.
- Камитакахара М., Татсукава Э., Сибата Й., Умэмото С., Ёкои Т., Иоку К., Икеда Т. Влияние включения силикатов на in vivo реакции керамики α-трикальцийфосфата. Журнал материалов. 2016 май;27(5):97.
- Чаппелл Х. Ф., Джугдаохсинг Р., Пауэлл Дж. Дж. Физиологическая инкорпорация кремния в минеральную кость требует метаболизма орто-силикатной кислоты в SiO44. Журнал Королевского общества интерфейса. 2020 июнь;17(167):20200145.
- Гутьеррес-Прието С. Х., Фонсека Л. Ф., Секеда-Кастаньеда Л. Г., Диас К. Дж., Кастаньеда Л. Й., Лейва-Рохас Х. А., Сальседо-Рейес Х. С., Акоста А. П. 508 Разработка и биосовместимость материала гидроксиапатита, полученного из яичной скорлупы, модифицированного Si/PLGA для регенерации костей в стоматологии. Международный журнал стоматологии. 2019 5 декабря;2019:5949232.
- Сзурковска К., Сзелещук Л., Колмас Й. Эффекты условий синтеза на формирование Si-замещенных альфа-трикальцийфосфатов. Международный журнал молекулярной науки. 2020 1 декабря;21(23):9164.
