Морфология эдеагуса как дискриминантный маркер у двух близкородственных кактусофильных видов Drosophila (Diptera; Drosophilidae) в Южной Америке
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Drosophila serido и D. antonietae являются сестринскими видами, принадлежащими к кластеру Drosophila buzzatii. Морфологически их можно различить только по количественным признакам. В данной статье мы анализируем длину и эквивалентную среднюю кривизну четырех областей аэдегуса D. antonietae и D. serido. Образцы D. serido и D. antonietae были правильно классифицированы в 96.74% случаев. Основываясь только на переменной, которая в наибольшей степени способствовала различению групп (эквивалентная средняя кривизна арки IV аэдегуса), мы наблюдали значительное внутривидовое морфологическое расхождение в D. serido по сравнению с D. antonietae, что согласуется с другими маркерами. Высокое морфологическое расхождение в эквивалентной средней кривизне арки IV аэдегуса показывает, что эта область эволюционировала быстрее, чем другие, с момента расхождения двух видов. Обсуждается важность настоящего исследования для понимания генетической основы, контролирующей формирование аэдегуса у видов кластера Drosophila buzzatii.
Введение
Морфологические характеристики исторически использовались в эволюционных и таксономических исследованиях. Тем не менее, отсутствие качественных морфологических различий среди родственных видов затрудняет установление диагностических морфологических характеристик между ними. В многих случаях количественные вариации морфометрических признаков достаточно для различения родственных видов (Moreteau et al. 2003, Moraes et al. 2004).
Морфология адеагуса (внешние мужские половые органы) имеет чрезвычайное значение для таксономической характеристики видов Drosophila (Vilela 1983, Silva and Sene 1991, Liu et al. 1996, Moreteau et al. 2003, Kullikov et al. 2004), а также для других двукрылых. Количественные вариации морфологических характеристик адеагуса также использовались для различения родственных видов Drosophila (Silva and Sene 1991, Kullikov et al. 2004). В группе Drosophila repleta , которая включает более 90 неотропических видов, большинство считается родственными видами. Однако между ними существует заметное различие в форме адеагуса (форма + размер), которое считается основным диагностическим признаком в группе (Vilela 1983).
Кластер Drosophila buzzatii (repleta группа, mulleri подгруппа, buzzatii комплекс) является монофилетической группой, состоящей из семи родственных кактусофильных видов: D. buzzatii, D. borborema, D. koepferae, D. antonietae, D. gouveai, D. serido и D. seriema. В этом кластере количественные различия морфологических характеристик крыла (Moraes et al. 2004) и мужских половых органов (Silva и Sene 1991, Tidon-Sklorz и Sene 1995, Prado et al. 2004) успешно использовались для различения видов и популяций. Среди семи видов этого кластера D. buzzatii и D. borborema имеют адеаги, которые отличаются по форме и размеру от других видов (Tidon-Sklorz и Sene 1995). Однако морфология адеагуса других видов кластера схожа с так называемым типом адеагуса D. serido (Рисунок 1a), и на основе этого наблюдения эти виды изначально были классифицированы как принадлежащие к одному виду (Vilela и Sene 1977). Для изучения адеагуса этих видов Silva и Sene (1991) разделили его на четыре основные области, ограниченные контрольными точками (Рисунок 1b). Каждая область, ограниченная двумя соседними контрольными точками, была названа аркой. На основе длины арок исследователи выделили пять различных типов адеагуса, названных от A до E, специфичных для каждого вида.
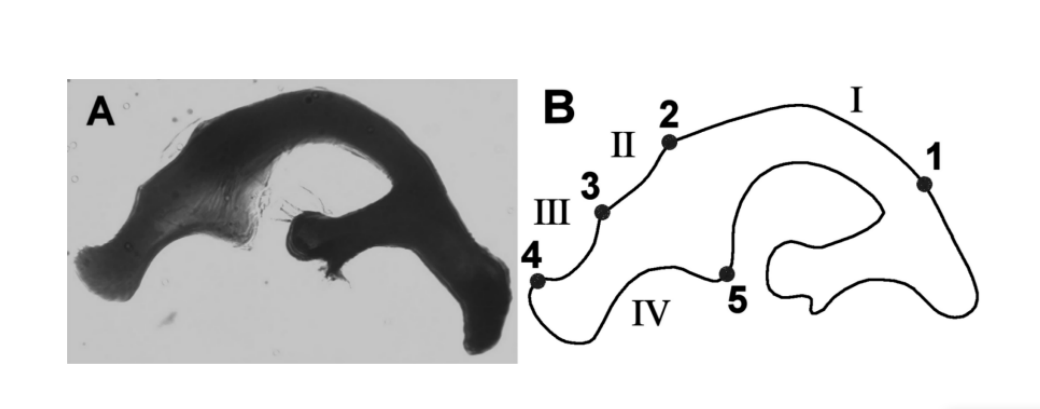
Drosophila serido и D. antonietae — это два родственных вида, принадлежащих к кластеру Drosophila buzzatii, анализируемому в данном исследовании. D. antonietae встречается в мезофильных лесах в регионах бассейна Парана-Парагвай в Южной Америке, ассоциирован с кактусом Cereus hildemannianus (Tidon-Sklorz и Sene 2001). D. serido присутствует на северо-восточной Катаинге и Атлантическом побережье Бразилии, от северо-востока до южного региона Бразилии, ассоциирован с рядом родов кактусов (Pereira et al. 1983). На южной границе распространения D. serido находится зона контакта с D. antonietae (A.C. Morales et al., неопубликованные данные). Несмотря на то, что D. serido и D. antonietae имеют различные метафазные пластинки (Baimai et al. 1983), аллоэнзимные паттерны (A.C. Morales et al., неопубликованные данные, Mateus и Sene 2003), митохондриальный гаплотип (Manfrin et al. 2001) и спутниковую ДНК (Kuhn и Sene 2005), они имеют одинаковую фиксированную хромосомную инверсию 2x7 (Ruiz et al. 2000), что может указывать на близкие филогенетические отношения. В морфологических терминах только количественные вариации могут различать эти два вида (Silva и Sene 1991, Moraes et al. 2004).
В этой статье были проанализированы морфометрические характеристики аэдегуса образцов D. antonietae из нескольких различных популяций, охватывающих все известные места обитания этого вида, а также образцов D. serido, происходящих из двух различных популяций. Мы выбрали эти виды, потому что их можно различить по генетическим маркерам и, имея вторичную контактную зону, с популяцией в симпатрии, с возможным образованием гибридов в южном регионе Бразилии. Кроме измерений длины арки аэдегуса, уже использованных в работе Силвы и Сене (1991), также были использованы измерения кривизны этих арок (Прадо и др. 2004). Нашими основными целями были введение и тестирование использования мер кривизны в видах кластера Drosophila buzzatii и определение областей аэдегуса, которые в наибольшей степени способствовали различению видов D. serido и D. antonietae. Обсуждаемые здесь данные подчеркивают важность этих областей аэдегуса для будущих исследований с целью понимания генетической основы аэдегуса видов, принадлежащих к кластеру Drosophila buzzatii, а также для изучения области контакта между двумя видами.
Материалы и методы
Образцы
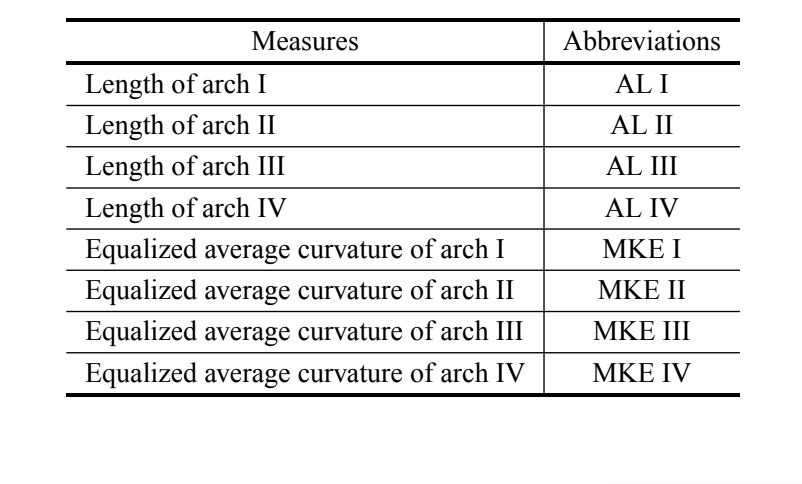
Было проанализировано пятьдесят восемь аэдегов от вида D. antonietae из нескольких различных популяций, представляющих всю область распространения, и 34 аэдега D. serido, принадлежащих популяциям, расположенным в Junco do Seridó/PB и Milagres/BA (типовая локализация) (Таблица I). Все проанализированные особи были собраны в естественных условиях (дикие мухи). Аэдеги были подготовлены в срезы для оптической микроскопии согласно Канеширо (1969). Все аэдеги, использованные в этой статье, были депонированы в Лаборатории эволюционной генетики при USP – Рибейран-Прету. Изображения аэдегов были увеличены в 200 раз и оцифрованы с микроскопа (Axioplan2 Zeiss), оснащенного системой цифровой съемки изображений Axiovision Zeiss и сохранены на компьютере.
Измерение и статистический анализ
Пять точек были определены вручную как контрольные точки, согласно Силве и Сене (1991). Контрольные точки использовались для установления внутренних контуров исследуемой области; области между двумя смежными контрольными точками являются арками (Рисунок 1b).
Как и в работе Силвы и Сене (1991), были измерены длины арок I, II, III и IV адеагуса (Таблица II). Это измеряет расстояние, накопленное между последовательными контрольными точками. Кроме того, мы также выполнили уравненные измерения кривизны арок. В кратце, непрерывная кривизна — это геометрическая мера, которая выражает скорость изменения угла между касательной к кривой и осью x (Коста и др. 2004). Значения уравненной кривизны генерируются через стандартизацию с помощью сигмоиды непрерывной кривизны для усиления точек низкой кривизны исследуемой области (Коста и Сезар 2000). Этот этап позволяет максимизировать информацию о кривизне анализируемой структуры. Для проведения анализов мы использовали средние значения уравненных кривизны арок I, II, III и IV адеагуса (Таблица II). Измерения были получены в соответствии с методологией, описанной Прадо и др. (2004).
Мы провели три различных дискриминантных анализа, используя только меры длины арки (дискриминант I) и эквивалентную среднюю кривизну (дискриминант II), а также дискриминантный анализ, использующий все меры вместе (дискриминант III). Эти анализы были проведены для получения правильных процентов классификации индивидуумов, для проверки, какие переменные больше всего способствовали дискриминации групп, и для сравнения использования мер кривизны с мерами длины арки, ранее выполненными Силвой и Сене (1991). Более низкие значения лямбды Уилка (которые варьируются от 0 до 1) указывают на лучший анализ. Кроме того, с данными из дискриминантного анализа III был выполнен анализ канонических переменных. Анализ дискриминантных и канонических переменных был выполнен с использованием программного обеспечения Splus (версия 1.8).
Абсолютное значение канонических стандартизированных коэффициентов, полученных в результате анализа канонических переменных, представляет собой вес каждой переменной в формировании канонического корня, где более высокие значения соответствуют большему различию между группами. Эти коэффициенты будут представлены для демонстрации относительного вклада каждой переменной в формирование полученного канонического корня и для определения, какая переменная является наиболее важной для дискриминации групп.
Кроме многомерного анализа, наиболее важная мера для дискриминации видов использовалась индивидуально для получения правильного процента классификации индивидуумов с помощью метода байесовской классификации (Duda et al. 2000). Для этого нормальные кривые были установлены на основе среднего значения и стандартного отклонения каждой группы в отношении переменной, определяя функцию плотности и вероятность, используемую в байесовском анализе.
Результаты
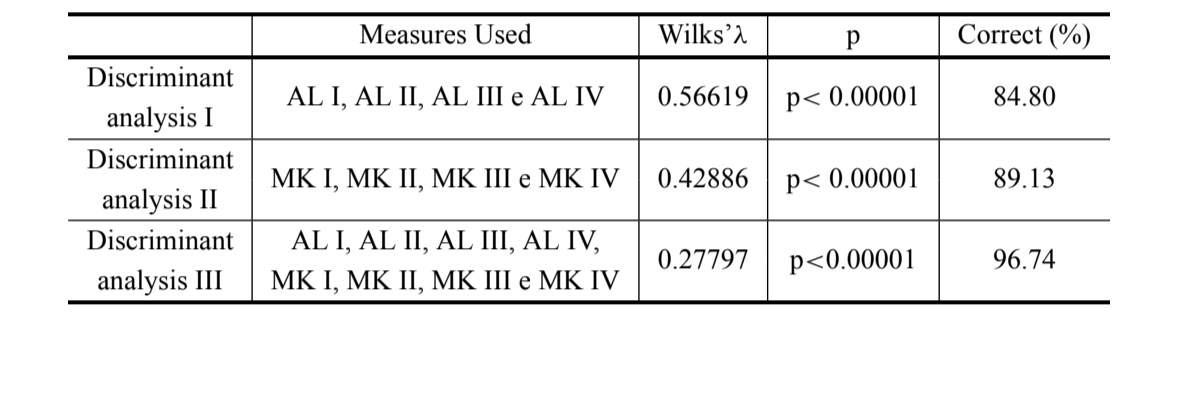
Результаты трех проведенных дискриминантных анализов представлены в таблице III. Дискриминация между D. antonietae и D. serido выше, когда используются длины арок адеагуса вместе с мерами кривизны (дискриминант III) (λ Уилкса = 0.27797; p<0.00001), где 96.74% индивидуумов классифицируются правильно (таблица III), правильная классификация D. antonietae составляет 98.30%, а D. serido — 94.10%.
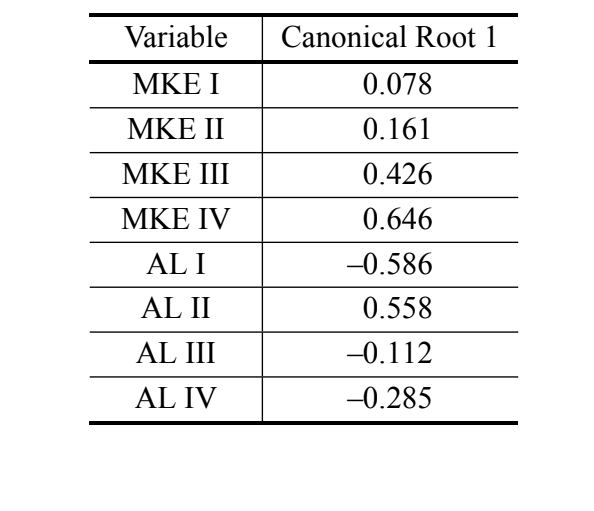
В анализе канонических переменных с использованием мер дискриминантного анализа III была получена только одна каноническая ось. Канонические стандартизированные коэффициенты (вес каждой переменной) показаны в Таблице IV. Абсолютные значения этих коэффициентов указывают на то, что наиболее важной переменной для формирования канонического корня была MKE IV, в то время как наименее важной была переменная MKE I. Нормальные кривые, полученные по среднему значению и стандартному отклонению двух групп в отношении канонических оценок, показаны на Рисунке 2, на котором мы можем наблюдать дискриминацию между D. antonietae (более высокие канонические оценки) и D. serido (более низкие канонические оценки).
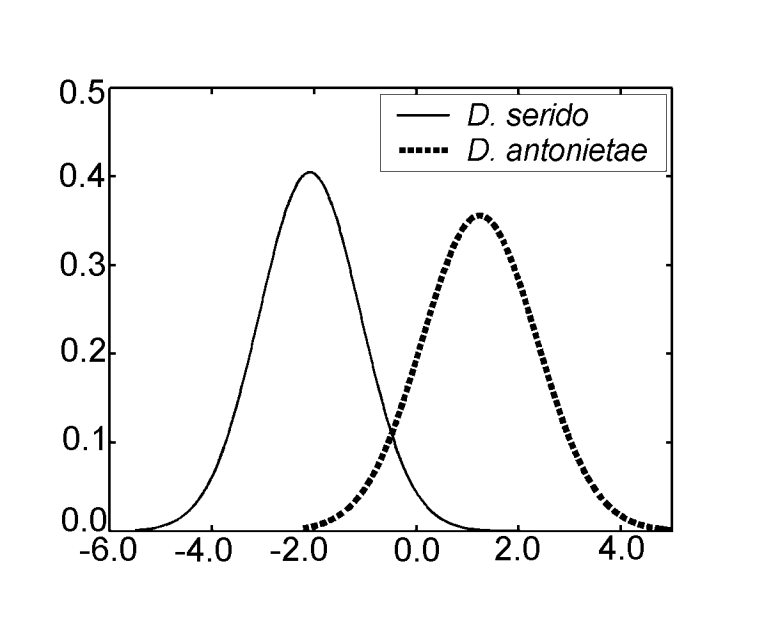
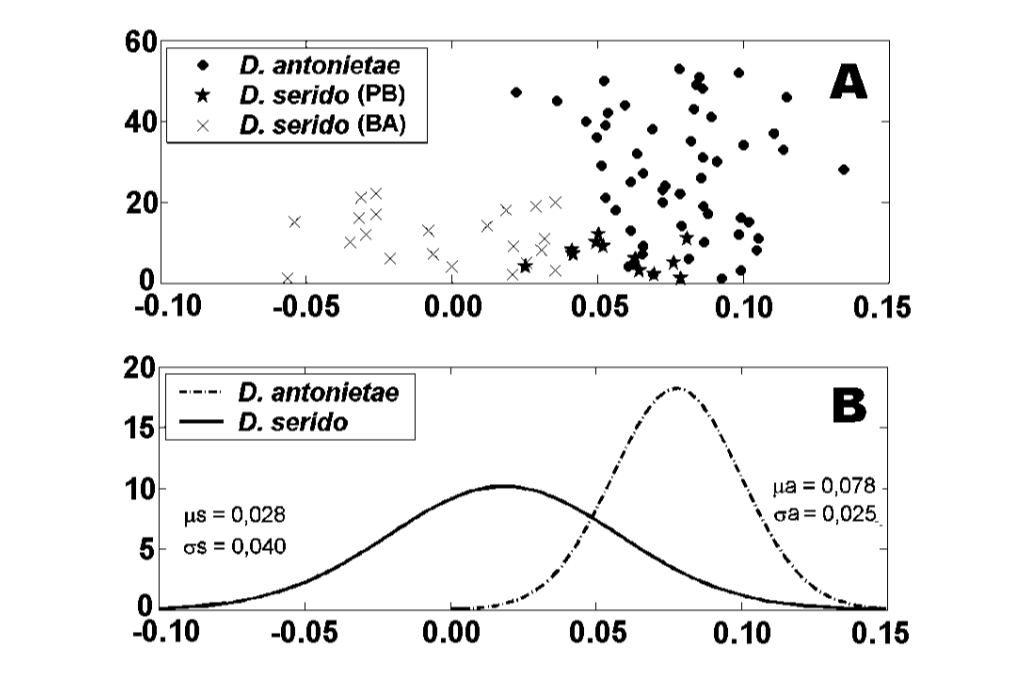
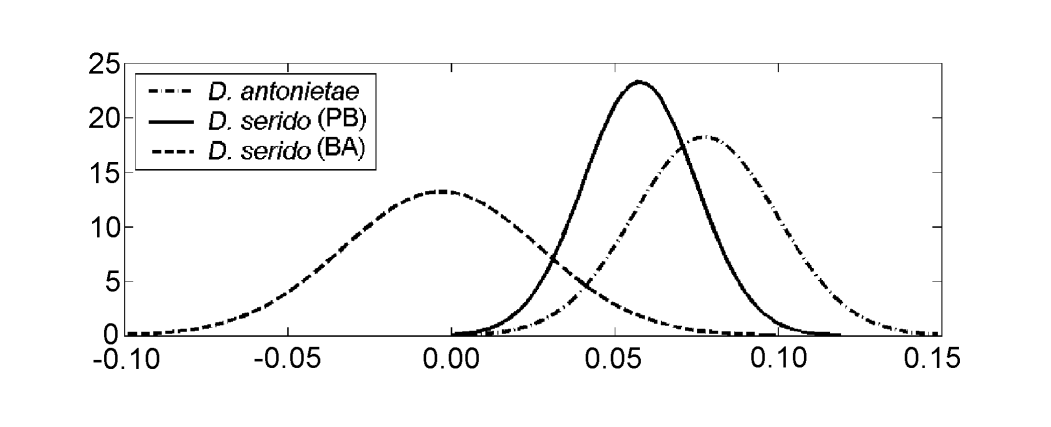
Значения для каждого индивидуума, полученные из анализа MKE IV, показаны на рисунке 3a. В отношении этой меры D. serido имеет большую вариацию вокруг среднего (стандартное отклонение = 0.04), чем D. antonietae (стандартное отклонение = 0.025) (рисунок 3b), в основном потому, что существуют значительные различия в отношении этой меры между обеими популяциями, которые составляют выборку D. serido (рисунок 3a; рисунок 4).
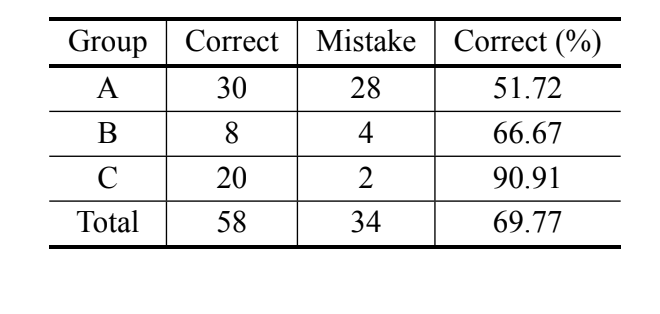
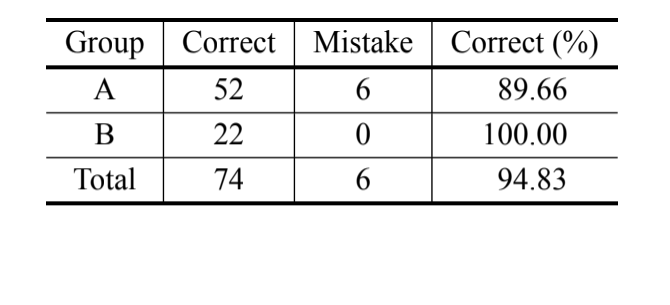
В соответствии с байесовским анализом, основанным только на измерении MKE IV, 69,8% индивидуумов были правильно классифицированы, и более 90% индивидуумов D. serido из Милагрес/BA были правильно классифицированы. Тем не менее, был зафиксирован высокий процент ошибок среди индивидуумов D. serido из Жунко до Серидо/PB и
D. antonietae (Таблица V). Тот же анализ был проведен без индивидуумов D. serido из Жунко до Серидо/PB, и процент правильных классификаций составил 94,83% (Таблица VI), что показывает крайнюю дивергенцию между индивидуумами популяции D. serido из Милагрес/BA и D. antonietae на основе MKE IV.
Обсуждение
Наши данные подтверждают существование количественных различий в морфологических характеристиках адеагуса проанализированных особей, что позволяет различать D. serido и D. antonietae. Более того, уравненная средняя кривизна арки IV (MKE IV) была переменной, которая в наибольшей степени способствовала различению групп (Таблица IV).
Длина первых четырех дуг адеагуса уже успешно использовалась для различения видов кластера Drosophila buzzatii, включая среди них D. serido и D. antonietae (адеагус Тип A и D соответственно в Silva и Sene 1991). В этой статье мы обнаружили значительное увеличение различимости групп, добавив меры уравненной средней кривизны в морфометрический анализ, где 96.74% особей правильно классифицированы (Таблица III). Таким образом, измерения уравненной средней кривизны важны для различения D. antonietae и D. serido и могут быть полезны в изучении зоны симпатри среди этих видов в южном регионе Бразилии. Поскольку меры кривизны не учитывают размер структуры, можно предположить, что небольшие количественные изменения в форме адеагуса, особенно в области дуги IV, могли произойти с момента события кладогенеза видов D. serido и D. antonietae.
Существует значительное морфологическое расхождение в отношении MKE IV между D. antonietae и D. serido, поскольку D. antonietae показывает относительно меньшее разнообразие вокруг среднего значения, чем D. serido (Рисунок 3b). Индивиды из разных популяций, представляющих всю область распространения популяций D. antonietae (Таблица I), были проанализированы; в этой выборке данные указывают на то, что существует однородность среди популяций D. antonietae . Монтейро и Сене (1995) проанализировали морфологию адеагуса индивидов из нескольких популяций D. antonietae с помощью метода морфометрии тросовой сети и также не наблюдали морфологических различий между ними. Аллоферментные (Матеус и Сене 2003) и микросателлитные паттерны (Л.П.Б. Мачадо и др., неопубликованные данные) также показали однородность среди различных популяций D. antonietae. Эти результаты предполагают генетический поток между популяциями D. antonietae, способствованный ассоциацией этого вида и его хозяина кактуса Cereus hildmaniannus , который встречается в мезофильных галерейных лесах вдоль рек бассейна Парана-Парагвай, формируя коридоры миграции для индивидов вида D. antonietae (Монтейро и Сене 1995).
Drosophila serido имеет, сравнительно, более высокую межвидовую вариацию в отношении MKE IV, чем D. antonietae (Рисунок 3b), как можно наблюдать по различиям, найденным среди особей из популяций Жунку до Серидо/PB и Милагрес/BA. Особи D. serido из популяции Жунку до Серидо/PB имеют промежуточные значения для MKE IV по сравнению с теми, что найдены для популяций D. serido в Милагрес/BA и проанализированных популяций D. antonietae (Рисунок 4). Эти данные предполагают морфологическую дифференциацию между обеими популяциями D. serido, вероятно, из-за ограничения генетического потока между ними. Между бразильскими штатами Баия и Пернамбуку находится большая река, река Сан-Франсиску, которая может действовать как географический барьер, предотвращая генетический поток между популяциями D. serido, проанализированными в данной статье. Морфологические различия между популяциями D. serido согласуются с другими работами, поскольку этот вид является полиморфным по отношению к другим маркерам. Северо-восточные популяции D. serido имеют метафазные пластины типа I, в то время как некоторые прибрежные популяции имеют метафазные пластины типа III (Аррайал до Кабо/RJ) и типа IV (Перуйбе/SP) (Баймай и др. 1983). Что касается хромосомных инверсий, хотя все популяции D. serido имеют фиксированную инверсию 2x7, четыре полиморфные инверсии ограничены северо-восточными популяциями (2a8, 2b8, 2c8 и 2d8), а две фиксированные инверсии (2x8 и 2w8) встречаются в прибрежных популяциях (Тоси и Сене 1989, Руис и др. 2000). Более того, популяции D. serido из северо-восточного Бразилии частично изолированы репродуктивно от популяции Аррайал до Кабо/RJ вдоль бразильского побережья (Н.М.В. Биззо, неопубликованные данные). Недавние исследования также предполагают различия между популяциями D. serido на северо-востоке и прибрежной Бразилии на основе дифференциации митохондриальных гаплотипов (А.C. Моралес и др., неопубликованные данные).
Дифференциация между популяциями одного и того же вида является важным требованием в процессе видообразования, поэтому исследования, касающиеся различных популяций полиморфного вида, такого как D. serido, важны для количественной оценки морфологического расхождения в отношении генетического расхождения в естественных популяциях.
Не все арки аэдегуса одинаково информативны для различения видов. Согласно Силве и Сене (1991), арки II и III (Рисунок 1) являются наиболее информативными для различения видов в кластере Drosophila buzzatii. В сравнении парами, используя метод сетки, меры, связанные с аркой III, были наиболее значительными для различения между
D. antonietae и D. gouveai (Монтейро и Сене 1995). В ходе анализа геометрической морфометрии с использованием мер кривизны, Прадо и др. (2004) наблюдали, что кривизна и нормализованная длина арки III являются важными мерами для различения между видами D. gouveai и D. antonietae. Наши данные показывают, что MKE IV является наиболее важным для различения видов D. serido и D. antonietae; и, основываясь только на этой мере, возможно различить более 94% особей D. serido из популяции Милагрес/BA (типовая локализация) от особей D. antonietae (Таблица VI). Эти результаты показывают, что дистальная часть аэдегуса (арка III + арка IV) имеет наибольшие межвидовые различия, независимо от других частей этого органа, что предполагает, что эта область может считаться «горячей эволюционной точкой» (Куликов и др. 2004) для аэдегуса во время событий кладогенеза в кластере Drosophila buzzatii, но этот вопрос все еще остается открытым для обсуждения.
Морфометрические вариации между и внутри групп организмов отражают выражение фенотипа, возникающего в результате интегрированного полигенного контроля, который изменяется в процессе кладогенеза и эволюции групп (Falconer 1989). Кроме того, несколько эпигенетических и экологических факторов могут влиять на формирование структуры (Atchley et al. 1992), что затрудняет определение причин морфологического расхождения среди популяций и видов. Тем не менее, сравнительные морфометрические исследования гомологичных областей обоих видов, таких как арки аэдегуса, являются важными условиями для понимания генетической основы, контролирующей формирование этой области. Хотя генетическая основа аэдегуса открывается для других групп Drosophila (Liu et al. 1996), гены, контролирующие формирование аэдегуса у видов кластера Drosophila buzzatii , еще не установлены. Высокий процент правильности анализируемых индивидуумов в этой статье, основанный исключительно на MKE IV, указывает на то, что область арки четыре может быть полезной для будущих исследований по пониманию генетической основы аэдегуса в этих видах, поскольку установление информативных морфологических признаков среди различных таксономических групп является предварительным шагом в исследовании QTL (количественные локусы признаков), методологии для обнаружения, картирования и оценки эффектов некоторых локусов в метрических характеристиках.
Авторы: Фернандо Ф. Франко, Педро Р.Р. Прадо, Фабио М. Сене, Лусиано Ф. Коста и Маура Х. Манфрин
Ссылки
- Atchley WR, Cowley DE, Vogi C и Mc-Lellan T. 1992. Эволюционное расхождение, изменение формы и генетическая корреляционная структура в челюсти грызунов. Syst Biol 41: 196–221.
- Baimai V, Sene FM и Pereira MAQR. 1983. Гетерохроматин и кариотипическая дифференциация некоторых неотропических видов кактусовых мух из группы Drosophila repleta. Genetica 67: 81–92.
- Costa LF и Cesar RMJ. 2000. Анализ формы и классификация: теория и практика. CRC Press Book Series on Image Processing. Cambridge Univ Press, New York, 659 p.
- Costa LF, dos Reis SF, Arantes RAT, Alves ACR и Multinari G. 2004. Биологический анализ формы с помощью цифровой кривизны. Pattern Recognit 37: 515–524.
- Duda RO, Hart PE и Stork DG. 2000. Классификация образцов. J Wiley & Sons, New York, USA, 680 p.
- Falconer DS. 1989. Введение в количественную генетику. 2-е изд., Лондон: Longman.
- Kaneshiro KY. 1969. Исследование взаимосвязей видов гавайских мух Drosophila на основе внешних мужских половых органов. Univ Texas Publ 6918: 55–70.
- Kuhn GCS и Sene FM. 2005. Эволюционный оборот двух подсемейств спутниковой ДНК pBuM в кластере видов Drosophila buzzatii (группа repleta): от alpha до alpha/beta массивов. Gene 349: 77–85.
- Kullikov AM, Melnikov AI, Gornostaev NG, Lazebny OE и Mitrofanov VG. 2004. Морфологический анализ мужского копулятивного органа в группе видов Drosophila virilis: многомерный подход. J Zool. Syst Evol Res 42: 135–144.
- Liu J, Mercer JM, Stam LF, Gibson GC, Zeng Zhao-Bang и Laurie CC. 1996. Генетический анализ морфологической разницы в мужских половых органах Drosophila simulans и D. mauritiana. Genetics 142: 1129–1145.
- Manfrin MH, Brito ROA и Sene FM. 2001. Систематика и эволюция кластера Drosophila buzzatii (Diptera; Drosophilidade) с использованием mtDNA. Ann Entomol Soc Am 94: 333–346.
- Mateus RP и Sene FM. 2003. Временная и пространственная аллозимная вариация у южноамериканской кактусовой мухи Drosophila antonietae (Diptera; Drosophilidae). Biochem Genet 41: 219–233.
- Monteiro SG и Sene FM. 1995. Морфометрическое исследование популяций Drosophila serido из Центрального и Южного Бразилии. Rev Bras Genet 18 (Suppl.): 283.
- Moraes EM, Spressola VL, Prado PRR, Costa LF и Sene FM. 2004. Различия в морфологии крыльев среди родственных видов кластера buzzatii. J Zool Syst Evol Res 42: 154–158.
- Moreteau B, Gibert P, Pétavy G, Moereteau JC, Huey RB и David JR. 2003. Морфометрическая эволюция в кладе Drosophila: группа Drosophila obscure. J Zool Syst Evol Res 41: 64–71.
- Pereira MAQR, Vilela CR и Sene FM. 1983. Заметки о местах размножения и питания некоторых видов группы repleta рода Drosophila (Diptera; Drosophilidae). Cienc Cult 35: 1313–1319.
- Prado PRP, Franco FF, Manfrin MH, Costa LF и Sene FM. 2004. Легкий и быстрый способ анализа морфометрических характеристик. Proc Third Braz Symp Mathem Comp Biol 1: 329–340.
- Ruiz A, Cassian AM, Kuhn GCS, Alves Maqr и Sene FM. 2000. Загадка видообразования Drosophila serido: соединение новых кусочков. Genetica 108: 217–227.
- Silva AFG и Sene FM. 1991. Морфологическая географическая изменчивость в Drosophila serido (Diptera; Drosophilidae). Rev Bras Entomol 35: 455–468.
- Tidon-Sklorz R и Sene FM. 1995. Эволюция кластера buzzatii (Drosophila repleta species group) в средней Южной Америке. Evolución Biologica 9: 71–85.
- Tidon-Sklorz R и Sene FM. 2001. Два новых вида из родственного набора Drosophila serido (Diptera; Drosophilidae). Iheringia 90: 141–146.
- Tosi D и Sene FM. 1989. Дополнительные исследования хромосомной изменчивости в сложном таксоне Drosophila serido (Diptera; Drosophilidae). Rev Bras Genet 12: 729–745.
- Vilela CR. 1983. Ревизия группы видов Drosophila repleta (Diptera; Drosophilidae). Rev Bras Entomol 27: 1–114.
- Vilela CR и Sene FM. 1977. Два новых неотропических вида группы repleta рода Drosophila (Diptera; Drosophilidae). Papéis Avulsos de Zoologia 30: 295–299.
