Использование вакуумной плазменной обработки поверхности для улучшения гидрофильности и смачиваемости заменителей костной ткани и рассасывающихся мембран: исследование in vitro
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Фон/Цели: Мы хотели оценить in vitro, может ли вакуумная плазменная обработка поверхности заменителей костной ткани и рассасывающихся мембран улучшить гидрофильность и смачиваемость тестируемых материалов.
Методы: Всего для этого исследования было рассмотрено 28 стерилизованных образцов, которые были разделены на три группы. Шесть образцов были использованы для анализа SEM-EDS. Остальные 22 образца были случайным образом распределены по тестовой (обработанные плазмой, n = 11) и контрольной (без обработки, n = 11) группам. Вакуумная плазменная обработка поверхности была проведена в тестовой группе перед анализом SEM-EDS с использованием ACTILINK reborn с держателем материала (Plasmapp Co., Ltd., Дэеджон, Республика Корея). Чернила Plasmatreat (Plasmatreat, Штайнхаген, Германия) использовались для оценки различий в гидрофильности между тестовой и контрольной группами. Результаты измерялись по времени поглощения, степени смачиваемости и степени деконтаминации после различных временных циклов.
Результаты: После обработки поверхности вакуумным плазменным методом время абсорбции чернил статистически уменьшилось во всех подгруппах (p < 0.05), в то время как степень смачиваемости увеличилась. Анализы SEM-EDS показали увеличенную скорость снижения содержания углеродных примесей после до трех циклов обработки поверхности вакуумным плазменным методом. Более того, анализ SEM-EDS не выявил никаких участков повреждений, вызванных множественными обработками.
Выводы: В рамках ограничений этого in vitro исследования обработка поверхности вакуумным плазменным методом увеличила гидрофильность и смачиваемость протестированных биоматериалов. Частичные костные трансплантаты и костные блоки следует обрабатывать с использованием более длительных программ. Необходимы дальнейшие хорошо проведенные рандомизированные клинические испытания с расчетом размера выборки для подтверждения этих предварительных результатов.
Введение
Оральная имплантология признана безопасной и предсказуемой клинической методологией, способной обеспечить долгосрочные результаты в области оральной реабилитации. Оссеоинтеграция зубных имплантатов берет свое начало в начале 1950-х годов, когда профессор Пер-Ингвар Бранемарк, шведский ортопед, первоначально проводил ортопедические эксперименты на ногах кроликов. В настоящее время имплант считается оссеоинтегрированным, когда нет прогрессирующего
относительное движение между имплантатом и костью, с которой он должен иметь прямой контакт. В прошлом одним из самых важных аспектов достижения остеоинтеграции была первичная стабильность во время установки имплантата. С момента своего появления и до сегодняшнего дня литература была сосредоточена на чисто биологически ориентированных принципах. В связи с последним было исследовано и внедрено множество методов обработки поверхности для улучшения биологических характеристик поверхности имплантатов, включая модификации шероховатости поверхности имплантата и улучшения гидрофильности в процессе остеоинтеграции. Согласно недавним исследованиям, оба лечения, похоже, улучшают механизм остеоинтеграции, обеспечивая более сильное и быстрое образование кости, что позволяет ускорить остеоинтеграцию и добиться успешных долгосрочных результатов.
Несколько исследований оценили обработку поверхности зубных имплантатов и абатментов. Активирование поверхности титаново имплантата с помощью плазменной обработки может представлять собой положительную стратегию для удаления загрязняющих веществ с зубных абатментов и минимизации резорбции кости вокруг имплантата, а также увеличения процентов новой кости в непосредственном контакте с поверхностью имплантата. Этот феномен был продемонстрирован in vitro за счет увеличения адсорбции белка и адгезии остеобластов на поверхности титана. Однако, насколько известно авторам и на момент написания, ни одно исследование еще не оценивало методы, способные увеличить энергетическую поверхность костных заменителей и мембран. В одном из исследований на животных Хо Джик Ян и др. оценили эффект вакуумной плазменной обработки поверхности на человеческой акцеллюлярной дермальной матрице, подчеркивая потенциальный эффект обработки на улучшение результатов реконструктивной хирургии. Вакуумная плазменная обработка поверхности также продемонстрировала улучшение адгезии клеток, изменяя смачиваемость поверхности титаново пластины, с уменьшением угла контакта между биологическими жидкостями и поверхностью имплантата, что способствует диффузии остеобластных клеток и не оставляет остатков после обработки. Некоторые изменения в физико-химических характеристиках были зафиксированы, такие как свободная энергия поверхности, содержание углеводородов и функциональные гидроксильные группы, которые потенциально могут влиять на воспалительный ответ в периимплантной ткани. В клиническом рандомизированном контролируемом испытании обработка аргоновой плазмой продемонстрировала снижение ремоделирования кости вокруг имплантата, с статистически более сильными результатами до 5 лет наблюдения.
Основная цель этого in vitro исследования заключалась в оценке того, может ли вакуумная плазменная обработка поверхности заменителей костной ткани и рассасывающихся мембран, обычно используемых для сохранения лунки и процедур GBR, улучшить поверхностную энергию (гидрофильность) и смачиваемость тестируемых материалов. Нулевая гипотеза заключалась в том, что вакуумная плазменная обработка поверхности не влияет на время абсорбции или смачиваемость. Второстепенной целью было оценить, с помощью анализа SEM-EDS, степень деконтаминации после различных временных циклов. Это исследование было представлено в соответствии с рекомендациями CRIS (Контрольный список для отчетности о in-vitro исследованиях).
Материалы и методы
2.1 Образцы
Всего в этом рандомизированном (тестовом и контрольном) in vitro исследовании было рассмотрено 28 стерилизованных образцов. Расчет размера выборки не проводился, так как в научной литературе не было других исследований, сравнивающих биоматериалы с вакуумной плазменной обработкой поверхности и без нее. Максимальное количество образцов было использовано в соответствии с доступностью отдела. Образцы включали различные биоматериалы, обычно используемые во время сохранения лунки и/или процедур GBR, и представлены следующим образом:
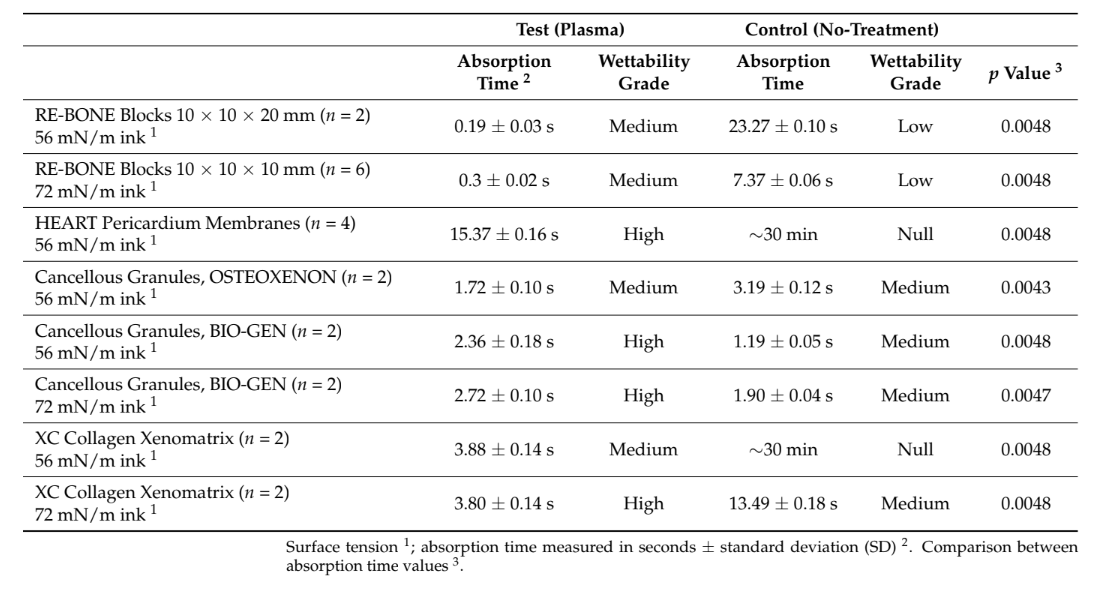
- Четырнадцать блоков RE-BONE размером 10 × 10 × 10 (8) и 10 × 10 × 20 (6) мм (UBGEN SRL, Вигонза, Италия);
- Четыре мембраны перикарда HEART (Bioteck SPA, Аркуньяно, Италия);
- Два гранула губчатой кости, 0.5 г~1 cc, 0.25–1 мм, OSTEOXENON (Bioteck SPA, Италия);
- Четыре гранула губчатой кости, 0.5 г, 0.25–1 мм (неколлагеновые), BIO-GEN (Bioteck SPA, Италия);
- Четыре коллагеновые ксеноматричные матрицы XC (Bioteck SPA).
Всего 6 из 28 образцов (блоки RE-BONE [UBGEN SRL, Вигонза, Италия]) были использованы для анализа SEM-EDS. Остальные 22 образца были случайным образом разделены на две равные группы по 11 образцов (тестовая, обработанная плазмой, и контрольная, без обработки) и протестированы для оценки времени абсорбции и степени смачиваемости. Все измерения были выполнены в Департаменте медицины, хирургии и фармацевтики Университета Сассари, Италия. Анализ SEM-EDS трех обработанных плазмой блоков RE-BONE (UBGEN SRL) был проведен в Центре исследований и разработок Plasmapp (Plasmapp Co, Республика Корея).
Для обработки образцов использовался ACTILINK, возрожденный с держателем для материалов (Plasmapp Co., Ltd., Тэджон, Республика Корея). Использовались чернила Plasmatreat (Plasmatreat, Штайнхаген, Германия) с различными поверхностными натяжениями. Поверхностная энергия различных стерильных биоматериалов с (тест) и без (контроль) обработки вакуумным плазменным методом была оценена путем измерения угла контакта (для оценки смачиваемости) и времени абсорбции (для оценки гидрофильности) использованных чернил.
2.2 Обработка вакуумным плазменным методом
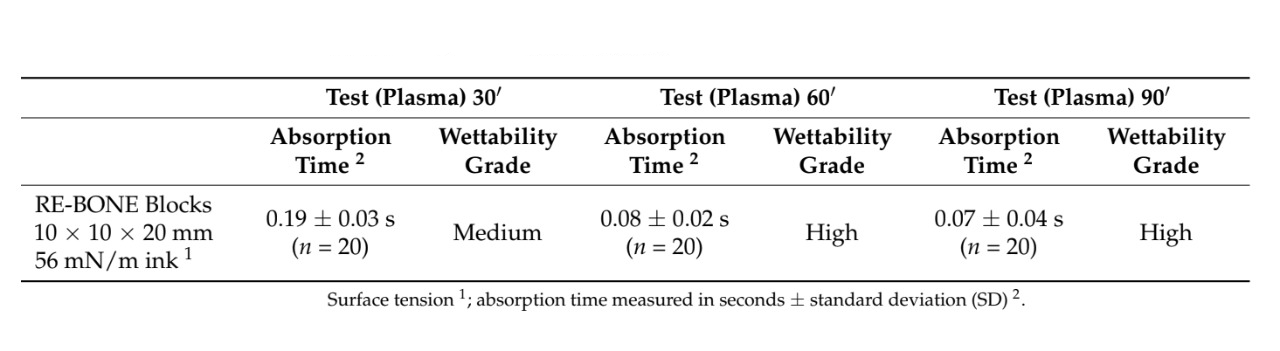
В тестовой группе обработка вакуумным плазменным методом проводилась с использованием машины ACTILINK reborn (Рисунок 1) с индивидуальным держателем (вихревой держатель), разработанным для удобства использования. Согласно протоколу производителей, время цикла обработки вакуумным плазменным методом, названное режимом VORTEX PLASMA, составило 30 секунд. Все биоматериалы в тестовой группе прошли одинаковое время цикла обработки вакуумным плазменным методом. Напротив, ни один из биоматериалов в контрольной группе не получил никакого типа обработки. В тестовой группе, после открытия стерильной коробки, тестируемый биоматериал был взят стерильными пинцетом и помещен в стерильный вихревой держатель, а затем помещен в машину ACTILINK для обработки вакуумным плазменным методом. После завершения обработки как обработанные, так и необработанные биоматериалы были помещены с помощью стерильного пинцета в стерилизованный держатель, и на каждый образец было нанесено пять капель чернил Plasmatreat с двумя различными поверхностными натяжениями (56 и 72 мН/м). Сразу после этого было зафиксировано соответствующее время абсорбции и степень смачиваемости, сделаны фотографии и критически сравнили для оценки гидрофильности и угла контакта между чернилами и поверхностью использованных биоматериалов. Поверхностные натяжения 56 и 72 мН/м были выбраны, потому что значение 56 мН/м было ближе всего к значению человеческой крови.

2.3 SEM-анализ
Для оценки влияния времени обработки вакуумной плазмой на деконтаминацию (уменьшение углеродных примесей) поверхности блока кости было проанализировано три блока RE-BONE (UBGEN SRL) с использованием системы SEM-EDS после до трех циклов обработки вакуумной плазмой. Шесть блоков RE-BONE размером 10 × 10 × 20 мм (UBGEN SRL) были использованы для исследования SEM-EDS. Два блока RE-BONE (UBGEN SRL) обрабатывались в рамках трех различных циклов ([A] 30 с, [B] 60 с и [C] 90 с) перед обработкой вакуумной плазмой. Для обработки использовалась машина ACTILINK reborn в режиме VORTEX PLASMA. После каждого цикла обработки блоки костей анализировались под сканирующим электронным микроскопом (SEM, Thermo Fisher Scientific, Phenom XL, Уолтхэм, Массачусетс, США), подключенным к энергодисперсионному рентгеновскому спектроскопу (EDS), чтобы обеспечить целенаправленный анализ поверхностей образцов.
2.4 Показатели результата
Время абсорбции и степень смачиваемости оценивались по видео, записанным во время процедур (Blackmagic Design Pocket Cinema Camera 4K, Blackmagic, Fremont, CA, USA). Испытательные и контрольные группы тестировались одновременно. Все тесты проводили два исследователя (М.Т. и М.Т.).
- Время абсорбции определялось как интервал, в секундах, от момента, когда последняя капля коснулась поверхности биоматериала, до момента, когда все капли чернил были абсорбированы в биоматериал. Записанное видео оценивалось с помощью приложения для видеомонтажа (iMovie для MacOS), а время абсорбции измерялось с использованием расширенной временной шкалы. Все измерения повторялись трижды двумя разными операторами (М.Т. и М.Т.). Среднее значение и стандартное отклонение (SD) были рассчитаны.
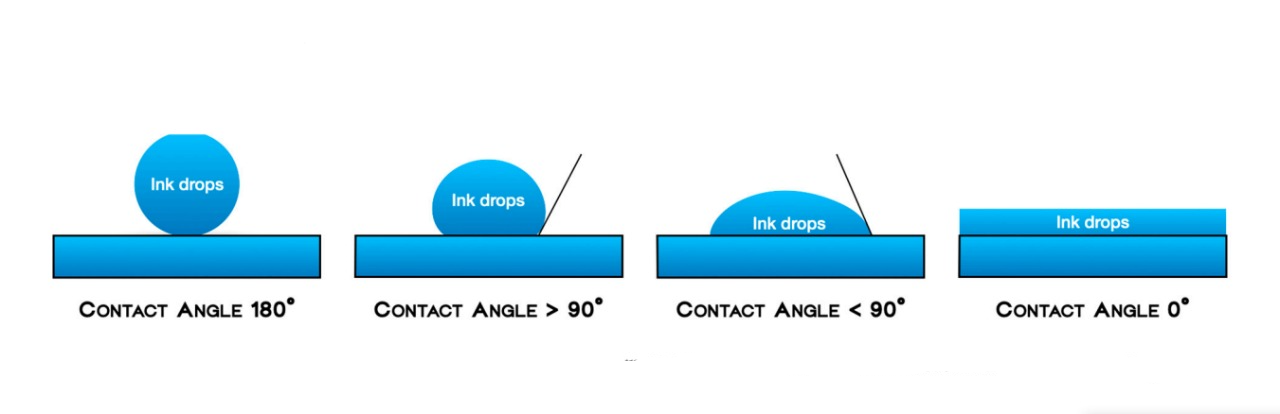
- Смачиваемость (в общем, называемая гидрофильностью) определялась как распространение капель чернил по поверхностям биоматериалов, измеряемое по плоскости капли на твердой поверхности. Четыре степени смачиваемости были определены следующим образом:
Нулевая степень: капли чернил оставались на том же месте, где они были капнуты, с углом контакта 180°; Низкая степень: когда пятно чернил слегка расширялось на поверхности, с углом контакта > 90°; Средняя степень: когда умеренное расширение пятна чернил на поверхности было заметно, и угол контакта был <90°; Высокая степень: когда пятно чернил определенно было впитано, с углом контакта 0° (Рисунок 2).
- SEM-анализ. Для визуализации изображений поверхности образцов с высоким разрешением использовалась сканирующая электронная микроскопия. С помощью SEM была проанализирована поверхность в изображениях. В частности, изображения SEM использовались для оценки скорости уменьшения углеродных примесей при трех различных временах цикла. Энергетически-дисперсионный рентгеновский спектроскоп (EDS) использовался для измерения энергии испускаемых фотонов в рентгеновском электромагнитном спектре и для получения химической информации (атомный процент).
2.5 Статистический анализ
Весь анализ данных был проведен в соответствии с заранее установленным планом анализа. Биостатистик с опытом работы в области стоматологии проанализировал данные с использованием программного обеспечения Ky Plot 2.0, Informer Technologies, Inc. NY, США, не зная кодов групп. Средние значения и стандартные отклонения были рассчитаны для каждого измерения. Для сравнения времени абсорбции между группами использовался калькулятор двухвыборочного теста Колмогорова–Смирнова. Статистические сравнения проводились на уровне значимости 0.05.
Результаты
Всего было использовано 28 образцов. Время абсорбции и смачиваемость 22 образцов после нанесения различных чернил с разными поверхностными натяжениями были оценены в обеих группах. Обработка поверхности вакуумной плазмой статистически снизила время абсорбции во всех обработанных образцах (p значение < 0.05, Таблица 1). Более того, для всех образцов, кроме гранул OSTEOXENON с чернилами 56 мН/м, смачиваемость в тестовой группе была более высокой по сравнению с контрольной группой. Наибольшая разница в смачиваемости была обнаружена для перикардиальной мембраны, с высоким уровнем в тестовой группе по сравнению с нулевым уровнем в контрольной группе. Лучшие результаты были получены для обработки поверхности вакуумной плазмой костных блоков, коллагеновых мембран, перикардиальных мембран и коллагеновых костных трансплантатов соответственно. Все данные представлены в Таблице 1. Пояснительные изображения представлены в Рисунке 3.
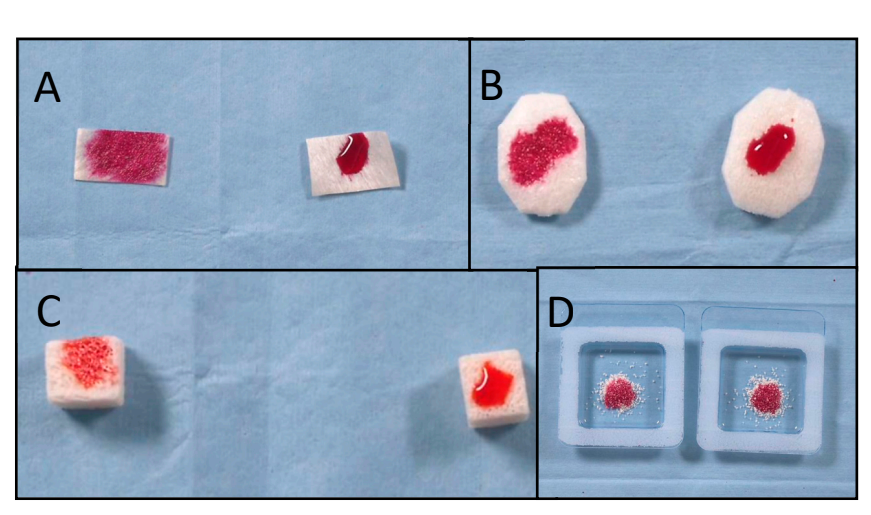
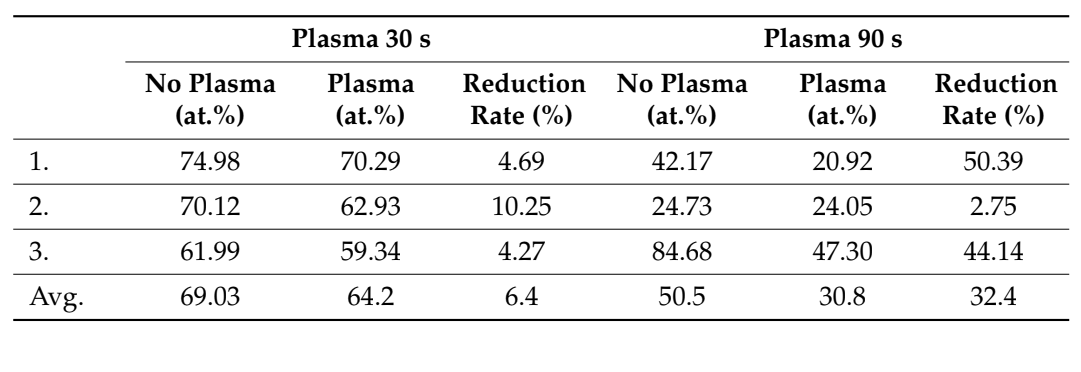
Шесть костных блоков (три после вакуумной плазменной обработки поверхности и три без какой-либо обработки) были оценены в анализе SEM-EDS после одного, двух и трех циклов соответственно. Уровень снижения углеродных примесей, как правило, увеличивался после трех циклов по сравнению с одним и двумя циклами. Более того, анализ SEM-EDS не показал повреждений биоматериалов после нескольких (до трех раз, 90 с, рисунок 4) вакуумных плазменных обработок поверхности, в то время как верхняя часть поверхности показала лучшую смачиваемость после трех циклов (рисунок 5). Все эти данные представлены в таблицах 2 и 3.


Обсуждение
Целью данного исследования было оценить, может ли эффект вакуумной плазменной обработки поверхности различных биоматериалов, используемых для сохранения лунки и процедур GBR, улучшить их гидрофильность и смачиваемость. Гидрофильность измерялась по времени абсорбции чернил и степени смачиваемости. Время абсорбции чернил образцов, обработанных плазмой, было значительно короче, чем у необработанных образцов. Таким образом, нулевая гипотеза о отсутствии различий была частично отвергнута. Эти первоначальные in vitro тесты показали, что вакуумная плазменная обработка поверхности оказала положительное влияние на костные блоки, мембраны перикарда, коллагеновые матрицы и коллагеновые костные трансплантаты как по времени абсорбции, так и по степени смачиваемости. Напротив, вакуумная плазменная обработка поверхности не смогла сократить время абсорбции для неколлагеновых костных трансплантатов. Это указывает на то, что вакуумная плазменная обработка поверхности преобразовала поверхности высушенных биоматериалов из гидрофобных в высокогидрофильные. Однако первоначальные характеристики поверхности важны для определения ожидаемых результатов.
Увеличение общего времени лечения, до трех циклов, улучшило результаты. Одно из возможных объяснений заключается в том, что углеродные примеси, как правило, уменьшаются после трех циклов. В условиях in vivo, вакуумная плазменная обработка поверхности человеческой акцеллюлярной дермальной матрицы показала улучшенное прорастание фибробластов, что указывает на улучшенную биосовместимость. В настоящем исследовании вакуумная плазменная обработка поверхности продемонстрировала некоторые положительные эффекты в отношении деконтаминации обработанных биоматериалов и активации поверхностей, уменьшая примеси и увеличивая их гидрофильность.
Несколько исследований в литературе подтвердили эффективность плазменной обработки в отношении адгезии клеток и активности фибробластов. Однако основными темами этих исследований были зубные абатменты и поверхности имплантатов.
Смачиваемость поверхности является одним из самых важных параметров, влияющих на биологический ответ на имплантированный материал, влияя на адсорбцию белков, адгезию/активацию тромбоцитов, коагуляцию крови и адгезию клеток и бактерий. В настоящем исследовании были использованы чернила для измерения времени абсорбции и степени смачиваемости протестированных биоматериалов. Поверхностное натяжение крови играет важную роль в человеческом организме. Согласно Хрнци́ру и Розине, поверхностное натяжение крови, оцененное в группе из 71 здорового человека с использованием метода капли при температуре 22 градуса Цельсия, составило 55.89 × 10(−3) N × m(−1), с SD = 3.57 × 10(−3) N × m(−1). Учитывая, что изменения в поведении поверхностного натяжения человеческой биологической жидкости характерны для некоторых заболеваний, в настоящем исследовании были использованы чернила с поверхностным натяжением 56 мН/м и 72 мН/м.
Анализируя данные, собранные в настоящем исследовании, было установлено, что в контрольной группе чернила с более высоким поверхностным натяжением (72 мН/м) впитывались быстрее, чем чернила с более низким поверхностным натяжением (56 мН/м), как в костных блоках, так и в коллагеновых ксеноматричных материалах, но не в неколлагеновых костных трансплантатах. Напротив, в тестовой группе разница не была значимой. Эти результаты могут означать, что после обработки поверхности вакуумным плазменным методом вариации в поверхностном натяжении могут быть менее значимыми для процесса заживления.
После до трех циклов времени СЭМ-имиджирование топографии поверхности не выявило изменений под воздействием вакуумной плазменной обработки поверхности, и физические повреждения не были обнаружены. Увеличение гидрофильности, снижение уровня примесей и сохранение оригинальной структуры, без каких-либо физических повреждений плазменно обработанных костных блоков, следует рассматривать как доказательства улучшенной биосовместимости и потенциальной биоинтеграции протестированных материалов.
Вакуумная плазменная обработка широко используется в медицине для улучшения биосовместимости и биоинтеграции в реконструктивной хирургии. Результаты аналогичного исследования in vitro подчеркивают потенциал плазменной обработки для повышения эффективности hADM в клинических условиях, предлагая многообещающий путь для улучшения результатов реконструктивной хирургии. Кроме того, вакуумная плазменная обработка также используется в других областях, таких как увеличение электрических свойств органосиликатных пленок или смачиваемости полимеров полиэфирэфиркетона (PEEK).
Основным ограничением настоящего исследования является небольшое количество образцов и, конечно, его in vitro природа. Другим ограничением является то, что угол контакта смачиваемости должен был быть предоставлен вместо уровня градации смачиваемости. Даже если результаты настоящего исследования обнадеживают для вакуумной плазменной обработки поверхности, данные in vitro не позволяют нам сделать какие-либо окончательные клинические выводы. Тем не менее, анализ данных SEM-EDS показал, что уровень углеродных примесей на поверхностях костных блоков, как правило, снижался при увеличении количества циклов; поэтому можно предложить увеличить количество циклов до трех в зависимости от используемых заменителей костной трансплантации. Более того, время абсорбции и уровень смачиваемости также улучшились после двух и трех циклов. В связи с последним, мембраны перикарда и костные трансплантаты, особенно неколлагеновые костные трансплантаты, могут быть обработаны увеличением количества циклов до двух или трех для снижения степени углеродных примесей и увеличения их гидрофильности. Однако для подтверждения этих предварительных результатов необходимы дальнейшие клинические рандомизированные контролируемые испытания. Еще одним ограничением этого исследования является то, что поскольку в научной литературе не было много аналогичных исследований, было нелегко определить критерий для интерпретации результатов, особенно в отношении уровня смачиваемости протестированных заменителей костной трансплантации и рассасывающихся мембран. Данные из аналогичных исследований in vitro и in vivo подтвердили положительный эффект плазменной обработки на имплантаты и абатменты при использовании аргоновой плазмы. Что касается последнего, данные из этого исследования in vitro должны рассматриваться как предварительный отчет для поощрения дальнейших клинических оценок.
Выводы
Обработка поверхности вакуумным плазменным методом статистически увеличила гидрофильность большинства протестированных биоматериалов, сократив время абсорбции и увеличив степень смачиваемости. Кроме того, уровень углеродных примесей можно было снизить, увеличив время цикла. Однако для подтверждения этих предварительных результатов необходимы дальнейшие рандомизированные контролируемые исследования с расчетом размера выборки.
Марко Талларико, Сильвио Марио Мелони, Микеле Троя, Карлотта Каччо, Ауреа Иммаколата Лумбау, Иева Гендвилиене, Франческо Маттиа Черузо и Милена Пизано
Ссылки
- Busenlechner, D.; Fürhauser, R.; Haas, R.; Watzek, G.; Mailath, G.; Pommer, B. Долгосрочный успех имплантатов в Академии оральной имплантологии: 8-летнее наблюдение и анализ факторов риска. J. Periodontal Implant. Sci. 2014, 44, 102–108. [CrossRef] [PubMed]
- Kim, T.-I. Дань доктору Пер-Ингвару Бранемарку. J. Periodontal Implant. Sci. 2014, 44, 265. [CrossRef] [PubMed]
- Mavrogenis, A.F.; Dimitriou, R.; Parvizi, J.; Babis, G.C. Биология остеоинтеграции имплантатов. J. Musculoskelet. Neuronal Interact. 2009, 9, 61–71. [PubMed]
- Peñarrocha, D.M.; Cavani, U.; Cuadrado, L. Атлас немедленной нагрузки зубных имплантатов; Springer International Publishing: Берлин/Гейдельберг, Германия, 2019; ISBN 9783030055462, 3030055469.
- Wong, M.; Eulenberger, J.; Schenk, R.; Hunziker, E. Влияние топологии поверхности на остеоинтеграцию имплантатов в трабекулярной кости. J. Biomed. Mater. Res. 1995, 29, 1567–1575. [CrossRef]
- Wennerberg, A.; Albrektsson, T. О поверхностях имплантатов: Обзор современных знаний и мнений. Int. J. Oral Maxillofac. Implant. 2010, 25, 63–74. [PubMed]
- Wennerberg, A.; Albrektsson, T. Влияние топографии поверхности титана на интеграцию кости: Систематический обзор. Clin. Oral Implant. Res. 2009, 20, 172–184. [CrossRef]
- Beutner, R.; Michael, J.; Schwenzer, B.; Scharnweber, D. Биологическая нано-функционализация поверхностей титано-содержащих биоматериалов: Гибкий инструмент. J. R. Soc. Interface 2010, 7, S93–S105. [CrossRef]
- Sun, X.D.; Liu, T.T.; Wang, Q.Q.; Zhang, J.; Cao, M.S. Модификация поверхности и функциональные возможности для титановых зубных имплантатов. ACS Biomater. Sci. Eng. 2023, 9, 4442–4461. [CrossRef] [PubMed]
- Canullo, L.; Tallarico, M.; Peñarrocha, M.; Corrente, G.; Fiorellini, J.; Peñarrocha, D. Обработка имплантатов плазмой аргона у пациентов с периодонтальным здоровьем: Результаты шести лет после нагрузки рандомизированного контролируемого испытания. Int. J. Periodontics Restor. Dent. 2017, 37, 683–690. [CrossRef]
- Canullo, L.; Tallarico, M.; Botticelli, D.; Alccayhuaman, K.A.A.; Neto, E.C.M.; Xavier, S.P. Изменения жестких и мягких тканей вокруг имплантатов, активированных с использованием плазмы аргона: Гистоморфометрическое исследование на собаке. Clin. Oral Implant. Res. 2018, 29, 389–395. [CrossRef]
- Yang, H.J.; Lee, B.; Shin, C.; You, B.; Oh, H.S.; Lee, J.; Lee, J.; Oh, S.K.; Oh, S.H. Улучшение биосовместимости и биоинтеграции человеческой акцеллюлярной дермальной матрицы с помощью обработки поверхности вакуумной плазмой. Bioengineering 2024, 11, 359. [CrossRef] [PubMed]
- Kawai, H.; Shibata, Y.; Miyazaki, T. Предварительная обработка плазмой с разрядом света усиливает дифференцировку остеокластов и их выживаемость на титановых пластинах. Biomaterials 2004, 25, 1805–1811. [CrossRef]
- Shibata, Y.; Hosaka, M.; Kawai, H.; Miyazaki, T. Обработка титановыми пластинами с помощью плазмы с разрядом света усиливает адгезию остеобластоподобных клеток к пластинам через механизм, опосредованный интегринами. Int. J. Oral Maxillofac. Implant. 2002, 17, 771–777. [PubMed]
- Canullo, L.; Genova, T.; Mandracci, P.; Mussano, F.; Abundo, R.; Fiorellini, J.P. Морфометрические изменения, вызванные обработкой холодной плазмой аргона на остеобластах, выращенных на различных поверхностях зубных имплантатов. Int. J. Periodontics Restor. Dent. 2017, 37, 541–548. [CrossRef] [PubMed]
- Noro, A.; Kaneko, M.; Murata, I.; Yoshinari, M. Влияние топографии поверхности и физико-химических свойств поверхности на смачиваемость циркония (тетрагональный цирконий поликристаллический). J. Biomed. Mater. Res. Biomater. 2013, 101, 355–363. [CrossRef]
- Canullo, L.; Tallarico, M.; Peñarrocha-Oltra, D.; Monje, A.; Wang, H.; Peñarrocha-Diago, M. Очистка абатментов имплантатов плазмой аргона: 5-летнее наблюдение рандомизированного контролируемого испытания. J. Periodontol. 2016, 87, 434–442. [CrossRef]
- Krithikadatta, J.; Gopikrishna, V.; Datta, M. Руководящие принципы CRIS (Контрольный список для отчетности о инвитро исследованиях): Концептуальная записка о необходимости стандартизированных руководств для улучшения качества и прозрачности в отчетности о инвитро исследованиях в экспериментальной стоматологии. J. Conserv. Dent. 2014, 17, 301–304. [CrossRef]
- Canullo, L.; Genova, T.; Chinigò, G.; Iacono, R.; Pesce, P.; Menini, M.; Mussano, F. Устройство для обработки вакуумной плазмой для повышения активности фибробластов на обработанных и шероховатых титановыми поверхностях. Dent. J. 2024, 12, 71. [CrossRef]
- Jeon, H.J.; Jung, A.; Kim, H.J.; Seo, J.S.; Kim, J.Y.; Yum, M.S.; Gweon, B.; Lim, Y. Улучшение адгезии и пролиферации остеобластов на поверхности имплантата, обработанной вакуумной плазмой. Appl. Sci. 2022, 12, 9884. [CrossRef]
- Pesce, P.; Menini, M.; Santori, G.; Giovanni, E.D.; Bagnasco, F.; Canullo, L. Фото- и плазменная активация титановыми поверхностями зубных имплантатов. Систематический обзор с мета-анализом предклинических исследований. J. Clin. Med. 2020, 9, 2817. [CrossRef]
- Lee, H.; Jeon, H.J.; Jung, A.; Kim, J.; Kim, J.Y.; Lee, S.H.; Kim, H.; Yeom, M.S.; Choe, W.; Gweon, B.; и др. Улучшение эффективности остеоинтеграции титановыми имплантатами через обработку поверхности плазмой. Biomed. Eng. Lett. 2022, 12, 421–432. [CrossRef] [PubMed]
- Fathi-Azarbayjani, A.; Jouyban, A. Поверхностное натяжение в патофизиологии человека и его применение в качестве медицинского диагностического инструмента. Bioimpacts 2015, 5, 29–44. [CrossRef] [PubMed]
- Hrncír, E.; Rosina, J. Поверхностное натяжение крови. Physiol. Res. 1997, 46, 319–321. [PubMed]
- Baklanov, M.R.; Gismatulin, A.A.; Naumov, S.; Perevalov, T.V.; Gritsenko, V.A.; Vishnevskiy, A.S.; Rakhimova, T.V.; Vorotilov, K.A. Комплексный обзор влияния химического состава, обработки плазмой и вакуумного ультрафиолетового (VUV) облучения на электрические свойства органосиликатных пленок. Polymers 2024, 16, 2230. [CrossRef]
- Primc, G. Стратегии для улучшения смачиваемости полимеров полиэфирэфиркетона (PEEK) с помощью неравновесной плазменной обработки. Polymers 2022, 14, 5319. [CrossRef]
