Гистологический анализ биологической ширины и ориентации коллагеновых волокон вокруг абатментов без винтов, с конусным соединением и полусферическим основанием через 8 и 16 недель после открытия имплантатов: наблюдательное клиническое исследование
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Цели: Целью данного исследования было гистологическое оценивание ориентации коллагеновых волокон вокруг абатментов с полусферическим основанием без винтов, типа Морса, у людей.
Методы: Это исследование было спроектировано как наблюдательное, контролируемое клиническое испытание для оценки гистологической ориентации коллагеновых волокон вокруг имплантатов. Биопсии периимплантной ткани были выполнены через 8 (группа A, контроль) или 16 (группа B, тест) недель после открытия имплантата и гистологически проанализированы под оптическим микроскопом с использованием гематоксилина и эозина, окраски по Массон и Пикро-Сириус, а также с помощью сканирующего электронного микроскопа.
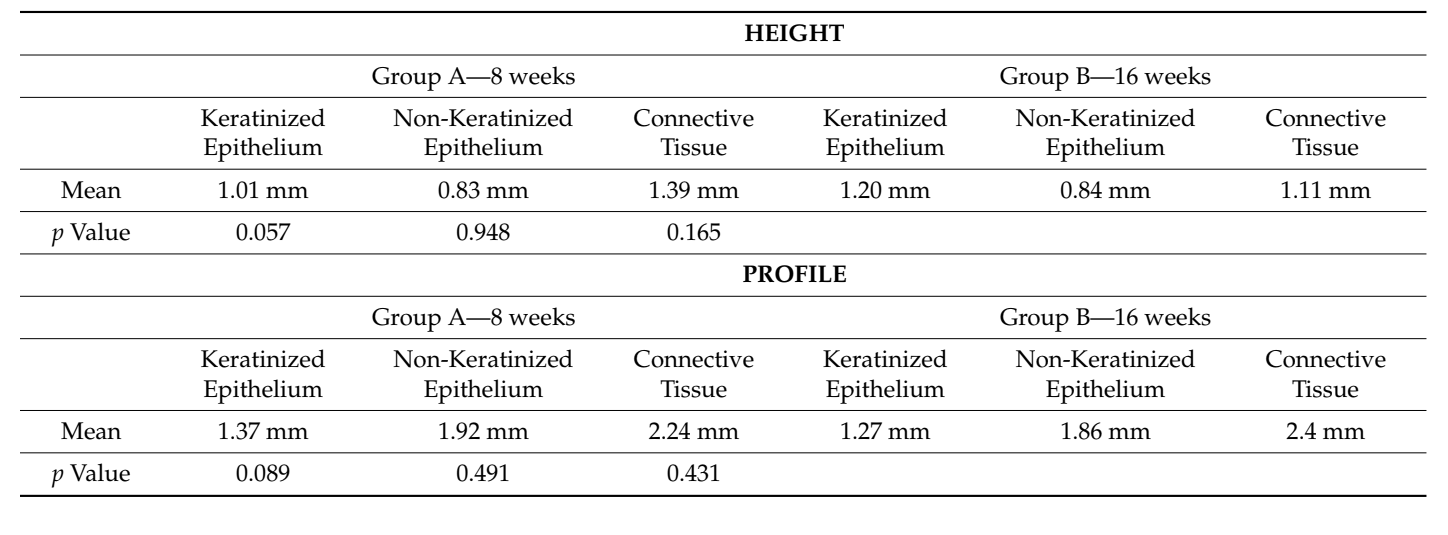
Результаты: В исследование были включены восемь пациентов, и было выполнено 16 биопсий. Все биопсии были правильно проанализированы. Гистологическое исследование поперечных сечений ткани, взятой через 8 недель после открытия имплантата, показало почти полное отсутствие эпителиального выстилки, в то время как пучки соединительной ткани в поверхностной части показали более низкий круговой паттерн. Гистохимическое исследование поперечного сечения ткани, взятой через 16 недель после открытия имплантата, показало частичное присутствие некератинизированного эпителиального выстилки на месте имплантата, а пучки коллагена показали большую организованность, с окружным курсом вокруг абатмента. На 8 неделе окончательный гистологический анализ показал среднюю высоту 1,01 мм для кератинизированного эпителия, 0,83 мм для некератинизированного эпителия и 1,39 мм для соединительной ткани. В то время как на 16 неделе значения составили 1,20 мм, 0,48 мм и 1,11 мм соответственно. Статистически значимых различий между группами не было найдено (p > 0,05).
Выводы: Гистологически не было обнаружено различий в высоте и профиле десны между 8 и 16 неделями заживления после установки протеза. В тестовой группе (16 недель) была обнаружена большая организация коллагеновых волокон с окружным курсом вокруг абатмента по сравнению с контрольной группой (8 недель).
Введение
Успех имплантационного лечения в первую очередь определяется остеоинтеграцией, но прежде всего определяется поддержанием стабильности как краевой кости, так и мягких тканей вокруг импланта с течением времени. Ожидается стабильное физиологическое ремоделирование краевой кости в среднесрочной и долгосрочной перспективе при использовании современных имплантационных поверхностей и соединений. В последнее десятилетие концепция биологической ширины широко обсуждается в области оральной имплантации. Характеристики периимплантной слизистой определяются в процессе установления биологической ширины, которая происходит после нескольких недель заживления после подключения заживляющих абатментов или протетических компонентов. Биологическая ширина вокруг импланта представляет собой сложную систему размером 3–4 мм. Она простирается от верхней части периимплантной слизистой до первого контакта кости с имплантом и состоит из сулкулярного эпителия, соединительного эпителия и волокнистой соединительной ткани. Однако было продемонстрировано различное расположение волокон соединительной ткани вокруг имплантов по сравнению с естественными зубами, с круговыми или кольцевыми расположениями, параллельными длинной оси и вставленному импланту. Роль биологической ширины заключается в создании биологического барьера против токсичных продуктов от бактерий, защищая подлежащую кость. В последние годы эта концепция стала очень популярной в современной стоматологической имплантологии, которая более ориентирована на потребности управления мягкими тканями. Управление мягкими тканями может осуществляться с помощью различных хирургических техник и в разное время во время имплантационного лечения, в зависимости от начального дефекта, анатомической области и эстетических соображений. Кратко, увеличение кератинизации тканей может быть выполнено для получения полосы кератинизации вокруг имплантов, что улучшает их эстетические результаты и снижает риск накопления налета. Напротив, увеличение толщины мягких тканей может быть выполнено для увеличения толщины периимплантных супракрестальных мягких тканей, которые имеют решающее значение для получения естественного профиля выхода для протетической реставрации и обеспечения удовлетворительного эстетического результата. Более того, тонкий биотип или фенотип часто противоречит резорбции для восстановления правильной биологической ширины. Микротрещины и микродвижения на интерфейсе имплант–абатмент также играют важную роль в стабильности жестких и мягких тканей вокруг импланта. Микропроницаемость на интерфейсе имплант–абатмент может определять проход бактерий и высвобождение мелких титановый частиц, которые вызывают воспаление в периимплантных тканях. По этим причинам сегодня импланты с конусным соединением Морса и без соединительного винта могут представлять собой хороший выбор.
Супрагингивальный фибровый аппарат состоит из плотной сети пучков коллагеновых волокон
, которые прикрепляют десну к зубам и кости, соединяя vestibular и oral interdental papillae [9]. Эта волоконная сеть обеспечивает механическое сопротивление, позволяя десне выдерживать трение от жевания. Юнкциональный эпителий образует корональную часть денто-гингивального соединения, в то время как апикальная часть состоит из соединительных тканей денто-гингивальных волокон, которые проникают в цемент корня, обеспечивая прикрепление соединительной ткани. Периимплантная слизистая оболочка вокруг успешных эндоссеосных имплантатов имеет много общего с тканями, окружающими натуральные зубы. Ламина проприя простирается коронально от альвеолярной кости и покрыта кератинизированным оральным эпителием. В здоровых условиях образуется мелкий сулкус, выстланный сулкулярным эпителием. Среди тканей, контактирующих с имплантатом, юнкциональный эпителий наиболее близок к таковому у натурального зуба, образуя биологическое прикрепление через базальную ламину и гемидесмосомы. Однако существуют различия в том, как соединительные ткани взаимодействуют с имплантатами из-за отсутствия цемента корня. В то время как денто-гингивальные волокна в натуральных зубах прикрепляются перпендикулярно или косо к минерализованному цементу, их прямое прикрепление к имплантатам остается предметом споров. Большинство соединительных волокон располагаются параллельно поверхности имплантата, либо в коронально-апикальном направлении, либо по окружности. Некоторые исследования предполагают наличие волокон, ориентированных перпендикулярно или косо к поверхности имплантата, особенно на микротекстурированных, а не гладких трансмукозных поверхностях.
Целью данного клинического испытания было предварительное оценивание, у людей, измерения биологической ширины и ориентации коллагеновых волокон вокруг имплантатов без винтов, с конусным соединением Морса, с полусферическими основаниями через 8 и 16 недель после открытия имплантатов. Следующий манускрипт был написан в соответствии с рекомендациями STROBE для отчетности об обсервационных клинических испытаниях.
Материалы и методы
Это исследование было спроектировано как обсервационное, контролируемое клиническое испытание, и его целью было оценить высоту и профиль биологической ширины, а также ориентацию коллагеновых волокон вокруг соединений имплант-абатмент без винтов с конусным соединением Морса среди участников через 8 и 16 недель после открытия имплантатов. Это исследование проводилось в соответствии с принципами, изложенными в Декларации Хельсинки о биомедицинских исследованиях с участием людей, с поправками 2018 года. Исследовательский протокол получил этическое одобрение от Университета Бухареста в Румынии (номер протокола 15/2024, 16 декабря 2024 года) и был зарегистрирован в онлайн-базе данных клинических исследований (номер регистрации: NCT06862505; 5 марта 2025 года). Любой пациент в возрасте 18 лет и старше, страдающий частичной адентией задних (премоляров и моляров) элементов, нуждающийся как минимум в двух реабилитациях с одиночными имплантатами без необходимости в мягкой и/или тканевой аугментации и способный понять и подписать форму информированного согласия, считался подходящим для участия в этом исследовании. Пациенты исключались, если присутствовало любое из следующих критериев исключения: системные или местные противопоказания для установки имплантатов; нелеченая пародонтальная болезнь; курение; остеопороз; неконтролируемый диабет; отказ от реабилитации с имплантатами; отказ от сбора биопсии; и системные патологии, которые могли бы компрометировать заживление периимплантных тканей. Всем выбранным пациентам была предоставлена информация обо всех хирургических и протезных процедурах, включая преимущества и потенциальные риски и осложнения данного исследования, и письменное информированное согласие было получено перед окончательной регистрацией.
2.1. Предоперационный и хирургический протокол
Пациенты изначально подвергались клиническим и инструментальным исследованиям для определения их общего состояния здоровья и соответствия критериям. Инструментальные тесты, требуемые отделением в рамках нормального протокола, включали: анализы крови, ЭКГ и кардиологическое обследование, а также Cone Beam КТ зубного ряда. Примерно за 10 дней до установки имплантатов все пациенты прошли сеансы профессиональной гигиены полости рта. Все пациенты получили профилактическую антибиотикотерапию: 2 г амоксициллина за 1 час до вмешательства или клиндамицин 600 мг за 1 час до установки имплантата в случае аллергии на пенициллин. Все пациенты полоскали рот раствором хлоргексидина 0,2% в течение 1 минуты перед любым хирургическим вмешательством. Местная анестезия (Септанест с адреналином, 1/100,000, Сеподонт, Матаро, Испания) вводилась инъекционным методом. Разрез и подъем трапециевидного мукопериостального лоскута выполнялись в выбранном месте для имплантации. После обнажения кости проводилась остеотомия с помощью пилотного направляющего диаметром 2,0 мм, на 1100 об/мин, с внешним холодным орошением. Начальная остеотомия была увеличена в соответствии с инструкциями производителя. Короткие зубные имплантаты (система Bicon, Бостон, Массачусетс, США) для замены одного или нескольких зубов устанавливались на 2-3 мм ниже уровня краевой кости, и использовались заживляющие колпачки. Лоскут был повторно позиционирован и пассивно зашит для обеспечения заживления по первичному натяжению. Использовался двухэтапный хирургический протокол. Через три месяца после установки имплантатов проводилась местная анестезия (Септанест с адреналином, 1/100,000, Сеподонт, Матаро, Испания) инъекционным методом с вазоконстриктором. Все имплантаты были обнажены путем выполнения минимально инвазивных линейных разрезов на гребне и удаления всех растущих тканей сверху. После удаления заживляющего колпачка была сделана слепочная оттиск.
После этого был установлен поликарбонатный заживляющий абатмент диаметром 4 (премоляры) или 5 (моляры) мм, который был зафиксирован на имплантатах. Пациенты были рандомизированы на группы, которые получили свои окончательные реставрации через 8 (контрольная группа) или 16 (тестовая группа) недель после подключения заживляющего абатмента, чтобы оценить заживление мягких тканей вокруг имплантатов за разные временные интервалы. Для всех пациентов было проведено интраоральное рентгенографическое обследование места имплантации, чтобы оценить правильность фиксации заживляющего абатмента изначально и их окончательной реставрации позже. Использовалась система выравнивания Ринна.
2.2. Техника сбора биопсии
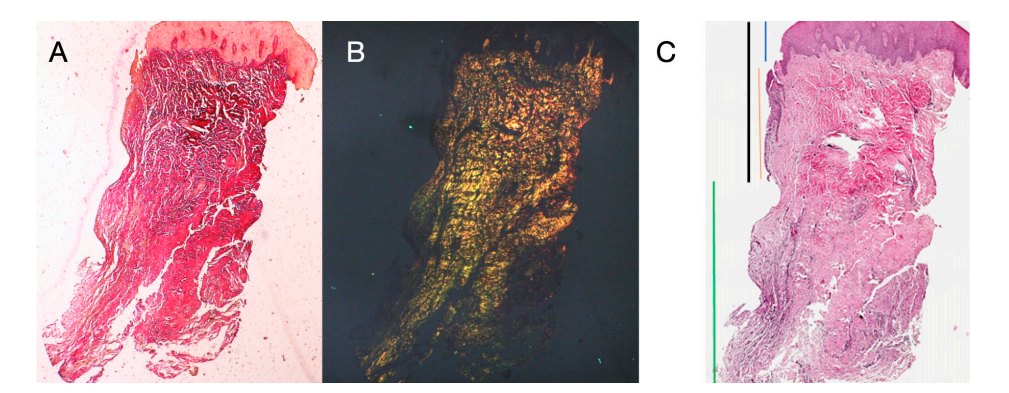
В обеих группах, на разных временных интервалах, биопсия мягкой ткани вокруг имплантата была собрана непосредственно перед установкой окончательной протезы. Анестезия проводилась с использованием инфильтрационной техники на расстоянии 10 мм от места забора образца. Использовался мукотом диаметром 5 (премоляры) или 6.5 (моляры) мм вокруг полусферических базовых абатментов. Каждый образец включал мягкие ткани, образовавшиеся вокруг абатментов в течение периода заживления 8 или 16 недель (Рисунок 1). Образцы были разделены на две идентичные части. Первые собранные части ткани фиксировались в 10% нейтральном буферном формалине для оптического исследования. Вторые части фиксировались в глутарральдегиде 2.5% в PBS 0.1 M pH 7.4 как минимум на 4 дня для наблюдения с помощью сканирующего электронного микроскопа. Послеоперационное обезболивание с использованием ибупрофена 600 мг назначалось по мере необходимости. Все пациенты находились под строгим наблюдением в течение следующих шести месяцев для оценки полного заживления собранной мягкой ткани.
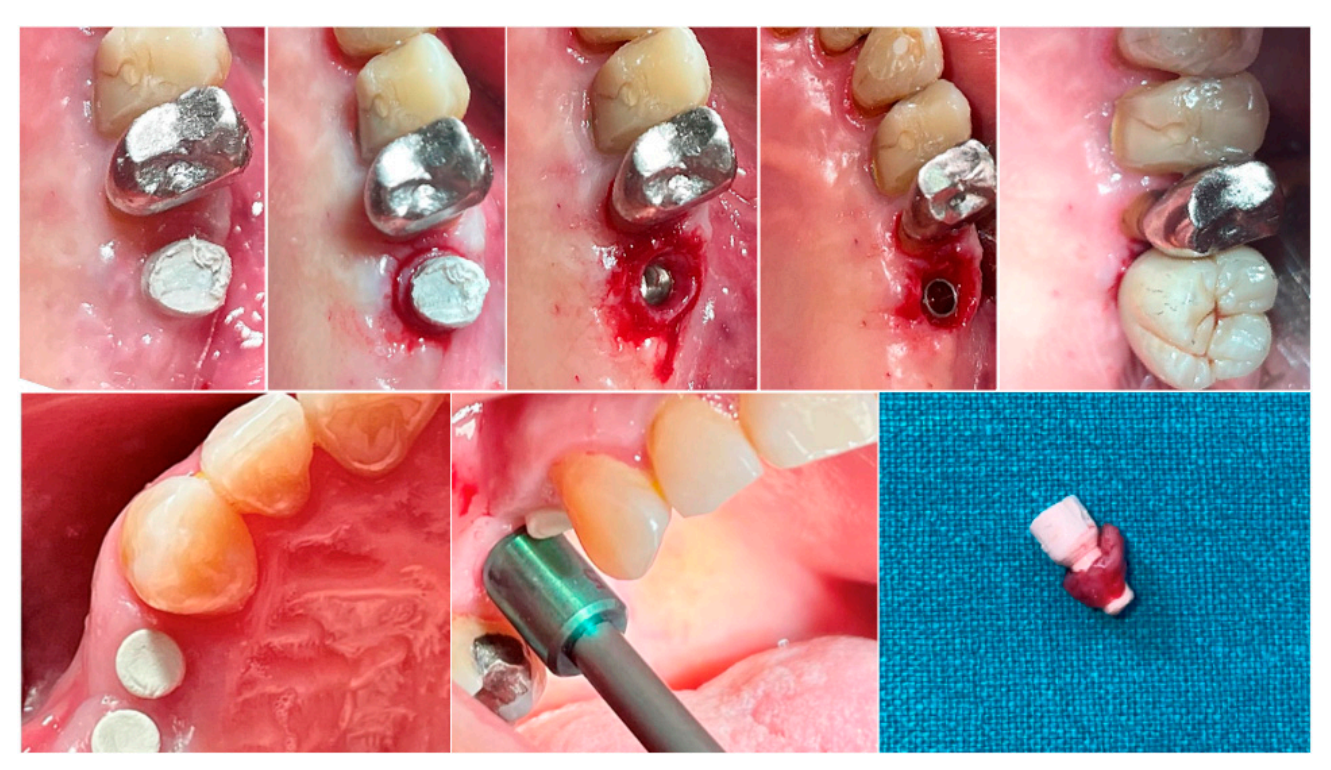
2.3. Показатели результатов
Основным результатом была неудача имплантата, определяемая как подвижность, инфекция, перелом и/или любая другая механическая или биологическая проблема, которая определила его удаление. Кроме того, любые биологические (например, устойчивая к лекарствам боль, отек, чрезмерная MBL, гнойное выделение и т. д.) и/или технические (например, перелом облицовочного материала и/или каркаса, ослабление винта и т. д.) осложнения были зафиксированы в ходе наблюдения.
Вторичными результатами были гистологический анализ с гистоморфометрией и анализ с использованием сканирующего электронного микроскопа (СЭМ).
Все гистологические образцы были проанализированы в Отделении радиологических, онкологических и патологических наук Университета «Ла Сапиенца», Рим, Италия. Для гистологической диагностики были определены две группы: те, кто прошел 8 или 16 недель заживления после вскрытия имплантата. Для гистологического анализа собранные образцы были дополнительно разделены на две части для поперечных и продольных исследований. Все образцы были залиты в парафин и нарезаны с помощью микротома для получения поперечных и продольных срезов, которые использовались для морфологических анализов. Для каждого образца, фиксированного формалином, две части были залиты в парафиновый воск: первая нарезана вдоль продольной оси, чтобы увидеть все длинные оси образца, а вторая - вдоль полукруглой оси, чтобы увидеть короткую ось образца. Гистологические срезы были окрашены гематоксилином и эозином, трихромом Массона и пикро-сириусом, и наблюдались с помощью оптического микроскопа Leica (Leitz Camera, Ветцлар, Германия).
Организация коллагеновых волокон была оценена с помощью гистологического исследования поперечных срезов, окрашенных гематоксилином и эозином, трихромом Массона и пикро-сириусом (с поляризованным светом и без него), и наблюдалась с помощью оптического микроскопа Leica. Биологическая ширина измерялась как высота и профиль продольных гистологических срезов, проанализированных с помощью световой микроскопии и гистохимически окрашенных гематоксилином и эозином, и наблюдалась с помощью оптического микроскопа Leica. Организация коллагеновых волокон также была оценена с помощью сканирующего электронного микроскопа (ZEISS EVO 40, ZEISS, Оберкохен, Германия).
Количественные гистоморфометрические измерения были оценены на продольных срезах с использованием программного обеспечения ImageJ 1.54 (Национальный институт здоровья, Бетесда, штат Мэриленд, США) при увеличении 1.6× . Стандартизация микроскопа была обеспечена использованием одного и того же оптического микроскопа Leica для морфологических анализов, а две опытные исследователи (R.C., C.D.G.), не знающие о типе образца, проводили оценки и гистоморфологические измерения.
Для анализа с помощью сканирующего электронного микроскопа образцы подвергались постфиксации в растворе тетроксида осмия 2% в H2O в течение 2 часов. Затем образцы промывались в H2O дважды по 20 минут, чтобы удалить раствор постфиксации. Затем проводилась дегидратация в восходящей серии спиртовых растворов (30–50–70–95–100%). Для сохранения их ультраструктурных поверхностных деталей образцы высушивались в аппарате Emitech K850 для "сушки в критической точке" (Emitech Ltd., Ашфорд, Кент, Англия). Высушенные образцы были смонтированы с помощью серебряного клея на алюминиевые подставки и затем покрыты слоем платины (2 минуты, 15 мА) с использованием распылителя Emitech K 550 (Emitech Ltd., Ашфорд, Кент, Англия). Образцы наблюдались в условиях высокого вакуума при 12 кВ с помощью сканирующего электронного микроскопа Hitachi SU3500 (Hitachi Ltd., Хитачи, Япония).
2.4. Размер выборки и рандомизация
Расчет размера выборки не проводился, так как настоящее исследование считалось пилотным, наблюдательным клиническим испытанием. Была создана случайная рандомизационная таблица, сгенерированная компьютером. Только один из исследователей, не участвующий в отборе и лечении пациентов, знал о последовательности рандомизации. Рандомизированные коды были помещены в последовательно пронумерованные, идентичные, непрозрачные, запечатанные конверты. Конверты открывались последовательно сразу после снятия оттиска; таким образом, распределение лечения было скрыто от исследователей во время набора и лечения пациентов.
2.5. Статистический анализ
Все анализы проводились в соответствии с заранее установленным планом анализа с использованием программного обеспечения SPSS для Mac OS X (версия 22.0; SPSS, Чикаго, Иллинойс, США). Данные анализировал стоматолог (М.Т.). Описательный анализ был выполнен для числовых параметров с использованием средних значений ± SD. Различия в средних составах тканей (высота и профиль) на 8 и 16 неделях сравнивались с использованием парных t-тестов. Пациент был статистической единицей анализов. Все статистические сравнения проводились с уровнем значимости 0.05.
Результаты
Было выбрано восемь пациентов в возрасте от 38 до 63 лет, четыре женщины и четыре мужчины (средний возраст 51.5 ± 9 лет). Каждый пациент получил две биопсии в двух разных местах в соответствии с рандомизацией. На 8 и 16 неделях после вскрытия имплантата клиническое обследование показало здоровые периимплантные ткани. Ни один пациент не выбыл. Ни один имплантат не потерпел неудачу во время остеоинтеграции, и в течение шести месяцев после установки протеза не было зарегистрировано биологических или технических осложнений. В световой микроскопии ткани показали полное отсутствие воспаления и увеличенную организацию коллагеновых волокон, расположенных по окружности абатмента. Объем ткани, включенной в образцы, позволил подготовить несколько срезов с различными окрасками как для световой, так и для сканирующей электронной микроскопии. Гистологическое исследование поперечных срезов, взятых через 8 недель после вскрытия имплантата, показало почти полное отсутствие эпителиального выстилки в месте имплантата, которое состояло из рыхлой соединительной ткани с небольшими новообразованными сосудами в присутствии очаговых геморрагических экстравазаций и лимфоцитарного воспалительного инфильтрата. Соседняя соединительная ткань выглядела более плотной, с обильным воспалительным инфильтратом, состоящим из лимфоцитов и плазматических клеток, преимущественно расположенных вокруг небольших сосудистых структур. Кроме того, пучки соединительной ткани в поверхностной части показали круговой рисунок. При исследовании трихромом Массона и Пикро Сириус, последний, наблюдаемый под оптическим микроскопом с поляризованным светом, продемонстрировал почти исключительное присутствие коллагена типа I (Рисунок 2).
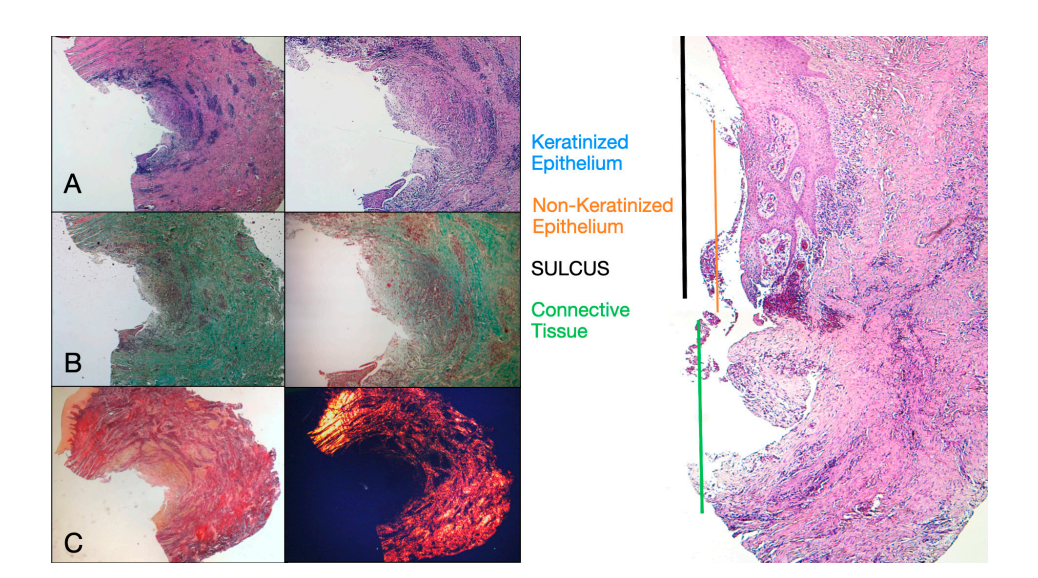
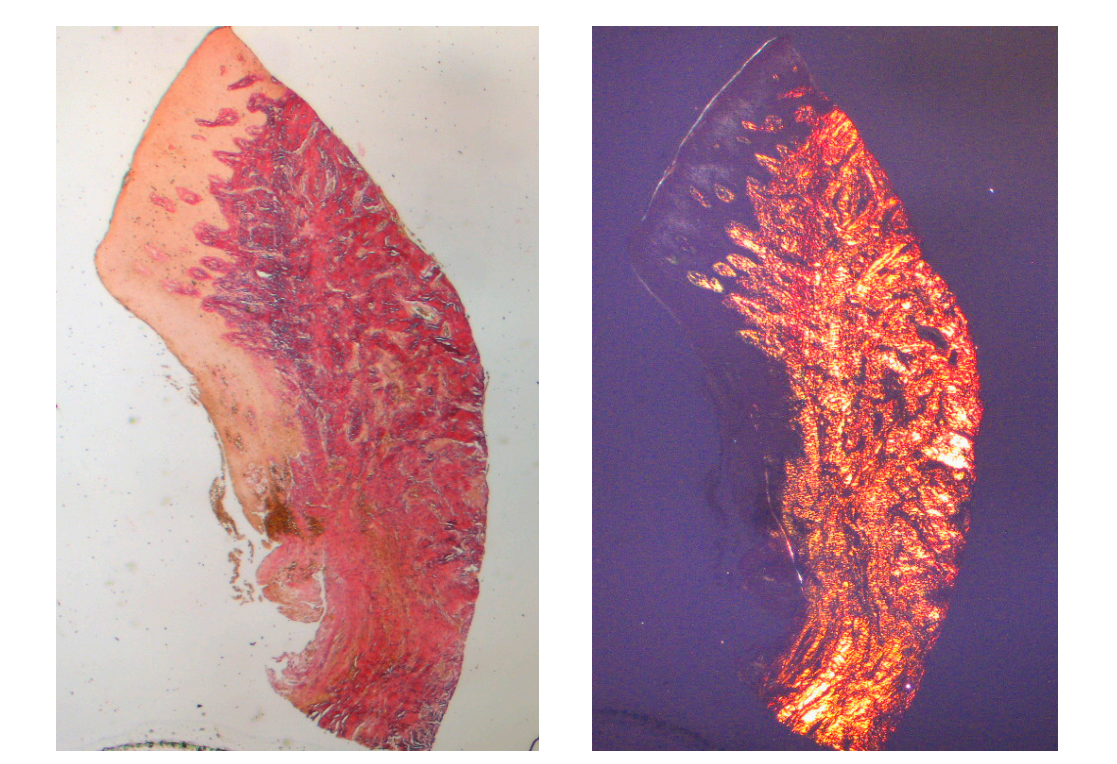
Анализируемая ткань в продольных срезах показала, как область борозды делится на две части, характеризующиеся областью, начинающейся от десневого края, выстланной кератинизированным малпигиевым эпителием, и областью, выстланной эпителием с менее выраженной кератинизацией. Последняя непрерывно переходит в депителизированную область, состоящую исключительно из рыхлой соединительной ткани с новообразованными сосудами. В контексте соединительной ткани наблюдается лимфоцитарный и плазматический клеточный воспалительный инфильтрат в подэпителиальных и периваскулярных областях (Рисунок 1). Пикро-Сириус окрашивание продольного среза, взятого через 8 недель после открытия имплантата, показывает наличие некоторых пучков коллагена, исходящих из части соединительной ткани, прилегающей к кости, которые идут вертикально к свободному краю десны, наряду с существенной дезорганизацией других коллагеновых волокон (Рисунок 3).
Гистохимическое исследование среза ткани, взятой через 16 недель после открытия импланта, показывает частичное присутствие некератинизированного эпителиального выстилки на месте импланта, которая состоит из зрелой рыхлой соединительной ткани, свободной от воспалительного инфильтрата. Внешняя соединительная ткань более организована, чем в предыдущем образце. Коллагеновые пучки показали большую организацию с окружным курсом вокруг абатмента. Окрашивание трихромом Массона и Пикро Сириус, последний также наблюдаемый с поляризованным светом, продемонстрировало почти исключительное присутствие коллагена типа I. Изображения, полученные с помощью этих красителей, более четко показывают организацию и ориентацию круглых волокон. Окрашивание продольного среза Пикро Сириус показывает, несмотря на артефакты, вертикальную организацию коллагеновых волокон в нижней части образца (Рисунок 4).
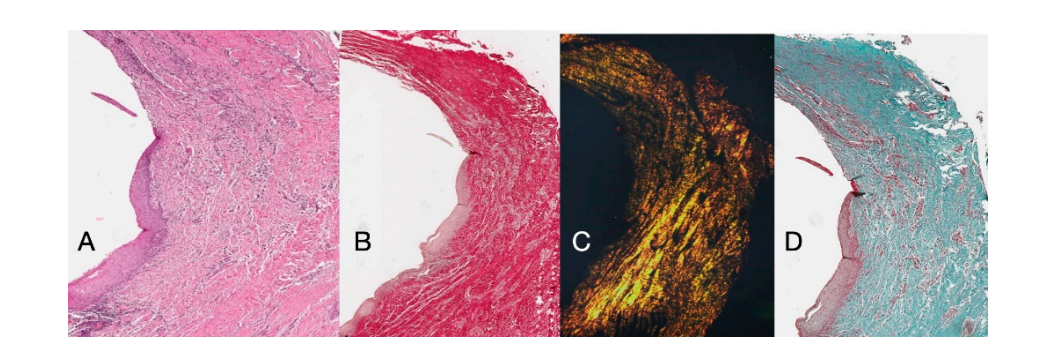
Гистохимические продольные срезы, сделанные через 16 недель после открытия имплантата, показали области десневого кармана, разделенные на область, начинающуюся от десневого края, выстланную кератинизированным малпигиевым эпителием, и область, выстланную некератинизированным эпителием. Последняя область непрерывна с депителизированной зоной, состоящей исключительно из соединительной ткани. Показано, что соединительная ткань состоит из коллагена типа I и свободна от воспалительного инфильтрата (Рисунок 5).
Наконец, гистологический анализ не показал статистически значимых различий в составе мягких тканей на обоих временных интервалах как по высоте, так и по профилю. Средние биологические ширины, измеренные на 8 и 16 неделях, составили 3.2 и 3.1 мм по высоте и 5.5 по профилю на обоих контрольных точках (Таблица 1).
Наблюдение с помощью электронного микроскопа с низким увеличением (Рисунок 6A) образцов показывает, что периимплантная слизистая оболочка свободна от воспаления, отека или экссудации крови. Вокруг заживляющего абатмента наблюдается наличие зрелой соединительной ткани, богатой упорядоченно организованными коллагеновыми волокнами. При более высоких увеличениях (Рисунок 6B,C) видны волнистые коллагеновые волокна, организованные упорядоченно и параллельно; они имеют преимущественно круговую организацию вокруг абатмента.
Чтобы более подробно проанализировать эту плотную матрицу, были получены изображения при увеличении 300× и 500× с помощью сканирующего электронного микроскопа. При этих увеличениях легко наблюдаются тонкие коллагеновые волокна, которые исходят из базальной мембраны (Рисунок 6D,E) и которые выступают в виде отдельных волокон, не организованных в пучки.

Обсуждение
Сегодня дентальные имплантаты являются распространенной и чрезвычайно эффективной процедурой для восстановления отсутствующих зубов. Исследование факторов, которые поддерживают периимплантные ткани в стабильном и долгосрочном здоровом состоянии, стало основной темой исследований по имплантатам. Для уменьшения потери краевой кости и поддержания уровней периимплантных мягких тканей были разработаны различные подходы, включая микро- и макро-дизайны имплантатов, хирургические и протезные процедуры, смену платформы и соединения имплант–абатмент.
Основная функция периодонтальных тканей, помимо прикрепления зуба к челюсти, заключается в защите десен; то есть, их функция заключается в обеспечении герметичности против загрязненной среды полости рта, противостоянии трению во время жевания и защите интерфейса между зубами и мягкими тканями от чуждых агентов. Биологическая ширина вокруг имплантата отличается от таковой вокруг натуральных зубов во многих аспектах, включая концепцию, формирование, ремоделирование, размер и структуру, и играет важную роль в ремоделировании периимплантных мягких и твердых тканей. В настоящем исследовании заборы периимплантных мягких тканей проводились через 8 и 16 недель после открытия имплантата и установки поликарбонатного полусферического заживляющего абатмента. Восемь недель заживления были выбраны в качестве контрольного условия. Наличие естественного барьера из соединительной ткани и эпителия через 8 недель согласуется с несколькими исследованиями, проводившими эксперименты на животных. Однако заборы, проведенные через 8 недель, показали скромное ремоделирование, с периваскулярным лимфоцитарным и плазмоцитарным инфильтратом, а периимплантные ткани имели морфоструктурные характеристики, наложенные на здоровые ткани. Образцы через 16 недель показали полное отсутствие воспаления и увеличенную организацию коллагеновых волокон, расположенных по окружности абатмента. Более того, в продольных гистологических срезах наблюдался морфоструктурный паттерн, где область сулкуса была разделена на две части: одна область начиналась от десневого края, выстланного кератинирующим эпителием Малпиги, а другая область была выстлана эпителием с менее выраженной кератинизацией (JE). Основное расположение волокон было параллельным в продольных срезах (Рисунок 4), относительно оси имплантата, и круговым в поперечных срезах (Рисунок 3). При более высоких увеличениях, 300× и 500× (Рисунок 6B,C) были видны волнистые коллагеновые волокна, расположенные упорядоченно и параллельно. Эти волокна в основном демонстрировали круговую организацию вокруг абатмента. Тонкие коллагеновые волокна, возникающие из базальной мембраны и проецирующиеся как одиночные волокна, не организованные в пучки, могли быть легко наблюдаемы на изображениях SEM с увеличением 3000× и 5000× (Рисунок 6D,E).
Настоящее исследование показало, что дизайн полусферического абатмента способствует образованию структурированного соединительнотканевого манжета с высокоориентированными волокнами, по сравнению со случайным распределением, наблюдаемым в абатментах с параллельными стенками. Это предполагает, что организация ВМК может быть подвержена влиянию макромасштабной геометрии ткани, направляя расположение волокон и морфогенез. Подобные исследования описывали этот эффект в имплантатах с переключением платформы, где ориентация коллагена обеспечивает механическое удержание для периодонтальных волокон. Модели на животных также сообщали о супракрестальных круглых сетях коллагеновых волокон, сопоставимых с десневыми связками.
Недавнее доклиническое исследование продемонстрировало, что вогнутый трансмукозный дизайн может способствовать большему отложению и росту соединительной ткани по сравнению с прямым дизайном. Результаты показали увеличение толщины соединительной ткани, более плотную перимплантную сеть и ориентацию коллагеновых волокон в сторону воротника абатмента, формируя широкую круглую коллагеновую структуру вокруг платформы имплантата. Настоящее исследование поддерживает эти наблюдения, так как введение полусферического профиля способствовало расположению коллагеновых волокон в хорошо организованные параллельные пучки.
Ориентация коллагеновых волокон является ключевым биомеханическим фактором, отражающим силы, действующие на соединительную ткань, особенно через коллагеновые пучки. Исследования показали, что чрезмерное накопление случайно ориентированного коллагена может привести к образованию дисфункциональной фиброзной ткани. Направленная организация коллагеновых волокон имеет решающее значение для стабильности мягких тканей вокруг имплантата, как отмечено Карьялайнен и др.
В настоящем исследовании средние биологические ширины составили 3.2 и 3.1 мм на 8 и 16 неделях соответственно. Сравнивая настоящие результаты с другими аналогичными исследованиями, в исследовании Томмаси и др. на 8 неделе после открытия среднее значение составило 2.7 мм, включая 1.5 мм эпителия и 1.2 мм соединительной ткани, в то время как профильное измерение составило 3.6 мм. В настоящем исследовании средние биологические ширины были немного выше как в эпителии, так и в соединительной ткани. Однако было обнаружено значительное увеличение общего профиля. Основное различие заключается в том, что в исследовании Томмаси второе наблюдение проводилось на 12 неделе вместо 16 недели. Возможное объяснение этой разницы заключается в том, что ткани продолжают расти как минимум в течение 4 месяцев после повторного открытия.
С помощью СЭМ также возможно обнаружить волнистые коллагеновые волокна, организованные упорядоченно и параллельно, с преимущественно круговой организацией вокруг абатмента.
В связи с этим можно предположить, что преобладающие организации круговых коллагеновых полос и вертикальных коллагеновых полос были организованы в зависимости от дизайна абатмента. С этой точки зрения возможность использования имплантатов или систем имплант–коронка, которые способствуют стабильности слизистого уплотнения, представляет собой важную область исследований. Это решение смещает соединительное уплотнение апикально относительно протезных компонентов, чьи микро-движения—часто препятствующие стабильному образованию соединительной ткани—не компрометируют окончательную стабилизацию уплотнения. Основным ограничением настоящего исследования был небольшой размер выборки, так как расчет размера выборки не был выполнен. Необходимы дальнейшие клинические испытания с большими выборками для подтверждения этих предварительных результатов.
Выводы
Гистологически не было обнаружено никаких различий в высоте и профиле десны между 8 и 16 неделями заживления после открытия имплантатов. На 16 неделе в обеих группах было найдено больше тканей. В тестовой группе (16 недель) была обнаружена большая организация коллагеновых волокон в окружных курсах вокруг абатментов по сравнению с контрольной группой (8 недель).
Фабрицио Заккео, Джулия Петроли, Марко Талларико, Черена Джога, Раффаэлла Карлетти, Чира Розариа Тициана Ди Джоя, Винченцо Петроза, Сильвио Марио Мелони, Дарио Мелодия, Милена Пизано и Андреа Чиконетти
Ссылки:
- Талларико, М.; Лумбау, А.М.И.; Мелони, С.М.; Иерия, И.; Парк, К.-Дж.; Задрозный, Л.; Ханари, Е.; Пизано, М. Пятилетнее проспективное исследование по неудачам имплантатов и ремоделированию краевой кости, ожидаемое при использовании имплантатов с уровнем кости с пескоструйной/кислотно-этчированной поверхностью и конусным соединением. Eur. J. Dent. 2022, 16, 787–795. [CrossRef]
- Чжэн, З.; Ао, Х.; Се, П.; Цзян, Ф.; Чен, В. Биологическая ширина вокруг имплантата. J. Prosthodont. Res. 2021, 65, 11–18. [CrossRef]
- Берглунд, Т.; Линдхе, Дж. Размеры периимплантной слизистой. Биологическая ширина пересмотрена. J. Clin. Periodontol. 1996, 23, 971–973. [CrossRef]
- Шьерано, Г.; Рамери, Г.; Кортеcе, М.; Айметти, М.; Прети, Г. Организация соединительной ткани барьера вокруг абатментов имплантатов с длительной нагрузкой у человека. Clin. Oral Implant. Res. 2002, 13, 460–464. [CrossRef]
- Родригес, Х.; Навахас, А.; Вела, Х.; Фортуно, А.; Хименес, Х.; Невинс, М. Расположение волокон периимплантной соединительной ткани вокруг имплантатов с конусными абатментами и его связь с подлежащей костью: Гистологическое исследование на человеке. Int. J. Periodontics Restor. Dent. 2016, 36, 533–540. [CrossRef]
- ван Экерен, П.; ван Эльсас, П.; Тахмасеб, А.; Висмейер, Д. Влияние начальной толщины слизистой на изменения краевой кости в аналогичных макрогеометрических имплантатах: Проспективное рандомизированное клиническое испытание. Clin. Oral Implant. Res. 2017, 28, 214–218. [CrossRef]
- Мишра, С.К.; Чоудхари, Р.; Кумари, С. Микропроницаемость на различных интерфейсах абатмента имплантата: Систематический обзор. J. Clin. Diagn. Res. 2017, 11, ZE10–ZE15. [CrossRef]
- Талларико, М.; Канулло, Л.; Канева, М.; Озкан, М. Микробная колонизация на интерфейсе имплантат-абатмент и ее возможное влияние на периимплантит: Систематический обзор и мета-анализ. J. Prosthodont. Res. 2017, 61, 233–241. [CrossRef]
- Шрёдер, Х.Е.; Листгартен, М.А. Десневые ткани: Архитектура пародонтальной защиты. Пародонтология 2000 1997, 13, 91–120. [CrossRef]
- Шупбах, П.; Глаузер, Р. Архитектура защиты человеческой периимплантной слизистой: Гистологическое исследование. J. Prosthet. Dent. 2007, 97 (Suppl. S6), S15–S25, Ошибка в J. Prosthet. Dent. 2008, 99, 167. [CrossRef]
- Джеймс, Р.А.; Шульц, Р.Л. Гемидесмосомы и адгезия клеток соединительной эпителии к металлическим имплантатам — предварительный отчет. J. Oral Implantol. 1974, 4, 294–302.
- Ацсута, И.; Аюкава, Я.; Кондо, Р.; Оширо, В.; Мацуура, Я.; Фурухаси, А.; Цукияма, Я.; Кояно, К. Уплотнение мягких тканей вокруг зубных имплантатов на основе гистологической интерпретации. J. Prosthodont. Res. 2016, 60, 3–11. [CrossRef]
- Берлунд, Т.; Абрахамссон, И.; Веландер, М.; Ланг, Н.П.; Линдхе, Дж. Морфогенез периимплантной слизистой: Экспериментальное исследование на собаках. Clin. Oral Implant. Res. 2007, 18, 1–8. [CrossRef] [PubMed]
- Морашини, В.; Пубель, Л.д.С.; Феррейра, В.; Барбоза, Е.д.С. Оценка выживаемости и успеха зубных имплантатов, сообщенных в продольных исследованиях с периодом наблюдения не менее 10 лет: Систематический обзор. Int. J. Oral Maxillofac. Surg. 2015, 44, 377–388. [CrossRef]
- Атиеh, М.А.; Ибрагим, Х.М.; Атиеh, Х.А. Платформенное переключение для сохранения краевой кости вокруг зубных имплантатов: Систематический обзор и мета-анализ. J. Periodontol. 2010, 81, 1350–1366.
- Батели, М.; Атт, В.; Струб, Дж.Р. Конфигурации шейки имплантата для сохранения уровня краевой кости: Систематический обзор. Int. J. Oral Maxillofac. Implant. 2011, 26, 290–303.
- Шварц, Ф.; Хегевальд, А.; Беккер, Дж. Влияние соединения имплантат-абатмент и позиционирования обработанного воротника/микрозазора на изменения уровня краевой кости: Систематический обзор. Clin. Oral Implant. Res. 2014, 25, 417–425. [CrossRef]
- Тетэ, С.; Мастрангело, Ф.; Бьянки, А.; Циззари, В.; Скарана, А. Ориентация коллагеновых волокон вокруг обработанных шейок титанов и циркониевых зубных имплантатов: Исследование на животных. Int. J. Oral Maxillofac. Implant. 2009, 24, 52–58.
- Шварц, Ф.; Хертен, М.; Загер, М.; Билинг, К.; Скулеан, А.; Беккер, Дж. Сравнение естественно возникающих и индуцированных лигатурой дефектов кости периимплантита у людей и собак. Clin. Oral Implant. Res. 2007, 18, 161–170, Ошибка в Clin. Oral Implant. Res. 2007, 18, 397. [CrossRef] [PubMed]
- Виньолетти, Ф.; Йоханссон, С.; Альбректссон, Т.; Де Санктис, М.; Роман, Ф.С.; Санз, М. Раннее заживление имплантатов, помещенных в свежие экстракционные лунки: Экспериментальное исследование на собаке бигле. Образование новой кости. J. Clin. Periodontol. 2009, 36, 265–277. [CrossRef] [PubMed]
- Лю, Й.; Ван, Дж. Влияние микрозазора и микродвижения интерфейса имплантат-абатмент на потерю краевой кости вокруг шейки имплантата. Arch. Oral Biol. 2017, 83, 153–160. [CrossRef] [PubMed]
- Родригес, Х.; Вела, Х.; Кальво-Гуирадо, Дж.Л.; Нарт, Дж.; Степперт, К.Ф.Э. Влияние платформенного переключения на ориентацию коллагеновых волокон и резорбцию кости вокруг зубных имплантатов: Предварительное гистологическое исследование на животных. Int. J. Oral Maxillofac. Implant. 2012, 27, 1116–1122.
- Нельсон, С.М. Геометрический контроль морфогенеза тканей. Biochim. Biophys. Acta BBA Mol. Cell Res. 2009, 1793, 903–910. [CrossRef] [PubMed]
- Лопес-Лопес, П.Ж.; Марек-Буэно, Дж.; Бокете-Кастро, А.; Агиляр-Сальватьера Рая, А.; Мартинес-Гонсалес, Дж.М.; Кальво-Гуирадо, Дж.Л. Влияние абатментов для заживления различного размера и анатомической формы, помещенных сразу в экстракционные лунки, на твердые и мягкие ткани периимплантата. Пилотное исследование на собаках фоксхаунд. Clin. Oral Implant. Res. 2016, 27, 90–96. [CrossRef]
- Ковани, У.; Джаммаринаро, Е.; Ди Пьетро, Н.; Бонкомпагни, С.; Растелли, Г.; Ромаско, Т.; Веласко-Ортега, Е.; Хименес-Герра, А.; Иеззи, Г.; Пиаттели, А.; и др. Анализ коллагеновых волокон в периимплантных мягких тканях вокруг двух различных абатментов с помощью электронной микроскопии (EM). J. Funct. Biomater. 2023, 14, 445. [CrossRef]
- Беллони, А.; Беллони, А.; Фурлани, М.; Фурлани, М.; Греко, С.; Греко, С.; Нотарстефано, В.; Нотарстефано, В.; Про, С.; Про, С.; и др. Лейомиома матки как полезная модель для раскрытия морфометрического и макромолекулярного состояния коллагена и его нарушения при фиброзных заболеваниях: Экспериментальное исследование на человеке. Biochim. Biophys. Acta BBA Mol. Basis Dis. 2022, 1868, 166494. [CrossRef]
- Карьялайнен, В.-П.; Кестиля, И.; Финнила, М.; Фолькесон, Е.; Туркевич, А.; Оннерфьорд, П.; Хьюз, В.; Тьёрнстранд, Дж.; Энглунд, М.; Саараккала, С. Количественный трехмерный анализ ориентации коллагена заднего рога человеческого мениска в состоянии здоровья и остеоартрита с использованием микро-компьютерной томографии. Osteoarthr. Cartil. 2021, 29, 762–772. [CrossRef]
- Томаси, Ч.; Тессароло, Ф.; Каола, И.; Веннстрём, Дж.; Нолло, Г.; Берглунд, Т. Морфогенез периимплантной слизистой пересмотрен: Экспериментальное исследование на людях. Clin. Oral Implant. Res. 2014, 25, 997–1003. [CrossRef]