Использование вакуумной плазменной обработки поверхности для улучшения заживления и регенерации костной ткани при сохранении лунки и GBR: серия случаев с гистологическим анализом
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Цель: Оценить клинические и гистологические результаты у пациентов, получивших коронки на имплантатах после обработки поверхности биоматериалов вакуумной плазмой (VPST), используемых для сохранения лунки (SP) и направленной регенерации кости (GBR).
Материалы и методы: Это исследование было спроектировано как серия случаев. Пациенты, нуждающиеся в удалении зуба и сохранении лунки или направленной регенерации кости, были включены в исследование. Техника сохранения лунки была выполнена после удаления зуба с использованием гетерологичного коллагенового костного трансплантата и коллагеновой ксеноматричной структуры, оба активированные вакуумной плазмой. В то же время была проведена двухступенчатая горизонтальная аугментация гребня с использованием индивидуальной титановый сетки и смеси аутологичных (необработанных) и гетерологичных (обработанных) костных трансплантатов, а также обработанной коллагеновой мембраны. ACTILINK Reborn с универсальным держателем Vortex (Plasmapp Co., Ltd., Дэеджон, Республика Корея) использовался для обработки всех биоматериалов. Показатели результатов включали неудачи имплантатов и протезов, осложнения и гистологическое исследование. Образцы мягких и твердых тканей были собраны в момент установки имплантата только у пациентов, прошедших лечение SP.
Результаты: Всего было пролечено шесть пациентов — трое с сохранением лунки и отсроченной установкой имплантата, и трое с поэтапной GBR. Ни один имплантат или протез не потерпели неудачу. Одна индивидуальная титановая сетка сломалась после плазменной обработки, что потребовало замены на мембрану из перикарда. Других осложнений не возникло. Гистологический анализ через три месяца после операции показал хорошо васкуляризованную новообразованную кость на разных стадиях созревания с интегрированными частицами костной пересадки, в то время как мягкие ткани выглядели физиологически структурированными.
Заключение: VPST может повысить гидрофильность биоматериалов, способствуя благоприятным результатам заживления в SP и GBR. Необходимы дальнейшие рандомизированные контролируемые испытания с соответствующими расчетами размера выборки для подтверждения этих предварительных результатов.
Введение
Оральная имплантология признана безопасной и эффективной клинической методологией, способной обеспечить долгосрочный успех в оральной реабилитации. Корни этой медицинской области восходят к началу 1950-х годов, когда доктор Пер-Ингвар Бранемарк, шведский ортопед, сделал революционные открытия, проводя ортопедические эксперименты на ногах кроликов. С тех пор эта область быстро развивалась, движимая достижениями в области биоматериалов и хирургических техник, что привело к улучшению результатов и повышению удовлетворенности пациентов.
В настоящее время имплантат считается остеоинтегрированным, когда отсутствует прогрессивное относительное движение между имплантатом и окружающей костью, что указывает на прямой контакт и стабильность. Первичная стабильность в значительной степени зависит от механического взаимозачета между поверхностью имплантата и костной тканью хозяина, что зависит от таких факторов, как плотность кости, дизайн имплантата и хирургическая техника.
Достижение и поддержание долгосрочной остеоинтеграции является сложной задачей и может быть затронуто различными биологическими и механическими факторами. К ним относятся системное здоровье пациента, локальное качество кости, условия нагрузки на имплантат и характеристики поверхности имплантата. Недавние исследования показывают, что модификация поверхностей имплантатов для повышения их биологической совместимости может значительно улучшить результаты остеоинтеграции. Были исследованы и внедрены многочисленные методы обработки поверхности для улучшения биологических характеристик поверхности имплантатов, поддерживающих процесс остеоинтеграции как для краткосрочного, так и для долгосрочного успеха. Среди них шероховатость поверхности и гидрофильность особенно важны для достижения высокого контакта кости с имплантатом (BIC). Эти характеристики поверхности предназначены для обеспечения лучшей стабильности в процессе заживления и позволяют быстрее нагружать имплантат, ускоряя механизм остеоинтеграции и способствуя более сильному и быстрому образованию кости.
Для повышения остеокондуктивности и остеоиндуктивности биоматериалов для регенерации костей было показано, что модификация их поверхности способствует адгезии клеток, пролиферации и образованию новой кости. Эти обработки включают аддитивные модификации, такие как покрытия, или субтрактивные модификации, включая травление, пескоструйную обработку и другие. Среди различных обработок биоматериалов, направленных на улучшение остеоинтеграции, плазменная обработка продемонстрировала значительные улучшения в адгезии клеток за счет изменения шероховатости поверхности и смачиваемости. Плазменная активация изменяет поверхность, вводя функциональные группы, увеличивая поверхностную энергию и усиливая гидрофильность. Это приводит к снижению угла контакта между биологическими жидкостями и поверхностью имплантата, облегчая диффузию остеобластных клеток без оставления остатков после обработки. Кроме того, плазменная обработка вызывает изменения в физико-химических свойствах, включая свободную поверхностную энергию, содержание углеводородов и наличие функциональных гидроксильных групп. Недавние достижения в технологии плазмы позволили разработать системы низкого давления, способные равномерно обрабатывать сложные геометрии имплантатов. Эти системы предлагают точный контроль над параметрами обработки, такими как мощность, состав газа и время экспозиции, что позволяет осуществлять индивидуальные модификации поверхности для повышения биосовместимости. Однако, несмотря на многообещающие результаты in vitro, клинические данные о плазменно обработанных биоматериалах остаются ограниченными и требуют дальнейшего изучения. Несмотря на многообещающие результаты из исследований in vitro, клинические данные о эффективности плазменно обработанных биоматериалов остаются ограниченными, что требует дальнейшего изучения.
Целью этого клинического аудита является оценка клинических и гистологических результатов пациентов, которые получают коронки на имплантатах после VPST биоматериалов, используемых для сохранения альвеол (SP) и направленной регенерации кости (GBR). Результаты этого исследования предназначены для информирования и потенциального уточнения существующих клинических протоколов, что способствует более точному и предсказуемому подходу в оральной реабилитации. Таким образом, этот клинический аудит может служить исследованием, подтверждающим концепцию.
Материалы и методы
Это исследование было разработано как исследование серии случаев фазы IV, с использованием материалов и устройств, одобренных CE, в рамках обычной профессиональной практики и без дополнительных рисков. Все случаи были выполнены в частной клинике в Риме, Италия, а данные были оценены в Департаменте медицины, хирургии и фармацевтики Университета Сассари, Италия. Исследование соответствовало принципам Хельсинкской декларации 2013 года и принципам хорошей медицинской практики. Медицинские данные были анонимизированы, чтобы пациенты не могли быть идентифицированы, и было получено освобождение этического комитета от согласия на серию случаев (номер отчета 41/1.6; выпущен 21 мая 2025 года).
Пациенты, нуждающиеся в безболезненном удалении безнадежного зуба и процедуре сохранения лунки, а также пациенты, нуждающиеся в процедуре направленной регенерации кости перед установкой имплантата, были включены в это исследование.
Критерии включения:
- Пациенты с как минимум одним безнадежным зубом в нижней или верхней челюсти, с неповрежденной постэкстракционной альвеолой, способные понять и дать информированное согласие, считались подходящими для включения в процедуру сохранения лунки; или любые пациенты, которым требовалась одиночная реставрация на имплантате и поэтапная горизонтальная направленная регенерация кости (дефект класса IV по классификации Коуэда и Хоуэлла) как в нижней, так и в верхней челюсти. Безнадежный зуб определялся как зуб с тяжелыми структурными, пародонтальными или эндодонтическими повреждениями, которые не могли быть предсказуемо вылечены или сохранены и рекомендованы к удалению. Общие критерии для классификации зуба как безнадежного включают: тяжелую пародонтальную болезнь с потерей ≥75% костной ткани, подвижность (III степень), или вовлечение в III классе разветвления; обширный кариес или переломы, делающие зуб нереставрируемым; неудачное эндодонтическое лечение с постоянной инфекцией; и травму, приводящую к нежизнеспособным корням или сильному смещению.
- Возраст 18 лет и старше и способность дать информированное согласие.
- Курильщики были классифицированы как: (1) некурящие; (2) умеренные курильщики (курящие до 10 сигарет в день); и (3) тяжелые курильщики (курящие более 11 сигарет в день). Тяжелые курильщики были исключены, в исследование были включены только категории 1 и 2.
- Биотип был классифицирован как: тонкий (≤1 мм), средний (>1–<2 мм) или толстый (≥2 мм). Критерии исключения:
- Общие противопоказания к имплантации.
- Пациенты, подвергшиеся облучению в области головы и шеи.
- Иммуносупрессивные или иммунокомпрометированные пациенты.
- Пациенты, получающие лечение или находящиеся на лечении внутривенными аминокислотными бисфосфонатами.
- Пациенты с нелеченым пародонтитом.
- Пациенты с плохой гигиеной полости рта и мотивацией.
- Неконтролируемый диабет.
- Тяжелые курильщики (более 11 сигарет в день).
- Беременность или кормление грудью.
- Злоупотребляющие наркотиками.
- Психиатрические проблемы или нереалистичные ожидания.
- Отсутствие антагониста, окклюдирующего зубного ряда в области, предназначенной для установки имплантата.
- Пациенты с инфекцией и/или воспалением в области, предназначенной для установки имплантата.
- Пациенты, участвующие в других исследованиях, если настоящее протокол не может быть должным образом соблюден.
- Пациенты, направленные только для установки имплантата и не могут быть наблюдаемы в центре лечения.
- Пациенты, которые не могут быть наблюдаемы в течение 5 лет.
2.1. Процедура сохранения альвеолярной ячейки
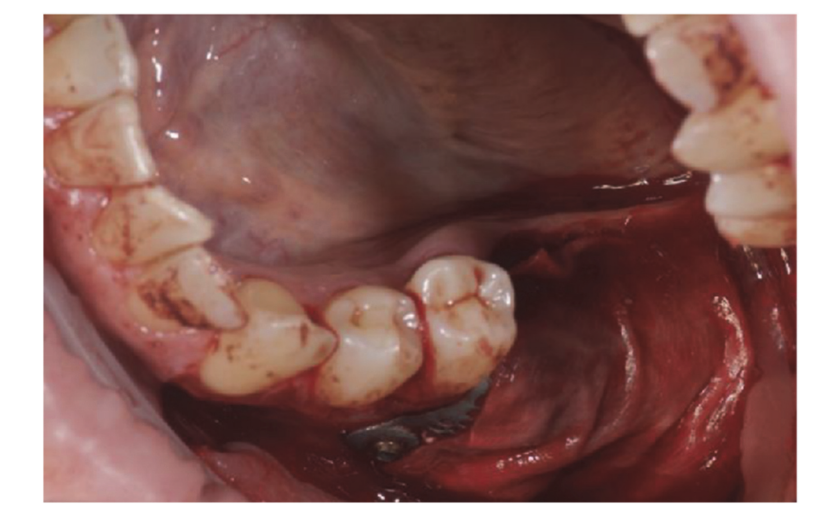
Пациенты, соответствующие критериям включения/исключения (Рисунок 1), были тщательно клинически обследованы для оценки состояния зубного кариеса и здоровья пародонта. Перед процедурой сохранения альвеолярной ячейки пациенты прошли предоперационное КТ с конусным лучом для количественной оценки объема кости. После подтверждения соответствия критериям и получения информированного согласия была проведена комплексная оральная оценка для оценки общего состояния полости рта и выявления любых патологий, требующих лечения перед сохранением альвеолы и имплантацией. Примерно за 10 дней до сохранения альвеолы и установки имплантата всем пациентам была проведена профессиональная гигиена полости рта, включая при необходимости дебридмент. Профилактическое назначение антибиотиков включало 2 г амоксициллина за час до операции или 600 мг клиндамицина в случае аллергии на пенициллин. Пациенты также полоскали рот 0,2% раствором хлоргексидина в течение одной минуты перед любой хирургической процедурой. Все хирургические вмешательства проводились под местной анестезией с использованием артикаина и адреналина (1:100,000). Внутривенная седация была по желанию. Безоперационное удаление зуба без поднятия лоскута было выполнено, за которым последовало кюретаж альвеолы, оценка целостности альвеолы и сохранение ячейки (Рисунок 2). Альвеолы после удаления заполнялись гетерологичной костной заменой с использованием натуральных гранул конской кости (Bioactiva, Arcugnano, Италия) и покрывались XC Collagen Xenomatrix (Bioteck S.p.A, Виченца, Италия). Обработка поверхности вакуумным плазменным методом проводилась с использованием машины ACTILINK reborn (Activelink reborn, Plasmapp Co., Ltd., Дэеджон, Республика Корея) с индивидуальным держателем (Рисунок 3), согласно опубликованному протоколу. Время цикла обработки поверхности вакуумным плазменным методом, названным режимом Vortex Plasma, составило 30 секунд.
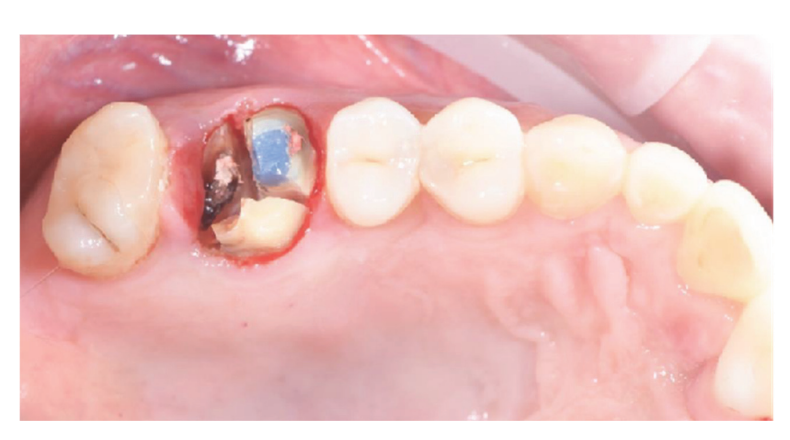
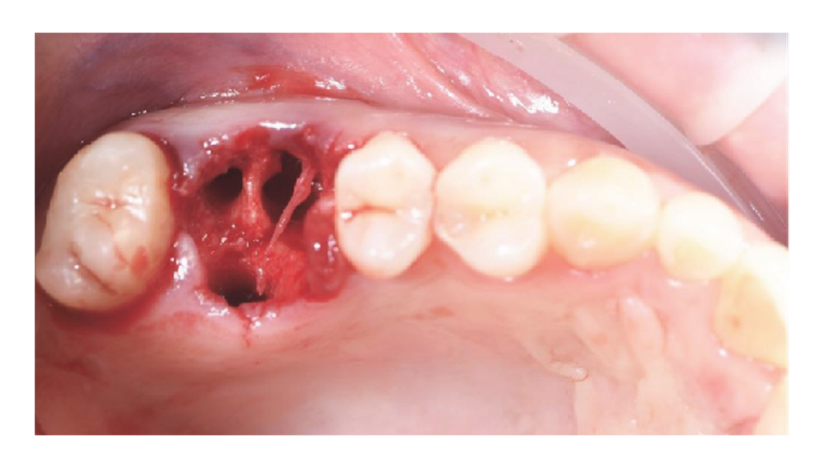

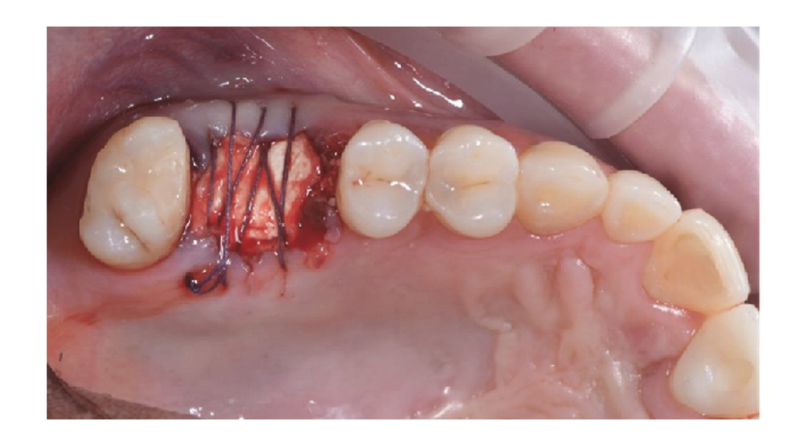
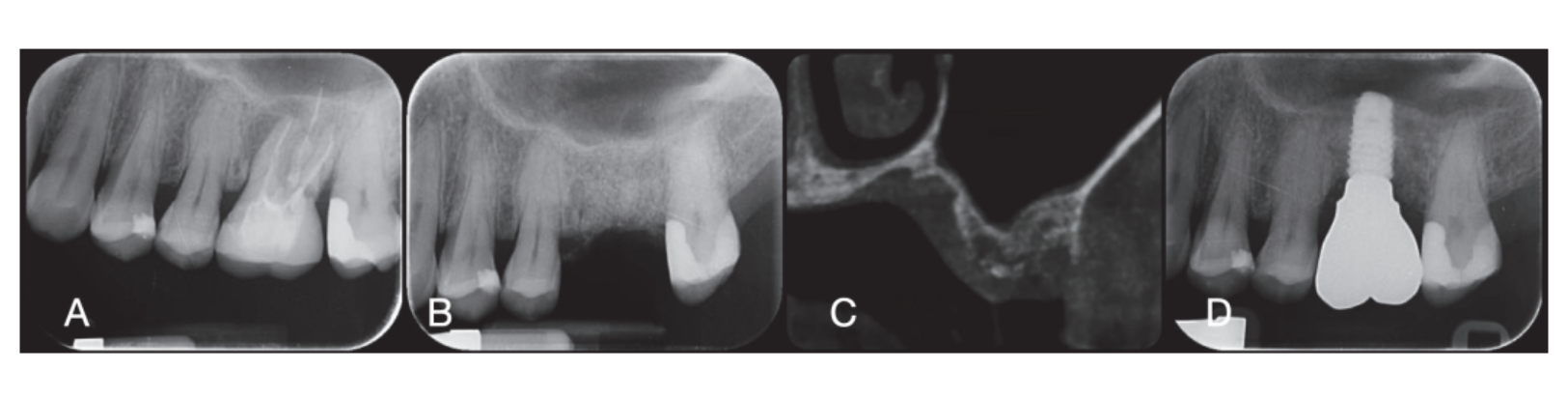
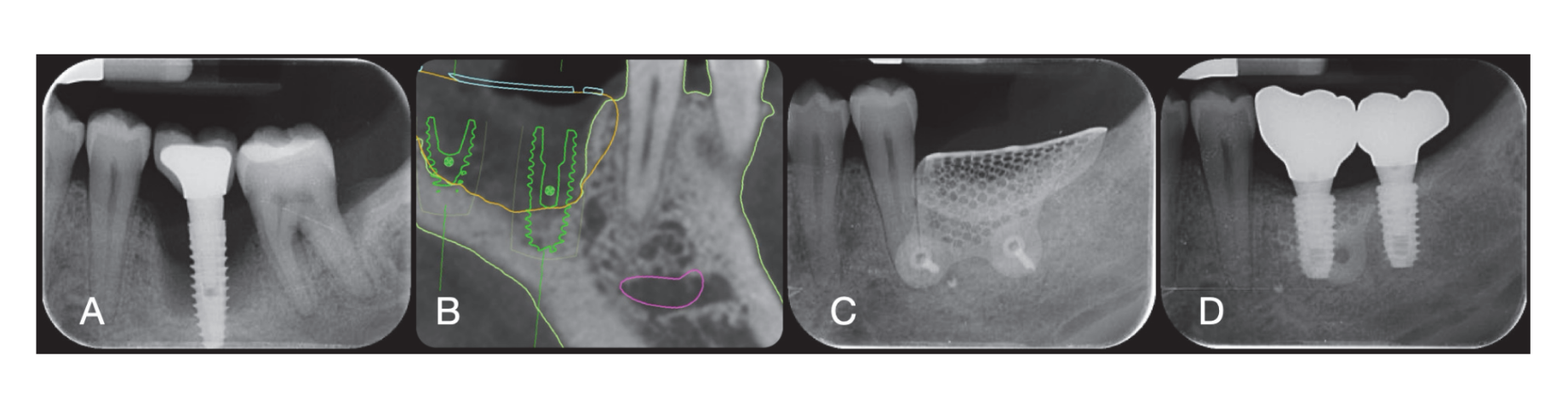
Хирургические участки были закрыты простыми швами Vicryl 4.0 (Revello S.p.A, Верона, Италия) (Рисунок 4). После периода заживления в три месяца была выполнена установка имплантата (Osstem Implant, Сеул, Республика Корея) в соответствии с инструкциями производителя. Гистологические образцы тканей были собраны непосредственно перед подготовкой места для имплантата (см. разделы 2.3 и 2.4). Места для имплантатов были подготовлены вручную, без хирургического шаблона, с использованием сверл увеличивающегося диаметра. Качество кости субъективно классифицировалось как твердая, средняя или мягкая. Момент затяжки был установлен на 35 Нсм во время установки имплантата. Имплантаты были установлены на 1,5 мм ниже неповрежденной щечной кости, и был принят протокол немедленной нагрузки с минимальным моментом затяжки 35 Нсм. Послеоперационное обезболивание с использованием ибупрофена 600 мг назначалось по мере необходимости. Все пациенты находились под строгим наблюдением для оценки полного заживления. Через три-четыре месяца после немедленной нагрузки были сняты окончательные слепки, и в течение месяца была установлена коронка без металла, поддерживаемая имплантатом, с винтовым креплением. Периапикальные рентгенограммы были получены в момент установки имплантата (Рисунок 5).
2.2. Постоперационные инструкции и протезирование после сохранения лунки
Мягкая диета была рекомендована на 30 дней в случае немедленной нагрузки. Ибупрофен (400 мг) был назначен для приема 2–4 раза в день во время еды, но пациентам было указано не принимать его при отсутствии боли (в случаях аллергии или проблем с желудком вместо этого был назначен 1 г парацетамола). Кроме того, была рекомендована 0,2% раствор хлоргексидина для полоскания рта на 1 минуту дважды в день в течение 14 дней. Пациентам не разрешалось носить съемные протезы, которые могли бы нагружать исследуемые имплантаты. Швы были удалены через 7–10 дней, и были даны инструкции по гигиене полости рта.
В момент установки имплантатов были установлены временные реставрации с немедленной нагрузкой. После остеоинтеграции (8 недель) временные реставрации были изменены в соответствии с управлением мягкими тканями. Через 3–4 месяца был снят окончательный цифровой или аналоговый слепок. Окончательные реставрации были установлены в течение месяца после проверки стабильности отдельных имплантатов. Жевательная поверхность находилась в легком контакте с противоположной челюстью. Были сделаны периапикальные рентгенограммы и клинические фотографии исследуемых имплантатов (Рисунок 5). Если уровни периимплантной маргинальной кости были неразборчивы, была сделана новая рентгенограмма, и были даны инструкции по гигиене полости рта.
2.3. Извлечение биопсии
Через три месяца была проведена установка имплантата (Osstem Implant, Сеул, Республика Корея) в соответствии с инструкциями производителя. Во время подготовки места для имплантата были получены биопсии мягких и твердых тканей с использованием мукотома диаметром 5 мм (внешний диаметр) для мягкой ткани и трефинного сверла диаметром 3,0 мм (внешний диаметр) для образцов кости. Образцы твердых тканей фиксировались в 10% нейтральном буферном формалине, а мягкие ткани - в 4% нейтральном буферном формалине для гистологического исследования.
2.4. Обработка образцов и гистологический анализ
Образцы твердых тканей были обезвожены с использованием восходящей серии этанола. После обезвоживания образцы были инфильтрированы метакрилатной смолой и затем вмонтированы. Блоки были нарезаны с использованием алмазного лезвия и дополнительно уменьшены до толщины около 100 мкм. Срезы были смонтированы на пластиковых слайдах, приклеены и окрашены с использованием Толуидинового синего и Желтого пиронина.
Образцы мягких тканей, фиксированные формалином, были инкапсулированы в парафин. Были получены гистологические слайды, окрашенные гематоксилином и эозином, трихромом Мэллори и Сириусом Ред. Слайды были качественно исследованы под световым оптическим микроскопом (Nikon Eclipse 80i, Nikon, Токио, Япония) и высокоразрешающим сканером при различных увеличениях (Hamamatzu NanoZoomer Series S60, Hamamatзу Фотоникс, Хамамацу, Япония). Кроме того, образцы, окрашенные Сириусом Ред, были исследованы под поляризованным светом для оценки организации коллагеновых волокон (Nikon Eclipse 80i, Nikon, Токио, Япония).
2.5. Процедура GBR
Пациенты были оценены на соответствие критериям участия в исследовании. Для каждого пациента был получен предоперационный КТ-сканирование для количественной оценки объема кости. Пациенты, у которых не было достаточного объема кости для установки имплантата, были проинформированы о деталях исследования и подписали форму информированного согласия на участие в исследовании. После подтверждения соответствия критериям и получения информированного согласия была проведена тщательная оральная проверка для оценки общего состояния здоровья и выявления любых оральных патологий, требующих лечения перед направленной регенерацией кости (GBR) и реабилитацией с помощью имплантатов. За десять дней до GBR и установки имплантатов все пациенты прошли профессиональные процедуры гигиены полости рта, включая при необходимости дебридмент. Удаленные зубы на операционных участках были экстрагированы за восемь недель до GBR и установки имплантатов. Пациенты получили 2 г амоксициллина (Zimox, Pfizer, Рим, Италия) за час до операции, затем по 1 г дважды в день в течение двух недель. В случаях аллергии на пенициллин вводили 600 мг клиндамицина с тем же послеоперационным режимом. Непосредственно перед операцией пациенты полоскали рот 0,2% раствором хлоргексидина (Curasept, Curaden Healthcare, Саронно, Италия) в течение одной минуты. Хирургическая процедура проводилась под сознательной седацией (Диазепам, Hoffmann-La Roche, Базель, Швейцария) и местной анестезией (Septanest с адреналином 1/100,000, Septodont, Сен-Мор-де-Фоссе, Франция). Срединный разрез (слегка смещенный в буковую сторону) был выполнен в остаточной кератинизации ткани с использованием хирургического лезвия № 15, за которым следовали два двусторонних вертикальных разреза на расстоянии одного или двух зубов. Полноценный лоскут был поднят за пределы мукогингивального соединения, как минимум на 5 мм за пределы костного дефекта, и место получения было тщательно очищено от остатков мягких тканей. Автогенная кость была собрана из запланированного места установки имплантата или из области нижней челюсти за молярами с использованием минимально инвазивного устройства для забора кортикальной кости (Micross, Meta, Реджио Эмилия, Италия). Костный дефект затем был заполнен 50:50 смесью автогенной кости и гетерологичного костного заменителя (натуральные гранулы конской кости, Bioactiva, Аркуняно, Италия), предварительно обработанными плазмой Vortex с использованием держателя материала. Затем была установлена плазмообработанная титановая сетка, спроектированная с помощью CAD/CAM (Exocad DentalCAD, Exocad, Дармштадт, Германия), индивидуально адаптированная по контуру и форме контралатеральной области (New Ancorvis Srl, Баргельлино, Кальдерара ди Рено, Италия), чтобы покрыть и защитить место пересадки. Индивидуальная титановая сетка была зафиксирована двумя-тремя заранее запланированными костными винтами и покрыта плазмообработанной мембраной перикарда (Bioactiva, Аркуняно, Италия) (Рисунки 6 и 7). Закрытие лоскута без натяжения было достигнуто с использованием швов Vicryl 4.0. После операции пациенты получили 80 мг кетопрофена (Oki, Dompé, Милан, Италия) и 4 мг/день бетаметазона (Bentelan, Glaxo, Верона, Италия) в течение двух дней. Им было рекомендовано полоскать рот 0,2% хлоргексидином (Curasept) три раза в день в течение двух недель и употреблять только мягкую пищу в течение 30 дней. Швы были удалены через 14-21 день. Базовые периапикальные рентгенограммы были сделаны в конце процедуры, во время повторного открытия, при доставке протеза и ежегодно после этого. Для обработки всех биоматериалов использовался ACTILINK Reborn с универсальным держателем Vortex (Plasmapp Co., Ltd., Республика Корея), как сообщалось ранее.

Шесть месяцев после GBR имплантаты были установлены в соответствии со стандартным протоколом производителя. После поднятия лоскута места для имплантатов были подготовлены с использованием сверл увеличивающегося диаметра, качество кости субъективно классифицировалось как жесткое, среднее или мягкое. Момент затяжки был установлен на 25 Нсм во время установки имплантатов. Имплантаты (Osstem TSIII SOI, Osstem Implant CO., LTD., Сеул, Республика Корея) были установлены в заранее запланированные протезные позиции. Поскольку имплантаты имели активированную поверхность, дополнительная обработка Vortex Plasma не проводилась. Имплантаты были установлены на уровне гребня или немного ниже, либо вручную, либо с использованием хирургического шаблона CAD/CAM. Через четыре месяца после установки имплантатов они были открыты, и мягкие ткани обрабатывались по мере необходимости. Затем были сняты цифровые или аналоговые слепки, и временные реставрации были предоставлены в соответствии с требованиями управления мягкими тканями. Через два-четыре месяца были установлены окончательные монолитные коронки из циркония, приклеенные на Ti-link, после подтверждения стабильности каждого имплантата. Жевательные поверхности были спроектированы так, чтобы находиться в легком контакте с противоположными зубами. Перипикальные рентгенограммы и клинические изображения были сделаны на этапе GBR, установки имплантатов, временных и окончательных реставраций (Рисунок 8). Инструкции по гигиене полости рта были предоставлены на каждом контрольном визите. Профессиональная гигиеническая поддержка была запланирована каждые шесть месяцев после окончательной нагрузки и по мере необходимости в течение протезных этапов. Зубочелюстное соотношение оценивалось на каждом контрольном приеме.
2.6. Показатели результатов
Основными результатами были:
- Неудача имплантата, определяемая как подвижность, инфекция, перелом и/или любая другая механическая или биологическая проблема, которая привела к его удалению.
- Неудача протеза считалась в любое время, когда его нужно было заменить.
- Любые биологические (например, устойчивая к лекарствам боль, отек, чрезмерная MBL, гнойное выделение и т.д.) и/или технические (например, перелом облицовочного материала и/или каркаса, ослабление винта и т.д.) осложнения фиксировались в ходе наблюдения.
Вторичным результатом было оценить регенерацию кости с помощью качественного гистологического анализа, оценивая степень минерализации кости.
Результаты
3.1. Клинические результаты
Всего было пролечено шесть пациентов. Три пациента с безнадежными зубами и неповрежденными лунками после удаления зуба прошли процедуру сохранения лунки и отсроченную (на три месяца) установку имплантата, в то время как другие три пациента с горизонтальными дефектами класса IV получили установку имплантатов в сочетании с направленной регенерацией кости. Шесть гистологических образцов у трех пациентов были собраны в момент установки имплантата в группе сохранения лунки. У каждого пациента мягкие и твердые ткани были собраны через три месяца после процедуры сохранения лунки, одновременно с хирургией имплантата, как описано. Всего было собрано шесть образцов и отправлено на гистологический анализ (три образца мягкой ткани и три образца кости).
Всего было пролечено шесть пациентов. Все пациенты были женщины в возрасте в среднем 50 лет (в диапазоне от 37 до 63). Ни один из пациентов не курил, и все пациенты были в хорошем состоянии здоровья (ASA 1). Все пациенты находились под наблюдением не менее 1 года после установки протеза, без выбытия.
Ни один из имплантатов или протезов не потерпел неудачу в течение года после установки имплантатов. У одного пациента, который прошел направленную регенерацию кости, титановая сетка сломалась после плазменной обработки. У этого пациента использовалась перикардиальная мембрана, которая была зафиксирована с помощью тегов. Других биологических или технических осложнений не наблюдалось.
У одного пациента в группе сохранения лунки, на момент установки имплантата, первичная стабильность составляла около 15–20 Ncm. Тем не менее, имплантат остеоинтегрировался, и финальная коронка была установлена.
3.2. Гистологическая оценка
Три месяца после операции по сохранению лунки, ни один из гистологических образцов не показал признаков воспаления или некроза.
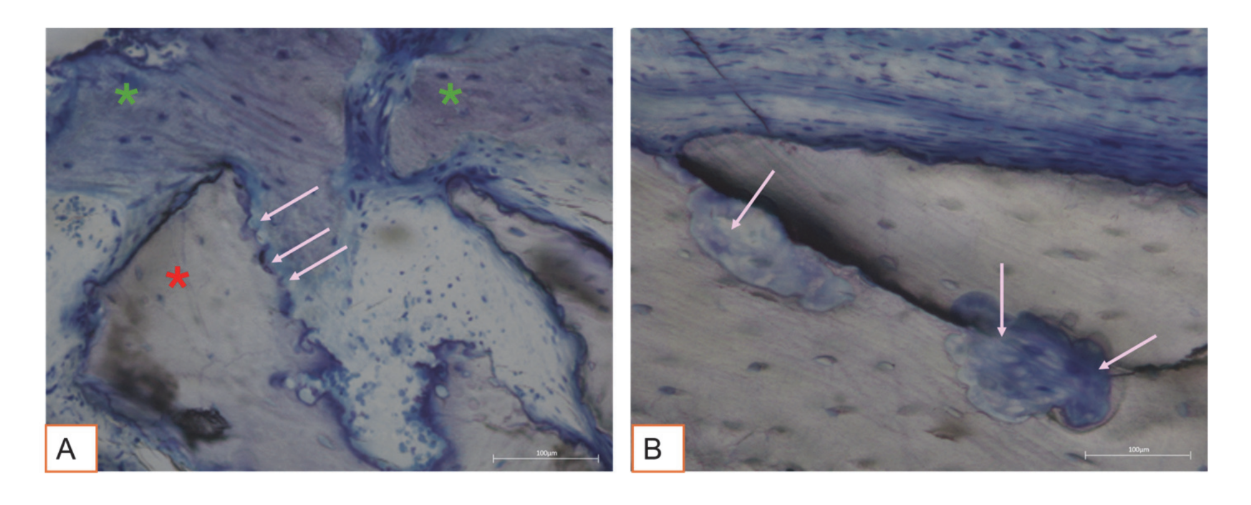
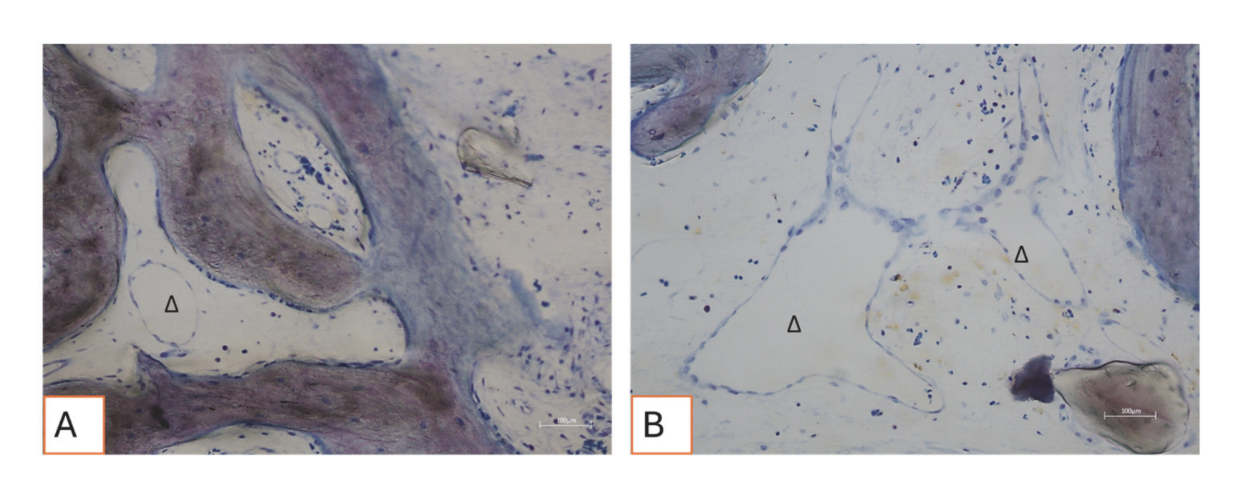
Все образцы твердых тканей продемонстрировали новообразованную кость, проходящую минерализацию на разных стадиях (Рисунок 9), которая окружала несколько частиц костной трансплантата, характеризующихся многочисленными поверхностными лакунами, соответствующими лакунам резорбции остеокластов (Рисунок 10). Новообразованная кость, по-видимому, была богата активными костными клетками, а именно клетками, подобными остеобластам, выровненными в линиях депонирования и секретирующими остеоидную матрицу, и незрелыми клетками, подобными остеоцитам, обитающими в лакунах волокнистой кости (Рисунок 9). Вокруг участков твердых тканей наблюдалась рыхлая соединительная ткань, которая, казалось, была богата клетками и кровеносными сосудами (Рисунок 11).
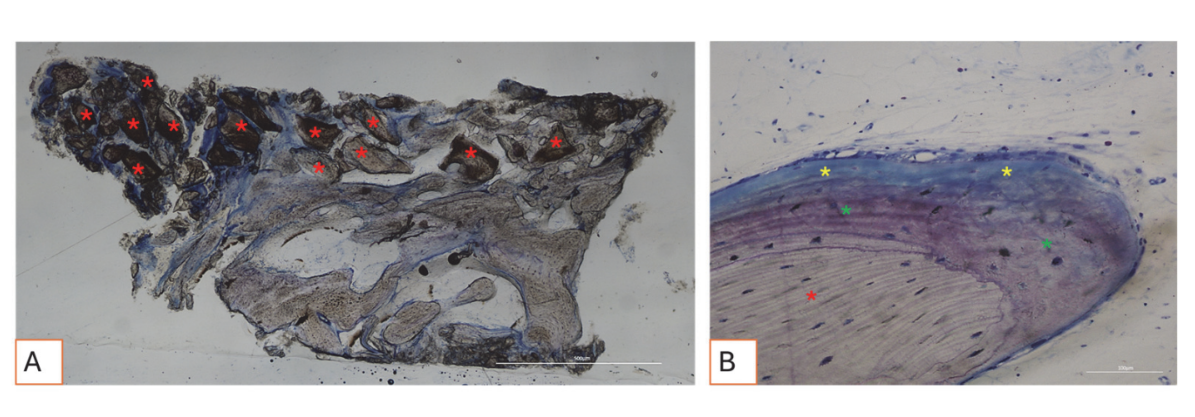
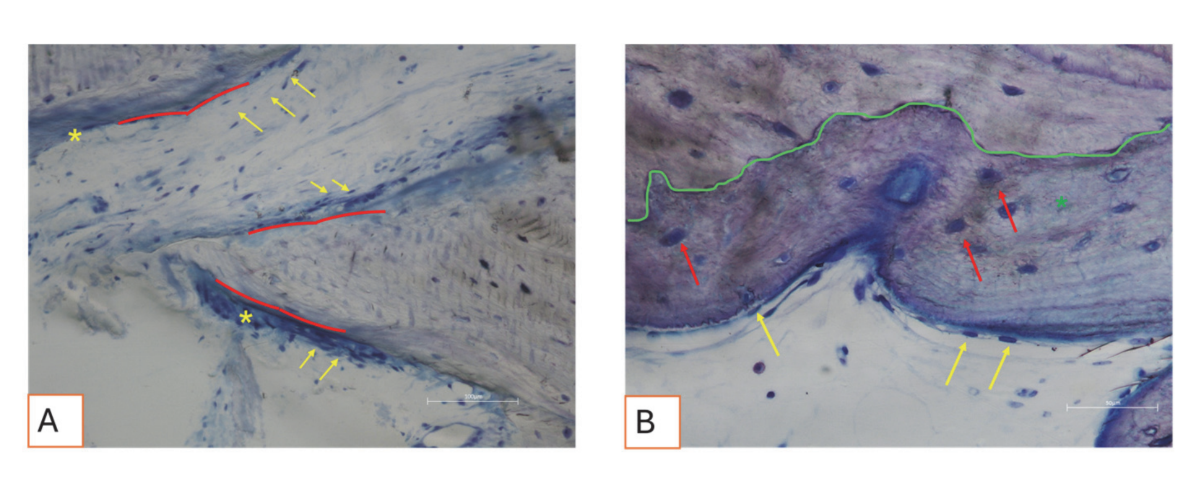
Мягкие ткани имели физиологическую морфологию. Соединительный компонент был слегка фиброзным, что соответствует послеоперационному заживлению (Рисунки 12 и 13).

Обсуждение
Это исследование изучало влияние VPST на биоматериалы, используемые в процедурах SP и GBR, оценивая его влияние на гидрофильность поверхности и результаты заживления. Результаты показывают, что обработка плазмой улучшает биологическую совместимость биоматериалов, способствуя эффективной остеоинтеграции и благоприятным реакциям заживления.
Гистологический анализ через три месяца не показал признаков некроза, воспаления или рубцевания. Как мягкие, так и твердые ткани продемонстрировали физиологическую архитектуру с хорошей васкуляризацией. Восстановленные после операции твердые ткани показали наличие активных остеобластов, секретирующих остеоидную матрицу и новообразованную костную ткань, что соответствует ожидаемым срокам заживления. Эти результаты согласуются с предыдущими исследованиями, сообщающими, что раннее образование кости характеризуется отложением остеоидной матрицы, которая постепенно минерализуется со временем. Частицы костного графта были хорошо интегрированы в новообразованную кость. Интересно, что многие из этих частиц демонстрировали поверхностные лакуны, совместимые с остеокластической резорбцией. Человеческие остеокласты, культивируемые в течение 21 дня на поверхности депротеинизированных гранул конской кости (DEBGs) и депротеинизированных гранул бычьей кости (DBBGs), резорбировали биоматериалы, проявляя типичные остеокластические маркеры и морфологические особенности более активно на DEBGs, чем на DBBGs. Эти результаты предполагают, что DEBGs поддерживают дифференцировку остеокластов и резорбционную активность. Более того, Ди Стефано и др. в клиническом и гистоморфометрическом исследовании, проведенном через шесть месяцев после графтирования лунки, сообщили, что DEBGs были связаны с значительно большим количеством новообразованной кости и меньшим процентом остаточного биоматериала по сравнению с DBBGs. Учитывая наши результаты, наличие лакун резорбции, наблюдаемых на поверхности DEBGs, может быть связано с внутренними свойствами самого материала, которые, похоже, дополнительно усиливаются обработкой VPST. Кроме того, VPST улучшает шероховатость поверхности и смачиваемость, способствуя лучшей дифференцировке клеток и образованию апатита, что имеет решающее значение для успешной регенерации кости. Анализ твердых тканей действительно показал множество линий отложения кости, характеризующихся наличием клеток, похожих на остеобласты, активно секретирующих остеоидную матрицу. Секреторная активность остеобластов играет критическую роль в образовании новой кости и в успешной интеграции биоматериала в ткани хозяина. Эти результаты подтвердили, что обработка VPST не ухудшила остеокондуктивные свойства графта DEBG, тем самым поддерживая его совместимость с физиологическими процессами регенерации кости. Более того, одновременное действие остеобластов на отложение матрицы и остеокластов на резорбцию формирует основу физиологического ремоделирования кости.
Этот динамический процесс строго регулируется через сложное клеточное взаимодействие между этими двумя типами клеток.
Что касается мягких тканей, гистологический анализ показал физиологическую архитектуру с незначительным фиброзным соединительным компонентом, что соответствует послеоперационному заживлению. Эти результаты согласуются с данными Пеллегрини и др., которые описали процесс заживления мягких тканей после процедур костной трансплантации в техниках сохранения лунки. Наличие незначительного фиброза в соединительной ткани можно интерпретировать как часть нормальной фазы ремоделирования, где фибробласты способствуют отложению внеклеточного матрикса и созреванию ткани.
Клинически не было зарегистрировано ни одного случая неудачи имплантатов или протезов в течение года после установки имплантатов, что подчеркивает клиническую надежность биоматериалов, обработанных плазмой. Это согласуется с предыдущими исследованиями, которые сообщали о повышенной стабильности имплантатов и показателях выживаемости, связанных с активированными плазмой поверхностями. Отсутствие биологических или технических осложнений, за исключением изолированного разрушения титановой сетки, дополнительно подтверждает клиническую безопасность и эффективность предложенного протокола лечения. Взаимодействие вакуумной плазмы с биологическими объектами также может иметь неблагоприятные эффекты, которые необходимо учитывать. Возможным объяснением разрушения титанової сетки является то, что титановая сетка была обработана сразу после тестирования на костном дефекте. Наличие биологических жидкостей могло вызвать гиперактивацию поверхности.
Насколько известно авторам, это первое исследование, оценивающее VPST на биоматериалах. Несмотря на эти многообещающие результаты, у данного исследования есть некоторые ограничения. Небольшой размер выборки и характер клинического аудита ограничивают обобщаемость полученных данных. Кроме того, отсутствие контрольной группы не позволяет провести прямое сравнение между обработанными плазмой и необработанными биоматериалами. Будущие исследования должны включать более крупные рандомизированные контролируемые испытания с долгосрочным наблюдением для подтверждения этих предварительных результатов и установления надежных клинических рекомендаций.
Выводы
Учитывая ограниченный размер выборки, эта предварительная серия случаев демонстрирует, что VPST может улучшить биологическую совместимость биоматериалов, используемых в процедурах SP и GBR. Эти предварительные результаты могут свидетельствовать о том, что обработка плазмой может быть безопасно интегрирована в клинические протоколы для потенциального улучшения результатов оральной реабилитации. Необходимы дальнейшие рандомизированные контролируемые испытания с расчетом размера выборки для подтверждения этих предварительных результатов и изучения долгосрочного влияния на выживаемость имплантатов и удовлетворенность пациентов.
Марко Талларико, Микеле Троя, Милена Пизано, Сильвио Марио Мелони, Дарио Мелодия, Клаудия Делла Виа, Доладжи Хенин, Франческо Маттиа Черузо, Карлотта Каччо и Ауреа Иммаколата Лумбау
Ссылки
- Бузенлехнер, Д.; Фюрхаузер, Р.; Хаас, Р.; Ватзек, Г.; Майлат, Г.; Поммер, Б. Долгосрочный успех имплантатов в Академии оральной имплантологии: 8-летнее наблюдение и анализ факторов риска. J. Periodontal Implant. Sci. 2014, 44, 102–108. [CrossRef] [PubMed]
- Ким, Т.И. Дань уважения доктору Пер-Ингвару Бранемарку. J. Periodontal Implant. Sci. 2014, 44, 265. [CrossRef] [PubMed]
- Маврогенис, А.Ф.; Димитриу, Р.; Парвизи, Дж.; Бабис, Г.Ц. Биология остеоинтеграции имплантатов. J. Musculoskelet. Neuronal Interact. 2009, 9, 61–71.
- Галлуччи, Г.О.; Хэмилтон, А.; Чжоу, В.; Бусер, Д.; Чен, С. Протоколы установки и нагрузки имплантатов у частично беззубых пациентов: систематический обзор. Clin. Oral Implant. Res. 2018, 29 (Suppl. S16), 106–134. [CrossRef]
- Вонг, М.; Эуленбергер, Дж.; Шенк, Р.; Хунцикер, Е. Влияние топологии поверхности на остеоинтеграцию имплантационных материалов в трабекулярной кости. J. Biomed. Mater. Res. 1995, 29, 1567–1575. [CrossRef]
- Веннерберг, А.; Альбректссон, Т. О поверхностях имплантатов: обзор современных знаний и мнений. Int. J. Oral Maxillofac. Implant. 2010, 25, 63–74.
- Веннерберг, А.; Альбректссон, Т. Влияние топографии поверхности титана на интеграцию с костью: систематический обзор. Clin. Oral Implant. Res. 2009, 20 (Suppl. S4), 172–184. [CrossRef]
- Казимирчак, П.; Прзекора, А. Остеокондуктивные и остеоиндуктивные модификации поверхности биоматериалов для регенерации кости: краткий обзор. Coatings 2020, 10, 971. [CrossRef]
- Канулло, Л.; Дженова, Т.; Чиниго, Г.; Иаконо, Р.; Песче, П.; Менини, М.; Муссано, Ф. Устройство для вакуумной плазменной обработки для повышения активности фибробластов на обработанных и шероховатых титановыми поверхностях. Dent. J. 2024, 12, 71. [CrossRef] [PubMed]
- Сибата, Й.; Хосака, М.; Каваи, Х.; Миядзаки, Т. Обработка титановыми пластинами с помощью плазменного разряда улучшает адгезию остеобластоподобных клеток к пластинам через механизм, опосредованный интегринами. Int. J. Oral Maxillofac. Implant. 2002, 17, 771–777.
- Норо, А.; Канэко, М.; Мурата, И.; Ёсинара, М. Влияние топографии поверхности и физико-химических свойств поверхности на смачиваемость циркония (тетрагональный цирконий поликристалл). J. Biomed. Mater. Res. Part B Appl. Biomater. 2013, 101, 355–363. [CrossRef] [PubMed]
- Талларико, М.; Мелони, С.М.; Троя, М.; Каччо, К.; Лумбау, А.И.; Гендвилиене, И.; Черузо, Ф.М.; Пизано, М. Использование вакуумной плазменной обработки поверхности для улучшения гидрофильности и смачиваемости биоматериалов: исследование in vitro. Dent. J. 2025, 13, 141. [CrossRef] [PubMed]
- Канулло, Л.; Пеллегрини, Г.; Канчиани, Е.; Хайнеманн, Ф.; Галльера, Е.; Деллавиа, Ч. Техника сохранения альвеолярного лунки: влияние биоматериала на паттерн регенерации кости. Ann. Anat. Anat. Anz. 2016, 206, 73–79. [CrossRef] [PubMed]
- Лоруссо, Ф.; Алла, И.; Герхке, С.А.; Кармин, М.Д.; Тари, С.Р.; Скаранo, А. Влияние различных протезных соединений зубных имплантатов на потерю краевой кости: новые данные из байесовского сетевого мета-анализа (NMA) и систематического обзора. Prosthesis 2024, 6, 186–205. [CrossRef]
- Удеабор, С.Е.; Хеселич, А.; Аль-Маваи, С.; Алькатани, А.Ф.; Садер, Р.; Ганати, С. Современные знания о заживлении лунки после удаления: нарративный обзор. Bioengineering 2023, 10, 1145. [CrossRef]
- Перротти, В.; Ничоллс, Б.М.; Пиаттели, А. Формирование и активность остеокластов человека на эквинизированном заменителе губчатой кости. Clin. Oral Implant. Res. 2009, 20, 17–23. [CrossRef]
- Ди Стефано, Д.А.; Заниол, Т.; Чинчи, Л.; Пиери, Л. Химическое, клиническое и гистоморфометрическое сравнение между эквинизированной костью, полученной с помощью энзиматического удаления антигенов, и бычьей костью, сделанной неантигенной с использованием высокотемпературного процесса при пересадке в лунку после удаления. Сравнительное ретроспективное клиническое исследование. Dent. J. 2019, 7, 70. [CrossRef]
- Ле, П.Т.М.; Шинтани, С.А.; Такадама, Х.; Ито, М.; Какутани, Т.; Китагаки, Х.; Тераучи, С.; Уэно, Т.; Накано, Х.; Накадима, Й.; и др. Обработка биоактивацией с использованием смешанной кислоты и тепла на титановыми имплантатами, изготовленными с помощью селективного лазерного плавления, улучшает дифференцировку предостеобластных клеток. Nanomaterials 2021, 11, 987. [CrossRef]
- Пеллегрини, Г.; Расперини, Г.; Обот, Г.; Фарронато, Д.; Деллавиа, Ч. Заживление мягких тканей в технике сохранения альвеолярной лунки: гистологические оценки. Int. J. Periodontics Restor. Dent. 2014, 34, 531–539. [CrossRef]
- Кахм, С.Х.; Ли, С.Х.; Лим, Й.; Чон, Х.Д.; Юн, К.И. Остеоинтеграция зубных имплантатов после вакуумной плазменной обработки поверхности in vivo. J. Funct. Biomater. 2024, 15, 278. [CrossRef]
- Песче, П.; Менини, М.; Сантори, Г.; Джованни, Е.; Багнаско, Ф.; Канулло, Л. Фото- и плазменная активация титановыми поверхностями зубных имплантатов. Систематический обзор с мета-анализом предклинических исследований. J. Clin. Med. 2020, 9, 2817. [CrossRef] [PubMed]
- Скрибанте, А.; Джидзони, М.; Пеллегрини, М.; Пуликари, Ф.; Мандредини, М.; Поли, П.П.; Майорана, Ч.; Спадари, Ф. Полностью цифровые индивидуализированные сетки в процедурах направленной регенерации кости: обзор. Prosthesis 2023, 5, 480–495. [CrossRef]
- Бергер, М.Б.; Бош, К.Б.; Коэн, Д.Ж.; Боян, Б.Д.; Шварц, З. Обработка титановыми поверхностями на столе улучшает клеточный ответ. Dent. Mater. 2021, 37, 690–700. [CrossRef] [PubMed]
