Результаты лечения зубными имплантатами у пациентов, получающих алендронат: результаты трехлетнего наблюдательного многоцентрового исследования
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Цель: Оценить 3-летние клинические и радиографические данные фиксированных зубных протезов на имплантатах, установленных пациентам, принимавшим алендронат 35–70 мг еженедельно в течение как минимум 3 лет до установки имплантатов.
Материалы и методы: Сорок последовательных пациентов, проходивших лечение пероральными бисфосфонатами и нуждающихся в восстановлении на основе имплантатов, были набраны в двух частных центрах в период с января 2008 года по декабрь 2011 года. Имплантаты были установлены с помощью минимально инвазивного подхода под антибактериальным и антибиотикотерапевтическим лечением, через 6 месяцев после прекращения приема алендроната. После 4 месяцев погруженного заживления имплантаты подверглись протезированию. Поддержание гигиены и клинические оценки проводились каждые 4 месяца в течение 3 лет. Критериями оценки были следующие: успех имплантата и протеза, показатели выживаемости, любые наблюдаемые клинические осложнения, ремоделирование краевой кости, глубина кармана при зондировании и кровотечение при зондировании.
Результаты: В конце исследования восемь пациентов выбыло. Окончательный размер выборки составил 32 последовательных частично или полностью беззубых пациента (32 женщины; средний возраст 64,6 года) с 98 погруженными имплантатами. У только одного пациента максиллярный имплантат не прижился в период заживления. Ни один протез не потерпел неудачу на протяжении всего наблюдения, и серьезных осложнений не было зафиксировано. Успех имплантатов и протезов составил общую выживаемость 98, 98% и 100% соответственно. Средняя потеря маргинальной кости за три года составила 1,35 ± 0,21 (ДИ 95% 1,24–1,38). Успешные параметры мягких тканей были обнаружены вокруг всех имплантатов.
Выводы: Оральная терапия бисфосфонатами, похоже, не оказала значительного влияния на выживаемость и успех имплантатов при точном выборе времени лечения, минимально инвазивном хирургическом подходе и постоянном наблюдении. Необходимы дальнейшие проспективные исследования с участием более крупных выборок и более длительными сроками наблюдения для подтверждения этих результатов.
Введение
Остеопороз — это прогрессирующее системное заболевание скелета, характеризующееся низкой плотностью костной ткани и микроархитектурным разрушением костной ткани, что приводит к увеличению хрупкости костей и восприимчивости к переломам (Kanis et al. 2008). Наиболее распространенное медицинское лечение остеопороза включает использование бисфосфонатов (БП) (Bernabei et al. 2014). В 2009 году Управление по контролю за продуктами и лекарствами США одобрило ежегодную инъекцию золедроновой кислоты для профилактики остеопороза у менопаузальных женщин (Khosla 2009). Бисфосфонаты являются стабильными аналогами естественно встречающихся неорганических пирофосфатов и классифицируются как антирезорбтивные препараты (Fleisch et al. 1966), используемые для снижения активности остеокластов, предотвращения резорбции костной ткани и уменьшения ее обмена (Reszka & Rodan 2004). Они обычно используются для лечения заболеваний, влияющих на метаболизм костей, включая множественную миелому, вторичный гиперкальциемию, вызванную злокачественными опухолями, костные метастазы при метастатическом раке простаты или молочной железы, болезнь Педжета, а также остеопороз (Sarzi Amadè et al. 2008).
Действие бисфосфонатов (БП) зависит от химической структуры препарата. Традиционно БП делятся на не содержащие азот (не-N-БП) и содержащие азот (N-БП). Не содержащие азот бисфосфонаты метаболизируются в клетке в соединения, которые заменяют терминальную пирофосфатную группу АТФ, образуя нефункциональную молекулу, которая конкурирует с аденозинтрифосфатом (АТФ) в клеточном энергетическом метаболизме. Остеокласт инициирует апоптоз и погибает, что приводит к общему снижению разрушения кости. Добавление аминогруппы к концу боковой цепи увеличивает эффективность препарата; однако механизм действия содержащих азот БП менее известен. Согласно исследованиям Резки и Родана (2004), N-БП ингибируют фермент фарнезилдисфосфатсинтазу в пути биосинтеза холестерина и нарушают путь изопренилации, что ингибирует белки и другие факторы, играющие ограничивающую роль в резорбции кости остеокластами. N-БП накапливаются в максимальной концентрации в костной матрице и в остеокластах, в основном в течение первых 24–48 часов после начала лечения. Конечным результатом является дисфункция клеток остеокластов и их смерть (Джонс и др. 2001). В результате ингибирования нормальной резорбции кости происходит снижение обмена костной ткани, увеличение плотности кости, улучшение минерализации и снижение риска переломов (Джонс и др. 2001).
Алендронат — это бисфосфонат, содержащий азот, который широко используется для лечения остеопороза (Tsetsenekou et al. 2012). Эффекты местно и/или системно введенного алендроната на остеоинтеграцию были тщательно оценены в экспериментах на животных (Abtahi et al. 2013). Однако, согласно рабочей группе, созданной Американским обществом по исследованиям костей и минералов, существует мало информации о побочных эффектах пероральных Н-БП (Kos et al. 2010).
Два недавних систематических обзора литературы предполагают, что прием пероральных БП не оказывал влияния на краткосрочные (1–4 года) показатели выживаемости имплантатов, даже когда возникали осложнения (Madrid & Sanz 2009; Ata-Ali et al. 2014). Тем не менее, все еще отсутствуют проспективные исследования, сообщающие о выживаемости и успехе имплантатов. Поскольку универсально принятые рекомендации еще не были опубликованы, клиническое управление остеонекрозом челюсти, связанным с бисфосфонатами, остается спорным (Rupel et al. 2014). С 2003 года были опубликованы сообщения о некрозе челюстных костей, возможно, связанном с применением бисфосфонатов (Hasegawa et al. 2012). Ведутся обсуждения о рисках, связанных с проведением пероральных хирургических процедур, особенно костной пластики и установки имплантатов, у пациентов, принимающих пероральные БП (Sarzi Amadè et al. 2008; Memon et al. 2012; Kwon et al. 2014). Те же авторы пришли к выводу, что предотвращение остеонекроза челюсти, связанного с БП, не является полностью возможным, но неинвазивные профилактические процедуры могут помочь снизить его заболеваемость (Sarzi Amadè et al. 2008; Memon et al. 2012; Kwon et al. 2014). Американская ассоциация челюстно-лицевых хирургов рекомендует приостановить прием БП за 3 месяца до и 3 месяца после пероральной хирургии, если это возможно, особенно если пациент использовал БП более 3 лет (Ruggiero et al. 2009; Allen & Ruggiero 2014). Для пациентов с историей лечения пероральными бисфосфонатами, превышающей 3 года, и тех, кто получает сопутствующее лечение преднизоном, следует рассмотреть дополнительные тесты и альтернативные варианты лечения (Grant et al. 2008).
Целью этого многоцентрового проспективного наблюдательного исследования было представить трехлетние данные о выживаемости и успехе имплантатов и протезов, а также о потере костной ткани вокруг имплантатов после установки фиксированного протеза на имплантатах, предоставленного пациентам, принимающим пероральные бисфосфонаты (алендронат 70 мг таблетка раз в неделю или 5–10 мг раз в день) в течение как минимум 3 лет до установки имплантата. Это исследование проводилось в соответствии с рекомендациями STROBE (Укрепление отчетности об наблюдательных исследованиях в эпидемиологии).
Материалы и методы
Дизайн исследования
Это многоцентровое проспективное наблюдательное исследование было разработано для оценки клинических и радиологических результатов фиксированного протеза на имплантатах, предоставленного пациентам, принимающим алендронат 70 мг таблетка раз в неделю или 5–10 мг раз в день, в течение как минимум 3 лет до установки имплантата. Сорок пациентов были отобраны и лечены в двух частных центрах (20 в Риме, 20 в Сассари, Италия) в период с января 2008 года по декабрь 2011 года. Все имплантационные и протезные процедуры выполняли два опытных клинициста. Исследование проводилось в соответствии с принципами, изложенными в Хельсинкской декларации 1964 года для биомедицинских исследований с участием людей, с поправками 2008 года. Пациенты были проинформированы о клинических процедурах, материалах, которые будут использоваться, преимуществах, потенциальных рисках и осложнениях, а также о необходимых оценках для клинического испытания и дали свое письменное согласие на участие в этом исследовании.
Любой здоровый пациент младше 90 лет, старше 18 лет на момент установки имплантата, нуждающийся в протезе на имплантатах, был приглашен участвовать в исследовании в последовательном порядке. Пациенты были включены в исследование после выполнения критериев включения и отсутствия каких-либо критериев исключения.
Критерии исключения были следующими:
- Общие медицинские (класс III или IV Американского общества анестезиологов, ASA) и/или психиатрические противопоказания;
- Беременность или грудное вскармливание;
- Злоупотребление алкоголем или наркотиками;
- Сильное курение (>10 сигарет в день);
- Лучевая терапия в области головы или шеи в течение последних 5 лет;
- Высокая и умеренная парафункциональная активность;
- Отсутствие зубов/протеза в противоположной челюсти;
- Леченый пародонтит;
- Постэкстракционные имплантаты;
- Кровотечение изо рта и индекс налета в полости рта выше или равен 25%;
- Высота <10 мм и ширина 5 мм кости для установки имплантатов;
- Недоступность для регулярных наблюдений.
Все пациенты были обследованы и лечены в соответствии с двухступенчатым диагностическим и терапевтическим протоколом (Рис. 1). Диагностические этапы следующие:
- Анамнез;
- Клиническое обследование и фотографии;
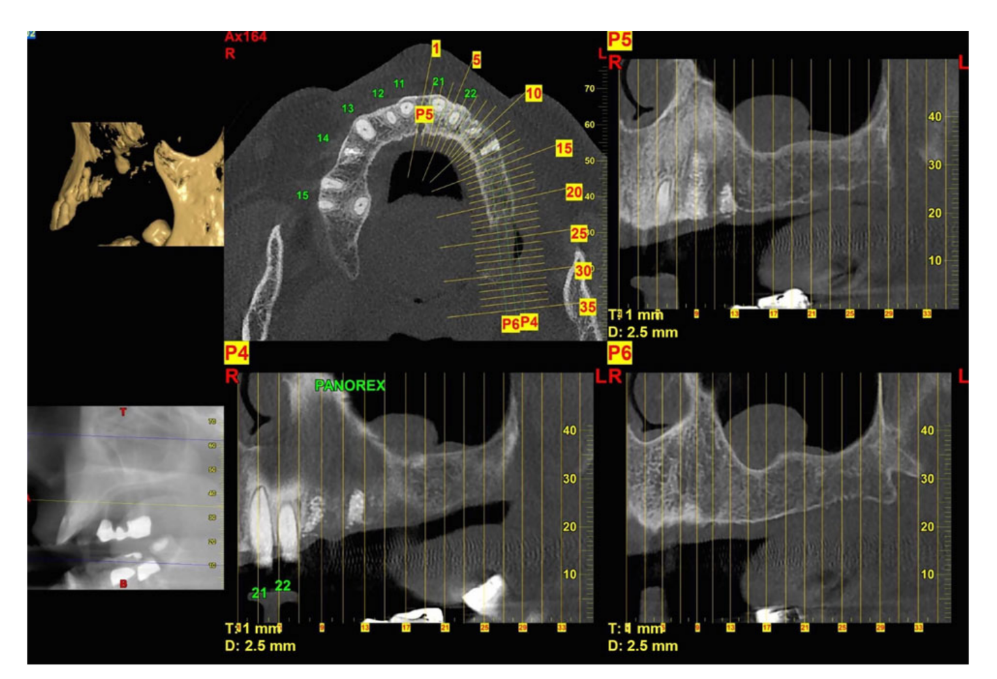
- Радиографическое обследование, включая периапикальные и панорамные рентгеновские снимки, компьютерную томографию (КТ) или конусно-лучевую компьютерную томографию (КЛКТ);
- Пародонтологическое обследование (зондирование и измерение индексов орального здоровья);
- Фотографическая документация;
- Информация для пациента (лекарства для приема и возможные последствия).
Клинические процедуры
Терапевтический протокол (Таблица 1):
- Профессиональная гигиена;
- Устранение всех очагов инфекции (остаточные корни, кариес, пародонтальная терапия):
- некорригирующее хирургическое лечение всех компрометированных зубов или с плохим прогнозом;
- восстановительное лечение зубов, пораженных кариесом;
- пародонтальное лечение и поддерживающая терапия;
- оценка адекватности съемного и несъемного протезирования. В частности, оценивалась герметичность протезных конструкций и стабильность съемного протеза, которые должны быть атравматичными.
В конце этапа профилактики пациенты были мотивированы следовать строгому протоколу домашней гигиены полости рта и соблюдать профессиональные рекомендации.
Все вмешательства проводили два опытных хирурга (MT & SMM). При планировании безболезненное удаление зуба проводилось как минимум за 8 недель до установки имплантата. Коронки многокорневых зубов были разделены. Корни затем удалялись индивидуально, при необходимости с помощью периотомы. Остаточные лунки удаления тщательно очищались от грануляционной ткани и остаточных волокон периодонтальной связки с помощью кюреток.
Предоперационный протокол требовал приостановки приема бисфосфонатов за 6 месяцев до операции и до полного заживления через 4–6 месяцев после установки имплантата. Антибиотики назначались профилактически за 7 дней до операции и продолжались в течение 7 дней (Sarzi Amadè et al. 2008):
- Амоксициллин и клавулановая кислота, по одной таблетке каждые 12 часов (2 г в день);
- Метронидазол 250 мг; по две таблетки каждые 8 часов (1,5 г в день).
Перед началом операции пациенты полоскали рот раствором хлоргексидина 0,2% в течение 1 минуты. Местная анестезия проводилась с использованием 4% раствора артикаина с эпинефрином 1 : 100.000 (Ubistein; 3M Italy SpA, Милан, Италия). Имплантаты устанавливались в запланированные анатомические участки с использованием безфлапного или минифлапного подхода, (Рис. 2). Плотность кости оценивалась во время сверления на основе опыта и ощущений клинициста, и это основывалось на классификации Лекхольма и Зарба (Brånemark et al. 1985). Каждое сверло использовалось с обильным орошением в соответствии с протоколом, рекомендованным производителем. Платформа имплантата располагалась на уровне альвеолярного гребня или немного ниже в эстетической зоне.
После установки имплантатов все пациенты получили устные и письменные рекомендации по поводу медикаментов, поддержания гигиены полости рта и диеты. Послеоперационное обезболивание проводилось с помощью ибупрофена 100 мг, который принимали каждые 8 часов в течение 2 дней после операции, а затем при необходимости. Пациентам было рекомендовано полоскать рот раствором хлоргексидина 0,2% дважды в день, не чистя область имплантата до удаления швов (через 10–14 дней).
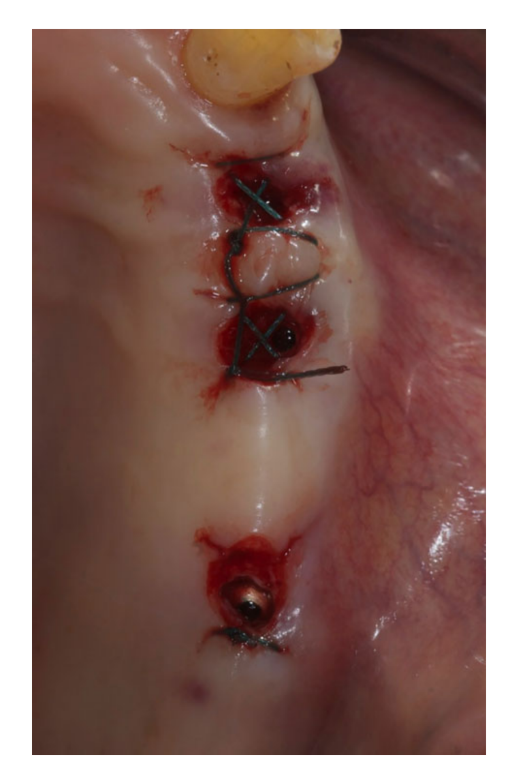
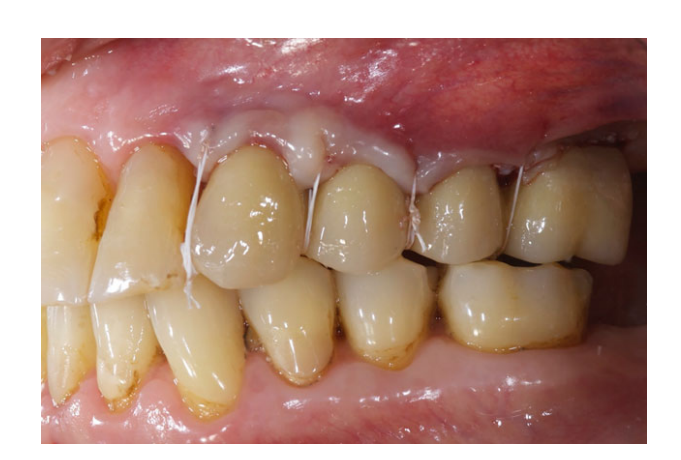
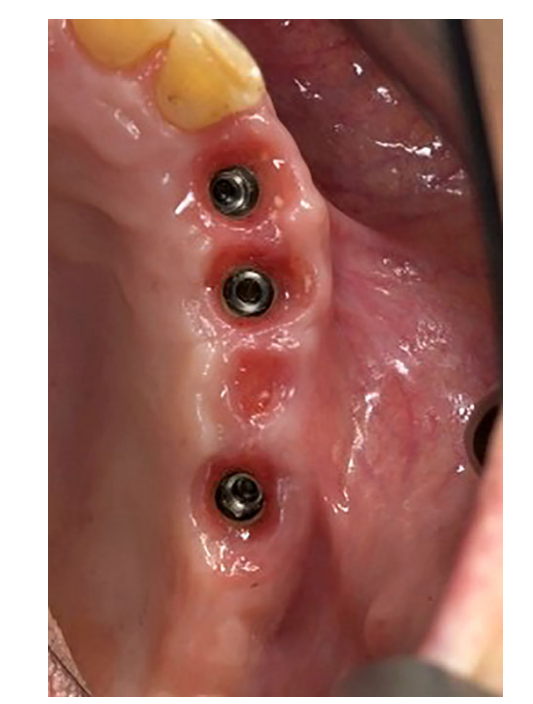
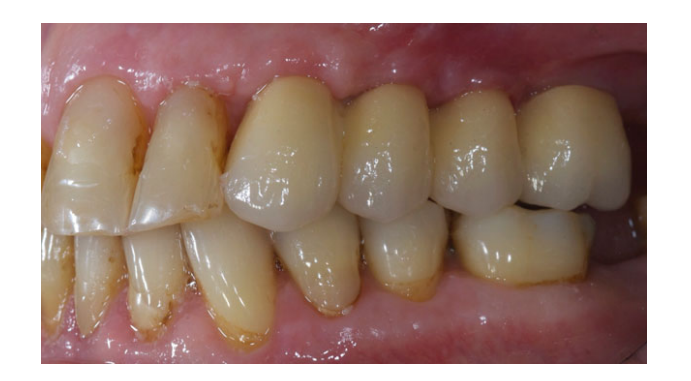
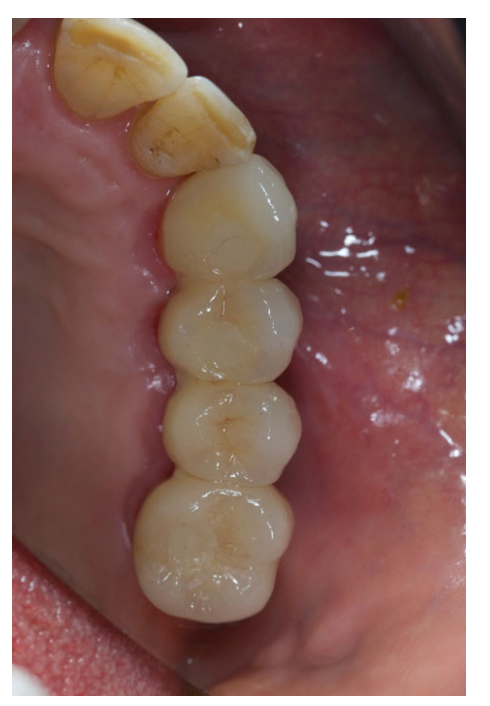
Все имплантаты были установлены под десну. Имплантаты были открыты через 3 месяца после их установки (Рис. 3 и 4). Снятие слепков проводилось с использованием полиэфирного материала (ImpregumTM, 3M ESPE, Зефельд, Германия) с помощью индивидуального открытого лотка (Diatray Top, Dental Kontor, Штокельсдорф, Германия). В момент доставки протеза (Рис. 5 и 6) была проведена коррекция окклюзии, а реставрации были либо прикручены, либо цементированы с использованием цемента на основе оксида цинка без эвгенола (Temp Bond NE, Kerr Corporation, Ориндж, Калифорния, США) через 12 недель после первой операции в соответствии с традиционным протоколом нагрузки (Gallucci et al. 2013). Контрольные визиты планировались через 1–6 месяцев, а затем ежегодно в течение 3 лет функционирования (Рис. 7). На каждом контрольном визите при необходимости проводилась коррекция окклюзии зубного протеза. Пациенты проходили профессиональную чистку у стоматологической гигиенистки каждые 4–6 месяцев. Периапикальные рентгенограммы получались ежегодно после окончательной доставки протеза с использованием того же индивидуального держателя Ринн (Rinn, Эльгин, Иллинойс, США).
Показатели результатов
Основными показателями результатов были показатели успеха и выживаемости имплантатов. На каждом контрольном обследовании имплантаты проверялись на интеграцию с тканями в соответствии с строгими параметрами, определенными Buser и др. (1990). В частности, интеграция считалась успешной, если были выполнены следующие параметры: (1) отсутствие повторяющейся периимплантной инфекции с гнойным выделением; (2) отсутствие постоянных субъективных жалоб, таких как боль, ощущение инородного тела и/или дисестезия; (3) отсутствие непрерывной радиолюсценции вокруг имплантата и (4) отсутствие какой-либо подвижности имплантата. Эти критерии доказали свою эффективность в определении успеха имплантационной системы и оценке долгосрочных результатов в клинических испытаниях. Успех протеза оценивался с учетом модификации критериев оценки, предложенной Ассоциацией стоматологов Калифорнии (CDA (Ассоциация CD 1976)).
Вторичными результатами были следующие: любые хирургические и протезные осложнения, возникшие в течение всего периода наблюдения, потеря краевой кости, глубина зондирования кармана (PPD) и кровотечение при зондировании (BOP).
- Осложнения: Рассматривались любые технические (перелом каркаса и/или облицовочного материала, ослабление винта и т.д.) и/или биологические (боль, отек, гной и т.д.) осложнения.
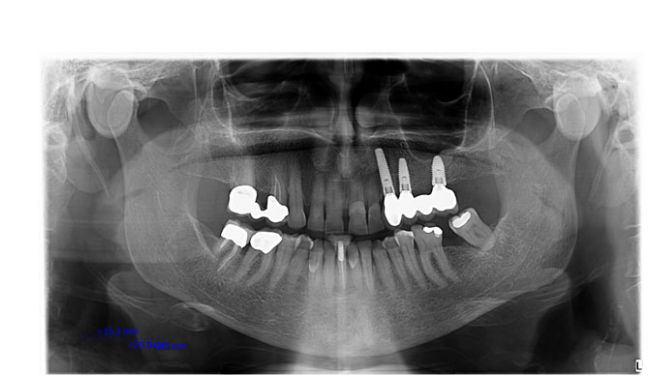
- Потеря краевой кости: Расстояние от самого коронального края воротника импланта до самой корональной точки контакта кости с имплантом принималось за уровень краевой кости (MBL). MBL вокруг имплантатов оценивался на интраоральных цифровых рентгенограммах, сделанных с использованием параллельной техники с помощью держателя для пленки (Rinn XCP, Dentsply, Elgin, IL, USA) при установке имплантата (базовый уровень) и через 12, 24 и 36 месяцев. Рентгенограммы принимались или отклонялись для оценки на основе четкости резьбы импланта. Все читаемые рентгенограммы отображались в программе анализа изображений (DFW2.8 для Windows, Soredex, Tuusula, Финляндия) на 24-дюймовом ЖК-экране (iMac, Apple, Cupertino, CA, USA) и оценивались в стандартизированных условиях (SO 12646:2004). Программное обеспечение было откалибровано для каждого отдельного изображения с использованием известного расстояния диаметра или длины импланта. Измерения уровня костного гребня мезиально и дистально рядом с каждым имплантом проводились с точностью до 0,1 мм и усреднялись на уровне пациента.
- PPD и BoP измерялись слепым оператором с помощью пародонтального зонда (PCP-UNC 15; Hu-Friedy Manufacturing, Chicago, IL, USA) на 6, 12, 24 и 36 месяцах. Для каждого импланта собирались три вестибулярных и три язычных значения и усреднялись на уровне пациента.
Два независимых и полностью слепых стоматолога (LC и EX) для каждого центра оценили выживаемость и уровень успеха имплантатов и протезов. Осложнения оценивались и лечились лечащими клиницистами (MT и SMM), которые не были слепыми. Уровень потери краевой кости (DMBL) оценивался независимым радиологом. Все периодонтальные измерения проводил независимый гигиенист.
Статистический анализ
Статистический анализ проводился для числовых параметров, таких как уровень краевой кости и параметры мягких тканей, с использованием SPSS для Mac OS X версии 22.0 (SPSS, Чикаго, IL, США). Описательный анализ проводился с использованием среднего стандартного отклонения (SD) и медианы с 95% доверительным интервалом (CI). Кумулятивные уровни выживаемости и успеха рассчитывались с использованием имплантатов и протезов в качестве статистической единицы анализа. Различия средних уровней краевой кости между контрольными точками, усредненные на уровне пациента, сравнивались с помощью теста знаков Уилкоксона для связанных выборок. Уровень статистической значимости был установлен на уровне 0.05. Сравнения между центрами проводились с помощью однофакторного дисперсионного анализа (ANOVA).
Результаты
В конце исследования восемь пациентов (20%) с 18 имплантатами (15,5%) выбыло. Один пациент в римском центре умер от рака печени. У пяти пациентов (двое в римском центре и трое в центре Сассари) были серьезные проблемы со здоровьем, не связанные с терапией зубными имплантатами, из-за чего они не смогли прийти на запланированные контрольные обследования. Два пациента переехали за границу. Однако, основываясь на телефонном интервью, все эти пациенты имели свои имплантаты в функционирующем состоянии без осложнений, связанных с пациентами (боль, отек). Окончательный размер выборки составил 98 имплантатов с шероховатой окисленной поверхностью и дизайном имплантата с конусным телом (NobelReplace, Nobel Biocare AB), которые были установлены у 32 последовательных беззубых пациентов (32 женщины) со средним возрастом 64,6 года (в диапазоне от 46 до 80). Каждый центр лечил одинаковое количество из 16 пациентов. Каждый пациент наблюдался в течение ≥3 лет функционирования (в диапазоне от 36 до 72 месяцев; среднее 47,6 месяцев). Не было явных начальных дисбалансов между двумя группами, кроме большего количества длинных имплантатов, использованных римским центром, и наличия большего числа случаев, леченных с использованием компьютерной помощи на основе шаблонной хирургии в центре Сардинии. Отклонений от оригинального протокола не произошло. Все собранные данные были включены в статистический анализ.
- Один из 98 имплантатов (1,02%) потерпел неудачу в период заживления, до доставки окончательных протезов, что привело к общей кумулятивной выживаемости имплантатов 98,98% на 3-летнем контроле. Единственный случай неудачи имплантата произошел у одного пациента центра Сардинии (имплантат узкой платформы длиной 10 мм). Имплантат не был заменен.
- На 3-летнем контрольном обследовании ни один из окончательных протезов не потерпел неудачу, что привело к кумулятивной выживаемости протезов 100%.
- Не было зафиксировано никаких протезных осложнений. Не было зарегистрировано серьезных биологических осложнений. У трех пациентов была воспаление мягких тканей вокруг имплантатов с кровоточивостью после 6 месяцев. Улучшение гигиены полости рта снизило воспаление вокруг имплантатов без каких-либо хирургических вмешательств.
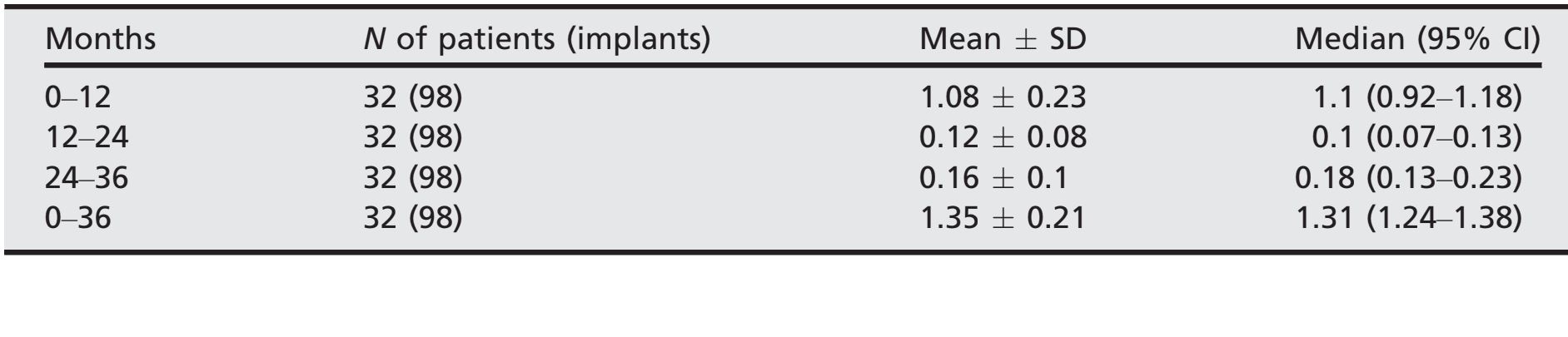
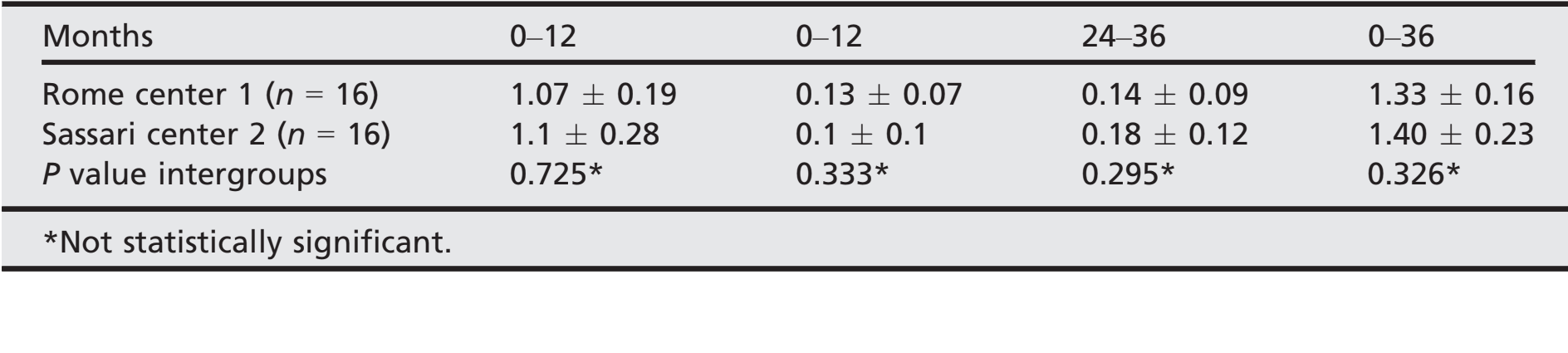
- После первоначальной средней потери краевой кости 1,08 ± 0,23 (медиана 1,1; ДИ 95% 0,92–1,18), все имплантаты потеряли в среднем 0,12 ± 0,08 (медиана 0,1; ДИ 95% 0,07–0,13) между 1- и 2-летним контролем, и 0,16 ± 0,1 (медиана 0,18; ДИ 95% 0,13–0,23) между 2- и 3-летним контролем, без статистически значимой разницы (P = 0,059). На 3-летнем контроле средняя потеря краевой кости составила 1,35 0,21 (медиана 1,31; ДИ 95% 1,24–1,38). Все данные представлены в таблице 2. На каждом контроле изменения уровня кости были схожи для обоих центров (P ≥ 0,05). Все данные представлены в таблице 3.
- На 3-летнем контрольном обследовании средние значения PPD составили 2,71 0,38 мм (95% ДИ = 2,54–2,86). Средние значения BoP составили 1,29 ± 0,76 (95% ДИ = 0,93–1,63).
Обсуждения
Настоящее проспективное наблюдательное исследование было разработано для оценки клинических и радиографических результатов фиксированного протеза на имплантатах, установленного пациентам, принимающим алендронат в дозе 70 мг один раз в неделю или 5–10 мг один раз в день в течение как минимум 3 лет до установки имплантата.
На трехлетнем контрольном обследовании результаты настоящего исследования показали выживаемость имплантатов и протезов на уровне 99% и 100% соответственно. Изменения в краевой кости, а также значения BOP и PPD, похоже, остаются стабильными после 3 лет, что подтверждает, что имплантационная терапия у пациентов, принимающих пероральные бисфосфонаты, является жизнеспособным методом лечения в соответствии с предложенным терапевтическим протоколом. Эти результаты согласуются с другими исследованиями, исследующими ту же тему. В ретроспективном исследовании Мемон и др. (2012) пришли к выводу, что бисфосфонаты не влияют на ранний успех имплантации или изменения в краевой кости. Джеффкот (2006) и Руссо Делло и др. (2007) в двух проспективных исследованиях сообщили, что пероральные бисфосфонаты, похоже, не увеличивают частоту возникновения ОНЖ. Грант и др. (2008) в ретроспективном исследовании на 115 пациентах (468 имплантов) сообщили, что терапия пероральными бисфосфонатами, похоже, не оказывает значительного влияния на успех имплантации.
Основные ограничения данного исследования заключаются в ограниченном числе участников, которые наблюдались в течение короткого периода. Тем не менее, несмотря на то, что восемь пациентов выбыло из исследования, 98 имплантатов были установлены у 32 пациентов, леченных по одному и тому же протоколу, и наблюдаемых в течение как минимум 3 лет, что позволяет обобщить результаты настоящего исследования на более крупную популяцию с аналогичными характеристиками.
Животное исследование показало, что применение бисфосфонатов вмешивается в нормальное ремоделирование костной ткани после удаления зуба, ставя под угрозу долгосрочное заживление вокруг имплантатов (Kim et al. 2013). Одним из самых серьезных, хотя и редких осложнений является остеонекроз челюстей, связанный с бисфосфонатами (BRONJ) (Kwon et al. 2014). Частота BRONJ может варьироваться в зависимости от способа введения и силы используемых препаратов. Американская ассоциация челюстно-лицевых хирургов сообщила, что распространенность BRONJ составляет от 0,8% до 12%, когда бисфосфонаты вводятся внутривенно (Ruggiero et al. 2009; Allen & Ruggiero 2014). Сообщается, что распространенность ниже, когда бисфосфонаты принимаются перорально. Однако было предложено уделять особое внимание пациентам, проходящим лечение бисфосфонатами более 3 лет, поскольку распространенность BRONJ увеличивается в течение периода лечения бисфосфонатами (Sarzi Amade` et al. 2008). После не очень оптимистичных предварительных результатов, основанных на неконтролируемых ретроспективных исследованиях, некоторые систематические обзоры предложили более оптимистичные результаты. Мадрид и Санц (2009) пришли к выводу, что пациент, принимающий пероральные бисфосфонаты в течение периода <5 лет, является «безопасным» для проведения стоматологических процедур, в частности, установки зубных имплантатов (Madrid & Sanz 2009). Более того, существует общий консенсус о том, что установка имплантатов не противопоказана у пациентов без рака, принимающих пероральные бисфосфонаты, в основном назначаемые при остеопорозе (Madrid & Sanz 2009). Совсем недавно Кумар и Хонне (2012), оценивая выживаемость зубных имплантатов у пользователей бисфосфонатов и не пользователей, пришли к выводу, что краткосрочная терапия бисфосфонатами не увеличивает и не уменьшает уровень выживаемости зубных имплантатов по сравнению с не пользователями.
Хотя подводная техника не является обязательным условием для остеоинтеграции (Tallarico et al. 2011), в настоящем исследовании все имплантаты были установлены подводным способом, без каких-либо хирургических осложнений. Это может быть одним из ключевых факторов наряду с значительной антибиотикотерапией и временной приостановкой приема алендроната, предотвращающей бактериальное загрязнение места имплантации.
В настоящем исследовании, несмотря на ограниченное количество пациентов, операция по установке имплантатов не привела к остеонекрозу челюсти, связанному с бисфосфонатами, через 3 года после установки имплантатов. Тем не менее, существуют достаточные доказательства, чтобы предположить, что всех пациентов, проходящих установку имплантатов, следует опрашивать о терапии бисфосфонатами, включая принимаемый препарат, дозировку и продолжительность лечения перед операцией. Потенциальные риски BRONJ необходимо объяснить пациентам перед установкой имплантата. Для пациентов с историей лечения пероральными бисфосфонатами, превышающей 3 года, и тех, кто получает сопутствующее лечение преднизоном, следует рассмотреть дополнительные тесты и альтернативные варианты лечения, а профилактика по-прежнему является наиболее эффективным средством для предотвращения возможных осложнений. Кроме того, анатомическое расположение имплантата и продолжительность терапии препаратом на момент установки не были значительными факторами в уровне успеха или костных изменениях.
Заключение
В рамках ограничений данного исследования, согласно предложенному терапевтическому протоколу и проведению минимально инвазивной подводной хирургии, терапия оральными бисфосфонатами, похоже, не оказала значительного влияния на выживаемость и успех имплантатов в среднесрочной перспективе. Эти выводы должны быть подтверждены дальнейшими проспективными исследованиями с участием более крупных выборок и более длительными сроками наблюдения.
Марко Талларико, Луиджи Канулло
Ссылки
- Абтахи, Дж., Агхолме, Ф., Сандберг, О. и Аспенберг, П. (2013) Влияние местной и системной доставки бисфосфонатов на фиксацию зубных имплантатов в модели остеонекроза челюсти. Журнал стоматологического исследования 92: 279–283.
- Аллен, М.Р. и Руджеро, С.Л. (2014) Обзор фармацевтических агентов и здоровья костей рта: как остеонекроз челюсти повлиял на эту область. Международный журнал оральных и челюстно-лицевых имплантатов 29: e45–e57.
- Ата-Али, Дж., Ата-Али, Ф., Пенаароха-Олтра, Д. и Галиндо-Морено, П. (2014) Каково влияние терапии бисфосфонатами на выживаемость зубных имплантатов? Систематический обзор и мета-анализ. Клинические исследования оральных имплантатов doi: 10.1111/clr.12526. [Epub ahead of print].
- Бернабе, Р., Мартоне, А.М., Ортолани, Е., Ланди, Ф. и Марзетти, Е. (2014) Скрининг, диагностика и лечение остеопороза: краткий обзор. Клинические случаи в минералогии и метаболизме костей 11: 201–207.
- Брэнемарк, П.И., Зарб, Г.А. и Альбректссон, Т. (1985) Тканеинтегрированные протезы: остеоинтеграция в клинической стоматологии. Чикаго: Издательство Квинтессенция.
- Бусер, Д., Вебер, Х.П. и Ланг, Н.П. (1990) Тканевая интеграция несмонтированных имплантатов. Результаты 1 года проспективного исследования с 100 полыми цилиндрическими и полыми винтовыми имплантатами. Клинические исследования оральных имплантатов 1: 33–40.
- Калифорнийская стоматологическая ассоциация, Рабочая группа по оценке качества. (1976) Оценка качества стоматологической помощи: рекомендации по оценке клинического качества и профессиональной деятельности и стандарты для проектирования программы, обеспечивающей качество ухода. Лос-Анджелес: Издательство Калифорнийской стоматологической ассоциации. Чикаго.
- Флейш, Х., Рассел, Р. и Страуманн, Ф. (1966) Влияние пирофосфата на гидроксиапатит и его последствия для гомеостаза кальция. Природа 212: 901–903.
- Грант, Б.Т., Аменедо, К., Фриман, К. и Краут, Р.А. (2008) Результаты установки зубных имплантатов у пациентов, принимающих оральные бисфосфонаты: обзор 115 случаев. Журнал оральной и челюстно-лицевой хирургии 66: 223–230.
- Хасэгава, Й., Кавабе, М., Кимура, Х., Курита, К., Фукута, Дж. и Ураде, М. (2012) Влияние протезов на первоначальное место возникновения остеонекроза челюстей, связанного с бисфосфонатами: ретроспективное исследование. Оральная хирургия, оральная медицина, оральная патология и оральная радиология 114: 318–824.
- Джеффкоат, М.К. (2006) Безопасность оральных бисфосфонатов: контролируемые исследования на альвеолярной кости. Международный журнал оральных и челюстно-лицевых имплантатов 21: 349–353.
- Джонс, Д.Х., Накасим, Т., Санчес, О.Х., Козерадзки, И., Комарова, С.В., Сароси, И., Морон, С., Рубин, Е., Сарао, Р., Ходжила, С.В., Комненович, В., Конг, Й.Й., Шрайбер, М., Диксон, С.Й., Симс, С.М., Хоха, Р., Вада, Т. и Пеннингер, Дж.М. (2006) Регуляция миграции раковых клеток и костной метастазии RANKL. Природа 440: 692–696.
- Канис, Дж.А., МакКлоски, Е.В., Йоханссон, Х., Оден, А., Мелтон, Л.Й. и Халтаев, Н. (2008) Эталонный стандарт для описания остеопороза. Кость 42: 467–475.
- Хосла, С. (2009) Увеличение возможностей лечения остеопороза. Новый английский журнал медицины 361: 818–820.
- Ким, И., Ки, Х., Ли, В., Ким, Х. и Парк, Дж.Б. (2013) Влияние системно введенных бисфосфонатов на заживление костей после удаления зуба и остеоинтеграцию зубных имплантатов в верхней челюсти кроликов. Международный журнал оральных и челюстно-лицевых имплантатов 28: 1194–1200.
- Кос, М., Бруско, Д., Кюблер, Дж. и Энгелке, В. (2010b) Клиническое сравнение пациентов с остеонекрозом челюстей, с историей и без истории применения бисфосфонатов. Международный журнал оральной и челюстно-лицевой хирургии 39: 1097–1102.
- Кос, М., Кюблер, Дж.Ф., Луцак, К. и Энгелке, В. (2010a) Остеонекроз челюстей, связанный с бисфосфонатами: обзор 34 случаев и оценка риска. Журнал черепно-челюстно-лицевой хирургии 38: 255–259.
- Кумар, М.Н. и Хонне, Т. (2012) Выживаемость зубных имплантатов у пользователей бисфосфонатов по сравнению с не пользователями: систематический обзор. Европейский журнал протезирования и восстановительной стоматологии 20: 159–162.
- Квон, Т.Г., Ли, С.О., Парк, Дж.В., Чой, С.Й., Риджал, Г. и Шин, Х.И. (2014) Остеонекроз, связанный с зубными имплантатами у пациентов, проходящих лечение бисфосфонатами. Клинические исследования оральных имплантатов 25: 632–640.
- Мадрид, С. и Санз, М. (2009) Какое влияние оказывают системно введенные бисфосфонаты на терапию оральными имплантатами? Систематический обзор. Клинические исследования оральных имплантатов 20: 87–95.
- Мемон, С., Уэлтман, Р.Л. и Катанчик, Дж.А. (2012) Оральные бисфосфонаты: ранний успех эндоссеосных зубных имплантатов и изменения коронковой кости. Ретроспективное исследование. Международный журнал оральных и челюстно-лицевых имплантатов 27: 1216–1222.
- Резка, А.А. и Родан, Г.А. (2004) Механизм действия бисфосфонатов, содержащих азот. Мини-обзоры в медицинской химии 4: 711–719.
- Руджеро, С.Л., Додсон, Т.Б., Ассаэль, Л.А., Ландесберг, Р., Маркс, Р.Е. и Мехротра, Б. (2009) Позиционная бумага Американской ассоциации оральных и челюстно-лицевых хирургов по остеонекрозу челюсти, связанному с бисфосфонатами – обновление 2009 года. Австралийский эндодонтический журнал 35: 119–130.
- Рупель, К., Отавиани, Дж., Гоббо, М., Контардо, Л., Тирелли, Г., Вескови, П., Ди Ленарда, Р. и Бьязотто, М. (2014) Систематический обзор терапевтических подходов к остеонекрозу челюсти, связанному с бисфосфонатами (BRONJ). Оральная онкология 50: 1049–1057. Руссо Делло, Н.М., Джеффкоат, М.К., Маркс, Р.Е. и Фугаццотто, П. (2007) Остеонекроз в челюстях пациентов, использующих оральные бисфосфонаты для лечения остеопороза. Международный журнал оральных и челюстно-лицевых имплантатов 22: 146–153.
- Сарци Амадэ, Д., Талларико, М., Лорети, М.Ц., Монтекки, П.П. и Никколи, А. (2008) Клинические рекомендации по профилактике остеонекроза челюстей у пациентов, проходящих лечение бисфосфонатами: обзор литературы и отчет о трех случаях. Минерва стоматологика 57: 429–446.
- Талларико, М., Ваккарелла, А. и Марци, Г.Ц. (2011) Клинические и радиологические результаты установки имплантатов в 1 и 2 этапа: результаты 1 года рандомизированного клинического испытания. Европейский журнал оральной имплантологии 4: 13–20.
- Цетсенекоу, Е., Пападопулос, Т., Каливос, Д., Папаиоанну, Н., Тангл, С. и Ватзек, Г. (2012) Влияние алендроната на остеоинтеграцию нанолеченых зубных имплантатов у новозеландских кроликов. Клинические исследования оральных имплантатов 23: 659–666.