Крестальный синус-лифтинг с использованием имплантата с внутренним L-образным каналом: результаты через 1 год после нагрузки из проспективного когортного исследования
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Цель: Оценить клинические и радиографические результаты процедуры одноэтапного поднятия синуса с использованием системы самонарезающих эндоссальных имплантатов (iRaise, Maxillent, Херцлия, Израиль), разработанной для увеличения синуса, через 1 год после нагрузки.
Материалы и методы: Пациенты, нуждающиеся в восстановлении в задней части верхней челюсти с остаточной альвеолярной гребнем высотой от 3 до 8 мм и шириной 5 мм дистально от клыка, как было измерено на КТ, были обработаны с использованием системы поднятия синуса iRaise. Показатели результатов включали: неудачи имплантатов и протезов, любые осложнения, увеличение высоты кости (iBH), потерю краевой кости (MBL), коэффициент стабильности имплантата (ISQ), радиографические модели ремоделирования тканей с использованием индекса ремоделирования синусного графта (SGRI), объемные измерения синусного графта, самооценка пациентами послеоперационного отека, потребление обезболивающих и гистологический анализ.
Результаты: Всего 30 последовательных участников со средним возрастом 54.2 ± 9.4 года прошли транс-крестное поднятие синусной мембраны, установку костного графта и имплантацию. Всего было установлено 50 имплантов (30 имплантов системы iRaise и 20 дополнительных имплантов iSure, Maxillent). Средний срок наблюдения составил 15.8 ± 2.1 месяца после нагрузки имплантов. Один пациент выбыл из исследования на 1-м году после нагрузки во время контрольного осмотра. Ни один имплант и ни одна протез не потерпели неудачу на протяжении всего наблюдения. У одного пациента произошел небольшой разрыв мембраны. Перед установкой импланта средняя высота остаточного альвеолярного гребня составила 4.64 ± 0.86 мм (диапазон: 3.4–6.4 мм; 95% ДИ: 4.39–5.01 мм). Через год после нагрузки высота кости составила 16.86 ± 3.13 мм (95% ДИ 15.83–18.07 мм). На контрольном осмотре через год после нагрузки средний MBL составил 0.19 ± 1.05 мм (95% ДИ 0.02–0.78 мм). Средний ISQ при установке импланта составил 65.2 ± 5.4 (95% ДИ 63.6–67.4) и увеличился в течение периода заживления, достигнув среднего значения 73.6 ± 3.7 (95% ДИ 73.1–75.9; диапазон 62–79). Разница была статистически значимой (8.4 ± 5.3; 95% ДИ 5.9–39.7; P = 0.0000). Через год после нагрузки оценка SGRI была проведена на 23 имплантах. В целом среднее значение SGRI составило 2.29 ± 2.41 мм (95% ДИ 1.22–2.98 мм). Объем кости при установке импланта составил 2.41 ± 0.25 CC (95% ДИ 2.22–2.48 CC). В течение 6-месячного периода погруженного заживления была зафиксирована небольшая констрикция кости на уровне 11.3% (2.13 ± 0.24 CC; 95% ДИ 2.02–2.26; разница = 0.27 ± 0.25 CC; 95% ДИ 0.10–0.36; P = 0.0011). На первом году после нагрузки костный графт оставался стабильным (2.11 ± 0.22 CC; 95% ДИ 2.02–2.24). Разница не была статистически значимой (0.02 ± 0.07 CC; 95% ДИ 0.01–0.04; P = 0.2166). С точки зрения пациента среднее значение боли составило 0.52 ± 0.74 (диапазон 0–3); среднее значение отека составило 0.27 ± 0.52 (диапазон 0–2); и среднее потребление анальгетиков составило 0.87 ± 4.94 таблетки (диапазон 0–4) через 3 дня после операции. Морфологические и гистоморфометрические анализы показали, что все образцы имели нормальную структуру без воспалительного инфильтрата через шесть месяцев после заживления. Были обнаружены следующие фракции (%): кость (незрелая кость + зрелая кость): 44.07 ± 4.91; остаточный биоматериал: 23.98 ± 2.64; медуллярные пространства: 31.95 ± 3.16.
Заключения: Увеличение дна синуса можно успешно выполнить с помощью транс-крестцального подхода, используя специализированную имплантационную систему. В течение первых 6 месяцев заживления наблюдалась физиологическая усадка на 11,3% от первоначального объема костного трансплантата; после этого дополнительного уменьшения объема трансплантата не наблюдалось. Необходимы долгосрочные клинические исследования для подтверждения этих предварительных результатов.
Введение
Поэтапное поднятие дна синуса является распространенным решением для установки имплантатов при тяжелой атрофии верхней челюсти. Однако поднятие дна верхнечелюстного синуса с использованием латерального подхода подразумевает выполнение большого слизисто-периостального лоскута, что неизбежно влияет на послеоперационное восстановление и дополнительные затраты на процедуру увеличения. Перфорации синусной мембраны, носовые кровотечения, послеоперационная боль, отеки, гематомы и инфекции синуса являются возможными осложнениями.
Подъем дна верхнечелюстной пазухи через альвеолярный гребень (трансальвеолярный) был впервые описан Татумом в конце 1970-х годов и впервые опубликован Бойн в 1980 году. Техника неоднократно модифицировалась. Основные проблемы этой техники заключаются в ограниченном объеме костной аугментации, отсутствии визуального доступа к месту, риске перфорации мембраны Шнайдера и послеоперационных симптомах.
Закрытый транс-крестцальный гидравлический подъем мембраны Шнайдера и одновременная аугментация костной ткани могут быть выполнены с использованием специализированного зубного имплантата. Этот подход в основном отличается от ранее описанных гидравлических техник, поскольку подъем мембраны Шнайдера и аугментация костной ткани выполняются через имплантат.
В общем, процедуры подъема синуса адекватно увеличивают вертикальные размеры резорбированного альвеолярного процесса в задней части верхней челюсти, что позволяет устанавливать имплантаты достаточной длины. Уровень сокращения объема графта, о котором сообщается в литературе, колеблется от 20% до 50% как для аутогенной кости, так и для костных заменителей, таких как деминерализованный лиофилизированный костный аллографт (DFDBA), минерализованный лиофилизированный костный аллографт (FDBA) и ксенографты. В последние годы получили популярность рассасывающиеся биокерамики, состоящие из смеси гидроксиапатита и бета-триоксида кальция, которые продемонстрировали биоактивность и остеокондуктивность в различных гистологических исследованиях. Тем не менее, использование костных заменителей вызывает сомнения, когда высота кости превышает 3 мм.
Промежуточный 6-месячный отчет по этому исследованию первых 18 пациентов показал физиологическое сокращение на 13,9% от первоначального объема костного трансплантата с использованием системы поднятия синуса iRaise. Настоящее исследование оценивало клинические и радиографические результаты одностадийной процедуры поднятия синуса с использованием самонарезающей эндоссеосной имплантантной системы (iRaise, Maxillent, Херцлия, Израиль), разработанной для увеличения синуса, с использованием конусно-лучевой компьютерной томографии (КЛКТ) через 1 год после нагрузки. Это исследование следовало принципам Укрепления отчетности об наблюдательных исследованиях в эпидемиологии (STROBE) для улучшения качества наблюдательных исследований (http://www.strobe-statement.org).
Материалы и методы
Это исследование было спроектировано как проспективное наблюдательное исследование. Пациенты проходили лечение в частной практике в Риме, Италия, с сентября по декабрь 2014 года. Всем пациентам была разъяснена природа исследования, и они дали свое письменное согласие на хирургические и протезные процедуры, а также на использование клинических и радиологических данных. Хирургические процедуры выполняли два клинициста (MT и SMM), имеющие обширный опыт в установке имплантатов и процедурах увеличения синуса.
Последовательные пациенты в возрасте 18 лет и старше, способные подписать информированное согласие, нуждающиеся в восстановительных работах на имплантах для реабилитации их атрофированной задней челюсти, считались подходящими для включения. Выбранный участок должен был иметь остаточный альвеолярный гребень высотой не менее 3–8 мм и шириной 5 мм дистально от клыка, измеренный на КТ.
Критерии исключения:
- Общие противопоказания к имплантации;
- Подвергались облучению в области головы и шеи < 1 года до имплантации;
- Неконтролируемый диабет;
- Беременные или кормящие;
- Злоупотребление веществами;
- Курильщик с большим стажем (≥ 11 сигарет в день);
- Психиатрическая терапия или нереалистичные ожидания;
- Иммуносупрессия или иммунодефицит;
- Лечение или под наблюдением с использованием пероральных или внутривенных амино бисфосфонатов;
- Отсутствие противоположной окклюзии/протеза в области, предназначенной для установки имплантата;
- Тяжелый бруксизм или сжатие зубов;
- Зажившие участки (не менее 3 месяцев после удаления зубов);
- Необработанный пародонтит;
- Плохая гигиена полости рта и мотивация (кровотечение при зондировании во всей полости рта и индекс налета во всей полости рта > 25%);
- Пациенты, участвующие в других исследованиях, если это мешает правильному соблюдению настоящего протокола.
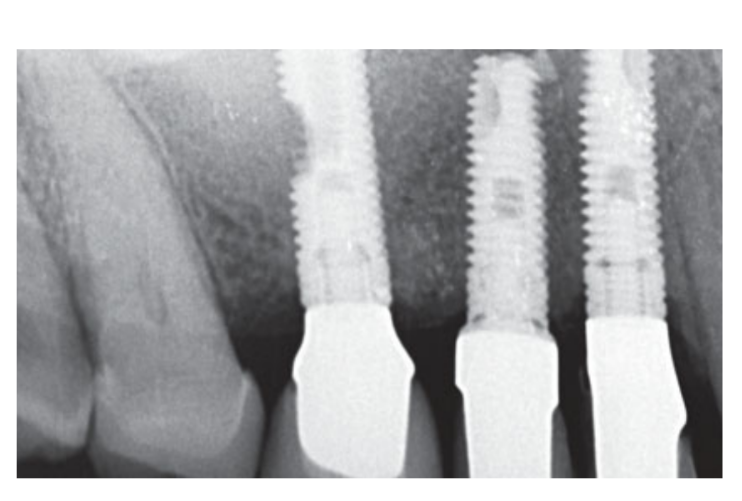
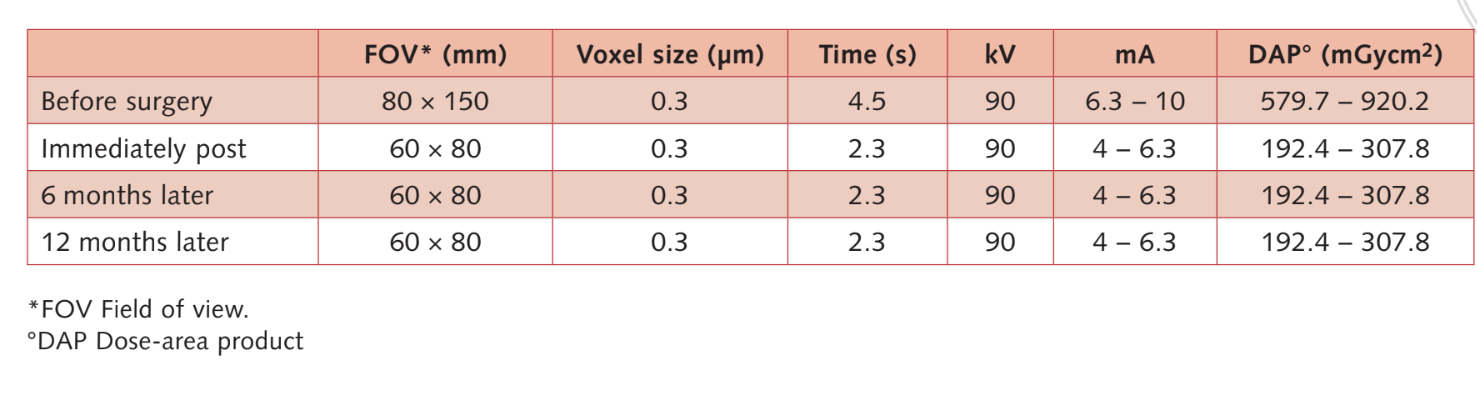
Умеренные курильщики были включены, и пациенты были классифицированы как некурящие или умеренные курильщики (≤ 10 сигарет в день). Предоперационные панорамные или перипикальные рентгенограммы и фотографии использовались для первоначального скрининга (Рис. 1 и 2). Компьютерная томография с конусным лучом проводилась для каждого пациента в течение 2 недель до операции (поле зрения 80 A~ 150 мм; размер вокселя 0.3 мкм; 4.5 с; 90 кВ; 6.3–10 мА; 579.7–920.9 мГр см2), сразу после процедуры, через 6 месяцев после установки имплантата и через 1 год после нагрузки (поле зрения 60 Å~ 80 мм; размер вокселя 0.3 мкм; 2.3 с; 90 кВ; 5–8 мА; 192.4–307.8 мГр см2) в рамках регулярного протокола лечения. Параметры экспозиции были установлены как можно ниже.
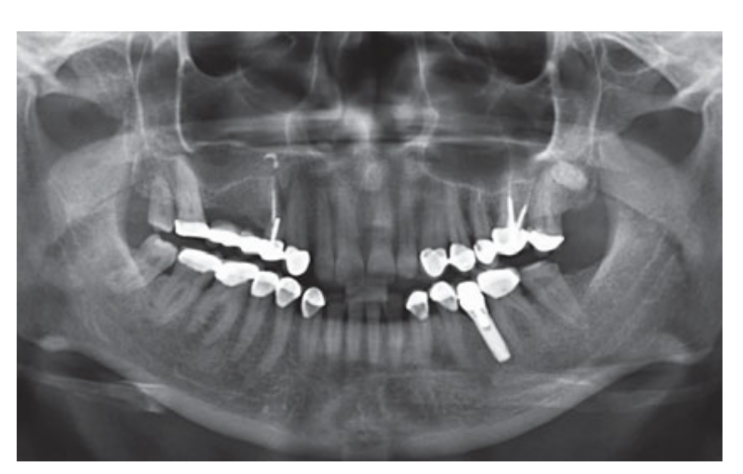
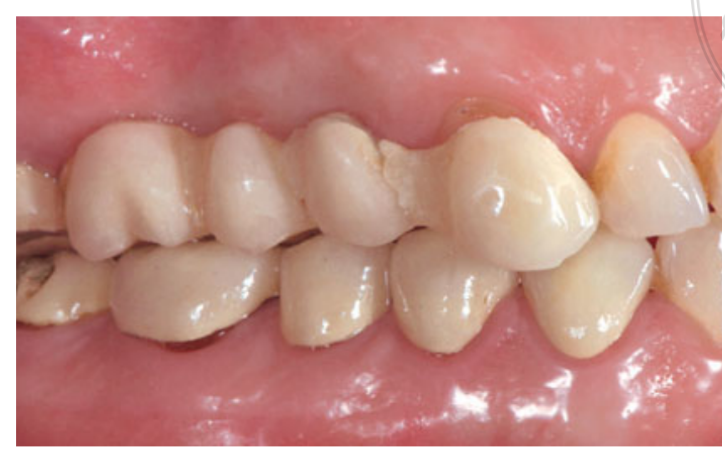
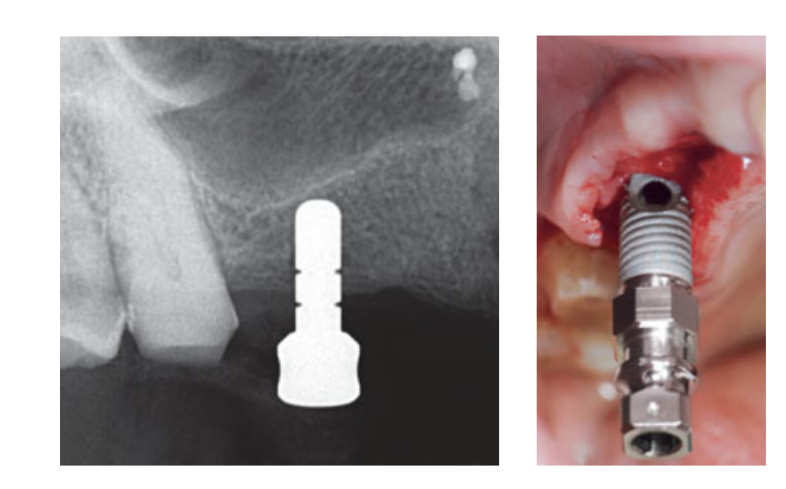
Интранозальная спрей-терапия (тиамфеникол глицината ацетилцистеин 810 мг/4 мл) и кортизон (бетаметазон 1 мг) вводились дважды в день, начиная с дня перед операцией. В день операции была введена однократная доза антибиотика (2 г амоксициллина и клавулановой кислоты или 600 мг клиндамицина, если есть аллергия на пенициллин) в профилактических целях за 1 час до операции. Полоскание рта хлоргексидином 0,2% проводилось в течение 1 минуты перед операцией. Местная анестезия с использованием артикаина с адреналином 1:100 000 была введена. Сделан разрез по средней линии, и был поднят полнослойный мукопериостеальный лоскут. Места для имплантатов были подготовлены в соответствии с протоколом сверления, предложенным производителем (Рис. 3а). Использовались стопоры для сверла и направляющие по глубине, чтобы достичь точного и безопасного контроля глубины остеотомии. Длина имплантата (от 13 до 16 мм) была выбрана заранее на основе остаточной высоты кости, измеренной с использованием предоперационных КТ-сканов, от костного гребня до дна синуса вдоль запланированной оси имплантата, и подтверждена с использованием специализированных рентгенографических инструментов (Maxillent). Имплантаты iRaise Sinus Lift (Maxillent) были вставлены в места остеотомии, выравнивая отверстие в имплантате по средней букалной линии и оставляя одну видимую резьбу винта над отверстием (Рис. 3б). Одноразовой трубчатый соединитель был прикручен к порту имплантата. Соединитель не касается имплантата, кроме силиконового кольца (медицинский силикон, предназначенный для имплантации). Затем 2-3 мл физиологического раствора были осторожно введены в синус через трубчатый соединитель и внутренний L-образный канал имплантата (диаметр 1,5 мм), изолированный от протезного соединения и, таким образом, от полости рта. Физиологический раствор был откачан обратно в шприц, и в откачанном физиологическом растворе было отмечено легкое физиологическое кровотечение. После этого шприц, заполненный 1 мл текучего материала костного трансплантата (MBCP Gel, Biomatlante, Виньё-де-Бретань, Франция), был смешан с 0,1 мл 0,9% стерильного физиологического раствора, который медленно вводился через тот же порт. MBCP Gel является 100% синтетическим инъекционным костным заменителем, состоящим из 60% бипацифического кальциевого фосфата и 40% гидроксиапатита, суспендированного в растворимом полимере, с гранулометрией от 80 до 200 мкм. После завершения процедуры трансплантации гидравлическая система была отключена, и вся длина имплантата была вставлена в место остеотомии и в трансплантированную синусовую полость и оставлена на заживление на 6 месяцев в соответствии с погруженным протоколом. Дополнительные имплантаты (iSure, Maxillent) были установлены в обработанной области после завершения хирургической последовательности iRaise (Maxillent) или через 6 месяцев в случаях, когда у пациентов была остаточная высота кости ≤ 3 мм в запланированном месте.
Интраназальная спрей-терапия (тиамфеникол глицинат ацетилцистеин 810 мг/4 мл) и кортизон (бетаметазон 1 мг) продолжались в течение 10 дней после операции. Антибиотики продолжались в течение 7 дней (1 г амоксициллина и клавулановой кислоты или 300 мг клиндамицина дважды в день) после операции. Полоскание рта хлоргексидином 0,2% использовалось в течение 1 минуты дважды в день в течение 2 недель, и мягкая диета рекомендовалась на 1 месяц. Ибупрофен 400 мг или парацетамол 1 г назначались в случае боли. Швы были удалены через 1 неделю, и инструкции по гигиене полости рта были усилены.
Шесть месяцев после установки имплантатов и увеличения синуса были подключены заживляющие абатменты. У пациентов, которым требовались поэтапные имплантаты, использовалась откалиброванная трефиновая бороздка с внешним диаметром 3,0 мм для подготовки участка, и был взят образец для гистологического анализа.
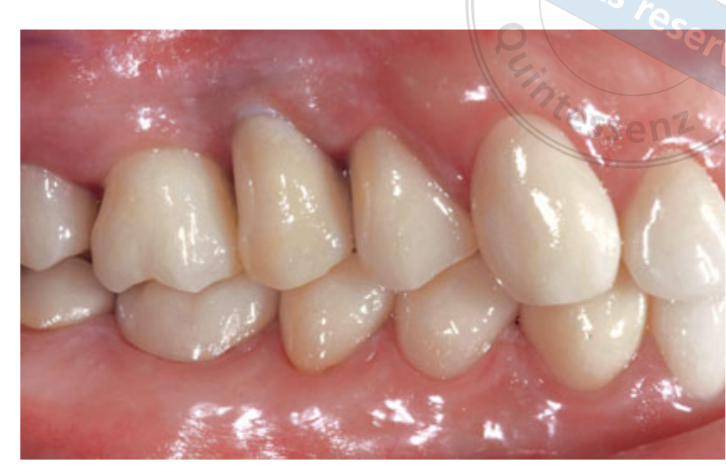
Две недели после второй операции был снят слепок с открытой лотком с использованием полиэфирного материала (Impregum, 3M ESPE, Зифельд, Германия). Временные реставрации не использовались. Окончательные реставрации были изготовлены с использованием технологии компьютерного проектирования (CAD) / компьютерного производства (CAM) и доставлены через 4 (одиночные коронки) до 6 недель (фиксированные протезы). Затем была тщательно проверена окклюзия. Повторные визиты для поддержания гигиены полости рта назначались каждые 4 месяца после нагрузки. Окклюзия также оценивалась при каждом визите (Рисунки 4 и 5).
Показатели результатов
Показатели результатов этого исследования были следующими:
- Имплантат считался неудачным, если он проявлял какую-либо подвижность, оцененную путем постукивания или покачивания головки имплантата металлическими ручками двух инструментов, и/или инфекция, требующая удаления имплантата, или любые механические осложнения (например, перелом имплантата), делающие имплантат бесполезным, хотя он все еще оставался механически стабильным в кости. Радиографическая оценка проводилась с использованием интраоральной рентгенограммы, сделанной с параллельной техникой, строго перпендикулярной интерфейсу имплантат-кость.
- Протез считался неудачным, если его необходимо было заменить альтернативным протезом.
- Любые биологические (боль, отек или гной, и т. д.) и/или механические (ослабление винта или перелом каркаса и/или облицовочного материала и т. д.) осложнения.
- Изменения уровня маргинальной кости оценивались с помощью интраоральных цифровых периапикальных рентгенограмм (прибор Digora Optime, Soredex, Тусула, Финляндия; Пластина для изображения, PSP [пластина с фотостимулируемым фосфором] размер 2, размер пикселя 30 мкм, разрешение 17 lp/mm), сделанных с параллельной техникой с использованием коммерчески доступных держателей для пленки (Rinn XCP; Dentsply Rinn, Эльгин, Иллинойс, США) при установке имплантата (базовый уровень), нагрузке имплантата и через 1 год после нагрузки. В случае нечитаемой рентгенограммы рентгенограмма была сделана снова. Все рентгенограммы отображались в пакете программного обеспечения для анализа изображений (DfW 2.8 для Windows, Soredex), который был откалиброван с использованием известной длины или диаметра зубных имплантатов. Расстояние от самого коронального края воротника имплантата до вершины костного гребня измерялось с точностью до 0,01 мм и принималось за уровень маргинальной кости. Мезиальные и дистальные значения усреднялись для каждого имплантата. Отрицательная разница между временными точками принималась за потерю маргинальной кости (MBL).
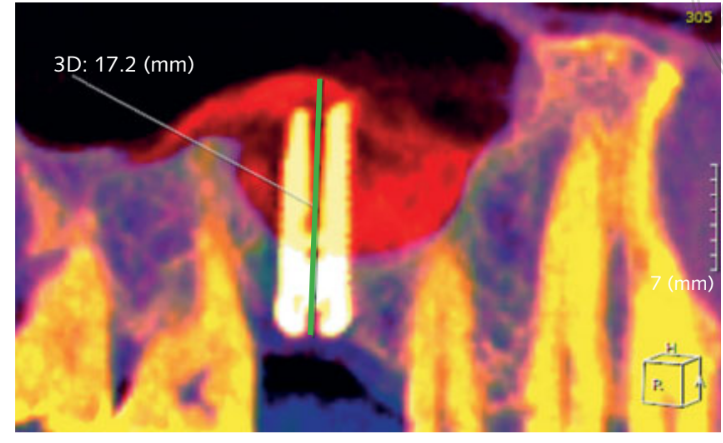
- Увеличенная высота кости (iBH) рассчитывалась на КТ-скане как расстояние между костным гребнем и самым верхним радиопрозрачным знаком материала пересадки, измеренным вдоль длинной оси имплантата. Прирост кости определялся как разница между iBH и предоперационной остаточной высотой альвеолярной кости (aBH), рассчитанной как расстояние между костным гребнем и полом синуса, измеренным вдоль длинной оси в идеальном положении имплантата (Рисунок 6).
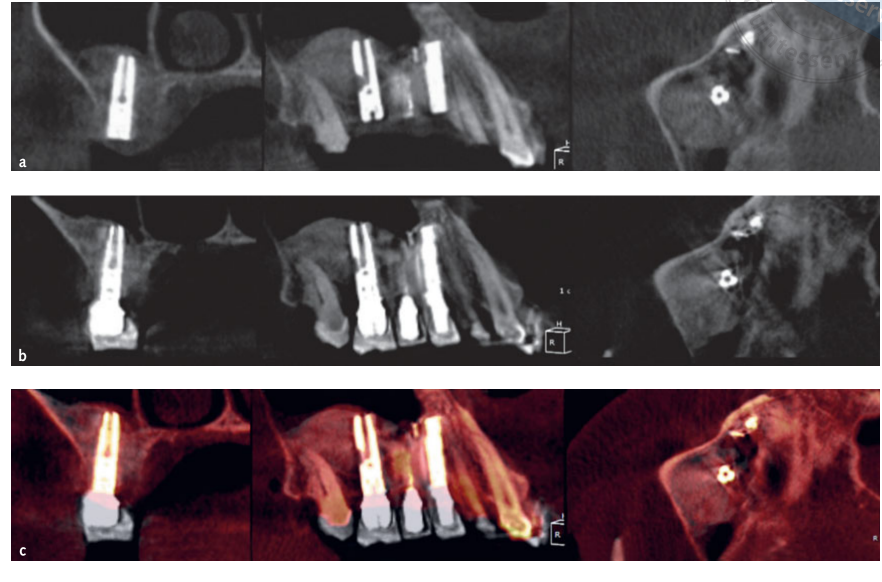
- Объемные измерения синусовых пересадок проводились на КТ-скане с использованием программного обеспечения OnDemand 3D, дополнительного модуля Fusion (Cybermed, Юсонг-гу, Тэджон, Корея) (Рисунок 7). Fusion — это инструмент визуализации, который использует продвинутую технику регистрации для наложения объемных данных с использованием информации о вокселях. Технология, лежащая в основе Fusion, известная как MI или Взаимная Информация, вычисляет статистическую зависимость между двумя объемами, интенсивность и значения корреляции энтропии и сравнивает разницу в энтропии суммы отдельных изображений и совместной энтропии объединенных изображений для слияния данных. Наложения постоперационных и предоперационных данных DICOM пациента выполнялись автоматически путем рисования области интереса (VOI) наложением на область, включающую неизменные анатомические ориентиры (например, зубы, базальный череп, имплантаты), и вручную проверялись на полное совпадение, обеспечивая максимальную точность наложения. Затем объемы пересаженного материала рассчитывались по сегменту в синусовой полости с использованием инструмента сегментации (OnDemand 3D, Cybermed). Этот инструмент предоставляет объемную информацию на основе непрозрачности пересаженного материала (Рисунки 8 и 9). Сегментированная область включала имплантаты и пересадку. Однако имплантаты могли быть четко отличимы от пересаженных материалов по их плотности и структуре и были исключены из измерений. КТ-сканы были сделаны до установки имплантата, сразу после и на 6- и 12-месячных контрольных обследованиях в соответствии с принципом ALARA (как можно ниже, разумно достижимо) (Таблица 1). Технология SMAR (Soredex Metal Artifact Reduction) использовалась для минимизации рассеяния от металлических артефактов. Один и тот же клиницист, который ранее не участвовал в исследовании, оценивал все 2- и 3-мерные радиографические измерения.
- Крутящий момент вставки фиксировался при установке имплантата с использованием хирургического блока (iChiro Pro, BienAir, Биен, Швейцария).
- Коэффициент стабильности имплантата (ISQ) фиксировался хирургом с использованием анализа резонансной частоты (прибор Osstell Mentor, Osstell, Гетеборг, Швеция). Для каждого имплантата проводились два измерения: одно букопалатальное с бугристой стороны и одно мезио-дистальное с мезиальной стороны. Оба измерения усреднялись, и результат отображался устройством в единицах ISQ, варьирующихся от 1 до 100. Значения фиксировались при установке имплантата (базовый уровень) и на 6-месячном контрольном обследовании.
- Пациенты самостоятельно сообщали о послеоперационной боли по порядковой шкале (0 = нет боли; 1 = легкая боль; 2 = умеренная боль; 3 = сильная боль): оценивалась через 3 дня после операции на послеоперационном осмотре слепым оценщиком.
- Пациенты самостоятельно сообщали о послеоперационном отеке по порядковой шкале (0 = нет отека; 1 = легкий отек; 2 = умеренный отек; 3 = сильный отек): оценивалась через 3 дня после операции на послеоперационном осмотре слепым оценщиком.
- Потребление обезболивающих: количество использованных таблеток (из 12 предоставленных таблеток [Ибупрофен 400 мг или парацетамол 1 г для тех, кто аллергичен к НПВП]): фиксировалось через 3 дня после операции на послеоперационном осмотре слепым оценщиком.
- Гистоморфометрический анализ использовался для вычисления объемных долей тканей (выраженных в процентах от общего объема), которые составляют образец (кость, биоматериал, мягкие ткани). Гистологические образцы были собраны и фиксированы в 10% формалине, затем обезвожены в увеличивающихся количествах спирта (70%, 80%, 90%, 96%, 100%), инфильтрированы в спиртовую смолу в уменьшающемся соотношении (3 спирта:1 смола, 1:1, 1:3, чистая смола) и, наконец, вмонтированы в чистую метилметакрилатную смолу (Technovit 7200 VLC, Exact Kulzer, Bio-Optica, Милан, Италия). После этого образцы были разрезаны пополам с помощью алмазного лезвия, чтобы получить два среза для каждого образца. Эти срезы были приклеены на пластиковые слайды, отшлифованы до толщины 100 мкм и в конечном итоге отполированы с помощью оксида алюминия 0,1%. Образцы были окрашены дихромной краской, состоящей из толуидинового синего и пиронина желтого, которая подчеркивает все различные тканевые фракции. Слайды были исследованы и сфотографированы с помощью светового и поляризованного микроскопа (Nikon Eclipse, Nikon Instruments S.p.A, Флоренция, Италия).
Статистический анализ
Весь анализ данных проводился в соответствии с заранее установленным планом анализа. Описательный анализ выполнялся с использованием среднего значения ± стандартного отклонения (SD), медианы и 95% доверительного интервала (CI) (SPSS для Mac OS X версии 22.0, IBM Corporation, Армонк, Нью-Йорк, США). Сравнения между различными конечными точками наблюдения и базовыми измерениями проводились с помощью парного t-теста Студента для выявления любых изменений. Все статистические сравнения проводились на уровне значимости 0.05. Пациенты использовались в качестве статистической единицы.
Результаты
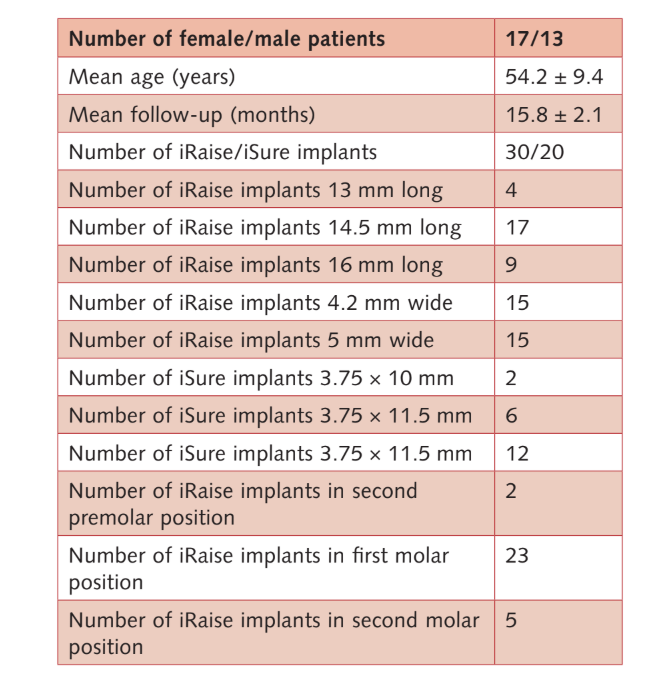
Всего 33 пациента были отобраны для участия, но трое из них отказались участвовать в исследовательском протоколе. Таким образом, 30 последовательных участников (17 женщин, 13 мужчин) со средним возрастом 54.2 ± 9.4 года (в диапазоне: 28–75) и тяжелой атрофией задней челюсти подверглись транс-крестовому поднятию синусной мембраны, установке костного графта и имплантации в запланированном месте, без отклонений от первоначального протокола. Средний срок наблюдения составил 15.8 ± 2.1 месяца после нагрузки на имплант (в диапазоне: 12–18). Основные характеристики пациентов и имплантов представлены в Таблице 2.
Всего было установлено 50 имплантатов (30 систем имплантатов iRaise и 20 дополнительных имплантатов iSure. Один пациент выбыл через год после загрузки на контрольном осмотре (пациент не захотел возвращаться для оценок). В течение периода наблюдения не было ни одного случая отказа имплантатов и протезов. Один пациент испытал небольшую разрыв мембраны, который был заделан коллагеновой губкой (Parasorb Cone, RESORBA Medical GmbH, Нюрнберг, Германия). Процедура была прервана и успешно повторена через 2 месяца. Других интраоперационных или послеоперационных неблагоприятных событий не наблюдалось.
Перед установкой имплантата средняя высота остаточного альвеолярного гребня составила 4.64 ± 0.86 мм (диапазон: 3.4–6.4 мм; 95% ДИ: 4.39 до 5.01 мм). Сразу после установки имплантата высота кости составила 17.92 ± 2.63 мм (95% ДИ 17.02 до 18.90). Через год после нагрузки высота кости осталась стабильной, со средним значением 16.86 ± 3.13 мм (95% ДИ 15.83 до 18.07). Разница составила 1.09 ± 1.60 мм (95% ДИ 0.00 до 1.16; P = 0.0010). Средний прирост кости (iBH - aBH) по сравнению с исходным уровнем составил 12.15 ± 2.96 мм (95% ДИ 11.22 до 13.38; P = 0.0000).
Средний уровень маргинальной кости при установке имплантата составил -0.16 ± 0.86 мм (95% ДИ -0.41 до -0.21).
При нагрузке имплантата средний уровень маргинальной кости составил 0.11 ± 1.06 мм (95% ДИ -0.15 до 0.60). На контрольном осмотре через 1 год после нагрузки средний MBL составил 0.19 ± 1.05 мм (95% ДИ 0.02 до 0.78). Разница от исходного уровня составила 0.36 ± 0.53 мм; 95% ДИ 0.08 до 0.47; P = 0.00095). Данные представлены в таблице 3.
Средний крутящий момент при установке имплантата составил 31.6 ± 8.1 Нсм (95% ДИ 29.9 до 35.7) (iChiro Pro, BienAir). Средний ISQ при установке имплантата составил 65.2 ± 5.4 (95% ДИ 63.6 до 67.4) и увеличился в течение периода заживления, достигнув среднего значения 73.6 ± 3.7 (95% ДИ 73.1 до 75.9; диапазон 62–79) при соединении с абатментом для заживления (через 6 месяцев после установки имплантата). Разница была статистически значимой (8.4 ± 5.3; 95% ДИ 5.9 до 39.7; P = 0.0000).
При установке имплантата 24 из 30 имплантатов имели костный графт над верхушкой имплантата. В целом (n = 30), среднее значение составило 2.95 ± 2.56 мм (95% ДИ 2.18 до 4.0). Через год после нагрузки средний костный графт над верхушкой был наблюдаем в 23 имплантатах. В целом (n = 29), среднее значение составило 2.29 ± 2.41 мм (95% ДИ 1.22 до 2.98).
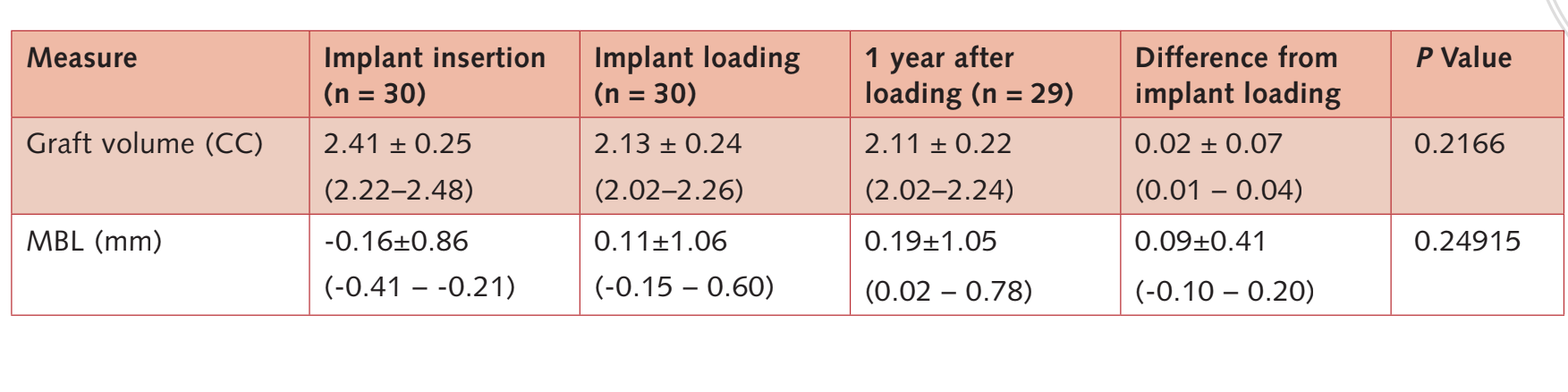
Объем кости при установке имплантата составил 2.41 ± 0.25 CC (95% ДИ 2.22 до 2.48). В течение 6-месячного периода погруженного заживления наблюдалось незначительное сокращение кости на 11.3%. (2.13 ± 0.24 CC; 95% ДИ 2.02 до 2.26; разница = 0.27 ± 0.25 CC; 95% ДИ 0.10 до 0.36; P = 0.0011). В течение первого года после нагрузки костный графт оставался стабильным (2. 11 ± 0.22 CC; 95% ДИ 2.02 до 2.24).
Разница не была статистически значимой (0.02 ± 0.07 CC; 95% CI 0.01 до 0.04; P = 0.2166).
Данные представлены в таблице 3.
Пациенты сообщили о своих ощущениях после операции. Среднее значение боли составило 0.52 ± 0.74 (диапазон 0–3); среднее значение отека составило 0.27 ± 0.52 (диапазон 0–2); среднее потребление анальгетиков составило 0.87 ± 4.94 таблеток (диапазон 0–4).
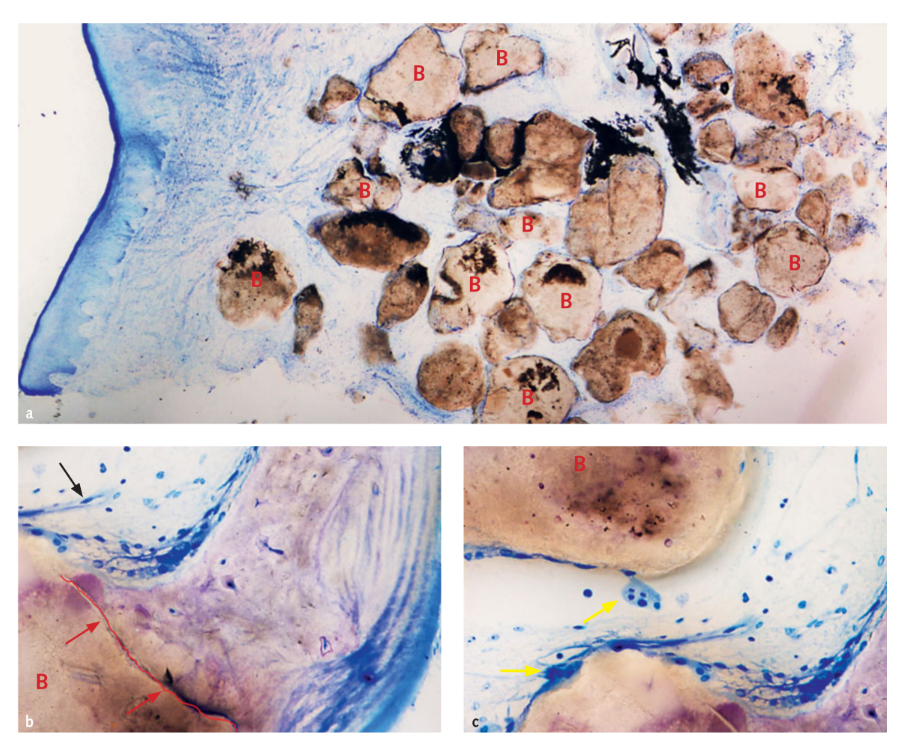
В трех случаях, когда был установлен поэтапный дополнительный имплантат, был взят образец трансплантата для гистологического анализа. Морфологические и гистоморфометрические анализы показали, что через 6 месяцев заживления все образцы имели нормальную структуру без наличия воспалительного инфильтрата (Рис. 10). Биоматериал оказался окруженным минерализованной матрицей, что свидетельствует о больших участках минерализации как при низком (Рис. 10a), так и при высоком увеличении. На рисунке 10b микрофотография показывает тесный контакт между трансплантатом и новой костной матрицей. Кровеносные сосуды были очевидны в костномозговых пространствах, предположительно, для поддержания ткани в фазах формирования и организации (Рис. 10b и 10c). Было обнаружено много костных клеток, в частности остеобластоподобных клеток на границах новой трабекулярной кости в тесном контакте с остеокластами в активной фазе формирования и ремоделирования новой кости (Рис. 10c). Гистоморфометрический анализ показал следующие доли тканей (%): кость (незрелая кость + зрелая кость): 44.07% ± 4.91; остаточный биоматериал: 23.98% ± 2.64; костномозговые пространства: 31.95% ± 3.16.
Обсуждение
Целью настоящего проспективного исследования было сообщить о данных через 1 год после нагрузки на новую имплантационную систему, которая позволяет одновременно выполнять синусный графт и установку имплантата с использованием трансрескального подхода. Поскольку оно было разработано как проспективное когортное исследование, основным ограничением является отсутствие контрольной группы. Тем не менее, настоящее исследование является одним из первых, которое оценивает клинические и рентгенографические данные из процедуры поднятия синуса с использованием специализированного имплантата с внутренним L-образным каналом через 1 год после нагрузки. Другим ограничением настоящего исследования может быть технология, использованная для измерения сокращения объема кости. Хотя эта технология позволяет накладывать и сегментировать различные объемы кости, научных доказательств не представлено. Поэтому данные следует интерпретировать с осторожностью.
На протяжении всего периода наблюдения ни один имплантат не потерпел неудачу, и был зафиксирован только один разрыв мембраны, без других неблагоприятных событий. Таким образом, основным клиническим аспектом этого проспективного исследования было то, что поднятие мембраны синуса можно безопасно выполнять с использованием гидравлического давления непосредственно через канал имплантата, что позволяет проводить костную трансплантацию (также через канал) и установку имплантата одновременно. Представленный подход можно применять при минимальном остаточном объеме кости в 3 мм между костным гребнем и полом синуса.
Согласно недавнему обзору Кокрана Эспозито и др. по процедурам поднятия синуса, использование костного заменителя вызывает сомнения, когда высота кости превышает 3 мм. Тем не менее, различные материалы для пересадки, как по отдельности, так и в комбинации, были подтверждены для эффективного использования в процедурах увеличения синуса, включая аутогенную кость, аллогенную кость, ксеногенную кость и аллопластические материалы (например, гидроксиапатит [HA], бета-трикальцийфосфат [β-TCP]). В настоящем исследовании использовалась смесь 60% HA и 40% β-TCP. Временная рукопись, сообщающая данные через 6 месяцев после установки имплантата на 18 пациентов, заключила, что во время заживления наблюдалась физиологическая усадка в 13,9% от первоначального объема пересадки. Настоящее исследование проанализировало общий размер выборки из 30 пациентов, сообщив о незначительной усадке кости в 11,3% в течение 6-месячного периода погруженного заживления. После этого костный графт оставался стабильным, с усадкой 0,95%. Недавний систематический обзор Шанбхага и др. по процедурам увеличения синуса, выполненным с использованием традиционного латерального подхода, сообщил о снижении объемов увеличения в ранний период заживления от 18% до 22% при использовании костных заменителей, без значительных различий между материалами для пересадки. В частности, в рандомизированном контролируемом испытании Кюля и др., в течение первых 6 месяцев увеличения верхнечелюстного синуса объем уменьшился на 15% для бифазного кальцийфосфата (BCP, 60% HA и 40% β-TCP) и на 18%, когда исследователи добавили частиц аутологичной кости на тестовом участке, без статистически значимых различий между двумя группами. Несколько других исследований также подтвердили уменьшение объема материала для пересадки. Хатано и др. предположили, что аутогенная кость или костный заменитель имеют размерную усадку в высоту на 20% в течение до 2 лет. Хотя аутологичная кость считается золотым стандартом в соответствии с Вилтфангом, многие опасения связаны с наблюдаемой непредсказуемой резорбцией. Это утверждение было подтверждено Шанбхагом и др. в систематическом обзоре, когда использовались блоки аутологичной кости, которые уменьшились в объеме на 45% со временем после 6 до 24 месяцев. Те же авторы подтвердили, что неорганическая бычья кость, использованная как отдельно, так и в комбинации с аутологичной костью, показала изменение объема от 15% до 21%, что предполагает лучшую стабильность объема по сравнению с аутологичной костью. Результаты этих исследований поддерживают выводы данного исследования.
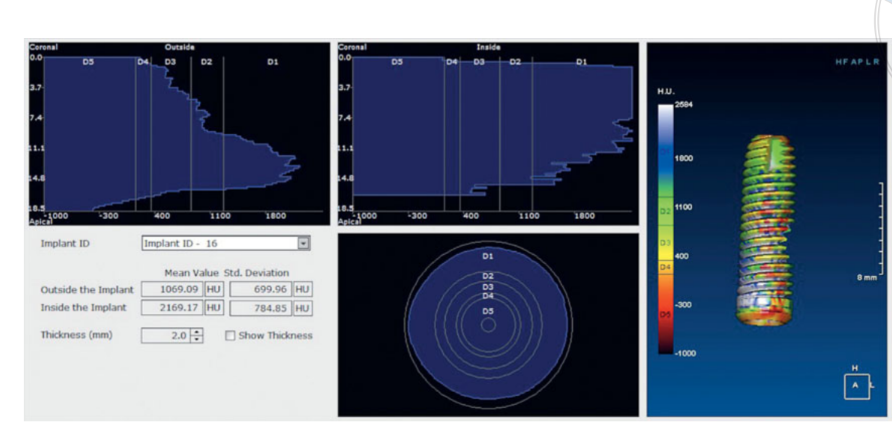
Гистология показала, что через 6 месяцев образцы характеризовались 44.07% ± 4.91 костной ткани на разных стадиях минерализации, 23.98% ± 2.64 остаточных частиц трансплантата и 31.95% ± 3.16 медуллярных пространств. Хотя примерно половина изначально пересаженного материала все еще присутствовала через 6 месяцев после погруженного заживления, радиологические данные из предыдущего предварительного исследования23 показали, что плотность трансплантата значительно улучшилась с 322.0 ± 100.42 единиц Хаунсфилда (HU) (диапазон: 177–449 HU; 95% ДИ: 246.4 до 377.6) до 1,062.0 ± 293.7 HU (диапазон: 573–1,489 HU; 95% ДИ: 876.12 до 1,259.88). Эта разница была статистически значимой (740.0 ± 295.35 HU; диапазон: 324–1,231; 95% ДИ: 426.04 до 811.96; P = 0.0001).
Единицы Хаунсфилда относятся к шкале D1-D5, основанной на значениях медицинской компьютерной томографии и не являются полностью надежными, когда речь идет о CBCT-сканированиях. Однако, согласно Кассетте и др., HU равнялся значениям плотности в градациях серого, умноженным на коэффициент преобразования 0.7. Таким образом, предыдущие предварительные исследования настоящего исследования показали среднюю плотность трансплантата (Рисунок 11), сопоставимую со значением D2 согласно классификации Лекхолма и Зарба. Кроме того, клинические данные показали, что средний ISQ при установке имплантата составил 65.2 ± 5.4 (95% ДИ 63.6 до 67.4) и увеличивался в течение периода заживления, достигая среднего значения 73.6 ± 3.7 (95% ДИ 73.1 до 75.9; диапазон 62–79). Разница была статистически значимой (8.4 ± 5.3; 95% ДИ 5.9 до 39.7; P = 0.0000). Все эти данные согласуются с высокими показателями выживаемости имплантатов, без каких-либо неудач в течение всего периода наблюдения.
Короткие имплантаты были предложены в качестве альтернативы процедурам поднятия синуса. Преимущества коротких имплантатов включают менее технически сложную операцию, следовательно, потенциально меньше осложнений и меньшие расходы (без костного графта). Данные нескольких рандомизированных контролируемых испытаний показали, что короткие имплантаты длиной от 4 до 8 мм могут быть подходящей, более простой, более дешевой и более быстрой альтернативой длинным имплантатам, установленным в увеличенной кости. Также было продемонстрировано, что процедуры поднятия синуса с использованием гидравлического давления обеспечивают высокую предсказуемость клинических результатов, вместе с крайне низкой заболеваемостью и сокращенными хирургическими тканями. Таким образом, как короткие, так и длинные имплантаты, установленные в сочетании с гидравлическим поднятием синуса, представляют собой жизнеспособные варианты лечения. Тем не менее, необходимы рандомизированные контролируемые испытания, а сроки наблюдения все еще слишком коротки, чтобы сделать окончательные выводы о наилучшем лечении для конкретных показаний.
Выводы
Увеличение синусового дна можно успешно выполнить с помощью транс-крестцального подхода, используя специализированную имплантационную систему, которая позволяет гидравлически поднимать мембрану Шнайдера, вводить текучий костный трансплантат и одновременно устанавливать зубные имплантаты с минимальным дискомфортом для пациента. Во время заживления наблюдалось физиологическое сокращение на 11,3% от первоначального объема костного трансплантата. После этого дополнительное уменьшение объема трансплантата не наблюдалось. Необходимы долгосрочные клинические исследования для подтверждения этих результатов.
Марко Талларико, Дэвид Л. Кохран, Эрта Ханари, Клаудия Деллавиа, Элена Канчиани, Эйтан Миджирицкий, Сильвио Марио Мелони
Ссылки
- Никениг Х.Й., Вихманн М., Цоллер Й.Е., Эйтнер С. Минимально инвазивное одноэтапное боковое поднятие синуса на основе 3-D – проспективное рандомизированное клиническое пилотное исследование с ослепительной оценкой послеоперационных видимых изменений объема мягких тканей лица. J Craniomaxillofac Surg 2014;42:890–895.
- Бешара С., Кубилиус Р., Веронези Г., Пирес Ж.Т., Шибли Ж.А., Мангано Ф.Г. Короткие (6 мм) зубные имплантаты против поднятия дна синуса и установки более длинных (≥10 мм) зубных имплантатов: рандомизированное контролируемое исследование с 3-летним наблюдением. Clin Oral Implants Res 2016 Jul 12. doi: 10.1111/ clr.12923. [Epub ahead of print].
- Катранжи А., Фотек П., Ванг Х.Л. Осложнения увеличения синуса: этиология и лечение. Implant Dent 2008;17: 339–349.
- Татум Х. мл. Реконструкции имплантатов верхней челюсти и синуса. Dent Clin North Am 1986;30:207–229.
- Бойн П.Ж., Джеймс Р.А. Пересадка дна верхнечелюстного синуса с использованием аутогенной костного мозга и кости. J Oral Surg 1980;38:613–616.
- Миш С.Е. Увеличение верхнечелюстного синуса для эндостеальных имплантатов. Организованные альтернативные планы лечения. Int J Oral Implantol 1987;4:49–58.
- Смилер Д.Г., Холмс Р.Е. Процедура поднятия синуса с использованием пористого гидроксиапатита: предварительный отчет. J Oral Implantol 1987;13:239–253.
- Вуд Р., Мур П. Пересадка верхнечелюстного синуса с использованием аутогенной кости, собранной интраорально, перед установкой имплантатов. Int J Oral Maxillofac Implants 1988;3:209–214.
- Кент Дж.Н., Блок М.С. Одновременное костное наращивание дна верхнечелюстного синуса и установка имплантатов с покрытием гидроксиапатитом. J Oral Maxillofac Surg 1989;47:238–242.
- Миш С.Е., Дитш Ф. Материалы для костных пересадок в имплантологии. Implant Dent 1993;2:158–167.
- Беттер Х., Славеску Д., Барбу Х., Кохран Д.Л., Чаушу Г. Минимально инвазивное устройство для поднятия синуса: предварительные результаты многоцентрового испытания безопасности и эффективности. Clin Implant Dent Relat Res 2014;16:520–526.
- Йоханссон Б., Грепе А., Ваннфорс К., Хирш Ж.М. Клиническое исследование изменений объема костных трансплантатов в атрофированной верхней челюсти. Dentomaxillofac Radiol 2001;30:157–161.
- Халльман М., Сеннерби Л., Зеттерквист Л., Лундгрен С. Трехлетнее проспективное исследование имплантируемых фиксированных протезов у пациентов, подвергшихся увеличению дна верхнечелюстного синуса с 80:20 смесью депротеинизированной бычьей кости и аутогенной кости: клинический, радиографический и анализ резонансной частоты. Int J Oral Maxillofac Surg 2005;34:273–280.
- Ваншиц Ф., Фигл М., Вагнер А., Рольф Е. Измерение изменений объема после увеличения дна синуса с использованием психогенного гидроксиапатита. Int J Oral Maxillofac Implants 2006;21:433–438.
- Кирмейер Р., Пайер М., Вехршуэц М., Яксе Н., Платцер С., Лоренцони М. Оценка трехмерных изменений после увеличения дна синуса с использованием различных материалов для пересадки. Clin Oral Implants Res 2008;19:366–372.
- Клайн Р.Й., ван ден Беккен Дж.Й., Бронкхорст Э.М., Берге С.Й., Мейер Г.Й., Янсен Я.А. Прогностическая ценность размеров гребня для резорбции аутогенной костной пересадки в поэтапной хирургии увеличения верхнечелюстного синуса с использованием конусно-лучевой КТ. Clin Oral Implants Res 2012;23:409–415.
- Уманьец-Корац С., У В., Хассан Б., Лю Y., Висмейер Д. Ретроспективный анализ скорости резорбции депротеинизированной бычьей кости как материала для пересадки верхнечелюстного синуса на конусно-лучевой компьютерной томографии. Clin Oral Implants Res 2014;25:781–785.
- Мелони С.М., Йованович С.А., Лолли Ф.М., Кассиса Ч., Де Риу Г., Пизано М., Лумбау А., Лугли П.Ф., Туллио А. Пересадка после поднятия синуса с использованием только неорганической бычьей кости по сравнению с 50:50 неорганической бычьей кости и аутогенной кости: результаты пилотного рандомизированного испытания через год. Br J Oral Maxillofac Surg 2015;53:436–441.
- Фрейссине П., Труйе Ж.Л., Рукет Н., Азимус Е., Ауфаж А. Оссеоинтеграция макропористых керамических фосфатов кальция с различным химическим составом. Biomaterials 1993;14:423–429.
- Дакульси Г., Лабу О., Малард О., Вейс П. Текущие достижения в области биокерамики бипараметрического фосфата кальция. J Mater Sci Mater Med 2003;14:195–200.
- Ле Нихуаннен Д., Саффарзаде А., Агуадо Е., Гойенваль Е., Готье О., Моро Ф., Пилет П., Спет Р., Дакульси Г., Лайроль П. Остеогенные свойства керамики фосфата кальция и композитов на основе фибрина. J Mater Sci Mater Med 2007;18:225–235.
- Эспозито М., Феличе П., Уортингтон Х.В. Интервенции для замены отсутствующих зубов: процедуры увеличения верхнечелюстного синуса. Cochrane Database Syst Rev 2014;13:CD008397.
- Талларико М., Мелони С.М., Ханари Э., Пизано М., Кохран Д.Л. Минимально инвазивная процедура увеличения синуса с использованием специализированного гидравлического устройства для поднятия синуса: проспективное исследование серии случаев по клиническим, радиологическим и ориентированным на пациента результатам. Int J Periodontics Restorative Dent 2017;37: 125–135.
- Талларико М., Беттер Х., Де Риу Г., Мелони С.М. Новая имплантационная система, предназначенная для гидравлического поднятия мембраны Шнайдера и одновременного увеличения костного трансплантата: ретроспективное клиническое исследование на срок до 45 месяцев. J Craniomaxillofac Surg. 2016;44:1089–1094.
- Шанбхаг С., Шанбхаг В., Ставропулос А. Изменения объема увеличений верхнечелюстного синуса с течением времени: систематический обзор. Int J Oral Maxillofac Implants 2014;29:881–892.
- Кюль С., Пайер М., Кирмейер Р., Вильдбургер А., Ачам С., Яксе Н. Влияние частиц аутогенной кости на раннюю стабильность объема верхнечелюстных трансплантатов с бипараметрическим фосфатом кальция: рандомизированное клиническое испытание. Clin Implant Dent Relat Res 2015;17:173–178.
- Хатано Н., Симидзу Й., Ооя К. Клиническая долгосрочная радиографическая оценка изменений высоты трансплантатов после увеличения дна верхнечелюстного синуса с 2:1 смесью аутогенной кости/ксенографта и одновременной установкой зубных имплантатов. Clin Oral Implants Res 2004;15:339–345.
- Вильтфанг Дж., Шультце-Мосгау С., Нкенке Е., Торвардт М., Нойкам Ф.В., Шлегель К.А. Увеличение onlay против процедуры поднятия синуса при лечении сильно резорбированной верхней челюсти: 5-летнее сравнительное продольное исследование. Int J Oral Maxillofac Surg 2005;34:885–889.
- Лекхольм У., Зарб Г.А. Выбор и подготовка пациента. В: Бране Марк П.И., Зарб Г.А., Альбректссон Т., редакторы. Тканевая интегрированная протезы: оссеоинтеграция в клинической стоматологии. Чикаго: Издательство Квинтессенс. 1985;1–356.
- Кассетта М., Стефанелли Л.В., Пачифици А., Пачифици Л., Барбато Е. Насколько точен CBCT в измерении плотности кости? Сравнительное исследование CBCT-CT in vitro. Clin Implant Dent Relat Res 2014;16:471–478.
- Эспозито М., Пеллегрино Г., Пистилли Р., Феличе П. Реабилитация задних атрофированных беззубых челюстей: протезы, поддерживаемые короткими 5 мм имплантатами или более длинными имплантатами в увеличенной кости? Результаты через год из пилотного рандомизированного клинического испытания. Eur J Oral Implantol 2011;4:21–30.
- Пистилли Р., Феличе П., Каннидзаро Г., Пиаттели М., Корвино В., Барауссе Ч., Бути Дж., Соарди Э., Эспозито М. Задние атрофированные челюсти, реабилитированные протезами, поддерживаемыми 6 мм длинными 4 мм широкими имплантатами или более длинными имплантатами в увеличенной кости. Результаты через год после нагрузки из пилотного рандомизированного контролируемого испытания. Eur J Oral Implantol 2013;6:359–372.
- Пистилли Р., Феличе П., Пиаттели М., Гессароли М., Соарди Э., Барауссе Ч., Бути Дж., Корвино В. Задние атрофированные челюсти, реабилитированные протезами, поддерживаемыми имплантатами 5 x 5 мм с новой нано-структурированной поверхностью титана, содержащей кальций, или более длинными имплантатами в увеличенной кости. Результаты через год из рандомизированного контролируемого испытания. Eur J Oral Implantol 2013;6:343–357.
- Гулье Ф.Л., Рагобер Г.М., Виссинк А., Мейер Г.Й. Одиночные коронки в резорбированной задней верхней челюсти, поддерживаемые либо 6-мм имплантатами, либо 11-мм имплантатами в сочетании с хирургией поднятия дна синуса: рандомизированное контролируемое испытание на 1 год. Eur J Oral Implantol 2014;7:247–255.
- Эспозито М., Барауссе Ч., Пистилли Р., Саммартино Г., Гранди Г., Феличе П. Короткие имплантаты против увеличения кости для установки более длинных имплантатов в атрофированных верхних челюстях: результаты через год после нагрузки из пилотного рандомизированного контролируемого испытания. Eur J Oral Implantol 2015;8:257–268.
- Эспозито М., Пистилли Р., Барауссе Ч., Феличе П. Трехлетние результаты рандомизированного контролируемого испытания, сравнивающего протезы, поддерживаемые 5-мм длинными имплантатами, или более длинными имплантатами в увеличенной кости в задних атрофированных беззубых челюстях. Eur J Oral Implantol 2014;7:383–395.