Увеличение костной ткани вокруг имплантата с помощью техники субперостального увеличенного слоя и костного блока животного происхождения: клинический случай
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Предпосылки: При использовании депротеинизированного бычьего костного минерала (DBBM), доставленного в виде частиц, техника субперостального периимплантного увеличенного слоя (SPAL) была эффективна в полном исправлении до 92% периимплантных бугристых костных дефицитов. Однако использование блока DBBM (bDBBM) может привести к улучшению периимплантного костного дефицита, а также к значительному латеральному увеличению кости, поскольку его механические свойства могут обеспечить лучшую размерную стабильность при манипуляциях с лоскутом по сравнению с частичным DBBM. Целью данного доказательства принципа является исследование возможности успешного использования SPAL для получения увеличения кости в местах периимплантных дефицитов при использовании bDBBM.
Презентация случая: Латеральное увеличение кости было выполнено с использованием техники SPAL на двух имплантатах, показывающих бугристый периимплантный костный дефицит сразу после их установки. Частичный лоскут был поднят, оставляя перостальную оболочку на бугристой кортикальной костной пластине. Перостальная оболочка, в свою очередь, была поднята для создания кармана, который использовался для стабилизации трансплантата bDBBM в периимплантных бугристых костных дефицитах. При повторном доступе открытые поверхности имплантатов были полностью покрыты новым толстым твердым тканевым материалом до их самой корональной части. Свободный эпителиально-соединительнотканный трансплантат был использован для увеличения фенотипа мягких тканей вокруг имплантата.
Заключение: При использовании для размещения bDBBM над самой корональной частью экспонированного имплантата, SPAL может успешно привести к увеличению толщины бугристой ткани вокруг имплантата. Clin Adv Periodontics 2022;12:39–43.
Предпосылки
Недавно была предложена упрощенная техника для увеличения костного компонента перимплантного фенотипа при установке имплантата, а именно, субпериостальная перимплантная увеличенная оболочка (SPAL). SPAL основана на разделении щечной лоскутной ткани на два слоя: периостальный слой, который создает "остеогенный" защищенный пространство для стабилизации трансплантата на тонкой или недостаточной щечной костной пластинке вокруг имплантата, и слизистый слой, который мобилизуется для обеспечения первичного заживления. Предыдущие исследования показали, что SPAL может привести к значительной коррекции декомпенсации, тем самым создавая условия для здоровья вокруг имплантатов. Также было показано, что SPAL эффективно лечит дефекты перимплантита типа декомпенсации, связанные как с интерпроксимальным, так и с циркумференциальным компонентом.
Во всех случаях, леченных с использованием SPAL, депротеинированный минерал костной ткани крупного рогатого скота (DBBM), доставляемый в виде частиц, был размещен между периостальной оболочкой и открытой поверхностью имплантата. Хотя было доказано, что он эффективно служит остеокондуктивным каркасом для создания пространства и получения полного покрытия периимплантных костных дефектов, частичный DBBM может быть связан с ограниченным увеличением толщины бугристой костной пластины.
Предклинические и клинические исследования, похоже, указывают на то, что направленная регенерация костной ткани (GBR) может привести к улучшению периимплантного костного дефицита, а также к значительному латеральному увеличению костной ткани при использовании блока DBBM (bDBBM). Настоящее исследование представляет собой доказательство принципа клинический отчет, направленный на изучение возможности успешного использования SPAL для получения увеличения костной ткани в местах периимплантных дефицитов при использовании bDBBM.
Этические аспекты
Настоящий отчет был одобрен Этическим комитетом Области Васта Эмилия Центро, Италия (протокол №637/2018/Oss/UniFe, дата одобрения 12.12.2018). Пациент предоставил письменное информированное согласие перед хирургическим лечением. Все клинические процедуры были выполнены в соответствии с Декларацией Хельсинки и Руководящими принципами надлежащей клинической практики.
Клиническая презентация, управление случаем и клинические результаты
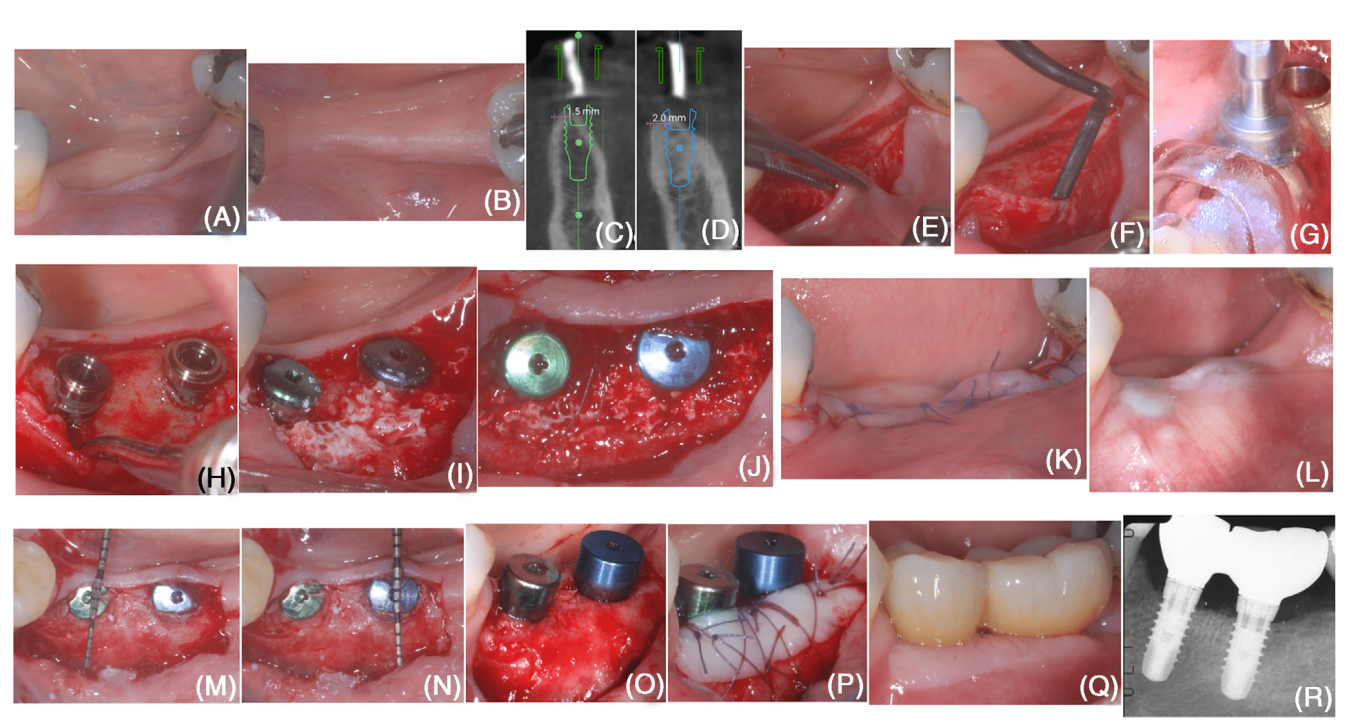
В октябре 2020 года 50-летняя женщина, не курящая, системно здоровая, обратилась для реабилитации беззубой области (#18 и #19; Рисунки 1A,B). После лечения III стадии пародонтита у пациента был зарегистрирован кровотечение при зондировании <10% и не было участков с глубиной зондирования ≥ 5 мм, и она была зачислена в поддерживающую
программа периодонтального ухода. Реабилитация на имплантатах была запланирована в области #18 и #19.
Положение имплантата было запланировано цифровым способом на основании исследования конусно-лучевой компьютерной томографии, и был изготовлен хирургический шаблон (Рисунок). Цифровое планирование показало формирование бугристой деhисценции при установке обоих имплантатов, что указывает на необходимость проведения процедуры горизонтальной костной аугментации (Рисунки 1C,D).
Пациенту была введена 2 г амоксициллина + клавулановой кислоты за 1 час до операции. Местная анестезия была достигнута с использованием артикаина с 1:100,000 адреналином, введенным путем местной инфильтрации.
На бугристой стороне был поднят лоскут с частичной толщиной (создавая "слизистый слой"), оставляя перостальную оболочку на беззубом гребне неповрежденной (Рисунок 1E). Затем перостальная оболочка была поднята от костного гребня с помощью микросurgical перостального лифта и туннельных ножей с различными угловыми острыми краями (Рисунок 1F). На язычной стороне был поднят лоскут полной толщины. Подъем был продлен в апикальном направлении, чтобы отделить поверхностные волокна мышц мойлоглоссуса и получить лоскут языка без натяжения.
Места для имплантатов были подготовлены с использованием компьютерного хирургического шаблона (Рисунок 1G), и два имплантата уровня ткани были установлены (Рисунок 1H). Имплантаты имели буковую декомпенсацию (измеренную как расстояние между апикальным краем полированной шейки имплантата и костным гребнем на буковой стороне имплантата) в 3 мм на #19 и 2 мм на #18. Коральные перфорации были выполнены с использованием карбидного бора.
bDBBM был обрезан с помощью высокоскоростного алмазного бора, чтобы получить однородную толщину 3–4 мм и был адаптирован под периостальным слоем, чтобы полностью покрыть открытую поверхность имплантата (Рисунок 1I). С использованием рассасывающегося шва 6/0 периостальный слой был стабилизирован к язычному лоскуту с помощью внутренних матрасных швов (Рисунок 1J). Слизистый слой был коронально продвинут, чтобы достичь первичного закрытия раны (Рисунок 1K).
Пациенту было рекомендовано избегать любого сжатия хирургического участка и не жевать или чистить зубы в обработанной области в течение 2 недель. Был назначен ополаскиватель для рта с 0,12% хлоргексидина (ополаскивание в течение 1 минуты дважды в день в течение 3 недель). Швы были удалены через 2 недели после операции.
Через 6 месяцев после установки имплантата (Рисунок 1L), была проведена повторная операция для экспозиции имплантата с использованием щечного лоскутного разреза с частичной толщиной. Ранее открытые поверхности имплантатов были полностью покрыты новой тканью, которая была не менее 3 мм в толщину в самой корональной части обоих имплантатов (Рисунки 1M–O). Восстановленная ткань оказала явное сопротивление проникновению с периодонтальным зондом, когда последний использовался с силой зондирования примерно 50 Н обученным оператором. Для увеличения фенотипа мягкой ткани вокруг имплантата был использован свободный эпителиально-соединительнотканный трансплантат (Рисунок 1P).
Цифровой отпечаток был снят через 4 недели после экспозиции имплантата. Форма и экстренная профиль финальной реставрации были спланированы цифровым образом. Две скрепленные коронки были изготовлены из моноблока циркония и цементированы на титановых вставках в соответствии с инструкциями производителя. Финальная реставрация была установлена через 4 недели после снятия отпечатка.
Состояние периимплантных тканей оказалось адекватным как при клиническом, так и при радиографическом обследовании (Рисунки 1Q–R).
Обсуждение
Настоящий отчет о случае предполагает, что bDBBM может представлять собой подходящую альтернативу частицам DBBM при применении техники SPAL для увеличения костной ткани в местах декомпенсации вокруг имплантатов.
В технике SPAL стабилизация трансплантата в субперостальном пространстве обеспечивается сшиванием его наиболее корональной части (тем самым ограничивая вредное воздействие механических разрушительных сил на смесь сгустка/трансплантата и способствуя тесному контакту последнего с высоко васкуляризованной структурой перостка) и последующим покрытием слизистой оболочкой. Одним из потенциальных недостатков при использовании частиц DBBM является возможность смещения и/или сжатия частиц трансплантата вокруг корональной части имплантата при сшивании. Эта проблема хорошо обоснована в литературе для ассоциации частиц DBBM и GBR. В отличие от этого, bDBBM может действовать как эффективный остеокондуктивный каркас, в то время как его механические свойства обеспечивают лучшую размерную стабильность при манипуляциях с лоскутом. Предыдущие доклинические и клинические исследования, похоже, подтверждают наши выводы. С другой стороны, жесткость блочного трансплантата требует идеальной пассивной адаптации слизистой оболочки, чтобы минимизировать риск перфорации лоскута и экспозиции трансплантата.
Открытие имплантата было выполнено через разрез с частичной толщиной лоскута, что предотвратило прямую инспекцию реконструированных тканей под периостом. Вместе с отсутствием гистологического анализа и/или послеоперационной трёхмерной рентгенографической оценки перимплантного пространства это препятствует возможности сделать какие-либо выводы о природе реконструированных тканей на ранее открытом вестибулярном аспекте имплантатов. Хотя толщина ткани (≥ 3 мм) и её высокая сопротивляемость проникновению зонда при повторном входе могут свидетельствовать о наличии минерализованного компонента на продвинутой стадии созревания, любые соображения о качестве субпериостальных тканей остаются спекулятивными, основываясь исключительно на механическом восприятии оператора во время зондирования. Доступные данные, полученные из экспериментальных исследований и 6-месячных человеческих гистологических образцов, где использовался bDBBM для латерального костного увеличения, показали более ограниченное образование новой кости, в основном расположенной на интерфейсе родной кости и bDBBM, по сравнению с частицами DBBM. Эти наблюдения, похоже, подтверждают необходимость улучшения остеогенных условий раны (например, кортикальные перфорации, использование дополнительных факторов роста) и/или ожидания более длительного времени созревания перед открытием имплантата, когда используется bDBBM. Клинические наблюдения, вытекающие из данного клинического случая, накапливаются с предыдущими данными из клинических случаев и ретроспективных серий случаев по технике SPAL. В целом, данные демонстрируют, что SPAL может быть успешно использована для увеличения костной ткани вокруг имплантата с использованием ксенографта на основе бычьей кости в различных клинических сценариях с точки зрения топографии имплантата (т.е. передний/задний сектор и верхнечелюстная/нижнечелюстная дуга), а также условий вестибулярной костной пластины на момент установки имплантата. В частности, клинически значимое увеличение было зарегистрировано для имплантатов с вестибулярной костной дефицитом или неповреждённой, но тонкой вестибулярной костной пластиной при установке. В имплантатах с костной дефицитом глубина дефектов до 6 мм была успешно исправлена с помощью SPAL. К сожалению, хотя данные обнадеживают, имеющаяся информация недостаточна для четкого определения местных показаний/противопоказаний к технике SPAL или для прояснения факторов, которые могут влиять на клинические результаты процедуры.
Заключение
Настоящий доказательство принципа кейс-отчет указывает на то, что техника SPAL может быть успешно использована для размещения bDBBM над самой корональной частью открытого импланта и достижения увеличения толщины бугристой ткани вокруг импланта.
Леонардо Тромбелли, Маттиа Севери, Лука Ортенси и Роберто Фарина
Ссылки
- Авила-Ортиз Г, Гонсалес-Мартин О, Кусо-Кейрига Е, Ванг ХЛ. Фенотип вокруг импланта. J Periodontol. 2020;91:283-288.
- Тромбелли Л, Севери М, Прамшталлер М, Фарина Р. Техника субперостального увеличения костной ткани вокруг импланта для горизонтального увеличения кости при установке импланта. Minerva Stomatol. 2018;67:217-224.
- Тромбелли Л, Севери М, Прамшталлер М, Фарина Р. Упрощенное управление мягкими тканями для увеличения костной ткани вокруг импланта. Int J Oral Maxillofac Implants. 2019;34:197-204.
- Тромбелли Л, Прамшталлер М, Севери М, Симонелли А, Фарина Р. Условия тканей вокруг имплантов, обработанных техникой субперостального увеличения костной ткани вокруг импланта: ретроспективное исследование случаев. Clin Oral Impl Res. 2020;31:992-1001.
- Тромбелли Л, Севери М, Фарина Р, Симонелли А. Техника субперостального увеличения костной ткани вокруг импланта для лечения поражений периимплантита. Clin Adv Periodontics. 2020;10:169-174.
- Беник ГИ, Тома ДС, Муньос Ф, Мартин ИС, Юнг РЕ, Хаммерле ХФ. Направленная регенерация кости при дефектах вокруг имплантов с использованием частиц и блоков ксеногенных костных заменителей. Clin Oral Impl Res. 2016;27:567-576.
- Беник ГИ, Тома ДС, Санз-Мартин И и др. Направленная регенерация кости на зубных имплантах из циркония и титана: пилотное гистологическое исследование. Clin Oral Impl Res. 2017;00:1-9.
- Беник ГИ, Эйзнер БМ, Юнг РЕ, Баслер Т, Шнайдер Д, Хаммерле ХФ. Изменения в твердых тканях после направленной регенерации кости при дефектах вокруг имплантов с сравнением блоков и частиц костных заменителей: 6-месячные результаты рандомизированного контролируемого клинического испытания. Clin Oral Impl Res. 2019;30:1016-1026.
- Аинамо Дж, Бэй И. Проблемы и предложения по регистрации гингивита и налета. Int Dent J. 1975;25:229-235.
- Мир-Мари Дж, Вуи Х, Юнг РЕ, Хаммерле ХФ, Беник ГИ. Влияние закрытия раны в слепую на стабильность объема различных материалов GBR: ин витро исследование с использованием конусно-лучевой компьютерной томографии. Clin Oral Impl Res. 2015;27:258-265.
- Наэнни Н, Бернер Т, Уоллер Т, Хюслер Дж, Хаммерле ХФ, Тома ДС. Влияние закрытия раны на стабильность объема при применении различных материалов GBR: ин витро исследование с использованием конусно-лучевой компьютерной томографии. J Periodontal Implant Sci. 2019;49:14-24.
- Лаас А, Хаммерле ХФ, Юнг РЕ, Тома ДС, Беник ГИ. Гистологические результаты после направленной регенерации кости при дефектах вокруг имплантов с сравнением индивидуально сформированных блоков и частиц костных заменителей. Int J Periodontics Restorative Dent. 2020;40:519-527.
- Араужо МГ, Сонхара М, Хаясибара Р, Кардарополи Г, Линдхе Дж. Увеличение бокового гребня с использованием трансплантатов, состоящих из аутологичной кости или биоматериала. Эксперимент на собаке. J Clin Periodontol. 2002;29:1122-1131.
- Ода А, Киносита К, Уэда М. Влияние перфорации кортикальной кости на дистракцию перостка: экспериментальное исследование на нижней челюсти кролика. J Oral Maxillofac Surg. 2009;67:1478-1485.
- Шварц Ф, Ротамель Д, Хертен М, Феррари Д, Загер М, Беккер Дж. Увеличение бокового гребня с использованием частиц или блоков костных заменителей, биопокрытых rhGDF-5 и rhBMP-2: иммуноистохимическое исследование на собаках. Clin Oral Impl Res. 2008;19:642-652.