Состояние периимплантных тканей у имплантатов, обработанных техникой субпериостальной увеличенной оболочки: ретроспективное исследование случаев
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Цели: Оценить состояние периимплантных тканей в краткосрочной перспективе у пациентов, получивших технику субперостной увеличенной имплантантной оболочки (SPAL), и у пациентов с достаточной толщиной (≥2 мм) бугристой кости периимплантного участка (PBBP) при установке имплантата.
Методы: Пациенты, у которых дефект декомпенсации или тонкая PBBP при установке имплантата были исправлены с помощью техники SPAL (группы SPALдехисценция и SPALтонкая, соответственно), и пациенты с остаточной толщиной PBBP ≥2 мм при установке имплантата (контрольная группа) были выбраны ретроспективно. Основным результатом было количество периимплантных участков с положительным результатом на кровотечение при зондировании (BoP) через 6 месяцев после протезирования. Также оценивались высота кератинизированной слизистой, уровень маргинальной мягкой ткани, индекс налета, глубина зондирования периимплантного участка, гной при зондировании и радиографический уровень костной ткани (RBL) в межзубных промежутках.
Результаты: В исследование были включены тридцать четыре пациента (11 в группе SPALдехисценция, 11 в группе SPALтонкий и 12 в контрольной группе). В каждой группе SPAL 10 пациентов (90.9%) показали толщину периимплантной ткани ≥2 мм в самой корональной части импланта при открытии. Преобладание (число) положительных по BoP участков составило 2, 1 и 0 в группах SPALдехисценция, SPALтонкий и контрольной группе соответственно. RBL составил 0.3 мм в группе SPALдехисценция, 0.2 мм в группе SPALтонкий и 0 мм в контрольной группе.
Заключение: После 6 месяцев протезирования пациенты, леченные с использованием техники SPAL, показывают ограниченное воспаление периимплантной слизистой в сочетании с мелким PD и адекватным KM. Однако у имплантатов, получивших технику SPAL, интерпроксимальный RBL был обнаружен апикально от его идеального положения.
Введение
Протезно-ориентированное размещение имплантатов в условиях уменьшенной горизонтальной костной размерности часто приводит к периимплантной костной деhисценции или фенестрации. Даже при наличии неповрежденной, но тонкой бугристой кортикальной костной пластины, хирургическая травма и последующее ремоделирование кости после установки имплантата могут привести к вертикальной потере кости с обнажением корональной части имплантата при открытии (Merheb et al., 2017, Monje et al., 2019, Spray, Black, Morris, 2000). Хотя было показано, что количество ремоделирования кости после установки имплантата было схожим как при тонких, так и при толстых бугристых костных пластинах (Merheb et al., 2017), такое ремоделирование может по-разному влиять на целостность периимплантной бугристой костной пластины (PBBP). В этом отношении был показан повышенный риск эстетических и биологических осложнений после установки имплантатов в участках с деhисценцией или тонкой PBBP по сравнению с толстой PBBP в доклинических (Monje et al., 2019) и клинических (Schwarz, Sahm, Becker, 2012, Jung et al., 2017) исследованиях. В совокупности эти результаты подчеркивают важность целостности и толщины PBBP при установке имплантатов для обеспечения стабильных, здоровых условий периимплантных тканей с течением времени (Sanz-Sánchez et al., 2018).
Наиболее документированная и эффективная процедура хирургической коррекции дефекта типа деисценции основана на использовании барьерных мембран в сочетании с костными заменяющими трансплантатами в соответствии с принципами направленной регенерации кости (GBR) (Sanz-Sánchez, Ortiz-Vigón, Sanz-Martín, Figuero, Sanz, 2015). Снижение или разрешение периимплантной костной деисценции, о котором сообщалось после GBR (Thoma, Bienz, Figuero, Jung, Sanz-Martín, 2019), кажется, положительно сказывается на долгосрочных условиях имплантатов, в терминах выживаемости имплантатов и стабильности периимплантных тканей (Sanz-Sánchez et al., 2018). К сожалению, не совсем ясно, в какой степени увеличенная толщина периимплантной кости, связанная с полным покрытием обнаженной поверхности имплантата, может поддерживать здоровье периимплантных тканей.
Недавно была описана упрощенная процедура костной аугментации, а именно техника субпериостальной аугментированной оболочки (SPAL), основанная на использовании периоста в качестве барьерной мембраны и трансплантата в качестве «устройства» для создания пространства для костной аугментации одновременно с установкой имплантата (Trombelli, Severi, Pramstraller, Farina, 2018). Эффективность этой техники для коррекции периимплантной костной деисценции и/или для увеличения толщины периимплантной кости была ранее сообщена (Trombelli, Severi, Pramstraller, Farina, 2019), и ее применение также было исследовано при лечении дефектов периимплантита (Trombelli et al. 2020). Целью настоящей ретроспективной серии случаев было оценить состояние периимплантных тканей в краткосрочной перспективе у пациентов, получающих технику SPAL, по сравнению с пациентами с адекватной толщиной (≥2 мм) PBBP при установке имплантата.
Материалы и методы
2.1 Дизайн исследования и этические аспекты
Настоящее исследование было разработано в соответствии с руководящими принципами STROBE, Приложение S1. Протокол был одобрен Этическим комитетом Area Vasta Emilia Centro, Италия (протокол № 637/2018/ Oss/UniFe, дата одобрения 12.12.2018). Каждый пациент предоставил письменное информированное согласие перед хирургическим лечением. Все клинические процедуры проводились в соответствии с Декларацией Хельсинки и Руководством по хорошей клинической практике (GCP).
2.2 Популяция исследования
Записи пациентов, прошедших имплант-supported протезирование в период с декабря 2015 года по июль 2018 года в Исследовательском центре по изучению пародонтальных и периимплантных заболеваний Университета Феррары и в одной частной стоматологической клинике в Ферраре, были отобраны для определения соответствия пациентов критериям включения в исследование. Включение пациентов в исследование зависело от следующих критериев:
- Не курящие или курящие ≤10 сигарет в день на момент операции;
- Не диабетики или хорошо контролируемые диабетики (HbA1c ≤ 7%) на момент операции;
- Наличие клинических параметров и рентгенографических исследований для исследования (см. «Параметры исследования» для подробностей).
- Не принимающие препараты, влияющие на костный метаболизм (например, бисфосфонаты, кортикостероиды);
- Прошедшие установку имплантата полностью в родной кости (с остаточной толщиной PBBP ≥2 мм после установки имплантата) или одновременно с техникой SPAL.
Включение имплантата в исследование подчинялось следующим критериям:
- Установка в заживленном гребне (имплантаты типа IV, Хаммерле, Чен, Уилсон, 2004);
- Первичная стабильность, оцененная по моменту вставки.
На основе условий PBBP на момент установки имплантата и его клинического ведения пациенты были разделены на три группы:
- Пациенты с имплантатом/имплантатами, имеющими остаточную толщину PBBP ≥2 мм после установки имплантата (контрольная группа);
- Пациенты с имплантатом/имплантатами, леченными с использованием техники SPAL для коррекции периимплантной костной деhисценции ≥3 мм одновременно с установкой имплантата (группа SPALдеhисценция);
- Пациенты с имплантатом/имплантатами, леченными с использованием техники SPAL для увеличения тонкой (≤1 мм) PBBP одновременно с установкой имплантата (группа SPALтонкая).
2.3 Клинические процедуры
Перед установкой имплантата все пациенты прошли активное лечение кариозных поражений и заболеваний пародонта и были включены в профессиональное обслуживание с частотой визитов, запланированной в соответствии с инструментом оценки PerioRisk (Тромбелли, Фарина, Феррари, Пасетти, Калура, 2009, Тромбелли и др., 2017).
Все хирургические процедуры проводились двумя опытными пародонтологами (Л.Т. и М.П.). Пациентам была введена 2 г амоксициллина + клавулановой кислоты (Аугментин, GlaxoSmithKline) за час до операции. Местная анестезия была достигнута с использованием артикаина с 1:100,000 адреналином, введенным местной инфильтрацией.
2.3.1 Хирургические процедуры — группы SPAL
У пациентов, у которых либо дефект декомпенсации, либо тонкая PBBP при установке были исправлены с помощью техники SPAL (Рисунки 1 и 2 соответственно), хирургический доступ к костному гребню был выполнен, как описано ранее (Тромбелли, Севери, Прамшталлер и Фарина, 2018). Кратко, слизистая оболочка была поднята на щечной стороне с помощью диссекции с частичной толщиной с использованием лезвия 15C, а также туннельных ножей (KPAX, TKN1X и TKN2X, Hu-Friedy) с различными угловыми острыми краями в зависимости от анатомического расположения. Затем надкостница была поднята с кости с помощью надкостничного подъемника (PTROM, Hu-Friedy), создавая карман, который мог вместить трансплантат. Полноценный лоскут был поднят на оральной (язычной/небной) стороне.
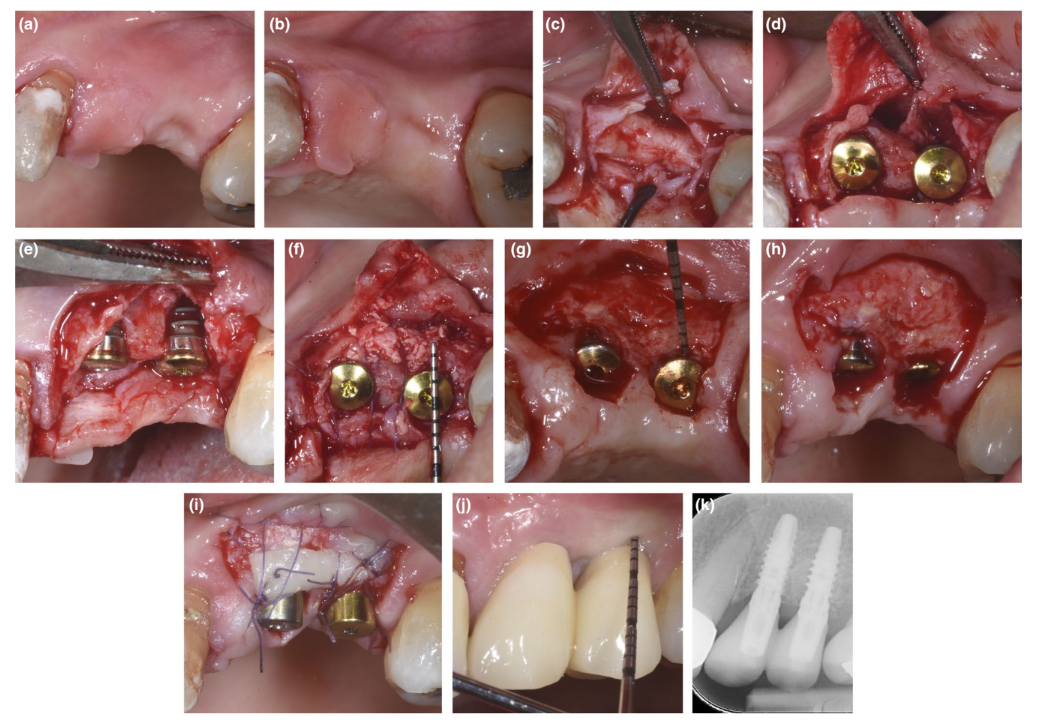
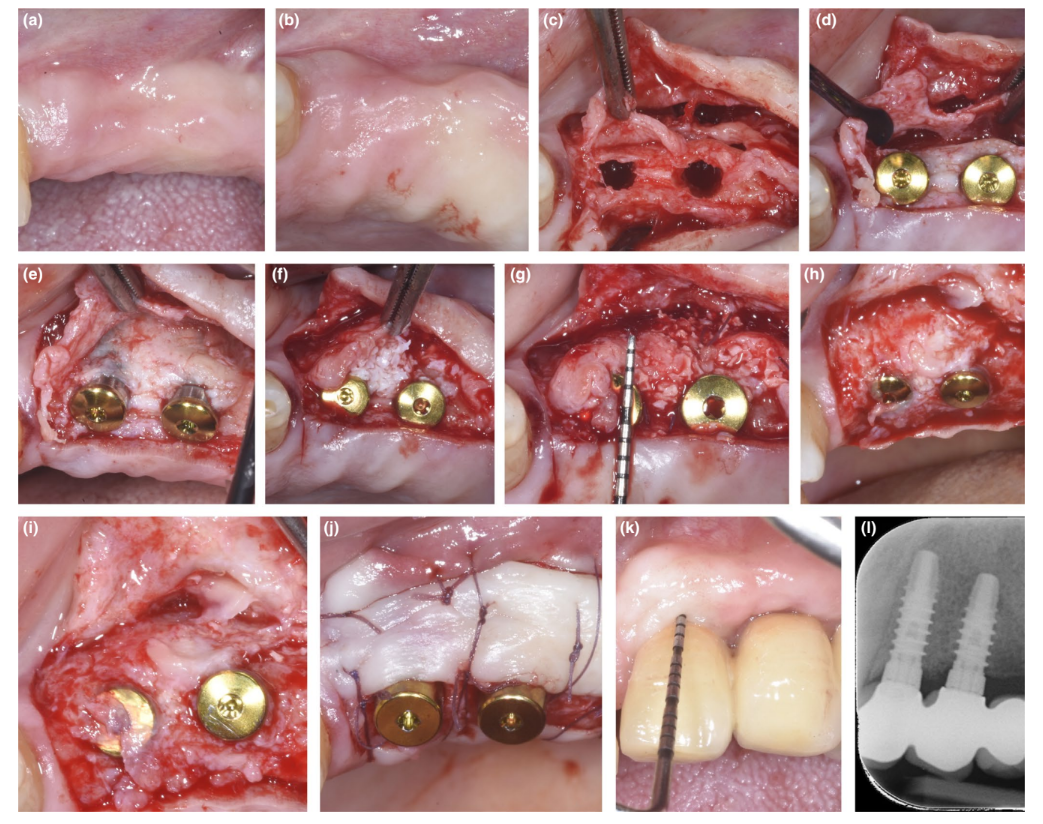
Имплантаты на уровне тканей (SPI Element™; Thommen Medical) были установлены. Использовался ксенографт на основе бычьей кости (Bio-Oss® гранулы губчатого вещества, размер частиц 0,25–1,0 мм; Geistlich Pharma, AG) как отдельно, так и в комбинации с аутогенными частицами кортикальной кости для заполнения хирургически созданного пространства между периостальной оболочкой и либо тонкой бугристой костью, либо обнаженной поверхностью имплантата. В случае наличия деhисценции была проведена пересадка для полного исправления дефекта вокруг имплантата до полированной шейки. Во всех случаях субпериостальный графт обеспечивал как минимум 2 мм толщины в самой корональной части имплантата.
Корональная часть периостальной оболочки была стабилизирована к оральному мукопериостальному лоскуту с помощью рассасывающихся внутренних матрасных швов (Vicryl 6/0, Ethicon). Затем слизистая оболочка была коронально продвинута и зашита без натяжения с помощью горизонтальных внутренних матрасных и прерывающихся швов, чтобы погрузить как графт, так и имплантаты.
При повторном вмешательстве для открытия имплантата была диссектирована щечная разрезная лоскутная ткань для установки заживляющего абатмента. Для обеспечения адекватных размеров кератинизированной перимплантной слизистой либо был выполнен лоскут, расположенный апикально, либо свободная десневая пересадка (Тромбелли, Севери, Прамшталлер и Фарина, 2019).
2.3.2 Хирургические процедуры — контрольная группа
Была поднята щечная и язычная/небная полная лоскутная ткань для обнажения костного гребня. Место имплантации было подготовлено в соответствии с инструкциями производителя, и были установлены имплантаты уровня ткани (SPI Element™; Thommen Medical). Из-за наличия остаточной толщины PBBP ≥2 мм процедура костной аугментации не проводилась. Во всех случаях лоскут был обрезан и размещен вокруг заживляющего абатмента с помощью рассасывающихся швов (Vicryl 6/0, Ethicon). Дизайн и манипуляции с лоскутом, а также техника наложения швов были выполнены для обеспечения адекватных размеров (высота, толщина) кератинизированной перимплантной слизистой.
2.3.3 Послеоперационные процедуры
Пациентам было рекомендовано не носить съемные протезы, чтобы избежать давления на хирургический участок, как минимум в течение 4 недель, и не жевать или чистить зубы в обработанной области примерно в течение 2 недель.
Для домашнего использования был назначен раствор хлоргексидина 0,12% (Curasept ADS Trattamento Rigenerante®; Curaden Healthcare) для химического контроля налета (полоскание в течение 1 минуты дважды в день в течение 3 недель). Швы были удалены через 2 недели после операции.
2.3.4 Время протезирования
Протезирование началось через 3–4 месяца после установки имплантата в контрольной группе, тогда как в группах SPAL - как минимум через 4 недели после открытия имплантата.
2.4 Параметры исследования
2.4.1 Клинические параметры
Через 6 месяцев после протезирования обученный экзаменатор (М.С.), который участвовал в предыдущих исследованиях по технике SPAL (Тромбелли, Севери, Прамшталлер, Фарина, 2019), выполнил следующие клинические измерения с помощью пародонтального зонда UNC-15 в следующей хронологической последовательности:
- Высота кератинизированной слизистой (КС): измерялась на средней щечной стороне имплантата как расстояние между щечной периимплантной слизистой и мукогингивальным соединением, и записывалась с точностью до миллиметра;
- Уровень краевой мягкой ткани (УКСТ) (Цитцманн, Шарер, Маринелло, 2001): измерялся на средней щечной стороне имплантата как расстояние между щечной периимплантной слизистой и соединением имплантата и абатмента, и записывался с точностью до миллиметра. УКСТ записывался как положительный или отрицательный, когда край абатмента находился выше или ниже слизистой соответственно;
- Индекс налета (ИН; О'Лири, Дрейк, Нейлор, 1972): фиксировался на мезощечной, средней щечной, дистощечной, средней язычной/небной сторонах имплантата как наличие или отсутствие супрагингивального налета после исследования юкстагингивального протезного края с помощью зонда;
- Глубина зондирования (ГЗ): измерялась от слизистой до самой глубокой проникаемости зонда на шести участках (мезощечный, средний щечный, дистощечный, дистоязычный, средний язычный и мезоязычный) с использованием силы 0.2–0.3 Н и записывалась с точностью до миллиметра;
- Кровоточивость при зондировании (КПЗ; Аинами и Бэй, 1975): фиксировалась как присутствующая или отсутствующая при оценке ГЗ;
- Гнойное выделение при зондировании (ГВЗ): фиксировалось как присутствующее или отсутствующее при оценке ГЗ.
2.4.2 Радиографический уровень кости
Нестандартизированные периапикальные рентгенограммы, сделанные с использованием техники параллельного длинного конуса через 6 месяцев после протезирования, были оцифрованы и проанализированы с помощью специально разработанного программного обеспечения (NIS elements v4.2; Nikon Instruments, Campi Bisenzio). Радиографический уровень кости (RBL) измерялся как расстояние (округленное до ближайших 0.1 мм) между апикальным краем полированной шейки имплантата и костным гребнем на мезиальном (mRBL) и дистальном (dRBL) аспектах каждого имплантата с использованием увеличения 10x–15x. Для калибровки использовалась контрольная метка высотой 1 мм, присутствующая на цифровой рентгенограмме.
Одним экзаменатором (A.S.) были выполнены радиографические измерения. Экзаменатор участвовал в сессии калибровки на выборке рентгенограмм, полученных от пациентов, не отобранных для настоящего исследования. Сессия калибровки состояла из двух сессий измерений RBL, проведенных с интервалом в 7 дней, и позволила достичь отличного внутрипроверочного согласия (k score = 0.89), со средней разницей между парными измерениями 0.04 ± 0.15 мм.
2.5 Статистический анализ
Пациент рассматривался как статистическая единица. Если два или более имплантата у одного пациента подходили для исследования, только один имплантат случайным образом включался в анализ. Данные описывались с использованием среднего значения и стандартного отклонения (SD), медианы и интерквартильного диапазона (IR), минимальных и максимальных значений для количественных переменных, а также частоты и процента для категориальных переменных.
Медианное количество участков с положительным BoP, оцененное через 6 месяцев после нагрузки имплантата, было основной переменной результата исследования. Медианные значения PD, KM, MSTL, RBL, количество участков с положительным PlI и количество участков с положительным SoP были вторичными переменными результата.
Из-за ограниченного размера выборки никаких инференциальных статистических методов не проводилось, и результаты были представлены в нарративной форме. Тем не менее, размер эффекта (ES) был рассчитан для каждой переменной результата согласно непараметрическому тесту Краскала–Уоллиса. ES классифицировался как малый (d = 0.1–0.3), средний (d = 0.3–0.5) или большой (d ≥ 0.5) (Коэн, 1988).
Результаты
3.1 Популяция исследования
В исследование были включены тридцать четыре пациента с 34 имплантами (11 в группе SPALдехисценция, 11 в группе SPALтонкий и 12 в контрольной группе). Подавляющее большинство пациентов были некурящими (90,9% в группе SPALдехисценция, 90,9% в группе SPALтонкий и 75% в контрольной группе). Импланты в группе SPALдехисценция в основном располагались в нижней челюсти, тогда как импланты в группах SPALтонкий и контрольной группе в основном устанавливались в верхней челюсти (Таблица 1). В течение периода наблюдения не было потеряно ни одного пациента или импланта.
В группе SPALдехисценция 1 пациент показал деhисценцию раны через 2 недели, с частичным обнажением витков импланта. Пациент наблюдался ежемесячно до повторного вмешательства, и участок локально дезинфицировался раствором хлоргексидина 0,12% на каждом визите.
В обеих группах SPALдехисценция и SPALтонкая повторное вмешательство проводилось через 3–6 месяцев после установки импланта (медиана: 4,0 месяца в обеих группах; p = 1; Таблица 1). Толщина периимплантной кости и высота и ширина деhисценции периимплантной кости, зарегистрированные для групп SPALдехисценция и SPALтонкая, представлены в Таблицах 2 и 3 соответственно. В каждой группе SPAL 10 пациентов (90,9%) не показали деhисценции периимплантной кости в сочетании с толщиной периимплантной кости ≥2 мм (Таблицы 2 и 3). Один пациент в группе SPALдехисценция представил остаточную деhисценцию 2 мм (Таблица 2), которая была закрыта свободным десневым трансплантатом. Один пациент в группе SPALтонкая показал толщину периимплантной кости 1 мм без деhисценции (Таблица 3).
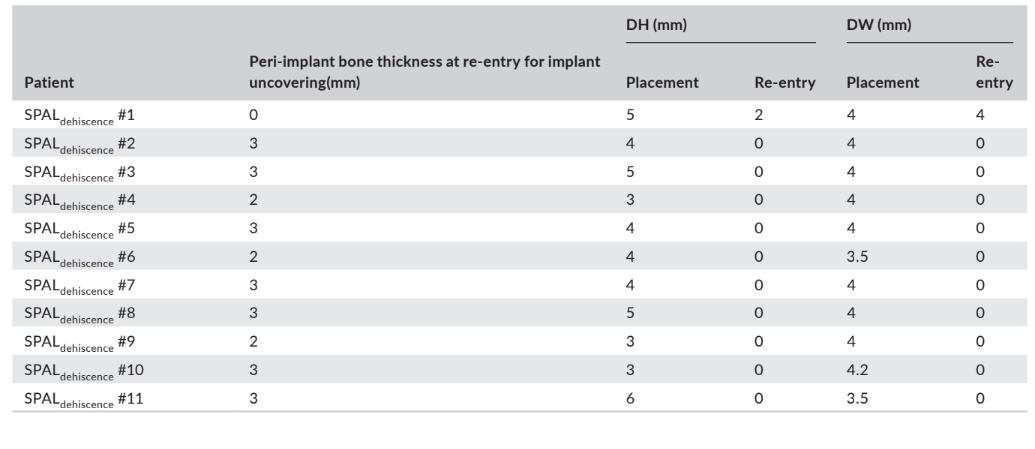
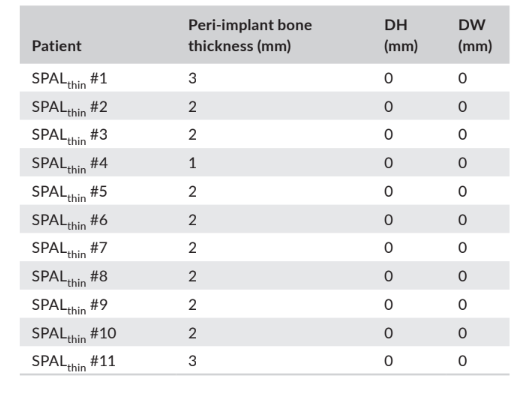
и ширина деисценции (DH и DW соответственно), оцененные при повторном
входе для вскрытия имплантата у каждого пациента группы SPALthin
В группе SPALdehiscence 8 имплантатов поддерживали фиксированный частичный протез, 2 имплантата были восстановлены с помощью одной коронки, и 1 имплантат был частью съемного протеза. В группе SPALthin 9 имплантатов поддерживали фиксированный частичный протез, 2 имплантата были восстановлены с помощью одной коронки, и 1 был частью съемного протеза. В контрольной группе 4 имплантата были частью фиксированного частичного протеза, а 8 имплантатов были восстановлены с помощью одной коронки.
3.2 Результаты исследования
Данные, связанные с клиническими результатами (т.е. PD, BoP, SoP, PlI, MSTL и KM) и RBL, оцененные через 6 месяцев после нагрузки импланта, представлены в Таблице 4.
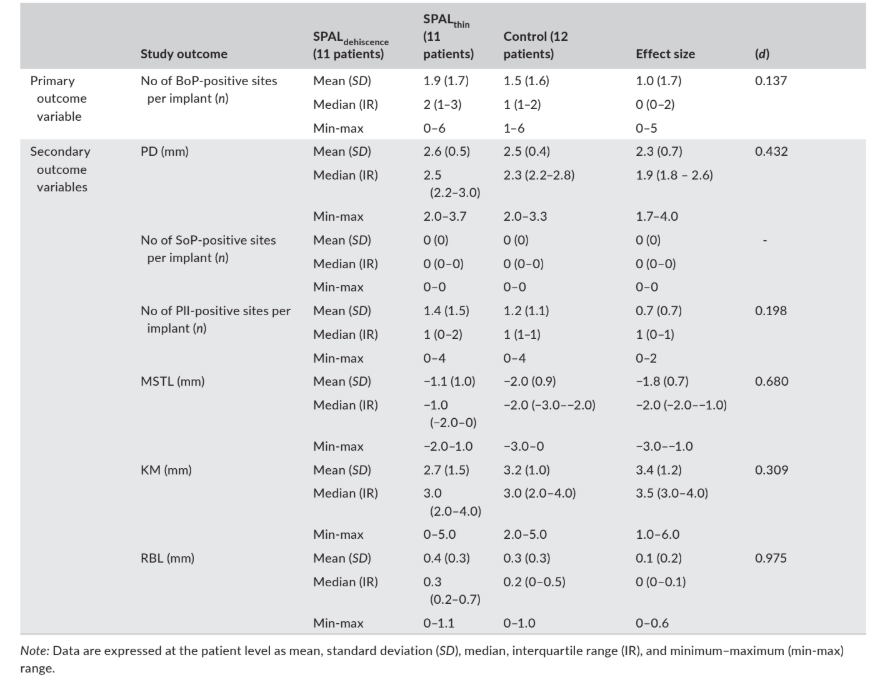
мягких тканей на краю, MSTL; и ширина кератинизированной слизистой, KM) и радиографический уровень кости (RBL), оцененные через 6 месяцев после нагрузки импланта.
Медианная распространенность (число) положительных по BoP участков составила 2, 1 и 0 в группах SPALdehiscence, SPALthin и контрольной соответственно.
Медианное число положительных по PlI участков составило 1 во всех группах. SoP был отрицательным на всех имплантационных участках.
Мукозный край находился на 1 мм (группа SPALdehiscence) или 2 мм (группы SPALthin и контрольная) выше соединения имплант–абатмент во всех группах, и исследуемые группы продемонстрировали медианный KM не менее 3 мм.
Радиографический уровень кости составил 0.3 мм в группе SPALdehiscence, 0.2 мм в группе SPALthin и 0 мм в контрольной группе.
ES был мал для числа положительных по BoP участков (d = 0.137) и PlI (d = 0.198), средним для KM (d = 0.309), PD (d = 0.432) и MSTL (d = 0.680), и большим для RBL (d = 0.975) (Таблица 4).
Обсуждение
Целью настоящей ретроспективной серии случаев было оценить состояние тканей вокруг имплантатов в краткосрочной перспективе у пациентов, получивших технику SPAL, и у пациентов с достаточной толщиной (≥2 мм) PBBP при установке имплантата. Результаты показали, что пациенты, леченные с использованием техники SPAL, продемонстрировали низкое количество воспаленных участков вокруг имплантатов и небольшую глубину кармана (<4 мм) через 6 месяцев после протезирования. Также уровень межзубной кости был найден апикально (хотя и в ограниченной степени) по отношению к полированному воротнику имплантата только в группах SPAL.
Кровотечение при зондировании было выбрано в качестве первичного исхода, поскольку (a) оценка BoP в настоящее время рассматривается как клинический показатель для различения между здоровьем и болезнью вокруг имплантатов, являясь неизменным диагностическим элементом периимплантита и периимплантита (Renvert, Persson, Pirih, Camargo, 2018, Berglundh et al., 2018), и (b) его отсутствие связано со стабильностью состояния тканей вокруг имплантатов (Jepsen, Rühling, Jepsen, Ohlenbusch, Albers, 1996, Luterbacher, Mayfield, Brägger, Lang, 2000). Пропорция воспаленных участков вокруг имплантатов, зафиксированная в исследуемых группах, сопоставима с предыдущими данными, оценивающими распространенность BoP на 289 имплантатах (Farina, Filippi, Brazzioli, Tomasi, Trombelli, 2017). Также аналогичные воспалительные состояния вокруг имплантатов были зарегистрированы через 18 месяцев после GBR (Jung et al., 2017).
В нашем исследовании была отмечена низкая частота воспаленных перипротезных слизистых участков во всех группах исследования. Это может быть отчасти связано с аналогичными характеристиками факторов, которые, как было показано, влияют на кровоточивость десен вокруг имплантатов, такими как низкое присутствие юкстагингивальной бляшки (Pontoriero et al., 1994; Salvi et al., 2012), небольшая глубина кармана (Farina, Filippi, Brazzioli, Tomasi, & Trombelli, 2017) и адекватное количество кератинизированной слизистой (Chung, Oh, Shotwell, Misch, Wang, 2006, Perussolo et al., 2018). Наши результаты согласуются с теми, которые были получены в недавнем систематическом обзоре биологических осложнений зубных имплантатов, установленных как в чистых, так и в увеличенных участках. Метанализ показал схожую распространенность перипротезного мукозита у пациентов, получавших (19.6%; 95% CI: 0%–40%) или не получавших (22.4%; 95% CI: 6%–38%) процедуры по сохранению альвеолярного гребня и/или вертикальному/латеральному увеличению гребня (Salvi, Monje, Tomasi, 2018). Также были зарегистрированы аналогичные воспалительные состояния у имплантатов, установленных в родной кости, по сравнению с имплантатами, установленными одновременно с процедурой GBR (Benic, Jung, Siegenthaler, Hammerle, 2009; Benic, Bernasconi, Jung, Hammerle, 2017).
Стоит отметить, что при повторном входе у большинства пациентов, получавших технику SPAL, была отмечена толщина костной ткани вокруг импланта ≥2 мм в самой корональной части импланта. Хотя измерение PBBP не было доступно при повторном входе для контрольной группы (одностадийная процедура), целостность PBBP после ремоделирования костной ткани вокруг импланта после установки может быть предположена на основе предклинических (Monje и др., 2019) и клинических (Spray, Black, Morris и Ochi, 2000) данных о критических размерах бугристой костной пластины. В совокупности доступные данные, похоже, указывают на то, что адекватные вертикальные и горизонтальные размеры тканей вокруг импланта, достигнутые с помощью процедур увеличения, могут способствовать условиям, ограничивающим воспаление тканей вокруг импланта. Однако связь между целостностью PBBP до самой корональной части импланта и тяжестью воспаления слизистой оболочки вокруг импланта не совсем ясна (Jung и др., 2017).
На 6 месяцах после протезирования была отмечена различная позиция уровня межзубного периимплантного костного уровня среди групп, с более апикальным RBL в группах SPAL. Примечательно, что в группах SPAL имплантаты уровня ткани были расположены немного субкристально (Рисунки 1 и 2). Хотя это могло облегчить пересадку периостального мешка до самой корональной части имплантата, а также закрытие с первичным намерением, субкристальное положение также могло способствовать межзубной костной ремоделированию (Saleh et al., 2018). Более того, поскольку имплантаты, получившие технику SPAL, подвергались дополнительной операции по вскрытию, включая апикально расположенный лоскут или свободную десневую пересадку, межзубное костное ремоделирование в группах SPAL также может частично объясняться негативным воздействием подъема лоскута на местное кровоснабжение. Последовательно, маргинальная, периимплантная потеря костной массы была зарегистрирована между повторным доступом для вскрытия и окончательной доставкой протеза другими авторами (Cardaropoli, Lekholm, Wennstrom, 2006, Nader et al., 2016). Также следует учитывать, что у некоторых пациентов группы SPALдехисценция пересадка была расширена на мезиальные и/или дистальные аспекты имплантата из-за межзубного расширения периимплантного костного дефекта. В группе SPALдехисценция таким образом, степень ремоделирования пересадки на межзубных участках могла негативно повлиять на значения RBL. Недавние данные показали, что даже медленно рассасывающиеся биоматериалы для пересадки, такие как DBBM, связаны с существенным уменьшением пересаженной области при 12-месячной радиографической оценке после эндосинусальных процедур увеличения (Franceschetti et al., 2019). Однако величина RBL, наблюдаемая в настоящем исследовании, ограничена по сравнению с той, что была зарегистрирована для имплантатов, установленных с сопутствующей GBR или в родной кости (Urban et al., 2019), и имплантатов с необработанной буковальной дехисценцией (Jung et al., 2017).
Для группы SPALдехисценция было отмечено немного более низкое значение KM и MSTL. Это произошло несмотря на то, что манипуляции с мягкими тканями вокруг имплантата были выполнены должным образом для обеспечения адекватных размеров кератинизации периимплантной слизистой и поддесневого положения протезных краев. Это наблюдение может быть частично связано с увеличенной ремоделированием кости (RBL), наблюдаемым в группе SPALдехисценция, что также могло затронуть регенерированную бугристую костную пластину. Недавний систематический обзор связал ремоделирование бугристой кости с возникновением рецессии мягких тканей вокруг имплантата (Aizcorbe-Vicente, Peñarrocha-Oltra, Canullo, Soto-Peñaloza, & Peñarrocha-Diago, 2020). В группе SPALдехисценция 1 пациент (9.1%) испытал деhисценцию раны через 2 недели, что привело к частичному обнажению резьбы имплантата при повторном доступе. Это наблюдение сопоставимо с частотой деhисценции раны и последующим обнажением мембраны после процедур GBR для коррекции деhисценции костной ткани вокруг имплантата при установке, как сообщается в недавнем мета-анализе, проведенном как на проспективных, так и на ретроспективных исследованиях (Garcia et al., 2018). В частности, обнажение мембраны произошло с частотой от 16.7% (Tawil, El-Ghoule, & Mawla, 2001) до 62.8% (Gher, Quintero, Assad, Monaco, & Richardson, 1994) и было связано с значительно более низким покрытием деhисценции (Garcia et al., 2018). Ограничения этого предварительного отчета включают ретроспективный дизайн, небольшой размер выборки и короткий период наблюдения в 6 месяцев после восстановления имплантатов. Также влияние факторов, связанных с пациентом (например, толщина мягких тканей в беззубой области, курение, диабет) и осложнений, связанных с операцией (например, перфорации периостальной и/или слизистой оболочки), на клинические результаты не было всесторонне проанализировано. Более того, для лечения SPAL были выбраны специфические клинические условия (т.е. тонкая PBBP или деhисценция костной ткани вокруг имплантата с ограниченной вертикальной размерностью). Необходимы дальнейшие исследования, чтобы оценить, какие клинические условия/поражения могут быть эффективно лечены с помощью техники SPAL или следует предпочесть более традиционное лечение (например, GBR).
В заключение, результаты настоящего исследования показали, что после 6 месяцев протезирования пациенты, леченные с использованием техники SPAL, демонстрируют ограниченное воспаление периимплантной слизистой в сочетании с мелким PD и адекватной KM. Однако у имплантатов, получивших технику SPAL, интерпроксимальная RBL была обнаружена апикально от ее идеального положения. Необходимо оценить, могут ли и в какой степени благоприятные краткосрочные результаты, наблюдаемые после применения техники SPAL, быть полезными для долгосрочных здоровых условий периимплантных тканей и стабильности бугристого слизистого профиля.
Леонардо Тромбелли, Маттиа Прамстраллер, Маттиа Севери, Анна Симонелли, Роберто Фарина
Ссылки
- Аинамо, Дж., & Бэй, И. (1975). Проблемы и предложения по регистрации гингивита и налета. Международный стоматологический журнал, 25, 229–235.
- Айскорбе-Висенте, Дж., Пеньярроча-Олтра, Д., Канулло, Л., Сото-Пеньялоза, Д., & Пеньярроча-Диаг, М. (2020). Влияние толщины лицевой кости после установки имплантата в заживленные гребни на перестроенную лицевую кость с учетом рецессии мягких тканей: систематический обзор. Международный журнал оральных и челюстно-лицевых имплантатов, 35, 107–119. https://doi.org/10.11607/jomi.7259
- Бенич, Г. И., Бернаскони, М., Юнг, Р. Е., & Хаммерле, С. Х. Ф. (2017). Клиническое и радиографическое внутрипредметное сравнение имплантатов, установленных с или без направленной регенерации кости: 15-летние результаты. Журнал клинической периодонтологии, 44, 315–325. https://doi.org/10.1111/jcpe.12665
- Бенич, Г. И., Юнг, Р. Е., Зигенталер, Д. В., & Хаммерле, С. Х. Ф. (2009). Клиническое и радиографическое сравнение имплантатов в регенерированной или естественной кости: 5-летние результаты. Клинические исследования оральных имплантатов, 20, 507–513. https://doi.org/10.1111/j.1600-0501.2008.01583.x
- Берглунд, Т., Армитидж, Г., Араухо, М. Г., Авила-Ортиз, Г., Бланко, Дж., Камарго, П. М., Цитцманн, Н. (2018). Периимплантные заболевания и состояния: Консенсусный отчет рабочей группы 4 Всемирного семинара 2017 года по классификации периодонтальных и периимплантных заболеваний и состояний. Журнал клинической периодонтологии, 45(Дополнение 20), S286–S291. https://doi.org/10.1034/j.1600-0501.1994.050409.x
- Кардирополи, Г., Лекхольм, У., & Венстром, Дж. Л. (2006). Изменения тканей при одиночных зубных протезах на имплантатах: проспективное клиническое исследование на 1 год. Клинические исследования оральных имплантатов, 17, 165–171. https://doi.org/10.1111/j.1600-0501.2005.01210.x
- Чунг, Д. М., О, Т. Дж., Шотвелл, Дж. Л., Миш, С. Е., & Ванг, Х. Л. (2006). Значение кератинизированной слизистой для поддержания зубных имплантатов с различными поверхностями. Журнал периодонтологии, 77, 1410–1420. https://doi.org/10.1902/jop.2006.050393
- Кохен, Дж. (1988). Статистический анализ мощности для поведенческих наук, 2-е изд. Махва, Нью-Джерси: Издательство Лоуренса Эрлбаума.
- Фарина, Р., Филиппи, М., Бразиоли, Дж., Томази, К., & Тромбелли, Л. (2017). Кровотечение при зондировании вокруг зубных имплантатов: ретроспективное исследование связанных факторов. Журнал клинической периодонтологии, 44, 115–122. https://doi.org/10.1111/jcpe.12647
- Франческетти, Дж., Фарина, Р., Миненна, Л., Риккардо, О., Стачи, К., Ди Раймондо, Р., … Тромбелли, Л. (2019). Влияние ремоделирования трансплантата на поддержку периимплантной кости при установке имплантатов одновременно с транс-крестным поднятием синусового дна: многоцентровое, ретроспективное исследование случаев. Клинические исследования оральных имплантатов, 31(2), 1–16. https://doi.org/10.1111/clr.13541
- Гарсия, Дж., Додж, А., Лупке, П., Ванг, Х. Л., Капила, Й., & Лин, Г. Х. (2018). Влияние экспозиции мембраны на направленную регенерацию кости: систематический обзор и мета-анализ. Клинические исследования оральных имплантатов, 29, 328–338. https://doi.org/10.1111/clr.13121
- Гер, М. Е., Кинтеро, Г., Ассад, Д., Монако, Е., & Ричардсон, А. С. (1994). Трансплантация кости и направленная регенерация кости для немедленных зубных имплантатов у людей. Журнал периодонтологии, 65, 881–891. https://doi.org/10.1902/jop.1994.65.9.881
- Хаммерле, С. Х., Чен, С. Т., & Уилсон, Т. Г. мл. (2004). Консенсусные заявления и рекомендуемые клинические процедуры по установке имплантатов в экстракционные лунки. Международный журнал оральных и челюстно-лицевых имплантатов, 19(дополнение), 26–28.
- Епсен, С., Рюлинг, А., Епсен, К., Оленбуш, Б., & Альберс, Х. К. (1996). Прогрессирующий периимплантит. Частота и предсказание потери прикрепления периимплантных тканей. Клинические исследования оральных имплантатов, 7, 133–142. https://doi.org/10.1034/j.1600-0501.1996.070207.x
- Юнг, Р. Е., Херцог, М., Вольлеб, К., Рамель, К. Ф., Тома, Д. С., & Хаммерле, С. Х. Ф. (2017). Рандомизированное контролируемое клиническое испытание, сравнивающее небольшие дефекты бугристого разрыва вокруг зубных имплантатов, обработанных направленной регенерацией кости или оставленных для спонтанного заживления. Клинические исследования оральных имплантатов, 28, 348–354. https://doi.org/10.1111/clr.12806
- Лютербахер, С., Мейфилд, Л., Бреггер, У., & Ланг, Н. П. (2000). Диагностические характеристики клинических и микробиологических тестов для мониторинга состояния периодонтальных и периимплантных слизистых тканей во время поддерживающей периодонтальной терапии (SPT). Клинические исследования оральных имплантатов, 11, 521–529. https://doi.org/10.1034/j.1600-0501.2000.011006521.x
- Мереб, Дж., Веркруйссен, М., Кук, В., Беккерс, Л., Тегельс, В., & Квиринен, М. (2017). Судьба бугристой кости вокруг зубных имплантатов. Исследование через 12 месяцев после нагрузки. Клинические исследования оральных имплантатов, 28, 103–108. https://doi.org/10.1111/clr.12767
- Монье, А., Шапюи, В., Монье, Ф., Муньос, Ф., Ванг, Х. Л., Урбан, И. А., & Бусер, Д. (2019). Критическая толщина бугристой кости вокруг имплантата пересмотрена: экспериментальное исследование на собаке бигле. Int J Oral Maxillofac Implants, 34, 1328–1336. https://doi.org/10.11607/jomi.7657
- Надер, Н., Абулхосн, М., Бербери, А., Манал, К., & Юнес, Р. (2016). Ремоделирование краевой кости вокруг заживляющего абатмента против установки окончательного абатмента на второй стадии операции: 12-месячное рандомизированное клиническое испытание. Журнал современных стоматологических практик, 17, 7–15. https://doi.org/10.5005/jp-journals-10024
- О'Лири, Т. Дж., Дрейк, Р. Б., & Нейлор, Дж. Е. (1972). Запись контроля налета. Журнал периодонтологии, 43, 38. https://doi.org/10.1902/jop.1972.43.1.38
- Перуссоло, Дж., Соуза, А. Б., Матарразо, Ф., Оливейра, Р. П., & Араухо, М. Г. (2018). Влияние кератинизированной слизистой на стабильность периимплантных тканей и дискомфорт при чистке: исследование с 4-летним наблюдением. Клинические исследования оральных имплантатов. Журнал клинической периодонтологии, 29, 1177–1185. https://doi.org/10.1111/clr.13381
- Понториеро, Р., Тонелли, М. П., Карневаль, Г., Момбелли, А., Ниман, С. Р., & Ланг, Н. П. (1994). Экспериментально индуцированный периимплантный мукозит. Клиническое исследование на людях. Клинические исследования оральных имплантатов, 5, 254–259. https://doi.org/10.1034/j.1600-0501.1994.050409.x
- Ренверт, С., Перссон, Г. Р., Пирих, Ф. К., & Камарго, П. М. (2018). Здоровье периимплантных тканей, периимплантный мукозит и периимплантит: определения случаев и диагностические соображения. Журнал клинической периодонтологии, 45(Дополнение 20), S278–S285. https://doi.org/10.1111/jcpe.12956
- Салех, М. Х. А., Равида, А., Суарез-Лопес Дель Амо, Ф., Лин, Г.-Х., Асаад, Ф., & Ванг, Х.-Л. (2018). Влияние положения соединения имплант-абатмент на потерю кости: систематический обзор и мета-анализ. Клинические исследования имплантатов и сопутствующие исследования, 20, 617–633. https://doi.org/10.1111/cid.12600
- Сальви, Г. Е., Аглиетта, М., Айк, С., Скулиан, А., Ланг, Н. П., & Рамсейер, К. А. (2012). Обратимость экспериментального периимплантного мукозита по сравнению с экспериментальным гингивитом у людей. Клинические исследования оральных имплантатов, 23, 182–190. https://doi.org/10.1111/j.1600-0501.2011.02220.x
- Сальви, Г. Е., Монье, А., & Томази, К. (2018). Долгосрочные биологические осложнения зубных имплантатов, установленных как в чистых, так и в увеличенных участках: систематический обзор и мета-анализ. Клинические исследования оральных имплантатов, 29(Дополнение 16), 294–310. https://doi.org/10.1111/clr.13123
- Санс-Санчез, И., Каррильо де Альборноз, А., Фигеро, Е., Шварц, Ф., Юнг, Р., Санс, М., & Тома, Д. (2018). Влияние процедур увеличения боковой кости на здоровье или заболевания периимплантных тканей: систематический обзор и мета-анализ. Клинические исследования оральных имплантатов, 29, 18–31. https://doi.org/10.1111/clr.13126
- Санс-Санчез, И., Ортис-Вигон, А., Санс-Мартин, И., Фигеро, Е., & Санс, М. (2015). Эффективность увеличения боковой кости на размер альвеолярного гребня: систематический обзор и мета-анализ. Журнал стоматологических исследований, 94, 1s–15s. https://doi.org/10.1177/0022034515594780
- Шварц, Ф., Захм, Н., & Беккер, Дж. (2012). Влияние результатов направленной регенерации кости в дефектах типа разрыва на долгосрочную стабильность здоровья периимплантных тканей: клинические наблюдения через 4 года. Клинические исследования оральных имплантатов, 23, 191–196. https://doi.org/10.1111/j.1600-0501.2011.02214.x
- Спрай, Дж. Р., Блэк, С. Г., Моррис, Х. Ф., & Очи, С. (2000). Влияние толщины кости на реакцию краевой кости: установка на стадии 1 через вскрытие на стадии 2. Анналы периодонтологии, 5, 119–128. https://doi.org/10.1902/annals.2000.5.1.119
- Тавил, Г., Эль-Гул, Г., & Маула, М. (2001). Клиническая оценка двуслойной коллагеновой мембраны (bio-gide), поддерживаемой аутогенными трансплантатами, в лечении костных дефектов вокруг имплантатов. Международный журнал оральных и челюстно-лицевых имплантатов, 16, 857–863.
- Тома, Д. С., Бьенц, С. П., Фигеро, Е., Юнг, Р. Е., & Санс-Мартин, И. (2019). Влияние процедур увеличения мягких тканей на здоровье или заболевания периимплантных тканей: систематический обзор и мета-анализ. Журнал клинической периодонтологии, 46(Дополнение 21), 257–276. https://doi.org/10.1111/jcpe.13050
- Тромбелли, Л., Фарина, Р., Феррари, С., Пасетти, П., & Калура, Г. (2009). Сравнение двух методов оценки периодонтального риска. Минерва стоматологика, 58, 277–287.
- Тромбелли, Л., Миненна, Л., Тоселли, Л., Заэтта, А., Чекки, Л., Чекки, В., … Фарина, Р. (2017). Прогностическая ценность упрощенного метода оценки периодонтального риска во время поддерживающей периодонтальной терапии. Журнал клинической периодонтологии, 44, 51–57. https://doi.org/10.1111/jcpe.12645
- Тромбелли, Л., Севери, М., Фарина, Р., & Симонелли, А. (2020). Техника субперостальной увеличенной оболочки для лечения поражений периимплантита. Клинические достижения в периодонтологии. https://doi.org/10.1002/cap.10107. [Epub ahead of print].
- Тромбелли, Л., Севери, М., Прамстраллер, М., & Фарина, Р. (2018). Техника субперостального увеличения для горизонтального увеличения кости при установке имплантата. Минерва стоматологика, 67, 217–224. https://doi.org/10.23736/S0026-4970.18.04161-4
- Тромбелли, Л., Севери, М., Прамстраллер, М., & Фарина, Р. (2019). Упрощенное управление мягкими тканями для увеличения кости вокруг имплантатов. Международный журнал оральных и челюстно-лицевых имплантатов, 34, 197–204. https://doi.org/10.11607/jomi.6959
- Урбан, И. А., Вессинг, Б., Аландез, Н., Мелони, С., Гонсалес-Мартин, О., Полицци, Г., … Цехнер, В. (2019). Многоцентровое рандомизированное контролируемое испытание с использованием новой коллагеновой мембраны для направленной регенерации кости в дефектных участках одиночных имплантатов: результаты при протезировании и через 1 год наблюдения. Клинические исследования оральных имплантатов, 30, 487–497. https://doi.org/10.1111/clr.13426
- Цитцманн, Н. У., Шарер, П., & Маринелло, С. П. (2001). Долгосрочные результаты имплантатов, обработанных направленной регенерацией кости: 5-летнее проспективное исследование. Международный журнал оральных и челюстно-лицевых имплантатов, 16, 355–366.