Коррекция дефицита бугристой кости вокруг импланта после субперостального увеличения с использованием блока или частиц ксеногенного графта: ретроспективное исследование
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Цель: Оценить эффективность техники субперостального увеличенного слоя вокруг имплантата (SPAL), выполненной с использованием депротеинизированного минерала костей крупного рогатого скота (DBBM), который доставлялся в виде частиц (pDBBM) или блока (bDBBM), для коррекции костной деhисценции вокруг имплантата (PIBD). Также были исследованы имплантаты с толстой (≥ 2 мм) бугристой костной пластинкой вокруг имплантата (PBBP) при установке.
Материалы и методы: В исследование были включены пациенты с PIBD ≥ 1 мм, леченные с использованием SPAL с pDBBM (SPALчастицы) или bDBBM (SPALблок), а также пациенты с имплантатом, показывающим PBBP ≥ 2 мм при установке (КОНТРОЛЬ). Повторное вмешательство проводилось через 6 месяцев (группы SPAL) или 3 месяца (КОНТРОЛЬ). Основным результатом была доля пациентов, у которых не было PIBD при повторном вмешательстве. Высота деhисценции кости (BDH) и ширина (BDW), толщина бугристых тканей (BTT) и уровень маргинальной кости (MBL) были вторичными результатами.
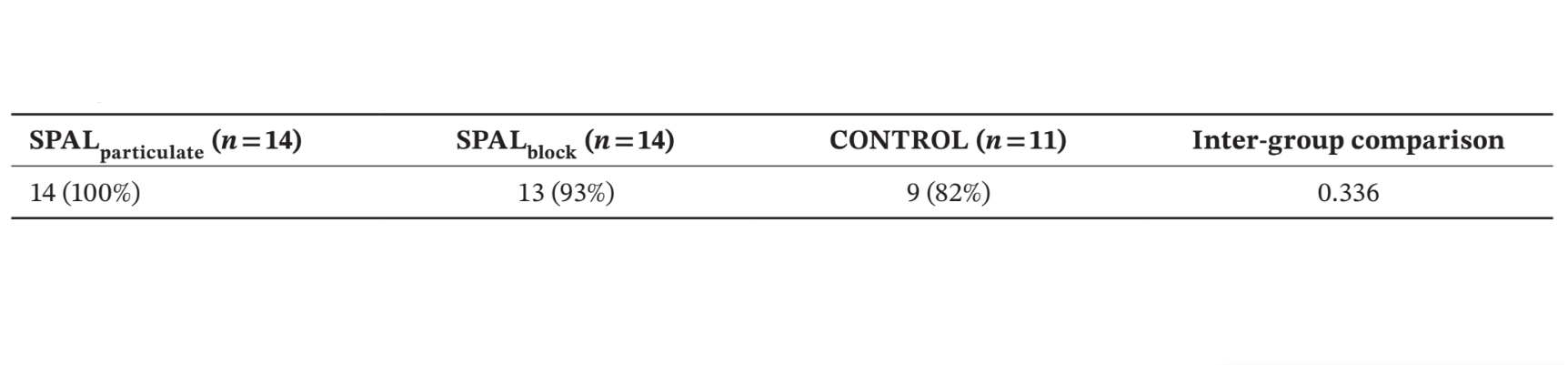
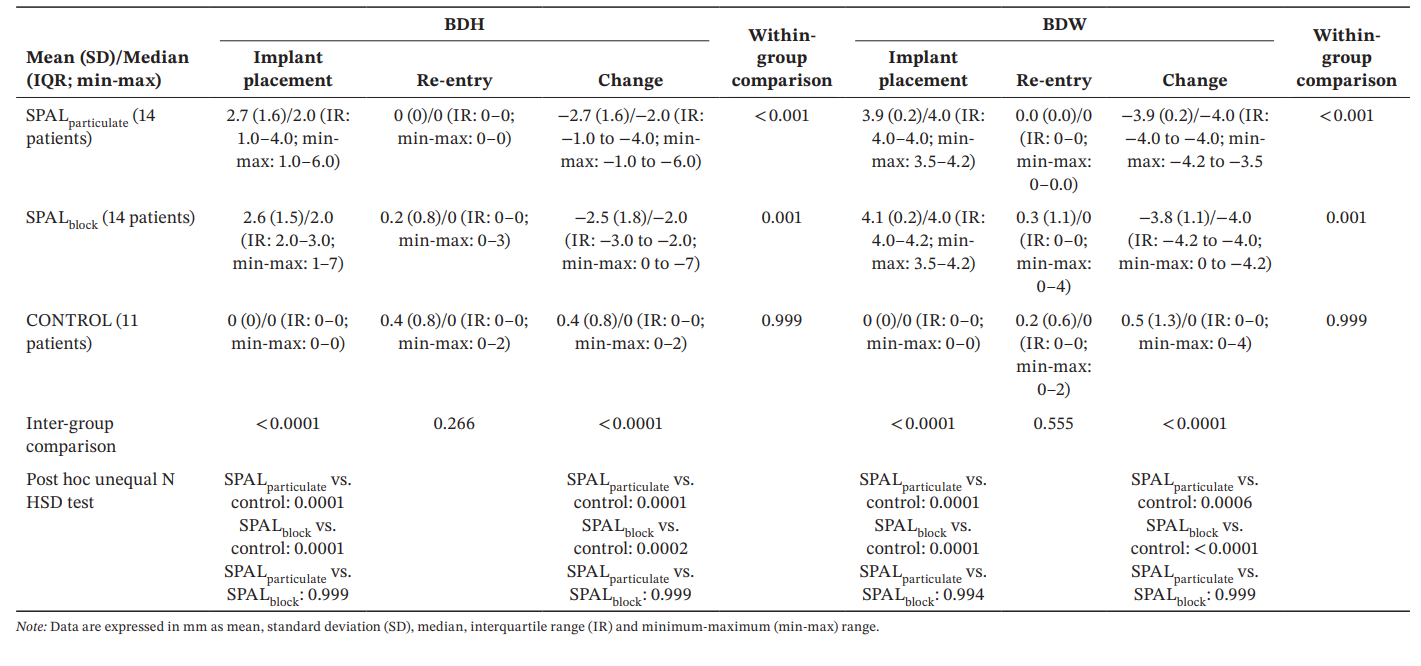
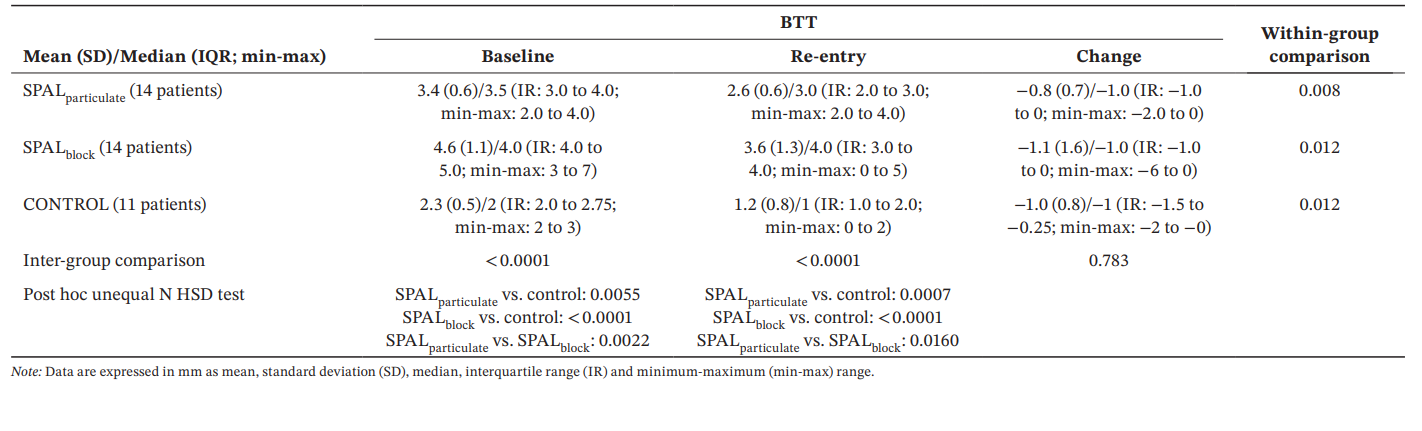
Результаты: Анализировались тридцать девять имплантатов у 39 пациентов (14 в SPALчастицы, 14 в SPALблок и 11 в КОНТРОЛЕ). PIBD не было обнаружено в SPALчастицы, тогда как в SPALблок был один случай PIBD. У двух пациентов в КОНТРОЛЕ была PIBD. Наблюдалось снижение как BDH, так и BDW как в SPALчастицы (2.7 ± 1.6 мм для BDH и 3.9 ± 0.2 мм для BDW), так и в SPALблок (2.5 ± 1.8 мм для BDH и 3.8 ± 1.1 мм для BDW). SPALблок показал большую BTT, чем SPALчастицы при повторном вмешательстве (3.6 ± 1.3 мм для SPALблок и 2.6 ± 0.6 мм для SPALчастицы, p = 0.0160). Все группы показали схожий уровень MBL.
Введение
Протезно-ориентированное размещение имплантатов в условиях уменьшенной горизонтальной костной структуры часто приводит к дефициту костной ткани вокруг имплантата (PIBD) (Bressan et al. 2017; Pramstraller et al. 2018).
Небольшие костные дефекты дефицита, оставленные для спонтанного заживления, показали больше вертикальной потери кости на щечной стороне после установки имплантата, а также большее краевое костное истощение по сравнению с участками, обработанными GBR (Jung et al. 2017; Monje et al. 2023). Хотя имплантаты с небольшими, неконтейнированными щечными костными дефицитами продемонстрировали высокие показатели выживаемости и здоровые периимплантантные ткани через 7,5 лет наблюдения (Waller et al. 2020), наличие явного PIBD было связано с более высокой частотой мукозитов и периимплантита, а также с более быстрым прогрессированием периимплантита по сравнению с имплантатами, полностью окруженными костью (Schwarz, Sahm, и Becker 2012; Monje et al. 2019). Несмотря на то, что прогностическая ценность PIBD для долгосрочного здоровья периимплантных тканей все еще остается спорной, коррекция щечного костного дефицита при установке имплантата была недавно рекомендована для улучшения стабильности и здоровых условий периимплантных тканей со временем (Herrera, et al. 2023; Monje et al. 2023; Song et al. 2024).
Для лечения PIBD были предложены процедуры увеличения как костной, так и мягкой ткани. Оба метода показали стабильные клинические и рентгенографические результаты в среднесрочной и долгосрочной перспективе (Jensen et al. 2023; Monje et al. 2023). Среди различных процедур бокового увеличения кости при одновременной установке имплантата, метод направленной регенерации кости (GBR) и техника субперостального увеличенного слоя вокруг имплантата (SPAL, Trombelli et al. 2018) были связаны с высокой вероятностью полного исправления PIBD (Severi et al. 2022). В частности, SPAL основан на использовании перостной ткани пациента в качестве барьерной мембраны для удержания трансплантата, действующего как каркас для создания пространства. При выполнении в сочетании с частицами декальцинированного бычьего костного минерала (DBBM), SPAL показал эффективность в полном исправлении до 90,9% PIBD (Trombelli et al. 2019, 2020). Недавнее ретроспективное исследование сравнивало состояния жесткой и мягкой ткани вокруг имплантатов, имеющих либо PIBD, обработанный SPAL, либо толстый (≥ 2 мм) PBBP при установке имплантата (Trombelli et al. 2020). Хотя в обеих группах были обнаружены аналогичные здоровые условия периимплантных тканей, более апикальное положение рентгенографического уровня краевой кости (MBL) было найдено в группе SPAL, что предполагает другой паттерн ремоделирования трансплантата по сравнению с родной костью (Trombelli et al. 2020). Эти результаты могут поставить под сомнение значимость физико-химических характеристик трансплантата в отношении стабильности реконструктивного результата после SPAL. В этом отношении анекдотический отчет предположил, что использование блока DBBM (bDBBM) может быть успешной альтернативой в сочетании с SPAL (Trombelli et al. 2022).
Таким образом, целью настоящего ретроспективного исследования было оценить эффективность SPAL, выполненного в сочетании с pDBBM или bDBBM, для коррекции PIBD. Более того, были проанализированы изменения в жестких тканях вокруг имплантатов, происходящие с момента установки имплантата до повторного доступа для его обнажения. Также была исследована контрольная группа, состоящая из имплантатов с толстой (≥ 2 мм) PBBP при установке имплантата.
Материалы и методы
2.1 Этические аспекты
Настоящее ретроспективное исследование было одобрено Этическим комитетом Area Vasta Emilia Centro, Италия (протокол № 523/2024/Oss/UniFe, дата одобрения 16.10.2024). Каждый пациент предоставил письменное информированное согласие перед хирургическим лечением.
Все клинические процедуры были выполнены в соответствии с Декларацией Хельсинки и Руководящими принципами надлежащей клинической практики (GCP).
2.2 Популяция исследования
Записи пациентов, прошедших имплант-supported протезирование в период с мая 2020 года по сентябрь 2021 года в Исследовательском центре по изучению пародонтальных и периплантитных заболеваний Университета Феррары и в одной частной стоматологической клинике в Ферраре, были отобраны для определения соответствия пациентов критериям исследования. Настоящее ретроспективное исследование проводилось в соответствии с рекомендациями/контрольным списком STROBE для поперечных исследований.
На основе состояния бугристой костной пластины в момент установки имплантата и хирургического вмешательства пациенты были разделены на 2 группы:
- Пациенты с как минимум одним имплантатом, имеющим PIBD ≥ 1 мм, леченные с использованием SPAL в сочетании с pDBBM (группа SPALчастиц );
- Пациенты с как минимум одним имплантатом, имеющим PIBD ≥ 1 мм, леченные с использованием SPAL в сочетании с bDBBM (группа SPALблок ).
Группы SPAL состояли из последовательно леченных пациентов, для которых можно было получить соответствующие клинические и рентгенографические измерения для анализа данных. Если два или более имплантата у одного пациента подходили для исследования, для анализа выбирался только имплантат с PIBD с наибольшей костной дефицитностью. Более того, пациенты с как минимум одним имплантатом, имеющим остаточную толщину PBBP ≥ 2 мм после установки имплантата, рассматривались как контрольная группа (группа CONTROL).
Все выбранные имплантаты должны были быть установлены в заживленном костном гребне (имплантаты типа 4C, Gallucci et al. 2018) и должны были демонстрировать первичную стабильность, оцененную по крутящему моменту при установке. Тяжелые курильщики (потребление сигарет > 10 сигарет/день) и пациенты с сахарным диабетом на момент операции были исключены из исследования.
2.3 Клинические процедуры
2.3.1 Предоперационные процедуры
Перед установкой имплантатов все пациенты прошли активное лечение кариозных поражений и заболеваний пародонта и были включены в профессиональное сопровождение с частотой визитов, запланированной в соответствии с инструментом оценки PerioRisk (Trombelli et al. 2009, 2017; Farina et al. 2021).
Все хирургические процедуры проводились двумя обученными операторами (L.T., M.S.). Пациентам вводили 2 г амоксициллина + клавулановой кислоты (Аугментин, GlaxoSmithKline, Верона, Италия) за 1 час до операции. Местная анестезия достигалась с использованием артикаина с 1:100,000 адреналином, вводимым местной инфильтрацией.
2.3.2 Хирургические процедуры
2.3.2.1 Группы SPAL.
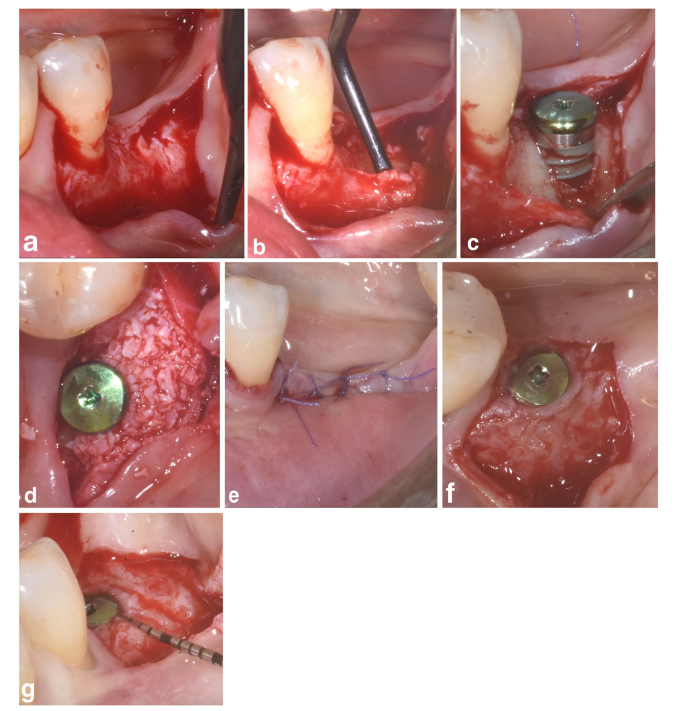
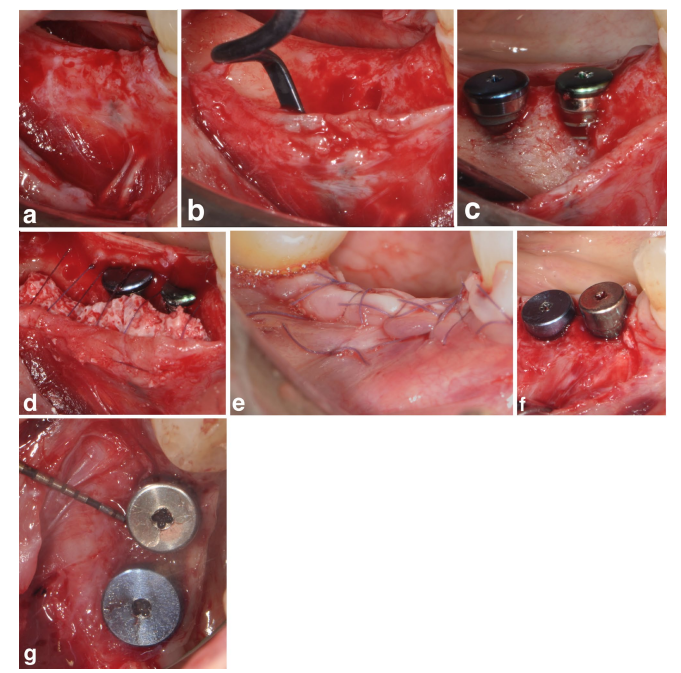
В группах SPALчастиц и SPAL-блоков хирургический доступ к костному гребню осуществлялся в соответствии с ранее описанной процедурой (Trombelli et al. 2018). Кратко, на щечной стороне была поднята слизистая оболочка с помощью диссекции с частичной толщиной с использованием лезвия 15C (Рисунки 1a и 2a). Затем надкостница была поднята от кости с помощью надкостного подъемника (PTROM, Hu-Friedy, Чикаго, Иллинойс), а также туннельных ножей (KPAX, TKN1X и TKN2X, Hu Friedy, Чикаго, Иллинойс) с различными угловыми острыми краями, создавая субнадкостничный мешок, который мог вместить трансплантат (Рисунки 1b и 2b). Полноценный лоскут был поднят на оральной (язычной/небной) стороне. Волокна мыщцы мойлоглоссуса были отделены от язычного лоскута с помощью тупого инструмента для обеспечения коронального продвижения. Коральные перфорации были выполнены с помощью откалиброванного цилиндрического карбидного бора для увеличения кровоснабжения хирургической области (Majzoub et al. 1999; Acar et al. 2016).
Имплантаты на уровне ткани (SPI Element; Thommen Medical, Гренхен, Швейцария) были установлены с корональным краем полированной манжеты толщиной 1 мм на уровне костного гребня (Рисунки 1c и 2c).
Ксеноимплантат на основе бычьей кости, предоставленный в виде частиц (гранулы Bio-Oss спонгиозы, размер частиц 0,25–1,0 мм; Geistlich Pharma, AG, Вольхузен, Швейцария) (Тромбелли и др. 2018) или блока (блок Bio-Oss; Geistlich Pharma, AG, Вольхузен, Швейцария) (Тромбелли и др. 2022), использовался для заполнения хирургически созданного пространства между периостальным слоем и открытой поверхностью имплантата. Блок был фрагментирован на более мелкие кусочки с помощью лезвия 15C или алмазной боры, чтобы адаптироваться к размеру субпериостального пространства и достичь желаемого контурирования щечной пластинки. Пересадка была выполнена для полного исправления PIBD до уровня костного гребня. Во всех случаях субпериостальный графт обеспечивал как минимум 2 мм толщины на полированной манжете имплантата.
Коронарная часть периостального слоя была затем зафиксирована к оральному лоскуту с помощью рассасывающихся внутренних матрасных швов (Vicryl 6/0, Ethicon, Somerville NJ, USA) (Рисунки 1d и 2d). Впоследствии слизистый слой был коронарно продвинут и зашит к оральному лоскуту с помощью горизонтальных внутренних матрасных и прерывающихся швов для обеспечения подводного заживления как для графта, так и для имплантата (Рисунки 1e–2e).
При повторном хирургическом вмешательстве через 6 месяцев для вскрытия имплантата был диссектирован щечный лоскут с частичной толщиной, чтобы установить заживляющий абатмент. Для оценки наличия/отсутствия остаточного PIBD была оценена наличие твердых тканей вокруг поверхности имплантата с использованием зонда UNC-15. Если не было проникновения зонда за полированную шейку имплантата, имплантат был классифицирован как “полностью исправленная деhisценция”.
Для обеспечения адекватных размеров кератинизации перипротезной слизистой (KT) была выполнена либо апикальная позиция лоскута (APF), либо свободная десневая пересадка (FGG) (Trombelli et al. 2019) (Рисунки 1f,g и 2f). Выбор выполнения APF или FGG основывался на необходимости обеспечить высоту KT не менее 2 мм как на щечной, так и на язычной сторонах имплантата.
2.3.2.2 Контрольная группа.
Буккальный и язычный/небный полнослойный лоскут были подняты для обнажения костного гребня. Место для имплантации было подготовлено в соответствии с инструкциями производителя, и имплантаты уровня ткани (SPI Element; Thommen Medical, Гренхен, Швейцария) были установлены с корональным краем полированной шейки диаметром 1 мм на уровне костного гребня. Процедура костной аугментации не проводилась. Во всех случаях лоскут был зашит с использованием внутренних матрасных и прерывистых швов (Vicryl 5/0, Ethicon, Сомервилл, Нью-Джерси, США) для обеспечения подводного заживления.
При повторном хирургическом вмешательстве через 3 месяца для обнажения импланта был поднят буккальный полнослойный лоскут для установки заживляющего абатмента. Лоскут затем был подрезан и адаптирован к заживляющему абатменту для обеспечения адекватных размеров кератинизированной слизистой вокруг импланта.
2.3.2.3 Послеоперационные процедуры.
Спасительное противовоспалительное средство (т.е. ибупрофен 600 мг в таблетках) было назначено сразу после операции, затем по мере необходимости в последующие послеоперационные дни. Пациентам было рекомендовано не носить съемные протезы, чтобы избежать давления на хирургический участок как минимум в течение 4 недель, а также не жевать и не чистить зубы в обработанной области примерно в течение 2 недель. Для домашнего использования был назначен 0,12% раствор хлоргексидина (Dentosan, Recor-dati, Милан, Италия) для химического контроля налета (полоскание в течение 1 минуты дважды в день в течение 3 недель). Швы были удалены через 2 недели после операции.
2.4 Параметры исследования
2.4.1 Клинические измерения
Для оценки эффекта лечения на PIBD были извлечены следующие клинические измерения из клинических карт:
- Высота костной деисценции (BDH): измеряется на средней щечной стороне имплантата как расстояние между апикальным краем полированной шейки имплантата и первым контактом кости с имплантатом;
- Ширина костной деисценции (BDW): измеряется на щечной стороне имплантата как самая широкая открытая часть шероховатой поверхности имплантата.
Во всех группах BDH и BDW оценивались сразу после установки имплантата и при повторном доступе для вскрытия имплантата.
Кроме того, толщина щечных тканей (BTT) измерялась как расстояние между щечным контуром полированной шейки и наружной стороной либо пересаженной области (группы SPAL), либо родного костного гребня (группа CONTROL) на средней щечной стороне имплантата. Исходная BTT была зафиксирована:
- Непосредственно после установки имплантата для контрольной группы;
- Непосредственно после пересадки для обеих групп SPAL; BTT был записан заново при повторном хирургическом вмешательстве для всех групп.
Все измерения проводились с использованием пародонтального зонда UNC-15 и округлялись до ближайшего миллиметра.
2.4.2 Радиографические Измерения
Периапикальные рентгенограммы, сделанные с использованием техники длинного конуса параллельно сразу после операции и при повторном вмешательстве для всех групп, были оцифрованы и проанализированы с использованием специально разработанного программного обеспечения (NIS elements v4.2; Nikon Instruments, Campi Bisenzio, Firenze, Italy). Уровень краевой кости (MBL) измерялся как расстояние (округленное до ближайших 0,1 мм) между самым апикальным краем полированной шейки имплантата и костным гребнем на мезиальном (mMBL) и дистальном (dMBL) аспектах каждого имплантата с использованием увеличения 10×–15×. MBL записывался как отрицательный или положительный, когда апикальный край полированной шейки находился соответственно апикально или коронально по отношению к костному гребню.
Ссылочная метка высотой 1 мм, присутствующая на цифровом радиографе, использовалась для калибровки.
Два эксперта (C.F. и M.S.) провели радиографические измерения. Эксперты участвовали в сессии калибровки на образце радиографий, полученных от пациентов, не отобранных для настоящего исследования. Сессия калибровки состояла из двух сессий измерений MBL, проведенных с интервалом в 7 дней, и позволила достичь отличного согласия между экспертами и внутри экспертов (k-оценка 0.87).
Статистический анализ
Частота пациентов, у которых грубая поверхность импланта покрывала до апикальной части полированной шейки (т.е. без PIBD) при повторном входе, считалась основным результатом. Значения и изменения в BDH, BDW, BTT и MBL были вторичными переменными результата.
Размер выборки был рассчитан с использованием данных, полученных из предыдущего исследования (Benic et al. 2019), где частота пациентов, у которых грубая поверхность импланта покрывала до плеча импланта при повторном входе, составила 91.7% в группах блоков DBBM и 25.0% в группе частиц DBBM соответственно. Z-тест оценил, что для достижения 95% статистической мощности с ошибкой альфа 0.05 требуется как минимум 11 пациентов для каждой из двух независимых групп SPAL.
Пациент рассматривался как статистическая единица. Данные описывались с использованием среднего, стандартного отклонения, медианы, интерквартильного диапазона (IR) и минимальных-максимальных значений для количественных переменных, а также процентных долей для категориальных переменных.
Внутригрупповые сравнения для непрерывной/ординальной переменной проводились с использованием теста знаков Уилкоксона для парных данных. Межгрупповые сравнения для непрерывной/ординальной переменной проводились с использованием ANOVA Краскала-Уоллиса. В случае значимости по тесту Краскала-Уоллиса были вычислены множественные (пост-хок) сравнения средних рангов; нормальные z-значения были вычислены для каждого сравнения, а также пост-хок вероятности (скорректированные по количеству сравнений) для двустороннего теста значимости. Межгрупповые сравнения для бинарной переменной проводились с использованием тестов хи-квадрат максимального правдоподобия с коррекцией Йетса. Изменение вторичных исходных переменных статистически оценивалось с использованием обобщенных линейных моделей (GLZ), скорректированных по значимым смешивающим факторам, с последующим ANOVA для повторных измерений для межгрупповых сравнений и с пост-хок тестом HSD с неравным N.
Результаты
4.1 Популяция исследования
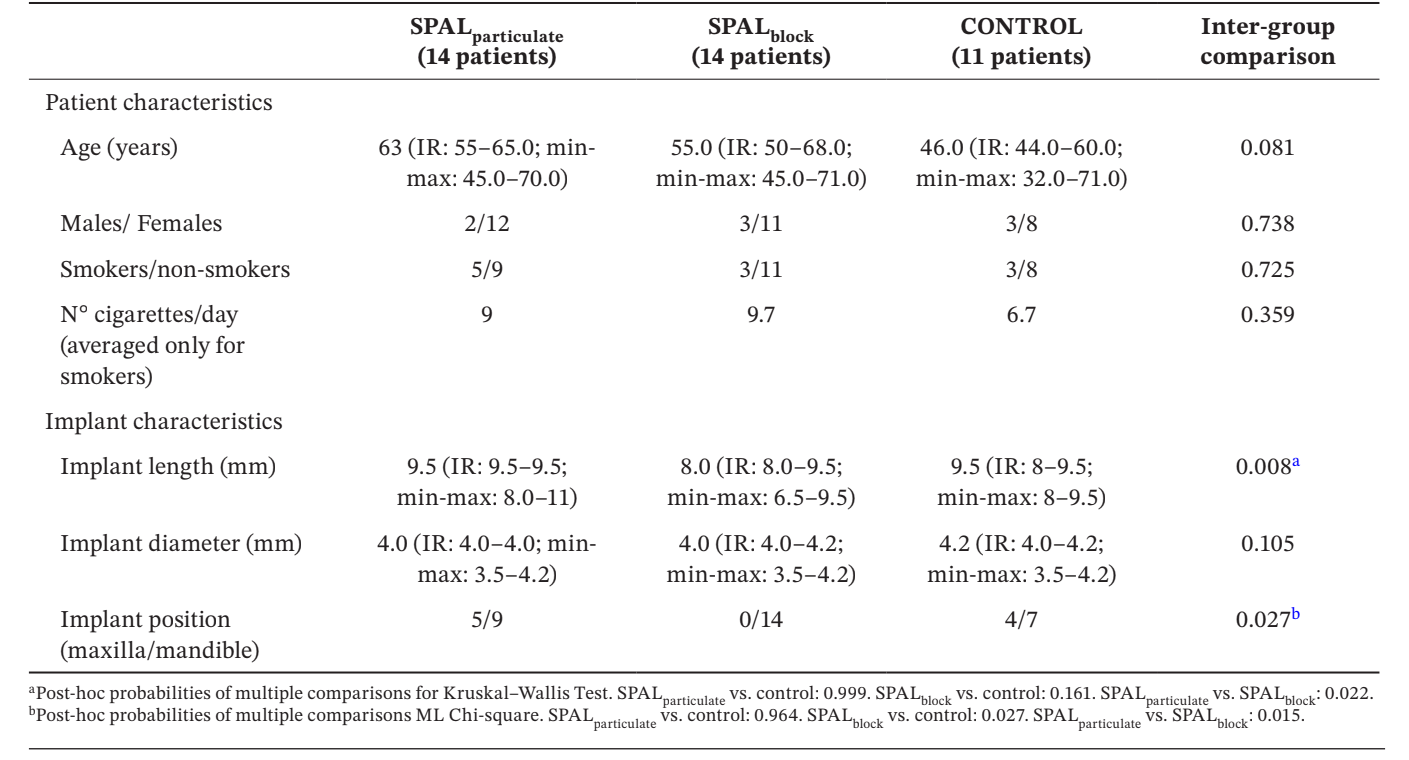
Тридцать девять имплантатов у 39 пациентов (14 в группе SPALчастицы, 14 в группе SPALблоки и 11 в контрольной группе) были выбраны для анализа (Таблица 1). Не было обнаружено различий по возрасту, полу и статусу курения между группами, подавляющее большинство пациентов не курили. В группах SPALчастицы и контрольной группе одна треть имплантатов находилась в верхней челюсти, тогда как все имплантаты находились в нижней челюсти в группе SPALблоки. Это различие было статистически значимым (p = 0.027). Имплантаты, установленные в группе SPALблоки, были значительно короче, чем те, что установлены в группах SPALчастицы и контрольной группе (p = 0.008).
4.1.1 Послеоперационное заживление
В группах SPALчастиц и CONTROL раннее заживление прошло без осложнений у всех пациентов.
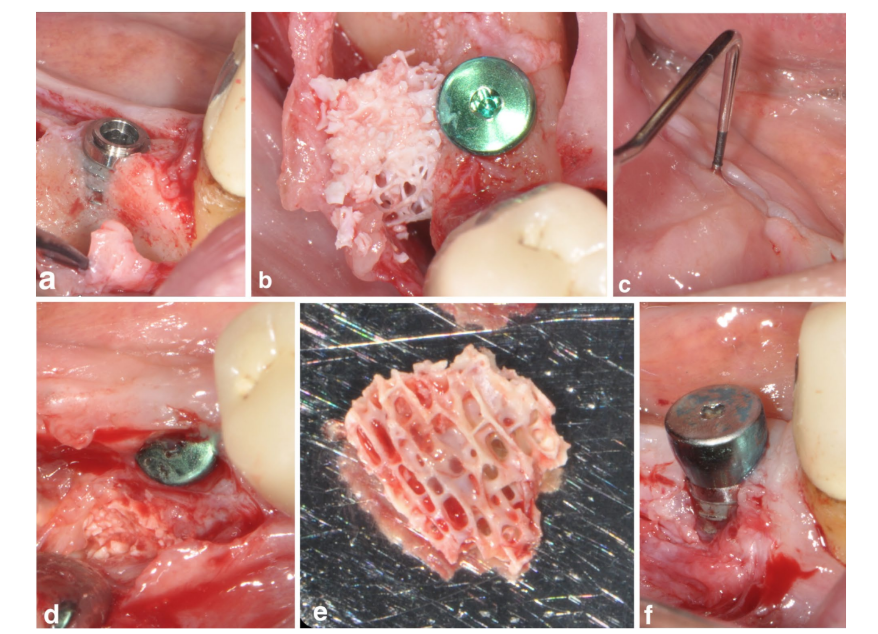
У одного пациента в группе SPALблок была зарегистрирована послеоперационная инфекция через 4 недели после хирургического вмешательства. Пациент сообщил о отеке и боли в области, подвергшейся хирургическому лечению, и была видна фистула, выделяющая гнойный экссудат (Рисунок 3a–f). После подъема лоскута частичной толщины блок-графт DBBM был обнаружен, вросшим в грануляционную ткань, и поэтому был удален.
4.2 Результаты исследования
4.2.1 Основной результат
Количество и % пациентов, у которых шершавая поверхность имплантата была покрыта до апикальной части полированной шейки при повторном входе (т.е. без PIBD), показаны в таблице 2. Остаточный дефект не был обнаружен в группе SPALчастиц, тогда как в группе SPALблоков пациент, у которого была инфекция послеоперационного графта, представил остаточный PIBD. Два пациента в группе КОНТРОЛЯ представили случай PIBD при повторном входе (таблица 2). Различия между группами не были статистически значимыми.
4.2.2 Вторичные результаты
Модель GLZ, скорректированная на выявленные сопутствующие факторы (длина и положение импланта), показала, что как лечение, так и время были значительными предикторами как для BDH, так и для BDW (время, p < 0.0001 для обоих; лечение, p < 0.001 для обоих). Сравнения внутри и между группами для BDH и BDW представлены в таблице 3. Тест Уилкоксона для парных данных показал значительное сокращение времени как для группы SPALparticulate (p < 0.001 для BDH и BDW), так и для группы SPALblock (p = 0.001 для BDH и BDW). При установке импланта группы SPAL были значительно отличны от группы CONTROL (p = 0.0001 для BDH и BDW). Однако значительных различий между группами при повторном входе для BDH и BDW не было обнаружено. В группе SPALblock пациент с остаточным PIBD показал BDH 3 мм и BDW 4 мм. В группе CONTROL два пациента с инцидентом PIBD при повторном входе показали BDH 2 мм и BDW 2 мм и BDH 2 мм и BDW 4 мм соответственно.
Для BTT модель GLZ, скорректированная по выявленным сопутствующим факторам, показала, что как лечение, так и время были значительными предикторами (p < 0.0001 для обоих факторов). Сравнения внутри и между группами для BDH и BDW представлены в таблице 4. Значительная разница между группами была наблюдаема как на исходном уровне, так и при повторном входе (p < 0.0001). В частности, группа SPALblock показала значительно большие значения, чем SPALparticulate как на исходном уровне (p = 0.0022), так и при повторном входе (p = 0.0160). Сравнения внутри группы показали значительное снижение BTT с течением времени для всех групп, величина этого снижения была схожа между группами.
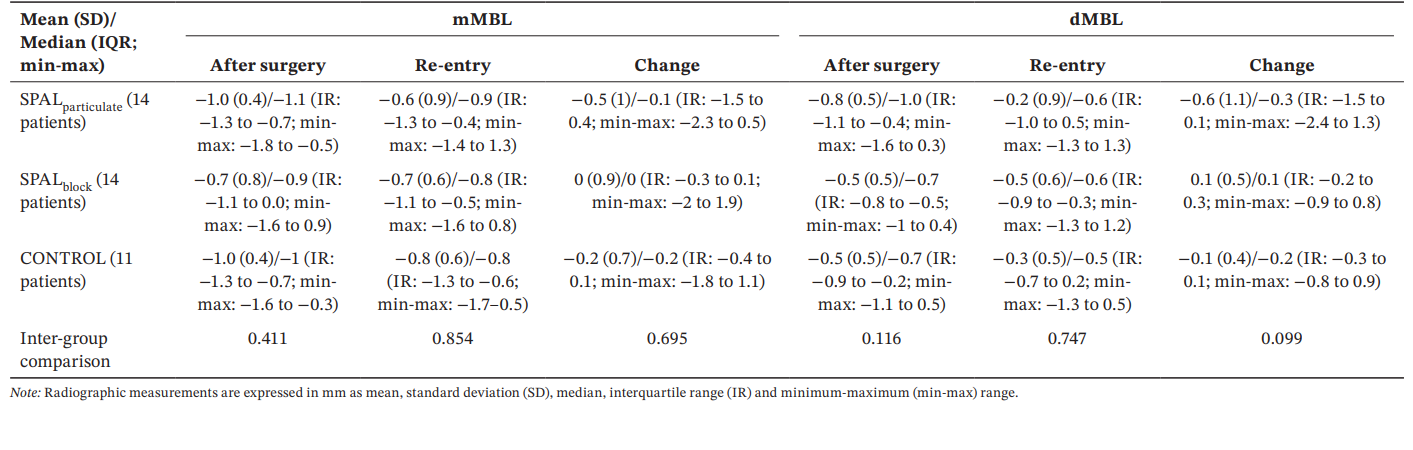
Все группы показали схожие значения mMBL и dMBL после операции и при повторном входе, а также изменения с течением времени (Таблица 5).
Обсуждение
Целью настоящего ретроспективного исследования было оценить эффективность техники SPAL, выполненной в сочетании с DBBM в форме частиц или блока, для полного исправления PIBD при установке имплантата. Группы SPAL также сравнивались с группой пациентов, у которых была перимплантная бугристая костная пластинка не менее 2 мм после установки имплантата. Результаты показали, что, независимо от формы DBBM, имплантаты, обработанные техникой SPAL, продемонстрировали аналогично высокий уровень пациентов с полной коррекцией дефекта через 6 месяцев повторного обследования. Группа SPALblock показала значительно большую BTT как на начальном этапе, так и при повторном обследовании. Однако степень ремоделирования трансплантата/костной ткани была схожа среди групп.
Выбор использования уровня полной коррекции деhisценции в качестве первичного результата был обусловлен тем фактом, что необработанный или частично скорректированный PIBD может (i) способствовать возникновению биологической осложнения (Monje et al. 2019; Schwarz, Sahm, and Becker 2012) и (ii) привести к увеличению межзубной перимплантной потери костной ткани (Jung et al. 2017). Группа CONTROL была включена для оценки степени ремоделирования двух биоматериалов трансплантата по сравнению с родной костью.
Эффективность SPAL, выполненной в сочетании с pDBBM для лечения PIBD, была сопоставима с той, что была зафиксирована в предыдущих клинических исследованиях, где использовался тот же частичный графт, показывая уровень полного покрытия декомпенсации в диапазоне от 80% до 91% (Trombelli et al. 2019, 2020). Эти результаты можно отчасти объяснить биологическими и техническими аспектами, специфичными для регенеративной процедуры. В технике SPAL слой периоста представляет собой источник остеогенных клеток, которые могут (i) благоприятно способствовать образованию новой кости (Ceccarelli et al., 2016) и (ii) действовать как индуктора неоангиогенеза, тем самым обеспечивая раннюю васкуляризацию графта DBBM (Nobuto et al. 2005). Более того, создание изолированного субпериостального пространства может позволить правильное размещение и стабилизацию графта в самой корональной части имплантата (Trombelli et al. 2018, 2019, 2020). Стабильность графта для поддержки остеокондуктивной активности графта также усиливается с помощью внутренних матрасных швов, которые фиксируют корональную часть периостального слоя к оральному лоскуту. Соответственно, сетевой мета-анализ, сравнивающий различные варианты лечения для полного исправления PIBD, показал, что SPAL с pDBBM имеет наивысшую вероятность успеха среди включенных процедур (Severi et al. 2022).
Недавно использование bDBBM в комбинации с SPAL было предложено как многообещающая альтернатива частичному трансплантату (Trombelli et al. 2022). Предполагается, что bDBBM действует как эффективный остеокондуктивный каркас благодаря своим механическим свойствам, которые включают ограниченное смещение при манипуляциях с лоскутом, а также более высокую размерную стабильность (Benic et al. 2016; Benic et al. 2017; Mir-Mari et al. 2016). Эффективность bDBBM подтверждается нашими данными, которые показали 93% уровень полного исправления PIBD. Более того, использование bDBBM привело к большему BTT, чем pDBBM как на начальном этапе, так и при повторном вмешательстве. Эти результаты согласуются с данными из исследования, в котором было показано, что комбинация bDBBM и коллагеновой мембраны, одновременно с установкой имплантата, превосходит комбинацию той же мембраны и pDBBM в полном разрешении дефекта и восстановлении толстой щечной пластины (Benic et al. 2019). Однако следует подчеркнуть, что у одного пациента, получившего блочный трансплантат, произошла инфекция трансплантата после операции, что привело к сохраняющейся декомпенсации через 6 месяцев. В предыдущих исследованиях, где использовался ксеногенный костный блок для процедуры увеличения гребня, проводимой перед установкой имплантата, сообщалось о частоте инфекций трансплантатов и последующем удалении от 33% (Ortiz-Vigón et al. 2017) до 40% (Schwarz et al. 2021) из обработанных случаев. Предклинические (Benic et al. 2016; Benic et al. 2017) и клинические (Laas et al., 2020) исследования показали, что bDBBM плохо колонизируется новым костным веществом по сравнению с pDBBM. Наблюдаемое ограниченное образование кости было связано с нарушенной васкуляризацией блока из-за его макроструктуры (Laass et al. 2020). Необходимо дополнительно оценить, в какой степени использование bDBBM может представлять собой безопасную и эффективную альтернативу pDBBM в комбинации с техникой SPAL.
Наш дизайн исследования может предоставить предварительное представление о степени ремоделирования трансплантата после процедур SPAL с различными формами трансплантатов по сравнению с ремоделированием кости после установки имплантата. Несмотря на то, что группа SPALblock показала значительно большую BTT как после операции, так и при повторном входе, величина ремоделирования трансплантата была схожа для двух трансплантатов и по сравнению с родной костью. Изменения BTT в группе SPALblock соответствовали предыдущим исследованиям, оценивающим ремоделирование трансплантата после процедуры GBR, выполненной с использованием bDBBM в сочетании с коллагеновой мембраной (Benic et al. 2019). В отличие от этого, то же исследование показало, что среднее снижение толщины для pDBBM плюс коллагеновая мембрана было в два раза больше (2 мм) по сравнению с нашими данными. Различия в изменениях BTT, наблюдаемые в двух исследованиях, могут быть объяснены различной динамикой ремоделирования трансплантата, а также степенью смещения трансплантата в результате конкретной регенеративной процедуры. В совокупности эти наблюдения предполагают необходимость переоценки размера BTT, чтобы компенсировать горизонтальное сжатие трансплантата после операции, независимо от используемых процедур увеличения кости.
В нашей контрольной группе MATERIAL состояли пациенты, у которых после установки имплантата была зафиксирована толщина PBBP не менее 2 мм. Этот выбор основывался на предыдущих исследованиях, показывающих, что толщина PBBP коррелирует с частотой вертикальной потери костной ткани на бугровой пластине после установки имплантата (Spray et al. 2000) и последующей необходимостью в процедурах костной аугментации (Roccuzzo, Imber и Jensen 2021). Интересно, что в контрольной группе также наблюдалось среднее снижение BTT на 1 мм, что привело к тому, что у двух пациентов (18%) произошел случай PIBD при повторном входе. Ремоделирование костной ткани превысило то, что было зафиксировано в предыдущих исследованиях, где снижение толщины PBBP после установки имплантата варьировало от 0,3 (Merheb et al. 2017) до 0,4 мм (Cardaropoli, Lekholm и Wennström 2006). Различные факторы, включая 3D-позиционирование имплантата (Nomiyama et al. 2022), методы подготовки места для имплантата (Baggi et al. 2008; Peker Tekdal et al. 2016), дизайн/поверхность имплантата (Linkevicius et al. 2020; Galindo-Moreno et al. 2016; Camarda et al. 2021), анатомическое расположение (переднее/заднее, нижняя челюсть/верхняя челюсть) (Ghaly et al. 2023), толщина периимплантантной слизистой (Maia et al. 2015; Suárez-López Del Amo et al. 2016), и протезное соединение (Linkevicius et al. 2015) могли частично объяснить это несоответствующее наблюдение.
Для облегчения закрытия первичного намерения были установлены имплантаты уровня ткани с корональным краем полированной манжеты на уровне костного гребня. В этом отношении нельзя исключить влияние позиционирования имплантата на количество коррекции PIBD, а также на степень ремоделирования периимплантной кости после установки имплантата (Saleh et al. 2018). Более того, группы SPAL и контрольная группа были повторно обследованы для вскрытия имплантатов в разные постоперационные периоды (6 месяцев против 3 месяцев). Эта разница могла по-разному повлиять на ремоделирование тканей после установки имплантата.
Периимплантная потеря краевой кости после установки имплантата может быть результатом физиологического ремоделирования из-за механической и термической травмы во время подготовки места для имплантата. Интересно, что в нашем материале было замечено ограниченное количество ремоделирования графта/кости, что было аналогично наблюдениям среди групп и соответствовало предыдущим исследованиям, где имплантаты уровня ткани были установлены эквикрестально (Saleh et al. 2018) или обработаны SPAL плюс pDBBM (Trombelli et al. 2020).
Некоторые ограничения настоящего исследования следует учитывать при интерпретации его результатов. Выбор пилотного исследования с ретроспективным дизайном был основан на отсутствии конкретных клинических показаний (т.е. факторов, связанных с пациентом/дефектом) для сочетания техники SPAL с частицами DBBM или блоком DBBM из-за ограниченных, анекдотических данных (Trombelli et al. 2022), поддерживающих использование блока DBBM в сочетании с техникой SPAL. Использовалась специфическая формулировка DBBM в соответствии с предпочтениями оператора. Этот беспристрастный выбор использованного графта не привел к значительным различиям в характеристиках пациентов и дефектов. Однако некоторые факторы, такие как анатомическое расположение и длина имплантатов, были неравномерно распределены между группами и, хотя и контролировались статистическим анализом, могли исказить наблюдаемые результаты. Поскольку включенные пациенты последовательно лечились в ходе рутинной клинической деятельности, зонд UNC 15 был регулярным/стандартизированным инструментом, используемым для всех клинических измерений, включая размеры PIBD. Другие методы измерения, такие как штангенциркуль (Roccuzzo, Imber, и Jensen 2021) или специально разработанное устройство (Merheb et al. 2017), могли бы привести к более точным записям размера декомпенсации и BBT.
В заключение, наши результаты, похоже, указывают на то, что SPAL, выполненный в сочетании с частичным или блочным графтом DBBM, так же эффективен в коррекции PIBD, как и в увеличении BTT через 6 месяцев.
Маттиа Севери, Чиара Францини, Анна Симонелли, Чиара Скаполи, Леонардо Тромбелли
Ссылки
- Баджи, Л., И. Каппеллони, М. Ди Джироламо, Ф. Макери и Г. Вайро. 2008. “Влияние диаметра и длины имплантата на распределение напряжений оссеоинтегрированных имплантатов в зависимости от геометрии кристаллической кости: трехмерный конечный элементный анализ.” Журнал протезирования зубов 100, № 6: 422–431. https://doi.org/10.1016/S0022-3913(08)60259-0.
- Бенич, Г. И., Б. М. Эйзнер, Р. Е. Юнг, Т. Баслер, Д. Шнайдер и К. Х. Ф. Хаммерле. 2019. “Изменения в жестких тканях после направленной регенерации кости периимплантных дефектов с сравнением блочных и частичных костных заменителей: 6-месячные результаты рандомизированного контролируемого клинического испытания.” Клинические исследования имплантатов 30: 1016–1026. https://doi.org/10.1111/clr.13515.
- Бенич, Г. И., Д. С. Тома, Ф. Муньос, И. С. Мартин, Р. Е. Юнг и К. Х. Ф. Хаммерле. 2016. “Направленная регенерация кости периимплантных дефектов с использованием частичных и блочных ксеногенных костных заменителей.” Клинические исследования имплантатов 27, № 5: 567–576. https://doi.org/10.1111/clr.12625.
- Бенич, Г. И., Д. С. Тома, И. Санц-Мартин и др. 2017. “Направленная регенерация кости на зубных имплантатах из циркония и титана: пилотное гистологическое исследование.” Клинические исследования имплантатов 28, № 12: 1592–1599. https://doi.org/10.1111/clr.13030.
- Брессан, Э., Н. Ферраресе, М. Прамстраллер, Д. Лопс, Р. Фарина и К. Томаси. 2017. “Размеры гребня беззубой челюсти в заднем секстанте: наблюдательное исследование на радиографиях конусно-лучевой компьютерной томографии.” Имплантология 26, № 1: 66–72. https:// doi.org/10.1097/ID.0000000000000489.
- Камарда, А. Дж., Р. Дюран, М. Бенкарим, П. Х. Ромпре, Г. Гертин и Х. Чиабурро. 2021. “Перспективное рандомизированное клиническое испытание, оценивающее влияние двух различных дизайнов шейки имплантата на заживление периимплантных тканей и функциональную оссеоинтеграцию через 25 лет.” Клинические исследования имплантатов 32: 285–296. https://doi.org/10.1111/clr.13699.
- Кардарополи, Г., У. Лекхольм и Дж. Л. Венстром. 2006. “Изменения тканей при одиночных зубных заменах на имплантатах: 1-летнее перспективное клиническое исследование.” Клинические исследования имплантатов 17, № 2: 165–171. https://doi.org/10.1111/j.1600-0501.2005.01210.x.
- Фарина, Р., А. Симонелли, А. Баралди и др. 2021. “Потеря зубов у пациентов с периодонтитом, соблюдающих и не соблюдающих рекомендации, с различными уровнями пародонтального риска во время поддерживающей пародонтальной терапии.” Клинические исследования 25, № 10: 5897–5906. https://doi.org/10.1007/s00784-021-03895-8.
- Галиндо-Морено, П., А. Леон-Кано, А. Монье, И. Ортега-Оллер, Ф. О'Валле и А. Катена. 2016. “Высота абатмента влияет на эффект переключения платформы на потерю краевой кости вокруг имплантата.” Клинические исследования имплантатов 27, № 2: 167–173. https://doi.org/10.1111/clr.12554.
- Галлуччи, Г. О., А. Хэмилтон, В. Чжоу, Д. Бусер и С. Чен. 2018. “Протоколы установки и нагрузки имплантатов у частично беззубых пациентов: систематический обзор.” Клинические исследования имплантатов 29, №. Дополнение 16: 106–134. https://doi.org/10.1111/clr.13276.
- Гали, М., Д. Тарраззи, В. Ся, С. Таррингтон и Т. Р. Шонбаум. 2023. “Изменения уровня краевой кости вокруг имплантатов в зависимости от расположения челюсти: систематический обзор и мета-анализ 4970 имплантатов.” Журнал имплантологии 49, № 4: 444–455. https://doi.org/10.1563/aaid-joi-D-22-00252.
- Эррера, Д., Т. Берглунд, Ф. Шварц и др. 2023. “Профилактика и лечение периимплантных заболеваний — клинические рекомендации уровня EFP S3.” Журнал клинической пародонтологии 50, №. Дополнение 26: 4–76. https://doi.org/10.1111/jcpe.13823.
- Йенсен, С. С., Т. Агалу, Р. Е. Юнг и др. 2023. “Отчет консенсуса группы 1 ITI: Роль размеров кости и процедур увеличения мягких тканей на стабильность клинических, радиографических и пациентских результатов имплантантного лечения.” Клинические исследования имплантатов 34, №. Дополнение 26: 43–49. https://doi.org/10.1111/clr.14154.
- Юнг, Р. Е., М. Герцог, К. Вольлеб, К. Ф. Рамель, Д. С. Тома и К. Х. Ф. Хаммерле. 2017. “Рандомизированное контролируемое клиническое испытание, сравнивающее небольшие дефекты бугровой декомпенсации вокруг зубных имплантатов, обработанных направленной регенерацией кости или оставленных для спонтанного заживления.” Клинические исследования имплантатов 28, № 3: 348–354. https://doi.org/10.1111/clr.12806.
- Лаас, А., Б. М. Эйзнер, К. Х. Ф. Хаммерле, Р. Е. Юнг, Д. С. Тома и Г. И. Бенич. 2020. “Гистологические результаты после направленной регенерации кости периимплантных дефектов с сравнением индивидуально сформированных блоков и частичных костных заменителей.” Международный журнал пародонтологии и восстановительной стоматологии 40, № 4: 519–527. https://doi.org/10.11607/prd.4575.
- Линкевичус, Т., А. Пуйсис, Л. Линкевичене, В. Пециулиене и М. Шлее. 2015. “Стабильность кристаллической кости вокруг имплантатов с горизонтально совпадающим соединением после утолщения мягких тканей: перспективное клиническое испытание.” Клиническая имплантология и сопутствующие исследования 17, № 3: 497–508. https://doi.org/10.1111/cid.12155.
- Линкевичус, Т., А. Пуйсис, Р. Линкевичус, Дж. Алкимавичус, Э. Гиневичюте и Л. Линкевичене. 2020. “Влияние погруженного абатмента или подкристального размещения имплантата на толщину мягких тканей и стабильность кристаллической кости. 2-летнее рандомизированное клиническое испытание.” Клиническая имплантология и сопутствующие исследования 22, № 4: 497–506. https://doi.org/10.1111/cid.12903.
- Майя, Л. П., Д. М. Рейно, В. А. Муглия и др. 2015. “Влияние толщины пародонтальных тканей на ремоделирование бугровой пластины на немедленных имплантатах с ксенографтом.” Журнал клинической пародонтологии 42: 590–598. https:// doi.org/10.1111/jcpe.12405.
- Мереб, Дж., М. Веркруйссен, В. Коуке, Л. Беккерс, В. Тейгельс и М. Квиринен. 2017. “Судьба бугровой кости вокруг зубных имплантатов. 12-месячное наблюдение после нагрузки.” Клинические исследования имплантатов 28, № 1: 103–108. https://doi.org/10.1111/clr.12767.
- Мир-Мари, Дж., Х. Вуи, Р. Е. Юнг, К. Х. Ф. Хаммерле и Г. И. Бенич. 2016. “Влияние закрытия раны с использованием слепого метода на стабильность объема различных материалов GBR: in vitro исследование с использованием конусно-лучевой компьютерной томографии.” Клинические исследования имплантатов 27, № 2: 258–265. https://doi.org/10.1111/clr.12590.
- Монье, А., В. Шаппюи, Ф. Монье и др. 2019. “Критическая толщина бугровой кости вокруг имплантатов: экспериментальное исследование на собаке бигле.” Международный журнал оральной и челюстно-лицевой имплантологии 34, № 6: 1328–1336. https://doi.org/10.11607/jomi.7657.
- Монье, А., А. Роккуццо, Д. Бусер и Х. Л. Ванг. 2023. “Влияние толщины бугровой кости на изменения размеров жестких и мягких тканей вокруг имплантатов: систематический обзор.” Клинические исследования имплантатов 34, № 3: 157–176. https://doi.org/10.1111/clr.14029.
- Нобуто, Т., Ф. Сува, Т. Коно и др. 2005. “Микроваскулярный ответ в периосте после хирургии мукопериостального лоскута у собак: ангиогенез и резорбция и образование кости.” Журнал пародонтологии 76, № 8: 1346–1353. https://doi.org/10.1902/jop.2005.76.8.1346.
- Номияма, Л. М., Е. К. Матумото, М. Г. Корреа и др. 2022. “Сравнение между безфлапной направленной и традиционной хирургией для установки имплантатов: 12-месячное рандомизированное клиническое испытание.” Клинические исследования 27: 1665–1679. https://doi.org/10.1007/s00784-022-04793-3.
- Ортис-Вигон, А., И. Суарез, С. Мартинес-Вилла, И. Санц-Мартин, Дж. Боллайн и М. Санц. 2017. “Безопасность и эффективность нового коллагенированного ксеногенного костного блока для латерального увеличения альвеолярного гребня для поэтапной установки имплантатов.” Клинические исследования имплантатов 29, № 1: 36–45. https://doi.org/10.1111/clr.13036.
- Пекер Текдал, Г., Н. Бостанджи, Г. Н. Белибасаксис и А. Гюркан. 2016. “Влияние имплантной остеотомии с использованием пьезоэлектрической хирургии на радиологические и молекулярные параметры потери кости вокруг имплантатов: рандомизированное контролируемое испытание с разделением челюсти.” Клинические исследования имплантатов 27, № 5: 535–544. https://doi.org/10.1111/clr.12620.
- Прамстраллер, М., Г. П. Шинкалья, Р. Веккьятини, Р. Фарина и Л. Тромбелли. 2018. “Размеры альвеолярного гребня в задних областях нижней челюсти: ретроспективное сравнительное исследование зубных и беззубых участков с использованием данных компьютерной томографии.” Хирургическая и радиологическая анатомия 40, № 12: 1419–1428. https://doi.org/10.1007/s00276-018-2095-0.
- Роккуццо, А., Дж. С. Имбер и С. С. Йенсен. 2021. “Необходимость латерального увеличения кости на двух имплантатах узкого диаметра: перспективное контролируемое клиническое исследование.” Клинические исследования имплантатов 32, № 4: 511–520. https://doi.org/10.1111/clr.13721.
- Салех, М. Х. А., А. Равида, Ф. Суарез-Лопес Дель Амо, Г. Х. Лин, Ф. Аса'ад и Х. Л. Ванг. 2018. “Влияние положения соединения имплантата-абатмента на потерю краевой кости: систематический обзор и мета-анализ.” Клиническая имплантология и сопутствующие исследования 20, № 4: 617–633. https://doi.org/10.1111/cid.12600.
- Шварц, Ф., Д. Сахин, С. Цивале-Швайгёфер и Дж. Беккер. 2021. “Долгосрочные результаты после латерального увеличения альвеолярного гребня с использованием коллагенированного ксеногенного костного блока: моноцентрическое, перспективное одноармное клиническое исследование.” Международный журнал имплантологии 7, № 1: 9. https://doi.org/10.1186/s40729-021-00293-3.
- Шварц, Ф., Н. Сахм и Дж. Беккер. 2012. “Влияние результатов направленной регенерации кости в дефектах типа декомпенсации на долгосрочную стабильность здоровья периимплантных тканей: клинические наблюдения через 4 года.” Клинические исследования имплантатов 23, № 2: 191–196. https://doi.org/10.1111/j.1600-0501.2011.02214.x.