Влияние одновременной немедленной имплантации и направленной костной реконструкции с использованием ультратонких титановый мембран на радиографические и клинические параметры через 18 месяцев нагрузки
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Фон: Целью данного проспективного исследования серии случаев было оценить выживаемость имплантов и протезов, осложнения и потерю краевой кости с использованием ультратонкой титановый мембраны с одновременной установкой импланта, чтобы обеспечить необходимое пространство для направленной реконструкции костной ткани альвеолярного дефекта.
Материалы и методы: пациенты были набраны и лечены в частной клинике в Риме, Италия, в период с марта 2016 года по октябрь 2017 года. Самонарезающие конусные импланты устанавливались с помощью компьютерной навигации и шаблонов. Автогенная кость помещалась отдельно на обнаженную поверхность импланта, затем смешивалась с неорганическим бычьим костным материалом. Наконец, мембрана была соединена и сформирована так, чтобы надежно закрыть область трансплантата, и крышка заживления была подключена и закручена на высотный соединитель. Показатели результатов включали: неудачи имплантов и протезов, биологические и механические осложнения, изменения краевого и объемного уровня кости, эстетическая оценка, проведенная в соответствии с розовым эстетическим баллом (PES).
Результаты: всего семь пациентов (пять женщин, два мужчины) со средним возрастом 52.7 ± 20.3 года (в диапазоне: 27–71) получили 10 самонарезающих конусных имплантатов и одновременную направленную регенерацию костной ткани с использованием ультратонких титановый мембран. Ни один из имплантатов и ни одна из протезов не потерпели неудачу в течение всего периода наблюдения. У одного пациента через месяц после установки имплантата было зафиксировано незначительное обнажение мембраны. Средняя потеря краевой кости (MBL) при нагрузке на имплантат составила 0.13 ± 0.09 мм (95 % ДИ 0.08–0.19). На 18-месячном контрольном обследовании средняя MBL составила 0.28 ± 0.33 мм (95 % ДИ 0.07–0.50). Разница не была статистически значимой (0.15 ± 0.31; 95% ДИ 0.05–0.35; P = 0.1888). Средняя горизонтальная ширина альвеолярного гребня составила 3.72 ± 1.08 мм (95% ДИ 3.22–4.22 мм). На II этапе операции средняя ширина кости составила 8.79 ± 0.98 мм (95% ДИ 8.51–9.07 мм). Средний прирост кости составил 5.06 ± 1.13 мм (95% ДИ 4.68–5.44 мм; P = 0.000). Средний объем пересаженной кости, рассчитанный с использованием техники суперпозиции, составил 0.99 ± 0.38 CC (95% ДИ 0.75–1.23 CC). Средний PES при нагрузке на имплантат составил 8.2 ± 0.8 мм (95 % ДИ 7.7–8.7). На 18-месячном контрольном обследовании средний PES составил 12.0 ± 0.7 мм (95 % ДИ 11.5–12.5). Разница была статистически значимой (3.8 ± 0.4; 95 % ДИ 3.5–4.1; P = 0.0000).
Заключение: с учетом ограничений настоящего проспективного исследования, направленная реконструкция кости с использованием ультратонкой титаново́й сетчатой мембраны с одновременной установкой имплантата, похоже, обеспечивает хорошие и стабильные результаты в успехе имплантации/протезирования. Необходимы дальнейшие исследования с более длительным наблюдением и большим размером выборки для подтверждения результатов этого предварительного отчета.
Введение
Атрофия альвеолярной кости является хронической и прогрессирующей клинической ситуацией, характеризующейся умеренной до выраженной потерей объема кости из-за потери или удаления зубов. Более того, местные условия или заболевания, такие как травматическое удаление, пародонтоз и травма, могут усугубить это патологическое состояние, делая установку зубных имплантатов трудной или неблагоприятной как с функциональной, так и с эстетической точки зрения. Чтобы преодолеть эти возможные недостатки, были введены техники реконструкции кости. Среди них направленная регенерация кости (GBR) является хирургической процедурой, которая использует материал трансплантата в качестве каркаса, изолированного и защищенного мембраной от неостеогенных клеток, происходящих из соседней соединительной ткани. Таким образом, барьерный эффект мембраны должен позволить только остеогенным клеткам, происходящим из окружающей кости и сосудов, перемещаться в костный дефект, позволяя образованию кости через наличие стимулирующих сигналов.
Как рассасывающиеся, так и нерассасывающиеся мембраны использовались для изоляции и поддержания правильного и запланированного биологического каркаса, необходимого для формирования новой костной ткани. Учитывая природу их функции, нерассасывающаяся мембрана должна быть более предсказуемой и безопасной в использовании. Однако основным ограничением является необходимость дополнительной операции для удаления мембраны. Тем не менее, направленная костная реконструкция обычно выполняется в два этапа или с использованием протокола погруженного имплантата, когда она выполняется в один этап. Таким образом, мембрану можно удалить при установке имплантата или на втором этапе, если GBR была выполнена одновременно с имплантатом.
В повседневной практике нерассасывающиеся мембраны из расширенного политетрафторэтилена (e-PTFE) могут рассматриваться как первый выбор при реконструкции горизонтальных и вертикальных костных дефектов. Тем не менее, начиная с 1990-х годов, различные исследователи изучали клиническое использование ультратонкой титаново́й сетки (Ti-сетки) для реконструкции атрофической челюсти и верхней челюсти. Титан более устойчив к коллапсу, чем e-PTFE и рассасывающиеся мембраны. Таким образом, жесткость титана может работать как каркас, поддерживая пространство, необходимое для регенерации кости, даже в случаях больших костных дефектов, таких как вертикальная костная реконструкция.
Пористость титановых сеток может быть изменена для достижения лучшей интеграции тканей и формирования. Изменение пористости титановый сеток позволяет жидкости и питательным веществам проходить через мембрану, избегая при этом инфильтрации клеток.
В настоящее время предложены различные формы титановый мембран, чтобы максимизировать образование новой кости, стабилизировать материалы трансплантата под мембраной и снизить риск экспозиции мембраны, что может привести к коллапсу и/или прорастанию соседних мягких тканей.
Целью данного проспективного исследования серии случаев было оценить выживаемость имплантатов и протезов, осложнения, потерю краевой кости, используя ультратонкую титановую мембрану и одновременное размещение имплантатов, чтобы обеспечить необходимое пространство для увеличения объема альвеолярной кости при дефектах. Это испытание следовало положениям Заявления о укреплении отчетности об наблюдательных исследованиях в эпидемиологии (STROBE).
Материалы и методы
Это исследование было разработано как исследование серии случаев для оценки клинических и радиографических результатов одновременной направленной реконструкции кости и размещения имплантатов с ультратонкой титановый мембраной. Пациенты были набраны и лечены в частной клинике в Риме, Италия, в период с марта 2016 года по октябрь 2017 года. Хирургические процедуры проводились опытным клиницистом (MT), сертифицированным в области терапии на основе имплантатов в Европейской ассоциации остеоинтеграции в 2013 году. Все пациенты были проинформированы о природе исследования и дали свое письменное согласие на хирургические и протезные процедуры, а также на использование радиологических и клинических данных для публикации. Принципы, изложенные в Хельсинкской декларации 2013 года, строго соблюдались. Более того, радиологический протокол был одобрен Научно-техническим и этическим комитетом Университета Сассари (2069/CE).
Любые последовательные пациенты в возрасте 18 лет и старше, которые обратились с частичной адентией верхней или нижней челюсти, способны понять и подписать информированное согласие и нуждающиеся в восстановлении на имплантатах, считались подходящими для включения в это исследование. Пациенты были окончательно включены, если у них была атрофия остаточного альвеолярного гребня класса IV-VI по Кавуду и Хоуэллу на обследовании с использованием конусно-лучевой компьютерной томографии. Пациенты исключались, если у них были общие противопоказания к имплантационной хирургии (такие как облучение области головы и шеи в течение предыдущих пяти лет до имплантации или неконтролируемый диабет); беременность или лактация; злоупотребление психоактивными веществами; психиатрическая терапия или нереалистичные ожидания; предыдущее или текущее лечение внутривенными бисфосфонатами; нелеченый пародонтит или плохая гигиена полости рта (кровоточивость при зондировании и/или индекс налета ≥ 25%); курильщики с большим стажем (≥11 сигарет в день); постэкстракционные участки.
Перед имплантационной хирургией был выполнен КТ-сканирование (CBCT, CRANEX 3D; Soredex, Туусула, Финляндия) и сделано цифровое слепок (интраоральный сканер CS 3600, Carestream Dental, Атланта, Джорджия, США). КТ-сканирование было настроено с полем зрения 80 мм× 150 мм; размером вокселя 0.3 мкм; 90 KV; 6.3–10 мА в течение 4.5 с, что привело к дозе-области продукта 579.7–920.2 (мГрсм2). Данные STL и DICOM (Цифровая визуализация и коммуникации в медицине) были импортированы в специализированное программное обеспечение для диагностики и планирования имплантации (3Diagnosys версия 4.2, 3DIEMME srl, Кантù, Италия). После этого имплантаты, ориентированные на протезирование, были виртуально спланированы.
За час до операции была профилактически введена однократная доза антибиотиков (2 г амоксициллина и клавулановой кислоты или 600 мг клиндамицина в случае аллергии на пенициллин). Полоскание рта 0,2% раствором хлоргексидина диглюконата проводилось в течение двух минут перед операцией.
Все пациенты были обработаны под оральной седацией с диазепамом 10 мг (Валиум, Roche S.p.A., Монца, Италия). Местная анестезия проводилась с использованием артикаина с адреналином 1:100 000. Сделан разрез в области кератинизированной ткани с помощью хирургического скальпеля лезвия № 15C. Полнослойный лоскут был поднят за пределы мукогингивальной границы. Затем были сделаны два вертикальных разреза на один зуб дальше от костного дефекта или как минимум на 5 мм в случае беззубой области. Затем место получения было очищено от всех остатков мягких тканей. Имплантат с самонарезающим конусом TSIII (Osstem Implant, Сеул, Корея) был установлен с помощью компьютерного шаблона, на уровне кости или на 1 мм глубже, в соответствии с протоколом сверления, предложенным производителем. Все хирургические шаблоны поддерживались зубами и были изготовлены без металлических втулок. Основная характеристика мембраны OssBuilder заключается в том, что она фиксируется непосредственно к имплантату в одноэтапном подходе. Для обеспечения мембраны на имплантате необходимо использовать специальный инструмент, называемый соединителем высоты (Osstem Implant). Этот инструмент доступен в разных высотах для соединения мембраны с имплантатом на разных уровнях в зависимости от остаточной кости и глубины имплантата. С помощью шестигранного ключа 1.2 соединитель высоты был закручен в фиксатор с усилием 5-8 N·cm. Затем аутогенная кость была собрана из соседней области с использованием минимально инвазивного коллектора кортикальной кости (Micross, Meta, Италия). Кость была собрана в области мезиальной или дистальной, близкой к дефекту. После этого костный дефект был измерен для определения соответствующей формы и размера титановой сетчатой мембраны (OssBuilder, Osstem Implant). Все использованные мембраны были из чистого титана 2-го класса и имели поры диаметром от 0,6 до 1 мм.
Автогенная кость была помещена отдельно на обнаженную поверхность имплантата. Затем был использован второй слой, состоящий из автогенной кости, смешанной с неорганическим бычьим костным материалом (Bio-OSS, Geistlich Biomaterials Italia S.r.l.) в соотношении 1:1, для заполнения оставшегося дефекта. Костный графт был переувеличен, чтобы компенсировать окончательную резорбцию графта. Наконец, мембрана была соединена с высотным соединителем и сформирована так, чтобы надежно закрыть область графта, и на высотный соединитель был установлен и закручен заживляющий колпачок с помощью драйвера колпачка при 5–8 Н·см. Была сделана периостальная инцизия, чтобы обеспечить пассивную, безнатяжную адаптацию и закрытие лоскута. Рана была зашита в два слоя с помощью шва 4-0 полиглактин 910 (Vicryl V271; Ethicon, West Somerville, NJ, USA) (Рисунки 1–3). Антибиотикотерапия была назначена на семь дней (1 г амоксициллина и клавулановой кислоты или 300 мг клиндамицина дважды в день) после операции. Было назначено полоскание рта 0,2% раствором хлоргексидина диглюконата в течение одной минуты, дважды в день, в течение трех недель, и рекомендована мягкая диета на четыре недели. Ибупрофен 400 мг (или парацетамол 1 г) следует принимать в случае боли.
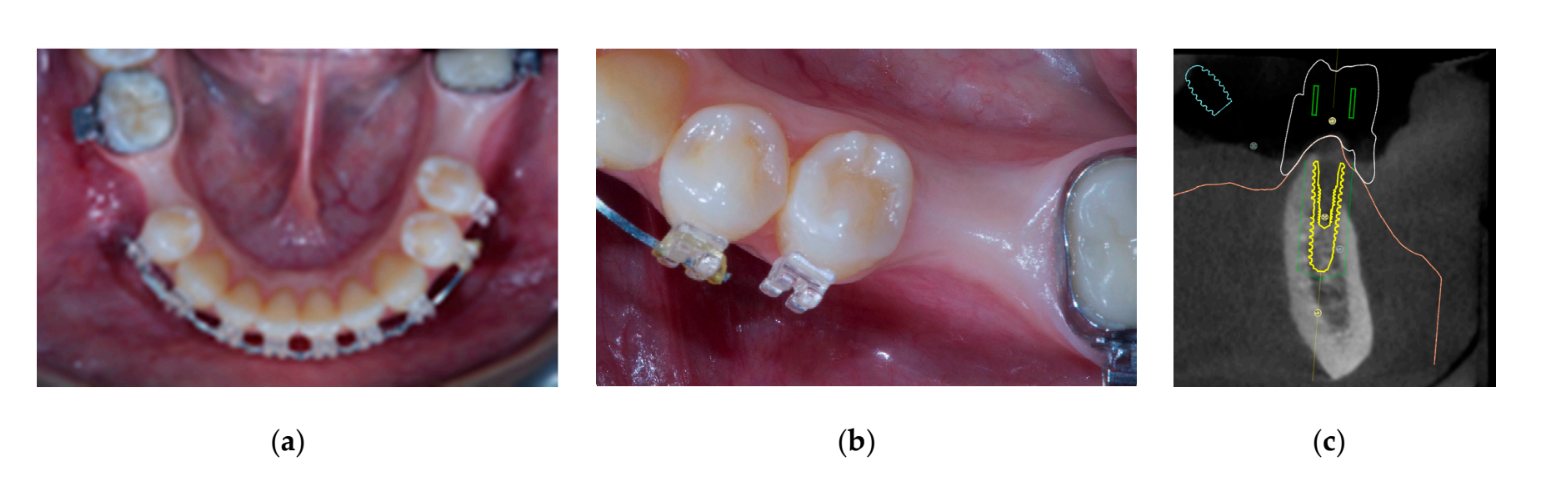
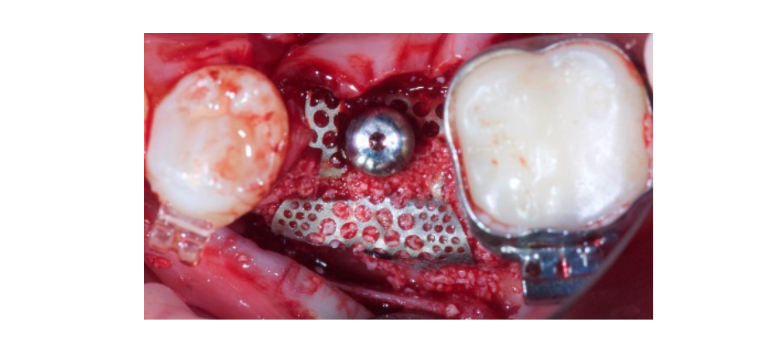
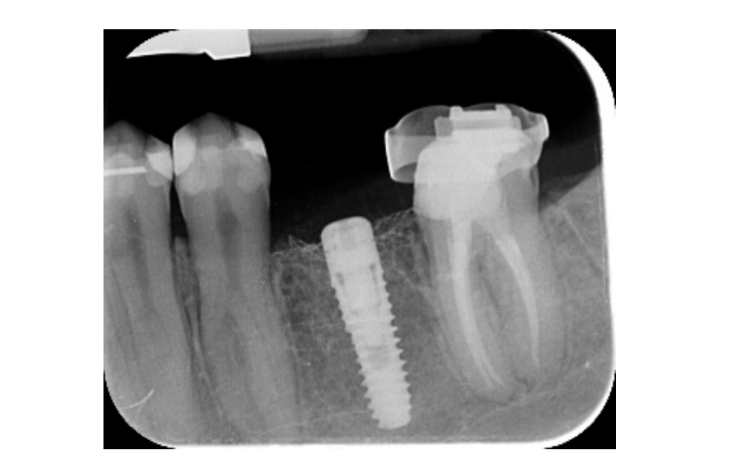
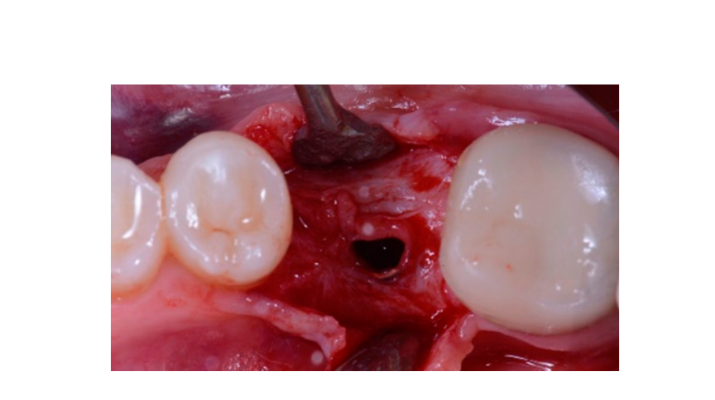
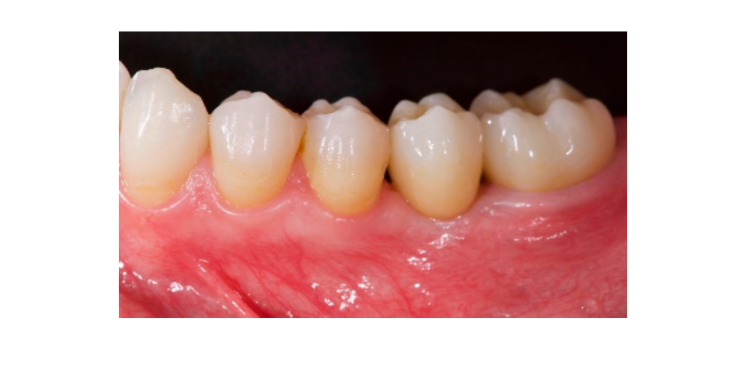
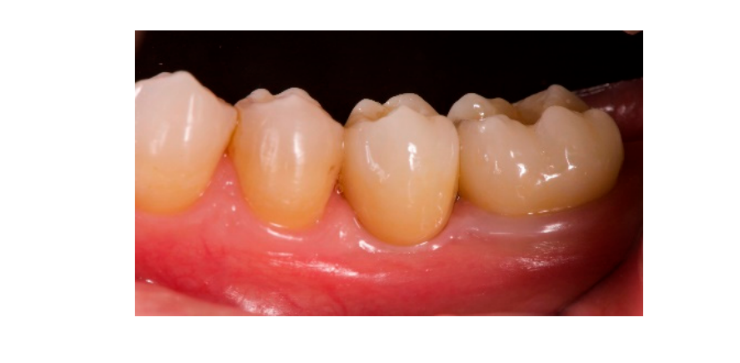
Семь-восемь месяцев после установки имплантата пациенту провели второе КТ-сканирование для оценки реконструкции кости. КТ-сканирование было настроено с полем зрения 60 мм × 80 мм; размер вокселя 0.3 мкм; 90 кВ; 4–6.3 мА в течение 2.3 с, что привело к дозе-области продукта 192.4–307.8 (мГрсм2). Затем была проведена хирургическая процедура второго этапа, при этом было обеспечено сохранение кератинизации тканей вокруг зубного имплантата. Ультратонкая титановая сетка была осторожно удалена, и на fixture был установлен абатмент для заживления (Рисунок 4). Затем мембрана, богатая тромбоцитами (PRF), была адаптирована к реконструированной кости, и лоскут был подтянут коронально и зашит. Через две недели была предоставлена временная реставрация. Через три-четыре месяца была выполнена реставрация из циркония с винтовым креплением CAD/CAM (Рисунки 5 и 6). Окклюзия была скорректирована, чтобы избежать преждевременных контактов. Были сделаны периапикальные рентгенограммы и клинические фотографии. Контрольные визиты были запланированы каждые три месяца после установки имплантата (Рисунки 7 и 8).
Включенные меры результатов:
- Коэффициент выживаемости имплантата: имплантат считался неудачным, если он проявлял какую-либо подвижность, перелом имплантата или инфекцию, требующую удаления имплантата.
- Реставрация считалась неудачной, если ее необходимо было заменить альтернативной реставрацией.
- Наличие биологических (боль, отек, гнойное выделение и т.д.) или механических (ослабление винта или перелом каркаса и/или облицовочного материала и т.д.) осложнений.
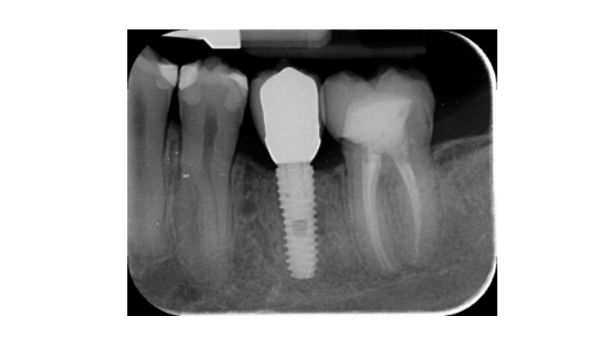
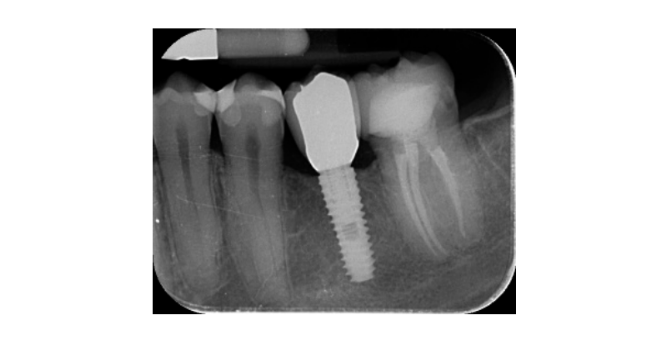
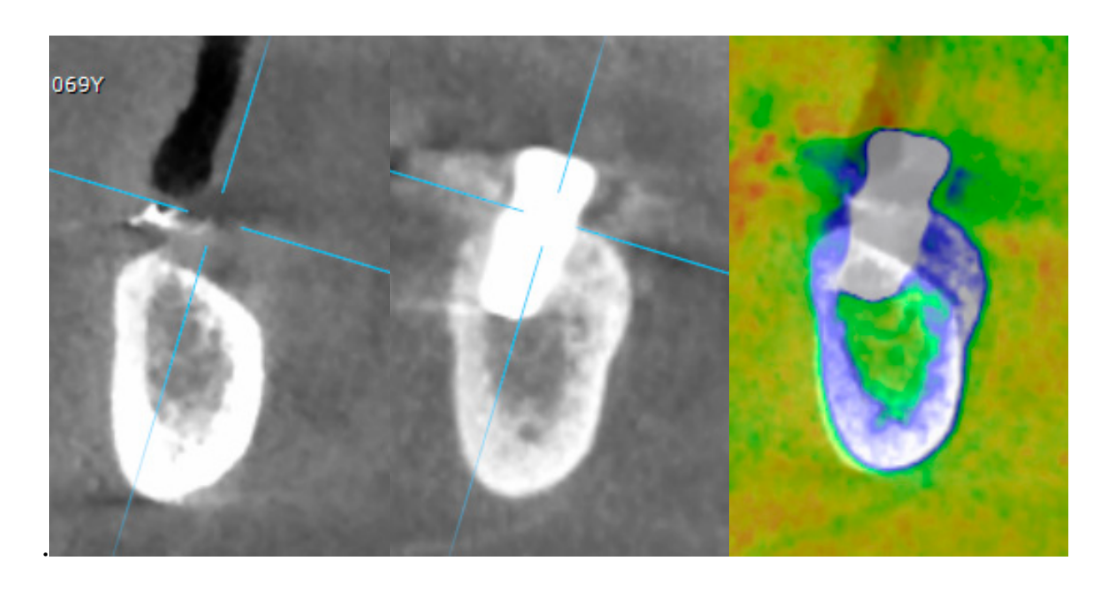
- Изменения уровня краевой кости оценивались с помощью цифровых периапикальных рентгенограмм (Digora Optime; Soredex, Тусула, Финляндия) с использованием параллельной техники и коммерчески доступных держателей для пленки. Оценивались три временных момента: при установке имплантата (базовый уровень), сразу после вставки реставрации и через год после нагрузки. Средние мезиальные и дистальные расстояния от самого коронального края имплантата до первого контакта кости с имплантатом измерялись с точностью до 0,01 мм и принимались за уровень краевой кости. Разница в уровнях между временными точками принималась за потерю краевой кости (MBL).
- Горизонтальное увеличение кости оценивалось на КТ-сканах, на 1 мм ниже оригинального костного гребня. Объемные данные накладывались с использованием соседних зубов в качестве контрольных точек, и новый набор данных DICOM сохранялся как отдельные файлы. Измерения проводились до и после лечения, а разница между этими двумя измерениями принималась за горизонтальное увеличение кости (Рисунок 9).
- Объемные измерения восстановленной кости проводились автоматически на объединенном наборе объемных данных КТ, с использованием модуля Fusion программного обеспечения OnDemand 3D (Cybermed Inc., Сеул, Корея), согласно ранее опубликованному протоколу [8].
- Эстетическая оценка проводилась в соответствии с розовым эстетическим баллом (PES) на вестибулярных и окклюзионных фотографиях, включая как минимум один соседний зуб с каждой стороны. Значения оценивались через 6 и 12 месяцев после нагрузки (наблюдение через 18 месяцев). Семь переменных (мезиальный папилла, дистальный папилла, уровень мягких тканей, контур мягких тканей, дефицит альвеолярного процесса, цвет и текстура мягких тканей) оценивались по шкале 2-1-0 (2 - лучший, 0 - худший) тем же слепым стоматологом.
Хирургические ставки по имплантации и протезированию, а также осложнения оценивались теми же клиницистами, которые выполняли все случаи (MT). Утрата краевой кости и оценка эстетики в розовом цвете оценивались любым независимым оценщиком, не участвовавшим ранее в исследовании (MM). Описательный анализ был выполнен для среднего ± стандартного отклонения (SD), медианы и 95% доверительного интервала (CI) с использованием Numbers (Версия 5.2) для Mac OS High Sierra 10.X. Сравнения между контрольными точками проводились с помощью парного t-теста Стьюдента с использованием SPSS (Версия 22.0; IBM Corporation, Армонк, Нью-Йорк, США) для Mac OS High Sierra 10.X. Все статистические сравнения проводились на уровне значимости 0.05. Статистической единицей был имплантат.
Результаты
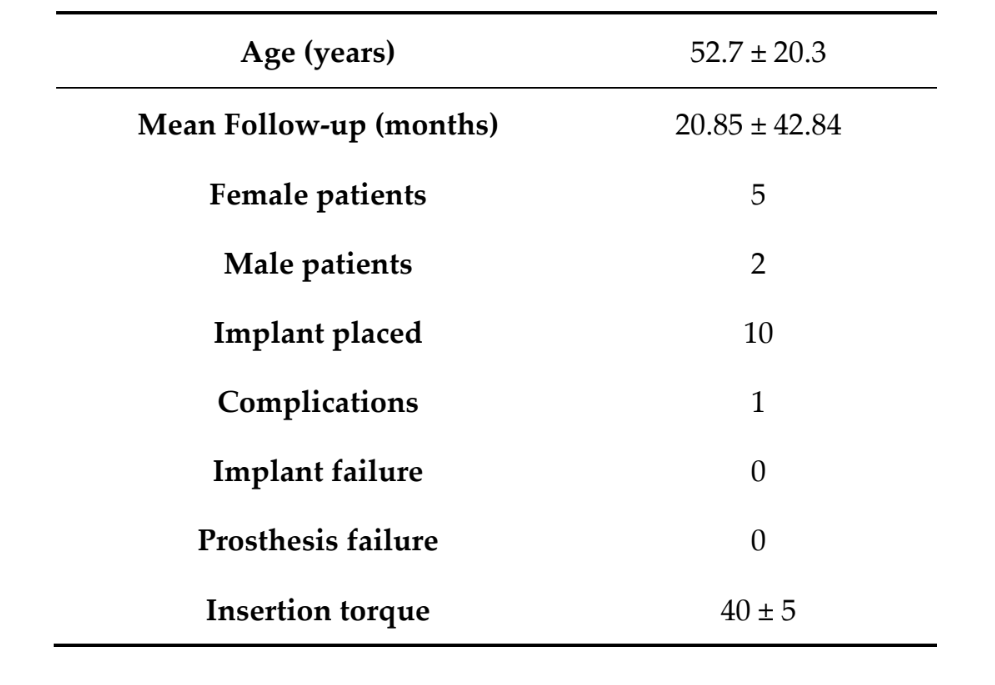
В общей сложности семь пациентов (пять женщин, два мужчины) со средним возрастом 52.7 ± 20.3 года (диапазон: 27–71) получили 10 самонарезающих конусных имплантатов TSIII (Osstem Implant) и одновременно проведенную направленную регенерацию костной ткани с использованием ультратонких титановый сетчатых мембран (OssBuilder; Osstem Implant). Через 18 месяцев после нагрузки ни один из пациентов не выбыл, и отклонений от оригинального протокола не произошло. Среднее время наблюдения составило 20.85 ± 42.84 месяца после установки имплантатов (диапазон: 18–24 месяца). Все имплантаты были установлены с крутящим моментом от 35 до 45 Н·см с использованием компьютерного, шаблонно-ориентированного подхода (Таблица 1).
В течение периода наблюдения не было зарегистрировано ни одного случая неудачи имплантов и протезов. У одного пациента через месяц после установки импланта было зафиксировано незначительное обнажение мембраны. Пациентам было рекомендовано аккуратно чистить мембрану мягкой зубной щеткой и применять спрей с хлоргексидином дважды в день. Полное заживление мягких тканей было отмечено через четыре недели.
Все импланты были установлены на уровне кости или на 1 мм глубже. Средняя потеря краевой кости при нагрузке на имплант составила 0.13 ± 0.09 мм (95% ДИ 0.08–0.19). На 18-месячном контрольном осмотре средняя потеря краевой кости составила 0.28 ± 0.33 мм (95% ДИ 0.07–0.50). Разница не была статистически значимой (0.15 ± 0.31; 95% ДИ 0.05–0.35; P = 0.1888) (Таблица 2).

Средняя горизонтальная ширина альвеолярного гребня составила 3.72 ± 1.08 мм (95% ДИ 3.22–4.22 мм). На II этапе операции средняя ширина кости составила 8.79 ± 0.98 мм (95% ДИ 8.51–9.07 мм). Средний прирост кости составил 5.06 ± 1.13 мм (95% ДИ 4.68–5.44 мм; P = 0.000). Средний объем пересаженной кости, рассчитанный с использованием техники суперпозиции, составил 0.99 ± 0.38 CC (95% ДИ 0.75–1.23 CC).
Средний PES при нагрузке на имплантат составил 8.2 ± 0.8 мм (95% ДИ 7.7–8.7). На 18-месячном контрольном осмотре средний PES составил 12.0 ± 0.7 мм (95% ДИ 11.5–12.5). Разница была статистически значимой (3.8 ± 0.4; 95% ДИ 3.5–4.1; P = 0.0000) (Таблица 2).
Обсуждение
Настоящее исследование было проведено для оценки клинических и радиологических данных через год после нагрузки при направленной регенерации кости с использованием ультратонкой титаново-решетчатой мембраны с одновременной установкой имплантата, чтобы обеспечить эффект каркаса (поддержание пространства), необходимый для восстановления костных дефектов гребня. Поскольку это исследование было спроектировано как проспективное исследование серии случаев, его основным ограничением является отсутствие контрольной группы. Основным ограничением настоящего исследования был небольшой размер выборки. Тем не менее, это исследование было спроектировано как проспективное исследование серии случаев. Это ограничение можно было бы решить, проведя дальнейшие испытания с большими размерами выборки, которые можно было бы рассчитать на основе предварительных результатов настоящего исследования. Еще одним ограничением этого исследования, которое могло быть смешивающим фактором, было то, что биотип десны не учитывался. Тем не менее, результаты настоящего исследования согласуются с ранее опубликованными отчетами. На самом деле, несколько исследователей поддержали идеальные механические свойства титаново-решетки в терминах жесткости, пластичности и упругости. Более того, титановая решетка, по-видимому, менее подвержена бактериальному загрязнению по сравнению с рассасывающимися материалами. Чтобы подчеркнуть эту концепцию, авторы наблюдали только одно незначительное обнажение мембраны через месяц после установки имплантата. Пациентам было рекомендовано осторожно чистить мембрану мягкой зубной щеткой и применять спрей с хлоргексидином дважды в день. Полное заживление мягких тканей было отмечено через четыре недели. Эта незначительная осложнение свидетельствует о эффективности этой титаново-решетки. Более того, в этом проспективном исследовании ни один имплантат и ни одна протез не потерпели неудачу в течение периода наблюдения. Благодаря этим данным разумно считать эту процедуру безопасной и простой для клинициста. Несколько характеристик барьерных мембран необходимы для успешной направленной регенерации кости, такие как клиническая управляемость, биосовместимость, способность к созданию пространства, исключение клеток и интеграция тканей. Титаново-решетки являются нерассасывающимися мембранами, и их пористость может варьироваться для достижения совместимости с тканями. В настоящем исследовании использовалась ультратонкая мембрана из чистого титана 2-го класса. Толщина титаново-решетки составила 100 мкм, в то время как пористость была от 0.6 до 1 мм в диаметре. Поры диаметром 1 мм могут обеспечить оптимальное кровоснабжение и диффузию факторов роста, необходимых для стимуляции заживления и регенерации кости. Однако поры диаметром 0.6 мм могут предотвратить смещение или миграцию материала для костной пересадки, позволяя при этом диффузию кровоснабжения. Более того, эти мембраны имели некоторые боковые перфорации, которые должны обеспечивать высокую механическую прочность, одновременно позволяя гибкость для формовки и модификации.
Тем не менее, экспозиция мембраны и инфекция относительно распространены. В отличие от мембраны PTFE, которая относительно толстая, примерно 200 мкм, и подвержена захвату бактерий из-за своей пористой структуры, титан может быть изготовлен в более тонкой форме.
Недавно стало известно, что ультратонкие поверхности с узорами, связанными с порами, каналами и другими особенностями в биоскелетах, влияют на миграцию клеток, пролиферацию и дифференцировку. Таким образом, технологии лазерной обработки благоприятны для создания различных ультратонких поверхностных узоров.
Для достижения хорошей и предсказуемой регенерации кости костный трансплантат должен включать три характеристики:
(1) Остебластные клетки или мезенхимальные стволовые клетки; (2) Факторы роста, чтобы обеспечить прогресс регенерации; и (3) «Скелет», способный обеспечить механическую поддержку для прикрепления и пролиферации клеток.
Авторы выдвинули гипотезу, что эта ультратонкая структура, использованная в данном проспективном исследовании, позволяет минимизировать прорастание мягких тканей в микро перфорации и сохраняет проницаемость питательных веществ или тканевой жидкости через мембрану, что способствует прикреплению, миграции и пролиферации клеток, полученных из костного мозга, что приводит к большей регенерации кости.
За последнее десятилетие долгосрочные исследования оценили и подчеркнули, что GBR является успешной и предсказуемой техникой для клинициста, позволяющей получить вертикальное и горизонтальное увеличение гребня. GBR можно достичь двумя различными подходами: применением либо политетрафторэтиленовой (PTFE) титаново-усиленной мембраны (т.е. нерассасывающейся мембраны) и ультратонкой титаново́й сетки, либо коллагеновой мембраны (т.е. рассасывающейся мембраны). Имплантаты устанавливались с использованием компьютеризированного шаблона, на уровне кости или на 1 мм глубже, в соответствии с протоколом сверления, предложенным производителем. На наш взгляд, этот направленный подход позволяет лучше установить имплантаты с учетом протезирования и обеспечивает регенерацию кости в соответствии с необходимым протезом.
Результаты настоящего исследования согласуются с недавней литературой, опубликованной по имплантации, проведенной после или во время процедуры GBR.
Заключения
С учетом ограничений настоящего проспективного исследования, направленная реконструкция кости с использованием ультратонкой титаново́й сетки с одновременной установкой имплантата, чтобы обеспечить необходимое пространство для увеличения кости в области альвеолярных дефектов, кажется, обеспечивает успех импланта/протеза. Необходимы дальнейшие исследования с большим размером выборки и более длительным наблюдением, чтобы подтвердить эти предварительные результаты.
Марко Талларико, Франческо Маттиа Черузо, Леонардо Муззи, Сильвио Марио Мелони, Ён-Джин Ким, Марко Гаргари и Маттео Мартинолли
Ссылки
- Atwood, D.A. Уменьшение остаточных гребней: основное заболевание полости рта. J. Prosthet. Dent. 1971, 26, 266–279.
- Chiapasco, M.; Casentini, P.; Zaniboni, M. Процедуры увеличения костной ткани в имплантологии. Int. J. Oral Implant. 2009, 24, 237–259.
- Rakhmatia, Y.D.; Jinno, Y.; Furuhashi, A.; Koyano, K.; Ayukawa, Y. Анализ микрокомпьютерной томографии раннего этапа заживления кости с использованием микропористой титановый сетки для направленной регенерации кости: предварительный эксперимент на модели собаки. Odontology 2017, 8, 25–417.
- Meloni, S.M.; Jovanovic, S.A.; Pisano, M.; De Riu, G.; Baldoni, E.; Tallarico, M. Одностадийная горизонтальная направленная регенерация кости с аутологичной костью, неорганической бычьей костью и коллагеновыми мембранами: наблюдение за перспективным исследованием через 30 месяцев после нагрузки. Eur. J. Oral Implantol. 2018, 11, 89–95.
- Becker, W.; Becker, B.; Mellonig, J. Перспективное многоцентровое исследование, оценивающее регенерацию периодонта при вторичных инвазиях класса II и инфрабоневых дефектах после лечения с использованием биоразлагаемой барьерной мембраны: результаты через 1 год. J. Periodontol. 1996, 67, 641–649.
- Zitzmann, N.U.; Naef, R.; Scharer, P. Рассасывающиеся и нерассасывающиеся мембраны в сочетании с Bio-Oss для направленной регенерации кости. Int. J. Oral Maxillofac. Implants 1997, 12, 844–852.
- Merli, M.; Moscatelli, M.; Mariotti, G.; Rotundo, R.; Bernardelli, F.; Nieri, M. Изменение уровня кости после вертикального увеличения гребня: рассасывающиеся барьеры против титаноусиленных барьеров. 6-летнее двойное слепое рандомизированное клиническое испытание. Int. J. Oral Maxillofac. Implants 2014, 29, 905–913.
- Meloni, S.M.; Jovanovic, S.A.; Urban, I.; Canullo, L.; Pisano, M.; Tallarico, M. Горизонтальное увеличение гребня с использованием GBR с мембраной из натурального коллагена и соотношением 1:1 частиц ксенографта и аутологичной кости: 1-летнее перспективное клиническое исследование. Clin. Implant Dent. Relat. Res. 2017, 19, 38–45.
- Sottosanti, J.S. Сульфат кальция: ценное дополнение к комплексу имплант/регенерация кости. Dent. Implant. Updat. 1997, 8, 25–29.
- Roccuzzo, M.; Ramieri, G.; Spada, M.C.; Bianchi, S.D.; Berrone, S. Вертикальное увеличение альвеолярного гребня с помощью титановый сетки и аутогенных костных трансплантатов. Clin. Oral Implant. 2004, 15, 73–81.
- Rakhmatia, Y.D.; Ayukawa, Y.; Furuhashi, A.; Koyano, K. Современные барьерные мембраны: титановая сетка и другие мембраны для направленной регенерации кости в стоматологических приложениях. J. Prosthodont. 2013, 57, 3–14.
- Tallarico, M.; Martinolli, M.; Kim, Y.; Cocchi, F.; Meloni, S.M.; Alushi, A.; Xhanari, E. Точность компьютерной помощи при установке имплантатов с использованием двух различных хирургических шаблонов, разработанных с металлическими рукавами или без них: рандомизированное контролируемое испытание. Dent. J. 2019, 7, 41.
- Tallarico, M.; Kim, Y.J.; Cocchi, F.; Martinolli, M.; Meloni, S.M. Точность новых шаблонов с рукавами для установки зубных имплантатов: перспективное многоцентровое клиническое испытание. Clin. Implant Dent. Relat. Res. 2019, 21, 108–113.
- Fürhauser, R.; Florescu, D.; Benesch, T.; Haas, R.; Mailath, G.; Watzek, G. Оценка мягких тканей вокруг коронок одиночных имплантатов: индекс эстетики. Clin. Oral Implant. 2005, 16, 639–644.
- Ciocca, L.; Lizio, G.; Baldissara, P.; Sambuco, A.; Scotti, R.; Corinadesi, G. Протезирование CAD-CAM – направленное увеличение кости атрофированных челюстей с использованием индивидуальной титановый сетки: предварительные результаты открытого перспективного исследования. J. Oral Implant. 2018, 44, 131–137.
- Schopper, C.H.; Goriwoda, W.; Moser, D. Долгосрочные результаты после направленной регенерации кости с рассасывающимися и микропористыми титановыми мембранами. J. Oral Maxillofac. Surg. Clin. North Am. 2001, 13, 449–458.
- Scantlebury, T.V. 1982-1992: десятилетие развития технологий для направленной регенерации тканей. J. Periodontol. 1993, 64, 1129–1137.
- A Fugazzotto, P. Уровни успеха и неудачи оссеоинтегрированных имплантатов в функции в регенерированной кости в течение 72 до 133 месяцев. Int. J. Oral Implant. 2005, 20, 77–83.
- Kim, Y.-K.; Yun, P.-Y.; Kim, S.-G.; Oh, D.S. Сравнение внутренней поверхности открытых и закрытых нерассасывающихся мембран с помощью сканирующей электронной микроскопии. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology 2009, 107, e5–e11.
- Watzinger, F.; Luksch, J.; Millesi, W.; Schopper, C.; Neugebauer, J.; Moser, D.; Ewers, R. Направленная регенерация кости с титановыми мембранами: клиническое исследование. Br. J. Oral Surg. 2000, 38, 312–315.
- Selvig, K.A.; Kersten, B.G.; Chamberlain, A.D.H.; Wikesjö, U.M.E.; Nilvúus, R.E. Регенеративная хирургия внутрикостных пародонтальных дефектов с использованием мембран ePTFE: сканирующая электронная микроскопическая оценка извлеченных мембран и клинического заживления. J. Periodontol. 1992, 63, 974–978.
- Hasegawa, H.; Masui, S.; Ishihata, H.; Kaneko, T.; Ishida, D.; Endo, M.; Kanno, C.; Yamazaki, M.; Kitabatake, T.; Utsunomiya, S.; и др. Оценка новой микроперфорированной мембраны из чистого титана для направленной регенерации кости. Int. J. Oral Maxillofac. Implants 2019, 34, 411–422.
- Roberts, E.W.; E Simmons, K.; Garetto, L.P.; A DeCastro, R. Физиология и метаболизм кости в стоматологической имплантологии: факторы риска остеопороза и других метаболических заболеваний костей. Implant. Dent. 1992, 1, 11–21.
- Wessing, B.; Urban, I.; Montero, E.; Zechner, W.; Hof, M.; Chamorro, J.A.; Martin N.A.; Polizzi, G.; Meloni, S.; Sanz, M. Многоцентровое рандомизированное контролируемое клиническое испытание с использованием новой рассасывающейся не перекрестно связанной коллагеновой мембраны для направленной регенерации кости на деhisced одиночных имплантатах: промежуточные результаты процедуры увеличения кости. Clin. Oral Implants Res. 2017, 28, e218–e226, doi: 10.1111/clr.12995.
- Urban, I.; Wessing, B.; Alández, N.; Meloni, S.; González-Martin, O.; Polizzi, G.; Sanz-Sanchez, I.; Montero, E.; Zechner, W. Многоцентровое рандомизированное контролируемое испытание с использованием новой коллагеновой мембраны для направленной регенерации кости на деhisced одиночных имплантатах: результаты при протезировании и через 1 год наблюдения. Clin. Oral Implants Res. 2019, doi: 10.1111/clr.13426.