Радиологический сравнительный анализ между заполнением физиологическим раствором и фибрином, обогащенным тромбоцитами, после гидравлического транс-крестцового поднятия синуса без дополнительных костных графтов: рандомизированное контролируемое исслед...
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Цели: Оценить выживаемость имплантатов, любые осложнения и изменения в высоте остаточной альвеолярной кости (RABH) с использованием физиологического раствора или фибрина, обогащенного тромбоцитами (PRF), после гидравлического транс-крестцового поднятия синуса.
Методы: Зубные имплантаты были установлены после гидравлического транс-крестцового поднятия синуса и заполнения физиологическим раствором (20 пациентов) или PRF (20 пациентов). Оценивались результаты выживаемости имплантатов, любые осложнения и изменения RABH. Были выполнены компьютерные томограммы с конусным лучом (CBCT) и сравнены до операции (T0), сразу после операции (T1), через 3 месяца (T2), 6 месяцев (T3) и 12 месяцев после операции (T4).
Результаты: В общей сложности у 40 пациентов было установлено 45 имплантатов со средней длиной 10.4 ± 0.8 мм в задней части верхней челюсти со средней высотой RABH 6.8 ± 1.1 мм. Увеличение RABH достигло пика на T1, и наблюдалось продолжительное провисание мембраны синуса, но оно стабилизировалось на T3. Тем временем, постепенное увеличение радиопрозрачностей было обнаружено под поднятой мембраной синуса. Заполнение PRF вызвало радиографическое увеличение костной ткани в синусе на 2.6 ± 1.1 мм, что было значительно больше, чем 1.7 ± 1.0 мм при заполнении физиологическим раствором на T4 (p < .05). Все имплантаты функционировали без значительных осложнений в течение одного года наблюдения.
Выводы: В этом рандомизированном контролируемом исследовании была подтверждена возможность гидравлического транс-крестцового поднятия синуса без костной пластики, и PRF может быть лучшим наполнителем для поддержки поднятой мембраны синуса. Тем не менее, дополнительная костная пластика все еще должна быть показана для случаев, требующих более 2–3 мм прироста костной ткани внутри синуса.
Введение
Установка зубных имплантатов в беззубой задний участок верхней челюсти часто ограничена из-за резорбции альвеолярного отростка под верхнечелюстным синусом после потери зуба. Чтобы преодолеть эти недостатки, были разработаны различные техники и инструменты для хирургии поднятия синуса. Трансальвеолярный (или транс-крестцовый) подход был введен Татумом, и инструмент, известный как "формирователь лунки", использовался для инфракции дна синуса и его перемещения в более апикальном направлении (Татум, 1986). Никакой материал для пересадки не использовался для увеличения и поддержания объема поднятой области. В пространство, созданное под поднятой мембраной синуса, были добавлены различные материалы, включая аутогенные, аллогенные или ксеногенные костные трансплантаты (Уоллес и др., 2012). Однако нет окончательного исследования, сообщающего о преимуществах костной пластики, вставленной в апикальную часть имплантата (Андреаси Басси, Лопес, Конфалоне и Каринчи, 2015). Кроме того, может существовать риск перфорации мембраны из-за острых краев гранул трансплантата (Кхер и др., 2014).
Недавно было продемонстрировано, что последовательный прирост костной ткани в верхнечелюстной пазухе может быть достигнут без добавления каких-либо костных трансплантатов (Лундгрен, Андерссон, Гуалини и Сеннерби, 2004; Недир, Бишоф, Васкес, Шмуклер-Монклер и Бернар, 2006; Недир, Нурдин, Васкес, Аби Наджм и Бишоф, 2016; Пальма и др., 2006; Сон, Ли, Аhn и Шин, 2008). Существует все больше доказательств того, что сам имплантат функционирует как "опора палатки", предотвращая обрушение поднятой мембраны синуса. Более того, мембрану синуса можно было бы поднимать больше и дольше в фазе формирования новой кости, если бы в пространстве между дном синуса и поднятой мембраной синуса находились материалы; для этой цели обычно используются физиологический раствор, собственная венозная кровь пациента и коллагеновые губки, пропитанные этими жидкостями (Лундгрен и др., 2004; Пальма и др., 2006; Сон и др., 2008).
Фибрин, обогащенный тромбоцитами (PRF), является аутологичным концентратом тромбоцитов, который содержит факторы роста, производимые тромбоцитами (PDGF), инсулиноподобный фактор роста (IGF), сосудистый эндотелиальный фактор роста (VEGF), трансформирующий фактор роста бета (TGF-β) и факторы ангиогенеза, производимые тромбоцитами (Петерсон и др., 2010). PRF использовался в качестве материала для трансплантации в процедурах увеличения верхнечелюстной пазухи как самостоятельно, так и в сочетании с материалами для трансплантации для стимулирования регенерации кости и увеличения объема вновь образованной кости за счет увеличения числа остеопроникаторных клеток (Мазор и др., 2009; Низам и др., 2018).
Целью этого рандомизированного контролируемого исследования было оценить, может ли введение физиологического раствора или PRF повлиять на выживаемость имплантатов, а также определить любые изменения в высоте остаточной альвеолярной кости (RABH) после гидравлического поднятия синусной мембраны с использованием транскретального подхода. Нулевая гипотеза заключалась в том, что нет разницы в увеличении RABH между группами.
Материалы и методы
Это исследование было спроектировано как рандомизированное контролируемое испытание и проводилось в двух центрах (Отделение челюстно-лицевой хирургии/Кафедра стоматологии, Больница Ханянг и Стоматологическая больница Апсун) с сентября 2016 года по август 2017 года. Исследование было одобрено Институциональным обзорным советом Больницы Ханянг (IRB No. 2016–05–039) и зарегистрировано в международной платформе регистрации клинических испытаний ВОЗ (KCT0005252). Оно проводилось в соответствии с Декларациями Хельсинки и международно признанными руководящими принципами для РКИ, включая заявление CONSORT (www.consort-statement.org). Все хирургические и протезные процедуры выполнялись двумя опытными клиницистами (YSC и CJP).
Для первоначального скрининга использовались периапикальные и панорамные рентгенограммы. В исследование были включены все здоровые пациенты в возрасте 18 лет и старше, у которых наблюдалась адентия в задней области верхней челюсти и уменьшенная RABH, что делало невозможным установку имплантатов длиной более 8,5 мм, после получения информированного согласия. Критерии исключения включали RABH менее 5 мм, измеренную на компьютерной томографии с конусным лучом (КТ), а также системные или местные противопоказания для установки имплантатов, включая историю неконтролируемых метаболических расстройств, курение, бруксизм или неконтролируемое пародонтальное заболевание. Зачисленные пациенты были проинформированы о хирургических процедурах, материалах, которые будут использоваться, преимуществах, а также потенциальных рисках и осложнениях этого клинического исследования.
После местной анестезии был поднят полнослойный лоскут для обнажения альвеолярного гребня. Проведено маркирование кортикальной кости, и использовало сверло диаметром 2,2 мм для сверления на глубину 1 мм ниже уровня синуса. Для увеличения места остеотомии и доступа к мембране синуса использовалась специальная система сверления (OneCAS Kit; Osstem) (Gatti et al., 2018). Инъекция и извлечение физиологического раствора повторялись поэтапно, чтобы гидравлически отделить и поднять мембрану от дна синуса. Любое повреждение мембраны было исключено благодаря отрицательному давлению, возникающему в результате аспирации введенного физиологического раствора. После рандомизации перед операцией пациенты были распределены на две группы: физиологический раствор или PRF. В группе физиологического раствора было введено 5 мл раствора для поддержки поднятой мембраны синуса, в то время как в группе PRF было получено такое же количество богатого лейкоцитами и тромбоцитами фибрина (L-PRF) с использованием протокола, примерно 480 g в течение 12 минут (относительная центробежная сила (RCF) сгустка = 408 g) с помощью центрифужного устройства (угол ротора 33°, радиус 50 мм на сгустке, 80 мм на максимуме, Intra-Lock, Boca Raton, FL) в стеклянных пластиковых трубках с покрытием 9 мл (Miron, Pinto, Quirynen, & Ghanaati, 2019) и вставлено en masse под поднятую мембрану синуса через отверстие для сверления имплантата.
В обеих группах не добавлялись материалы для костной пластики. Длина имплантатов определялась путем выбора ближайшего фиксатора, который был вдвое больше RABH, не превышая 11,5 мм. Все имплантаты (TS III SOI, Osstem) устанавливались с моментом затяжки более 25 Ncm. Имплантаты имели пескоструйную и кислотно-этидированную поверхность, покрытую буферным агентом pH, чтобы ввести гидрофильные свойства, способствовать остеоинтеграции в ранний период заживления и ускорить образование новой кости. После подключения заживляющего абатмента лоскуты сшивались без натяжения. Пациенты получали обезболивающие и антибиотики в течение 10 дней, а также назначался ополаскиватель для рта с 0,2% хлоргексидином трижды в день. Осложнения после операции были зафиксированы, а швы удалялись через 10 дней после операции.
Показатели результатов включали выживаемость имплантатов, биологические или механические осложнения и изменения в RABH. Выживаемость имплантатов оценивалась независимым оценщиком (KGH), и имплантат считался неудачным, если он проявлял подвижность, прогрессирующую потерю краевой кости, инфекцию или любые осложнения, делающие имплантат непригодным. Все биологические (боль, отек, гной, и т.д.) и/или механические (например, перелом) осложнения, которые возникли в течение одного года наблюдения, были зафиксированы и лечились теми же специалистами.
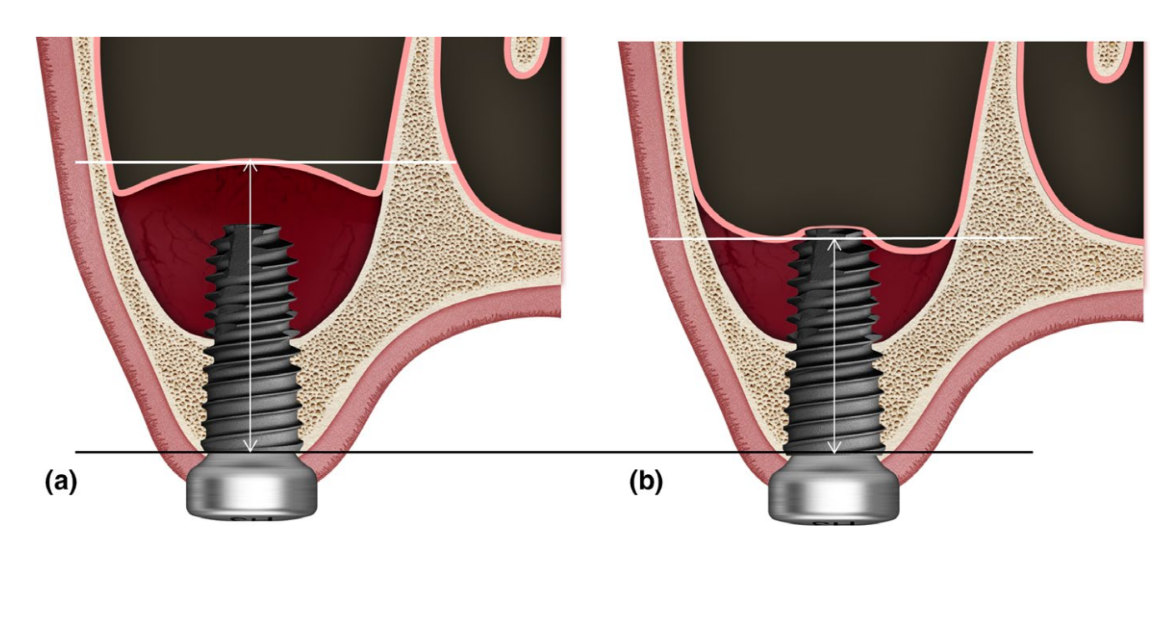
Изменения в RABH оценивались на изображениях CBCT, полученных до операции (T0), сразу после операции (T1), а также через 3 (T2), 6 (T3) и 12 месяцев (T4) после операции независимым слепым экспертом (SHJ). Параметры экспозиции для сканирования CBCT (поле зрения 35 × 50 мм; размер вокселя 0,2 мм; время 10,8 с; кВ 75; мА 10; произведение дозы на площадь 240 мГр·см2) были установлены на минимально возможном уровне (ALARA). RABH измерялся как максимальное расстояние от альвеолярного гребня до верхнего радиопрозрачного края в синусе, который предполагался как поднятая синусовая мембрана, параллельно длинной оси каждого имплантата на реконструированном корональном изображении CBCT (Рисунок 1). В частности, когда этот радиопрозрачный край опускался ниже апекса имплантата, проникающий апекс имплантата не учитывался как верхний радиопрозрачный край, а в случаях с несколькими имплантатами расстояния, измеренные на каждом имплантате, суммировались и усреднялись. Наложение и анализ изображений CBCT выполнялись с помощью программного обеспечения OnDemand3D (Cybermed Inc).
Статистический анализ
При предположении о равенстве дисперсий размер выборки был определен с уровнем альфа 0.05 для достижения мощности 90% на основе RABH, который варьировался от 1.5 до 6.0 мм со стандартным отклонением 0.9 мм из предыдущего исследования с использованием PRF (Mazor et al., 2009). Исходя из этих результатов, минимальный размер выборки был оценен в 21 субъект в каждой группе с учетом возможного уровня потерь 10% в течение периода исследования. Повторный анализ дисперсии (ANOVA) использовался для анализа влияния группы и времени на RABH, а также ад хок тест на основе коррекции Бонферрони для сравнения влияния группы на RABH в определенные временные периоды. Все статистические анализы проводились с использованием SPSS, версия 20 (SPSS Inc). Статистическая значимость была установлена как p < .05.
Результаты
Всего было последовательно включено 42 пациента, и два пациента выбыло (по одному в каждой группе) из-за потерь на этапе наблюдения. В конечном итоге данные от 40 пациентов (21 мужчина и 19 женщин) со средним возрастом 45.6 лет (в диапазоне от 27 до 70 лет) были собраны и оценены в этом исследовании (Таблица 1). В целом, средний RABH составил 6.8 ± 1.1 мм (в диапазоне от 5.3 до 8.1 мм), и всего было установлено 45 имплантатов со средней длиной 10.4 ± 0.8 мм в задней части верхней челюсти. В группе с физиологическим раствором было 22 имплантата, а в группе PRF - 23 имплантата соответственно.
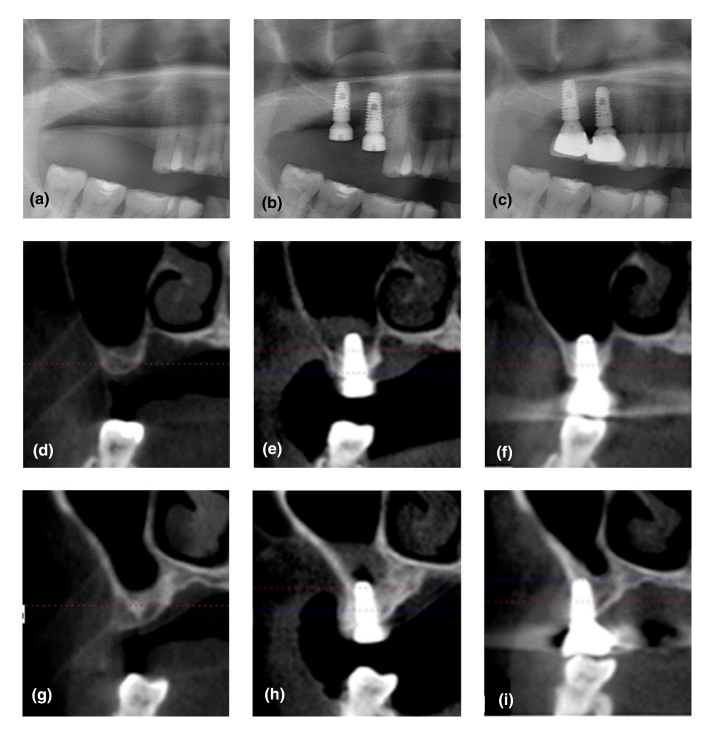
Не было зафиксировано ни одного провала имплантатов, и ни значительных осложнений, за исключением физиологического отека после операции, в обеих группах в течение периода наблюдения. Верхний радиопрозрачный край в синусе, который был четко обозначен на T1, был почти неразличим от оставшейся альвеолярной кости на T4 на панорамных и CBCT изображениях (Рисунок 2). Хотя материал костной пластики не использовался, было зафиксировано увеличение RABH, измеренного вокруг имплантатов, которое достигло пика на T1 и продолжало снижаться до T4. Увеличение RABH было показано со средним значением, стандартным отклонением и 95% доверительным интервалом (Рисунок 3), а мощность этого теста была оценена как 98.44%. Что касается влияния группы на увеличение RABH, значительная разница была обнаружена только на T4 (p < .05).
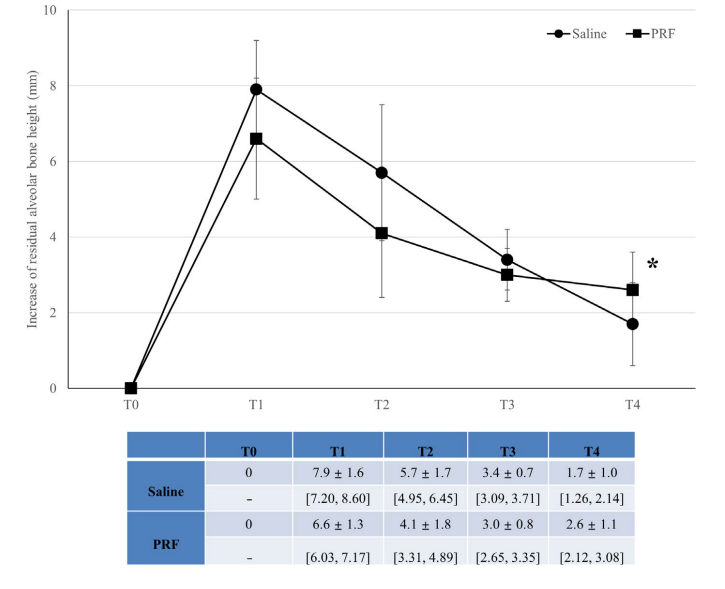
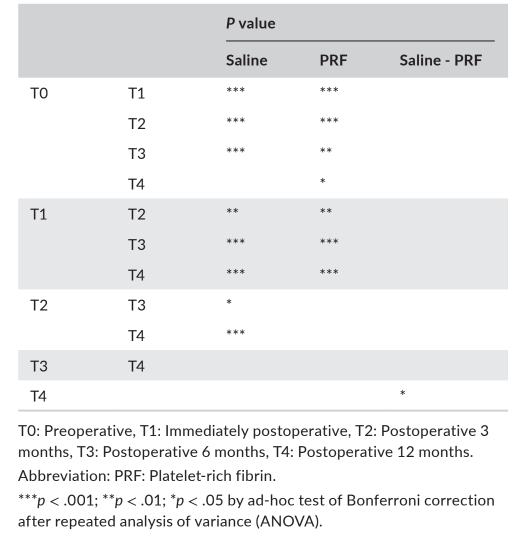
В таблице 2 представлены статистические значимости различий в измерениях между временными периодами и группами. В группе с физиологическим раствором наблюдалось статистически значимое различие среди RABH на всех временных периодах (p < .001), и тесты множественного сравнения Бонферрони показали статистически значимые различия на T0-T1, T0-T2, T0-T3, T1-T3, T1-T4, T2-T4 (p < .001), T1-T2 (p < .01) и T2-T3 (p < .05). В группе PRF также наблюдалось статистически значимое различие среди RABH на всех временных периодах (p < .001), и тесты множественного сравнения Бонферрони показали статистически значимые различия на T0-T1, T0-T2, T1-T3, T1-T4 (p < .001), T0-T3 (p < .01) и T0-T4 (p < .05).
Обсуждение
Это рандомизированное контролируемое исследование было разработано для оценки выживаемости имплантатов, осложнений и изменений в RABH с использованием физиологического раствора или PRF после гидравлического транс-крестцового поднятия синуса без вставки дополнительных костных трансплантатов. Несколько клинических публикаций продемонстрировали, что эффект "палатки" имплантатов, которые были установлены одновременно, предотвращал обрушение поднятой синусовой мембраны (Лундгрен, Крикио, Пальма, Салата и Сеннерби, 2008; Сон и др., 2008). Когда абсорбируемая желатиновая губка была свободно вставлена под поднятую синусовую мембрану в качестве альтернативы костному наполнителю, было также установлено, что она действует как удерживатель пространства для новой костной ткани в верхнечелюстном синусе (Сон и др., 2008). Наши результаты подтвердили выводы предыдущих исследований, включая провисание поднятой синусовой мембраны или повторную пневматизацию верхнечелюстного синуса (Лундгрен и др., 2004, 2008; Недир и др., 2016; Сон и др., 2008). Этот процесс был стабилизирован через 6 месяцев после операции, однако продолжался до 12 месяцев в обеих группах.
В этом исследовании было обнаружено радиографическое увеличение костной ткани на 1,7 ± 1,0 мм и 2,3 ± 1,9 мм в синусовой полости через год после гидравлического поднятия синуса без костных трансплантатов с добавлением физиологического раствора и PRF соответственно. Ранее сообщалось, что имплантаты, установленные в синусах 40 пациентов с использованием остеотомной техники без костных материалов, имели среднее увеличение RABH на сканированных панорамных радиографиях 2,9 ± 1,2 мм через 6 месяцев (Leblebicioglu, Ersanli, Karabuda, Tosun, & Gokdeniz, 2005); кроме того, как и в настоящем исследовании, выживаемость имплантатов составила 100%. Новое образование кости на 2,5 ± 1,2 мм от дна синуса до верхушки имплантата на периапикальных радиографиях через 1 год после поднятия дна синуса с использованием остеотомной техники без трансплантации (Nedir et al., 2006), и увеличение кости на 1,7 ± 2,0 мм на периапикальных радиографиях через 3 года после установки имплантата (Pjetursson & Lang, 2014) были продемонстрированы. В отличие от этих предыдущих исследований, наше исследование использовало изображения CBCT для более точного измерения изменений в поднятой синусовой мембране. Несмотря на то что значительные клинически значимые изменения были явно обнаружены при сравнении T1 и T4, а серийные CBCT увеличивали риск радиационного облучения, CBCT были сделаны на T2 и T3 исключительно в исследовательских целях. Более конкретно, T2 был включен для уточнения значительного оседания поднятой синусовой мембраны, что в основном наблюдалось через 3 месяца после операции (Lundgren et al., 2008), а T3 предполагался как важный с точки зрения интра-синусной регенерации кости, поскольку окклюзионная нагрузка обычно применяется к имплантатам через 6 месяцев после операции.
Некоторые клиницисты могут сомневаться в использовании термина RABH, поскольку мягкие и твердые ткани смешиваются на протяжении всего периода исследования. Поскольку комплексное измерение мягких и твердых тканей внутри синуса считалось важным для понимания изменений внутри синуса до формирования кости, мы приняли термин RABH и измерили самое дальнее расстояние до верхнего радиопрозрачного края внутри синуса. Иногда было технически сложно четко разделить их.
Радиопрозрачности отсека, который был заполнен либо физиологическим раствором, либо PRF под поднятой мембраной синуса, наблюдались постепенно увеличивающимися, и дальнейшие исследования будут необходимы для подтверждения формирования новой кости в этом отсеке. Интересно, что предыдущие гистологические исследования в основном сообщали о формировании новой кости после поднятия мембраны синуса без костного трансплантата (Лундгрен и др., 2008; Пальма и др., 2006); однако одно исследование не показало заметного формирования новой кости (Ан, Чо, Бирн, Ким и Шин, 2011).
Многие клинические исследования сообщили о успешных результатах операции по поднятию синуса с использованием остеотомов (Giannini et al., 2015; Komarnyckyj & London, 1998). Однако возможны осложнения, возникающие в результате повторной тупой травмы внутреннего уха от ударов молотком, такие как доброкачественное пароксизмальное позиционное головокружение, и его распространенность может увеличиваться в случаях жесткого кортикального дна синуса или дна синуса с перегородкой (Ahn, Park, & Kim, 2012; Hatano, Sennerby, & Lundgren, 2007). Чтобы преодолеть ограничения традиционной техники остеотомии, на рынок имплантатов было представлено множество инновационных инструментов, и гидравлический подъемник в наборе CAS также предназначен для гидравлического подъема синусной мембраны вместо физиологического раствора. Еще одно преимущество гидравлического подъемника заключается в том, что синусная мембрана может быть поднята гораздо шире и выше (Дополнительные данные).
В нашем исследовании физиологический раствор или PRF были заполнены в новом отсеке под поднятой синусной мембраной в качестве прокладки для поддержки синусной мембраны, и все имплантаты были успешными. Хотя на T1 были некоторые пустоты, радиопрозрачности под поднятой синусной мембраной увеличивались с исчезновением пустот в обеих группах с течением времени. Наши результаты также предполагают, что PRF может более эффективно занимать пространство, созданное под поднятой синусной мембраной, чем физиологический раствор, и вызывать большее образование костной ткани внутри синуса без дополнительной костной пластики при гидравлическом транс-крестцовом поднятии синуса. Предварительное исследование показало, что PRF постепенно высвобождает аутологичные факторы роста и вызывает сильный и длительный эффект на пролиферацию и дифференцировку остеобластов (He, Lin, Hu, Zhang, & Wu, 2009). Кроме того, использование PRF в качестве единственного заполняющего материала во время одновременного поднятия синуса и имплантации было зарегистрировано как стабилизирующее высокое количество естественно регенерированной кости в подсинусной полости до кончика имплантатов (Mazor et al., 2009). Поскольку PRF является простым и недорогим биоматериалом, его использование кажется более актуальным вариантом, чем любой другой заполняющий материал во время операции по поднятию синуса без костных трансплантатов. Однако общий прирост кости ограничен 2–3 мм, и небольшая разница между группами физиологического раствора и PRF должна быть учтена перед рутинным применением PRF в качестве единственного заполняющего материала. Более того, как показано на рисунке 2f, эффект "палатки" имплантата не продержался до 12 месяцев после операции, и провисание тонкой и гибкой синусной мембраны было неизбежным почти во всех случаях. Строгие критерии включения для этой процедуры обязательны, и использование костных трансплантатов должно быть показано для случаев, требующих большего образования костной ткани внутри синуса, особенно над верхушкой имплантата.
Основным ограничением нашего рандомизированного контролируемого исследования было то, что ни негативный контроль без физиологического раствора и PRF, ни позитивный контроль с пересадкой не были установлены. Учитывая слепую природу транс-крестцального поднятия синуса, особенно гидравлического поднятия, практически очень трудно подтвердить полное удаление физиологического раствора, который использовался для отделения и поднятия мембраны синуса. Поэтому группу без физиологического раствора было почти невозможно установить в качестве негативного контроля, и вместо этого мы строго контролировали общий объем физиологического раствора, использованного во время операции. Группа с физиологическим раствором также была выбрана в качестве негативного контроля, чтобы сделать две процедуры, заполнение физиологическим раствором и PRF, как можно более схожими. Недавние исследования сообщили о способности формирования новой кости только при поднятии мембраны синуса и без костной пересадки (Лундгрен и др., 2004, 2008; Недир и др., 2006, 2016; Пальма и др., 2006; Сон и др., 2008; Сон, Мун, Мун, Чо и Кан, 2010; Уинтер, Поллак и Одрич, 2003). Основываясь на этих обнадеживающих результатах, группа с костной пересадкой не была установлена в качестве позитивного контроля, поскольку целью этого исследования было выяснить, может ли PRF предложить некоторые дополнительные преимущества по сравнению с отсутствием костной пересадки. Также было учтено, что существовали различные результаты по формированию костной ткани внутри синуса, которые нельзя сформулировать в соответствии с материалами для костной пересадки.
Заключения
В рамках ограничений данного исследования можно сделать следующие выводы:
- После гидравлического поднятия синуса с помощью транскретального метода использование физиологического раствора или PRF в качестве единственного материала для заполнения может привести к увеличению RABH, что является результатом прироста костной ткани в синусе на T4. Все имплантаты выжили, и в течение периода наблюдения не было зафиксировано значительных осложнений.
- Несмотря на эффект "палатки" от имплантатов, опущение мембраны синуса было стабилизировано на T3, однако продолжалось до T4.
- Заполнение PRF привело к значительно большему увеличению RABH по сравнению с физиологическим раствором на T4. Тем не менее, дополнительное костное пересаживание все еще должно быть показано для случаев, требующих большего прироста костной ткани в синусе, учитывая общий прирост костной ткани в синусе, ограниченный 2–3 мм.
Ён-Сок Чо, Кюн-Гюн Хван, Санг Хо Чун, Марко Талларико, Эми М. Квон, Чан-Чжу Пак
Ссылки
- Ahn, J. J., Cho, S. A., Byrne, G., Kim, J. H., & Shin, H. I. (2011). Новое образование кости после поднятия мембраны синуса без костного пересаживания: Гистологические находки у людей. International Journal of Oral Maxillofacial Implants, 26(1), 83–90.
- Ahn, S. H., Park, E. J., & Kim, E. S. (2012). Поднятие дна синуса с помощью реамера без остеотомии и одновременная установка имплантатов в области верхних моляров: Клинические результаты 391 имплантата у 380 пациентов. Clinical Oral Implants Research, 23(7), 866–872. https://doi.org/10.1111/j.1600-0501.2011.02216.x
- Andreasi Bassi, M., Lopez, M. A., Confalone, L., & Carinci, F. (2015). Гидравлическая техника поднятия синуса в будущем: Клинический и гистоморфометрический анализ человеческих биопсий. Implant Dentistry, 24(1), 117–124. https://doi.org/10.1097/ID.0000000000000200
- Gatti, F., Gatti, C., Tallarico, M., Tommasato, G., Meloni, S. M., & Chiapasco, M. (2018). Поднятие мембраны верхнечелюстного синуса с использованием специальной системы сверления и гидравлического давления: Двухлетнее проспективное когортное исследование. International Journal of Periodontics & Restorative Dentistry, 38(4), 593–599. https://doi.org/10.11607/prd.3403
- Giannini, S., Signorini, L., Bonanome, L., Severino, M., Corpaci, F., & Cielo, A. (2015). Доброкачественное пароксизмальное позиционное головокружение (BPPV): Может возникнуть после дентальной имплантологии. Мини-обзор. European Review for Medical and Pharmacological Sciences, 19(19), 3543–3547.
- Hatano, N., Sennerby, L., & Lundgren, S. (2007). Увеличение верхнечелюстного синуса с использованием поднятия мембраны синуса и периферической венозной крови для реабилитации на имплантатах атрофированной задней верхней челюсти: Серия случаев. Clinical Implant Dentistry and Related Research, 9(3), 150–155. https://doi.org/10.1111/j.1708-8208.2007.00043.x
- He, L., Lin, Y., Hu, X., Zhang, Y., & Wu, H. (2009). Сравнительное исследование тромбоцитарного богатого фибрина (PRF) и тромбоцитарной богатой плазмы (PRP) на эффект пролиферации и дифференцировки остеобластов крыс в vitro. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology, 108(5), 707–713. https://doi.org/10.1016/j.tripleo.2009.06.044
- Kher, U., Ioannou, A. L., Kumar, T., Siormpas, K., Mitsias, M. E., Mazor, Z., & Kotsakis, G. A. (2014). Клиническая и радиографическая серия случаев имплантатов, установленных с использованием упрощенной минимально инвазивной техники поднятия антральной мембраны в задней верхней челюсти. Journal of Cranio-Maxillofacial Surgery, 42(8), 1942–1947. https://doi.org/10.1016/j.jcms.2014.08.005
- Komarnyckyj, O. G., & London, R. M. (1998). Установка одностадийного дентального имплантата с остеотомом и без поднятия синуса: Клинический отчет. International Journal of Oral Maxillofacial Implants, 13(6), 799–804. Leblebicioglu, B., Ersanli, S., Karabuda, C., Tosun, T., & Gokdeniz, H. (2005). Радиографическая оценка дентальных имплантатов, установленных с использованием техники остеотома. Journal of Periodontology, 76(3), 385–390.https://doi.org/10.1902/jop.2005.76.3.385
- Lundgren, S., Andersson, S., Gualini, F., & Sennerby, L. (2004). Реформация кости с поднятием мембраны синуса: Новая хирургическая техника для увеличения дна верхнечелюстного синуса. Clinical Implant Dentistry and Related Research, 6(3), 165–173. https://doi.org/10.1111/j.1708-8208.2004.tb00224.x
- Lundgren, S., Cricchio, G., Palma, V. C., Salata, L. A., & Sennerby, L. (2008). Поднятие мембраны синуса и одновременная установка дентальных имплантатов: Новая хирургическая техника в увеличении дна верхнечелюстного синуса. Periodontology, 2000(47), 193–205. https://doi.org/10.1111/j.1600-0757.2008.00264.x
- Mazor, Z., Horowitz, R. A., Del Corso, M., Prasad, H. S., Rohrer, M. D., & Dohan Ehrenfest, D. M. (2009). Увеличение дна синуса с одновременной установкой имплантата с использованием тромбоцитарного богатого фибрина Чукруна в качестве единственного материала для пересаживания: Радиологическое и гистологическое исследование через 6 месяцев. Journal of Periodontology, 80(12), 2056–2064. https://doi.org/10.1902/jop.2009.090252
- Miron, R. J., Pinto, N. R., Quirynen, M., & Ghanaati, S. (2019). Стандартизация относительных центробежных сил в исследованиях, связанных с тромбоцитарным богатым фибрином. Journal of Periodontology, 90(8), 817–820. https://doi.org/10.1002/JPER.18-0553
- Nedir, R., Bischof, M., Vazquez, L., Szmukler-Moncler, S.,& Bernard, J. P.(2006). Поднятие дна синуса с остеотомом без материала для пересаживания: 1-летнее проспективное пилотное исследование с имплантатами ITI. Clinical Oral Implants Research, 17(6), 679–686. https://doi.org/10.1111/j.1600-0501.2006.01264.x
- Nedir, R., Nurdin, N., Vazquez, L., Abi Najm, S., & Bischof, M. (2016). Поднятие дна синуса без пересаживания: 10-летнее проспективное исследование. Clinical Implant Dentistry and Related Research, 18(3), 609–617. https://doi.org/10.1111/cid.12331
- Nizam, N., Eren, G., Akcalı, A., & Donos, N. (2018). Увеличение верхнечелюстного синуса с использованием лейкоцитарного и тромбоцитарного богатого фибрина и депротеинизированного костного минерала из бычьей кости: Гистологическое и гистоморфометрическое исследование с разделением рта. Clinical Oral Implants Research, 29(1), 67–75. https://doi.org/10.1111/clr.13044
- Palma, V. C., Magro-Filho, O., de Oliveria, J. A., Lundgren, S., Salata, L. A., & Sennerby, L. (2006). Реформация кости и интеграция имплантата после поднятия мембраны верхнечелюстного синуса: Экспериментальное исследование на приматах. Clinical Implant Dentistry and Related Research, 8(1), 11–24. https://doi.org/10.2310/j.6480.2005.00026.x
- Peterson, J. E., Zurakowski, D., Italiano, J. E. Jr, Michel, L. V., Fox, L., Klement, G. L., & Folkman, J. (2010). Нормальные диапазоны регуляторных белков ангиогенеза в человеческих тромбоцитах. American Journal of Hematology, 85(7), 487–493. https://doi.org/10.1002/ajh.21732
- Pjetursson, B. E., & Lang, N. P. (2014). Поднятие дна синуса с использованием трансальвеолярного подхода. Periodontology 2000, 66(1), 59–71. https://doi.org/10.1111/prd.12043
- Sohn, D. S., Lee, J. S., Ahn, M. R., & Shin, H. I. (2008). Новое образование кости в верхнечелюстном синусе без костных пересадок. Implant Dentistry, 17(3), 321–331. https://doi.org/10.1097/ID.0b013e318182f01b
- Sohn, D. S., Moon, J. W., Moon, K. N., Cho, S. C., & Kang, P. S. (2010). Новое образование кости в верхнечелюстном синусе с использованием только абсорбируемой желатиновой губки. Journal of Oral Maxillofacial Surgery, 68(6), 1327–1333. https://doi.org/10.1016/j.joms.2010.02.014
- Tatum, H. Jr (1986). Реконструкции имплантатов верхней челюсти и синуса. Dental Clinics of North America, 30(2), 207–229.
- Wallace, S. S., Tarnow, D. P., Froum, S. J., Cho, C. S., Zadeh, H. H., Stoupel, J., … Testori, T. (2012). Поднятие верхнечелюстного синуса с помощью бокового окна: Эволюция технологий и техники. Journal of Evidence Based Dental Practice, 12(3), 161–171. https://doi.org/10.1016/S1532-3382(12)70030-1
- Winter, A. A., Pollack, A. S., & Odrich, R. B. (2003). Поднятие синуса/альвеолярного гребня (SACT): Новая техника для установки имплантатов в атрофированные верхнечелюстные гребни без костных пересадок или мембран. International Journal of Periodontics Restorative Dentistry, 23(6), 557–565.
