Покрытие пескоструйной и кислотно-этилизированной поверхности имплантата с использованием pH-буферного агента после вакуумной УФ-фотофункционализации
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Ультрафиолетовая (УФ) фотофункционализация может сбросить биологическое старение титана после подготовки и хранения зубных имплантатов, преобразуя гидрофобные поверхности титана в супергидрофильные поверхности. Образование тромба вокруг имплантата может инициировать и способствовать процессу заживления на интерфейсе кость-имплантат. Цель этого исследования - оценить и сравнить способности wettability поверхности и свертывания крови имплантатов с обычной пескоструйной и кислотно-этчированной поверхностью (SA), пескоструйной и кислотно-этчированной поверхностью с обработкой вакуумным УФ (SA + VUV) и пескоструйной и кислотно-этчированной поверхностью, покрытой буферным агентом pH после обработки вакуумным УФ (SA + VUV + BS). Статические и динамические тесты на wettability поверхности и свертывание крови были проведены in vitro для SA + VUV и SA + VUV + BS (n = 5), в то время как гемостаз, возникающий в результате свертывания крови, оценивался in vivo для SA, SA + VUV и SA + VUV + BS (n = 4). Тест Краскала-Уоллиса показал статистически значимые различия (p < 0.05) во всех тестах, за исключением in vitro теста статического свертывания крови. Таким образом, обработка VUV эффективна для превращения поверхности SA в супергидрофильную в качестве альтернативы рутинному УФ-C облучению. Добавление буферного агента pH к SA + VUV также улучшило wettability поверхности и свертывание крови, что имеет решающее значение для успешной остеоинтеграции.
Введение
Титан широко используется для стоматологической и ортопедической реставрации и реконструкции благодаря своей биосовместимости, устойчивости к коррозии и механическим свойствам. Титан легко окисляется, образуя тонкий (1–5 нм), стабильный и пассивный слой, который саморегулируется и защищает поверхность металла от дальнейшего окисления. Этот слой диоксида титана (TiO2) считается ответственным за его эффективные биологические характеристики благодаря переносу ионов кальция и фосфора из костной матрицы внутри слоя TiO2. Однако со временем происходит значительное снижение остеоинтеграции и других биологических возможностей титана, поскольку содержание углерода на поверхности увеличивается из-за неизбежного осаждения углерода из атмосферы на слой TiO2 в виде углеводорода. Это явление определяется как биологическое старение титана, и способность титановым поверхностям привлекать белки и остеогенные клетки уменьшается с течением времени. Еще одно заметное изменение титановыми поверхностями со временем является исчезновение гидрофильности. Сразу после обработки титановыми поверхностями наблюдается угол контакта воды 0 или менее 5 градусов, и такие поверхности называются супергидрофильными. Эта характеристика постепенно ослабевает и становится гидрофобной через 2 и 4 недели, с углом контакта более 40 и 60 градусов соответственно.
Обработка поверхности используется для модификации топографии и энергии поверхности зубного имплантата, что приводит к улучшению смачиваемости, увеличению пролиферации и роста клеток, а также ускорению остеоинтеграции. Обработка поверхности может быть достигнута с помощью аддитивной или субтрактивной техники. Субтрактивная техника либо удаляет, либо шероховатит слой основного материала, как это показано на поверхности, обработанной пескоструйным методом и кислотным травлением (SA). В аддитивной технике другие материалы или химические агенты добавляются поверхностно на поверхность титана через покрытие, такое как распыление титановым плазменным методом, покрытие гидроксиапатитом, покрытие кальцийфосфатом и другие биомиметические покрытия. Сверление перед установкой имплантата вызывает травму костной ткани, аналогичную перелому. Место становится относительно гипоксичным, а внеклеточный pH становится кислым. В таких условиях стромальные клетки костного мозга проявляют сниженную активность щелочной фосфатазы (ALP) и синтез коллагена, оба из которых важны для формирования кости и остеоинтеграции. Гликолиз и синтез ДНК остеобластов также оказываются под влиянием кислых условий. Агрегация тромбоцитов, которая является критическим этапом в образовании кровяного сгустка или тромбообразовании, также снижается при внеклеточной ацидозе, что опосредуется путем входа ионов кальция. Формирование достаточного кровяного сгустка обеспечивает прямую и стабильную связь на интерфейсе кости и имплантата и играет важную роль в тромбообразовательных реакциях и остеоинтеграции. Более того, была установлена связь между различными поверхностями имплантатов и степенью образования фибринового сгустка.
В нашем предыдущем исследовании была представлена новая поверхность SA, покрытая буферным раствором pH после обработки вакуумным УФ (VUV). Эта поверхность была тесно связана с большей аффинностью к белкам, клеткам и тромбоцитам, что способствовало быстрому и стабильному свертыванию крови, тромбообразованию и остеоинтеграции. Целью настоящего исследования было оценить и сравнить смачиваемость поверхности и способности к свертыванию крови различных имплантантов, включая обычную поверхность SA (SA), поверхность SA с обработкой VUV (SA + VUV) и поверхность SA, покрытую буферным раствором pH после обработки VUV (SA + VUV + BS), с помощью in vitro и in vivo анализов.
Материалы и методы
2.1. Подготовка имплантатов
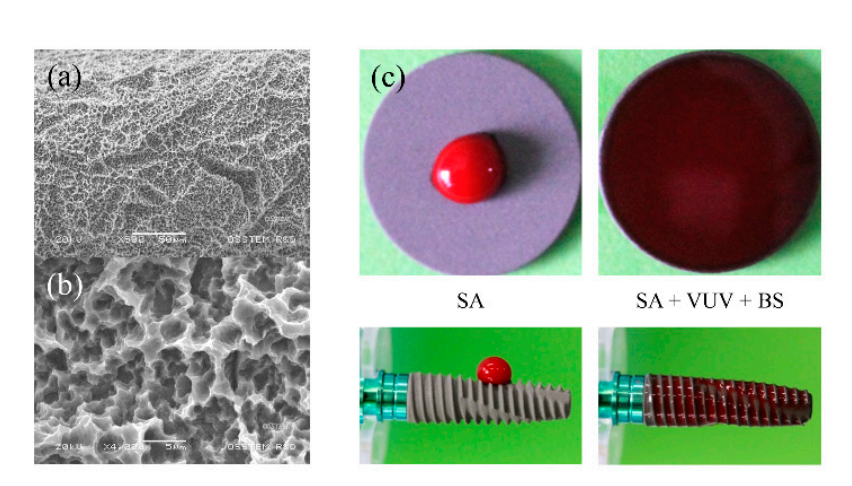
Имплантаты из коммерчески чистого титана (четвертый класс) были подготовлены как SA, SA + VUV (TS III SA, Osstem, Сеул, Корея) и SA + VUV + BS (TS III SOI, Osstem) для использования в этом исследовании. Как показано на рисунке 1a,b, шероховатость поверхности имплантатов была измерена и составила 2.5 ± 0.5 µm по значению Ra, а обработка VUV для фотофункционализации была достигнута путем экспонирования имплантата к лампам с низким давлением ртутного дугового разряда, излучающим UV-C и VUV в УФ-озоновом очистителе в течение 1 часа. Покрытие поверхности имплантата буферным раствором pH, состоящим как из положительно, так и из отрицательно заряженных ионных групп, с pKa значением 7.31 при 37°C, было добавлено для улучшения супергидрофильности (Рисунок 1c).
2.2. Витро тесты
2.2.1. Статическая смачиваемость поверхности
Гепаринизированная овечья кровь была налита в чашу диаметром 3,5 см на глубину 2-3 см. Имплантационные фиксаторы SA + VUV и SA + VUV + BS (n = 5, соответственно) были погружены в кровь до верхнего края апикальных витков, и время, необходимое для достижения верхней части имплантационного фиксатора, было зафиксировано для расчета скорости смачивания. Время не учитывалось от апекса имплантационного фиксатора, так как наличие прерывания апикальных витков вызвало резкое прекращение абсорбции крови.
2.2.2. Динамическая смачиваемость поверхности
Для имитации клинических ситуаций установки имплантационных фиксаторов в прозрачной акриловой пластине были сделаны отверстия для обеспечения видимости, в соответствии с протоколом сверления производителя для плотности жесткой кости с использованием набора 122 Taper Kit (Osstem). В каждое отверстие акриловой пластины была помещена 130 мкМ проба дефибринированной овечьей крови, и имплантационные фиксаторы SA + VUV и SA + VUV + BS (n = 5, соответственно) были погружены в отверстие с помощью динамометра (MX-500N, Imada Co., Токио, Япония) со скоростью 50 мм/мин, и время, когда кровь достигала 2 мм и 4 мм точек центральной оси фиксатора над горизонтальной пластиной, соответственно, было зафиксировано (Рисунок 2).

2.2.3. Статическое свертывание крови
Фиксаторы имплантатов SA + VUV и SA + VUV + BS, длиной 11,5 мм и диаметром 4,5 мм (n = 5, соответственно), были погружены до конца в посуду диаметром 3,5 см, заполненную 3 мл не-гепаринизированной овечьей крови. Вес (г) кровяного сгустка вокруг фиксатора имплантата измерялся через 5 мин, 7,5 мин, 10 мин и 12,5 мин соответственно.
2.2.4. Динамическое свертывание крови
Эта модель активного свертывания крови была разработана для имитации непрерывного кровоснабжения капиллярами. Имплантаты SA + VUV и SA + VUV + BS, длиной 10 мм и диаметром 4,0 мм (n = 5), были вставлены с предустановленным моментом вставки 5 Н см в модифицированную трубку Эппендорфа, которая была соединена с насосом шприца, подающим овечью кровь, смешанную с 1 МЕ/мл гепарина, на дне при 37°C. После 30 минут кровоснабжения при скорости инфузии 0,05 мл/мин было измерено время (мин), пока кровь не перестала капать из-за образования сгустка вокруг имплантата, и объем (мл) крови, который был собран в нижней 15 мл трубке под трубкой Эппендорфа.
2.3. Внутриорганизмный тест
Использовалась модель нижней челюсти собаки бигля. Все процедуры проводились с одобрения Этического комитета по экспериментам на животных Комитета по уходу и использованию животных учреждения (CRONEX-IACUC 20191002; Cronex, Хвасунг, Корея) в соответствии с рекомендациями по исследованию животных: отчетность о внутриорганизмных экспериментах (ARRIVE).
Четыре суки бигля в возрасте 18 месяцев подверглись двусторонней экстракции их нижних премоляров и первого моляра под общим наркозом. Анестезионный протокол для всех хирургических процедур включал 1 мл внутримышечной инъекции с дозой 15 мг/кг тилетамина/золазепама (Zoletil 50, Virbac, Сеул, Корея) и 5 мг/кг ксилазина (Rompun, Bayer Korea, Сеул, Корея). После местной анестезии был поднят полнослойный мукопериостеальный лоскут рядом с нижними премолярами и молярами (Рисунок 3). Зубы были разрезаны пополам под обильным орошением с помощью маленькой бороздки. Экстракции проводились с помощьюElevators и щипцов. Лоскуты были закрыты одиночными прерывающимися швами. Протокол послеоперационного ухода включал антибиотики и контроль боли. В этот период все собаки находились на мягкой диете и имели свободный доступ к воде.
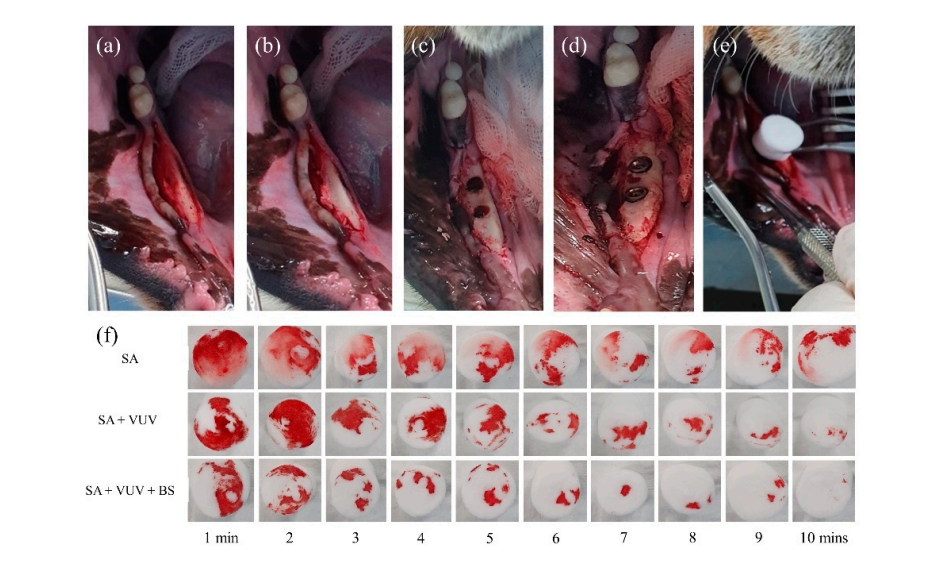
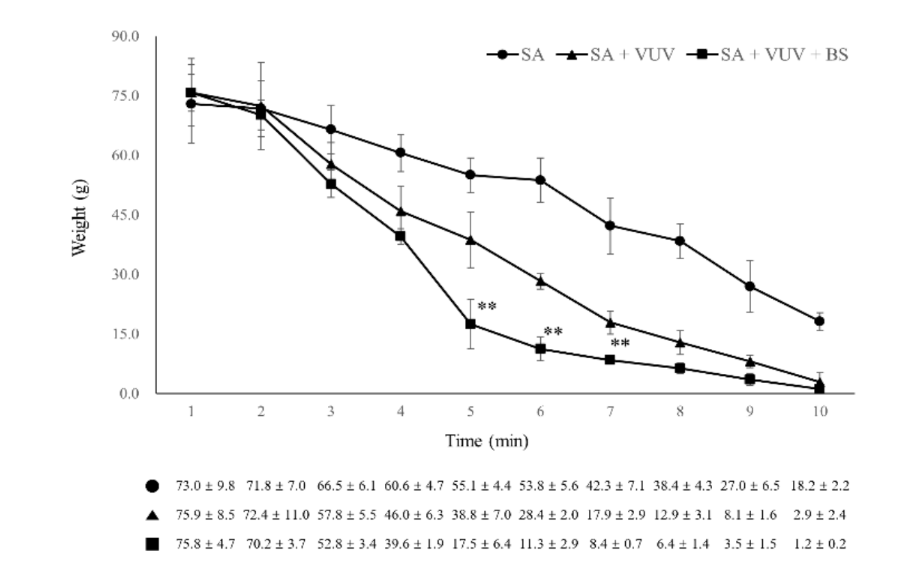
Три месяца после экстракций была проведена хирургическая установка зубных имплантатов в заживленных участках экстракции в стерильных условиях. После местной анестезии был поднят полный толщины лоскут для обнажения альвеолярного гребня, и неровный альвеолярный гребень был выровнен. Последовательные сверления были выполнены для последовательных мест установки имплантатов, которые были больше, чем имплантационный фиксатор, с использованием направляющего сверла, сверла с диаметром 2,2 мм, конусного сверла с диаметром 3,0 мм, конусного сверла с диаметром 4,0 мм и ультраконусного сверла с диаметром 6,0 мм. Всего было установлено 12 имплантационных фиксаторов SA, SA + VUV и SA + VUV + BS, длиной 8,5 мм и диаметром 3,5 мм, с двусторонним установочным моментом 35 Н см. Вся кровь из зазора между отверстием и имплантационным фиксатором впитывалась в ватный шарик до 10 минут после установки имплантата, и вес (г) ватного шарика измерялся каждую минуту для оценки потенциала свертывания крови имплантационных фиксаторов. Все экспериментальные животные были умерщвлены после операции путем внутривенного передозировки хлорида калия.
2.4. Статистический анализ
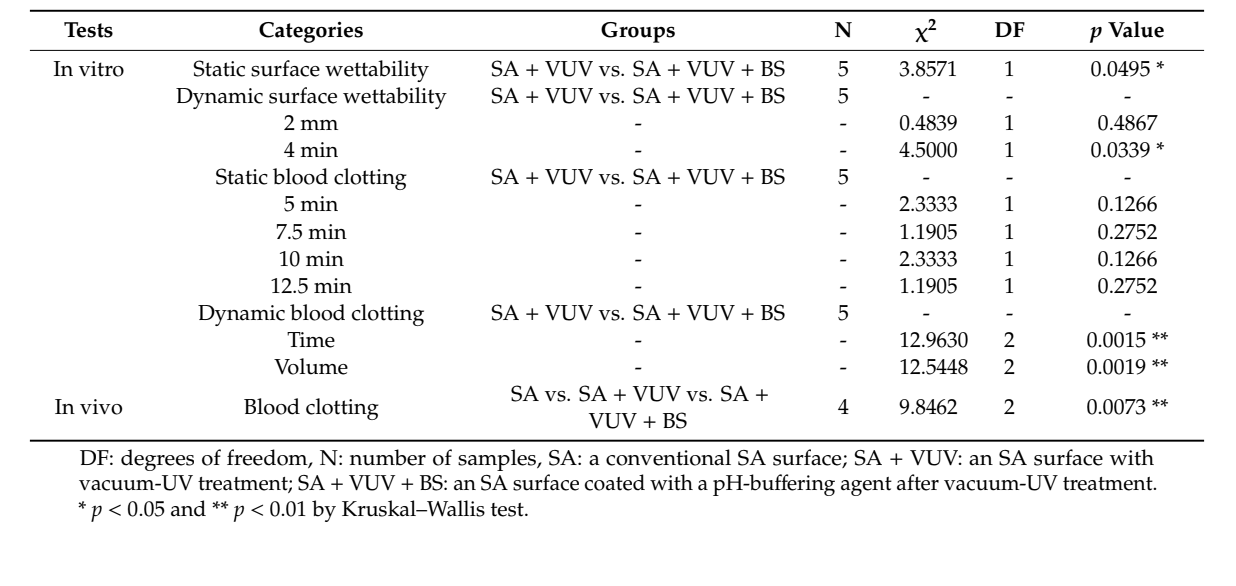
Из-за небольшого размера выборки мы провели тест Краскала–Уоллиса, который является непараметрическим сравнением разницы средних без предположения о нормальности, чтобы изучить различия между SA + VUV и S + VUV + BS in vitro, а также между SA, SA + VUV и SA + VUV + BS in vivo, с уровнем статистической значимости p < 0.05 при α = 0.05. Все статистические анализы были выполнены с использованием SAS, версии 9.4 (SAS Inc., Кэри, Северная Каролина, США).
Результаты
3.1. In Vitro тесты
3.1.1. Статическая смачиваемость поверхности
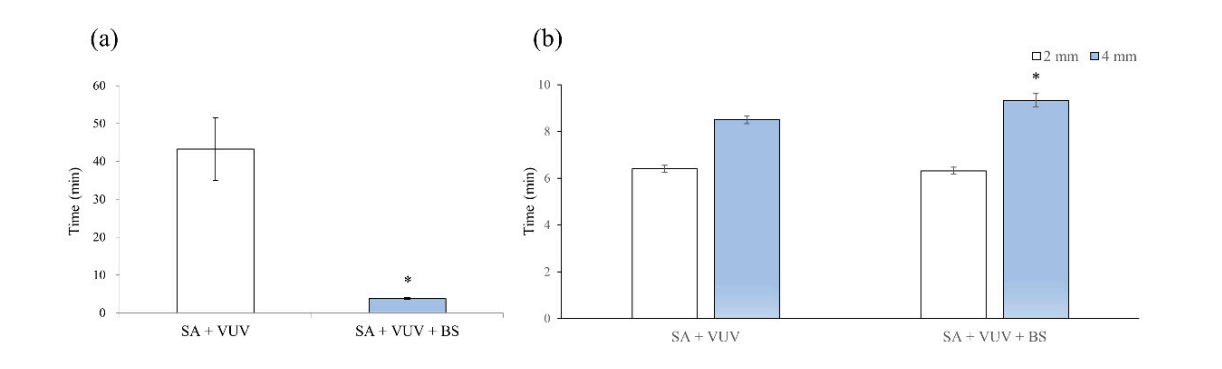
Время, которое потребовалось, прежде чем кровь достигла верхней части импланта, составило 43.3 ± 8.3 мин и 3.8 ± 0.3 мин для SA + VUV и SA + VUV + BS соответственно, и статистически значимая разница (p < 0.05) между ними была очевидна (Рисунок 4a).
3.1.2. Динамическая смачиваемость поверхности
Время, которое потребовалось, прежде чем кровь достигла 2 мм над горизонтальной пластиной, составило 6.4 ± 0.1 мин и 6.3 ± 0.2 мин, а для 4 мм над горизонтальной пластиной - 8.5 ± 0.2 мин и 9.3 ± 0.3 мин для SA + VUV и SA + VUV + BS соответственно. Статистически значимая разница (p < 0.05) между SA + VUV и SA + VUV + BS была найдена только для времени, прежде чем кровь достигла 4 мм над горизонтальной пластиной (Рисунок 4b).
3.1.3. Статическое свертывание крови
В SA + VUV масса образовавшегося вокруг имплантата тромба, измеренная через 5 мин, 7.5 мин, 10 мин и 12.5 мин после погружения имплантата в кровь, составила 0.04 ± 0.01 г, 0.09 ± 0.03 г, 0.23 ± 0.06 г и 0.39 ± 0.16 г соответственно. В SA + VUV + BS массы составили 0.07 ± 0.03 г, 0.12 ± 0.02 г, 0.39 ± 0.20 г и 0.61 ± 0.18 г соответственно, и не было статистически значимых различий между SA + VUV и SA + VUV + BS в любое время (p > 0.05).
3.1.4. Динамическое свертывание крови
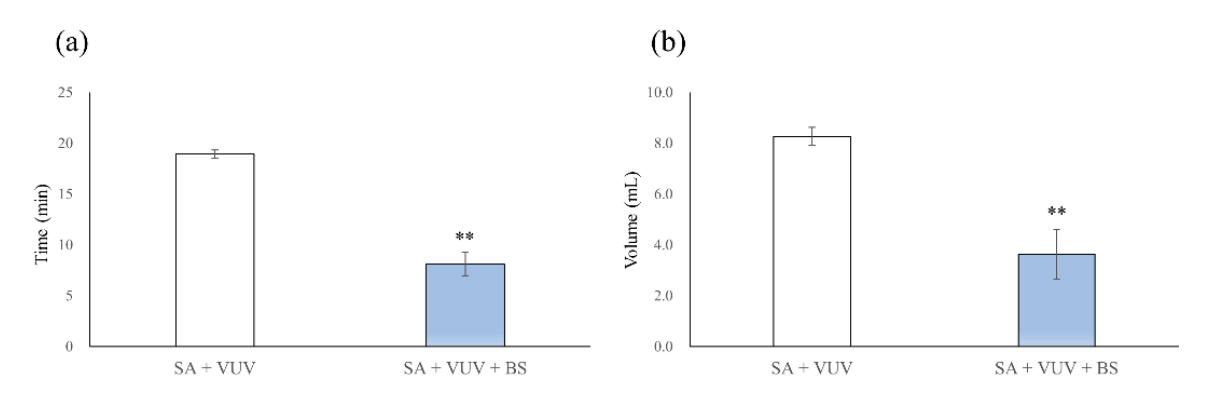
Время для достижения полной гемостаза составило 19.0 ± 0.4 мин и 8.1 ± 1.2 мин в SA + VUV и SA + VUV + BS соответственно, и было статистически значимое различие между SA + VUV и SA + VUV + BS (p < 0.01, Рисунок 5a). Кроме того, объемы собранной крови в нижележащей трубке составили 8.27 ± 0.36 мл и 3.64 ± 0.99 мл в SA + VUV и SA + VUV + BS соответственно, с очевидным статистически значимым различием (p < 0.01, Рисунок 5b) между SA + VUV и SA + VUV + BS.
3.2. Внутриорганизмный тест
Среди SA, SA + VUV и SA + VUV + BS были статистически значимые различия в весах всего крови, поглощенной в ватном шарике, измеренные на 5-й, 6-й и 7-й минутах (p < 0.01, Рисунок 6). Сводная статистика этого исследования представлена в Таблице 1.
Обсуждение
Фотофункционализация УФ, метод модификации поверхностей титана после УФ-обработки, который включает изменение физико-химических свойств и улучшение биосовместимости, была предложена для сброса биологического старения титана. После обработки УФ-излучением слой TiO2 на поверхности титана, содержащий углеводороды, стал значительно гидрофильным или супергидрофильным. Известно, что количество углерода на поверхности варьируется в зависимости от возраста поверхности и, как сообщается, может увеличиваться до примерно 60% - 70% атомных компонентов поверхности. УФ-обработка очищает такие загрязненные углеродом титановыми поверхности, снижая процент углерода до менее 20% и одновременно увеличивая уровень остеоинтеграции. В УФ-спектре как УФ-А, так и УФ-С преобразуют биологически старые поверхности титана из гидрофобных в супергидрофильные, но только УФ-С (200–280 нм) известен своей эффективностью в снижении углерода на поверхности до уровня, эквивалентного новой поверхности, и в повышении биоактивности. УФ-С способен удалять углеводороды из слоя TiO2 титана путем прямой фотодекомпозиции, что более эффективно, чем фотокатализм УФ-А. В нашем исследовании все имплантаты были фотофункционализированы УФ-С и VUV (100–200 нм), и радикальное удаление углеводородов из слоя TiO2 титана могло обеспечить большую супергидрофильность. VUV быстро поглощается водой в атмосфере и, следовательно, способен генерировать различные реактивные кислородные виды, разрывая водородные связи в молекулах воды через гидролиз. Гидролиз, инициированный VUV, является эффективным методом получения гидроксидных или гидроксильных групп на слое TiO2, который обеспечивает постоянную супергидрофильность. Поскольку обработка VUV, как правило, приводит к образованию большего количества озона в атмосфере и гидроксильных радикалов в воде, ее следует строго ограничить только лабораторными или заводскими условиями, а не клиническими.
Чтобы ускорить заживление костей и улучшить анкерование кости к имплантату, интерфейс кость/имплантат можно улучшить топографически и биохимически, добавляя неорганические фазы, такие как фосфат кальция, и органические молекулы, такие как белки, ферменты или пептиды, на или в слой TiO2. Наноструктурированные поверхности имплантатов, которые имеют обширную площадь поверхности, высокую свободную энергию поверхности и смачиваемость, кажутся способными изменять реакцию тканей хозяина. Поверхности имплантатов SA продемонстрировали предсказуемые клинические результаты и считаются стандартной поверхностью имплантата. Супергидрофильность SA + VUV + BS, которая ранее была обнаружена на плоской поверхности дисков, была подтверждена в нашем тесте статической смачиваемости поверхности. Поскольку способность привлекать кровь к верхней части имплантата (примерно на 4 мм выше горизонтальной пластины в нашем исследовании) является тем, что большинство клиницистов в конечном итоге предпочитают проверять в клинических условиях, мы добавили новый динамический тест смачиваемости поверхности, чтобы более подробно сравнить скорости смачивания SA + VUV и SA + VUV + BS. Поскольку SA является сухой поверхностью, которая не контактировала с какой-либо жидкостью, смачиваемость поверхности SA + VUV + BS может быть значительно превосходящей по сравнению с SA исключительно за счет эффекта буферного агента pH SA + VUV + BS. Однако, учитывая, что имплантаты устанавливаются с сухими поверхностями или без дополнительной гидратации в реальных клинических ситуациях, мы выбрали наивный SA, а не SA, гидратированный в растворе, в качестве контроля. Более гидрофильная поверхность ранее была обнаружена как тесно связанная с превосходной и более быстрой остеоинтеграцией. Более того, известно, что смачиваемость поверхности изменяет биологические реакции поверхностей имплантатов в отношении адгезии белков и других молекул, а также взаимодействия клеток.
Поскольку образование тромба сигнализирует о начале процесса заживления, взаимодействие между имплантатом и кровью считается важным для успешной остеоинтеграции титановый имплантатов после имплантации. Образование тромба на шероховатых титановый поверхностях может вызывать привлечение клеток и стимулировать заживление ран, и было установлено, что как преостеобласты, так и остеобласты могут прикрепляться к поверхности имплантата, покрытой тромбоцитами и фибрином, где они дифференцируются под воздействием остеогенных факторов и цитокинов, выделяемых из периимплантного тромба. Образование тромба на имплантате с различными поверхностями имплантатов считается решающим фактором в эффективном удержании фибрина и может критически влиять на заживление костей и остеоинтеграцию, влияя на транспорт макромолекул, поведение клеток и контактную/дистанционную остеогенез. В тесте статического свертывания крови SA + VUV + BS показал превосходное поглощение крови вокруг имплантатов по сравнению с SA + VUV, но не в статистически значимой степени. Это указывает на то, что поверхность SA, фотофункционализированная VUV, имеет по крайней мере равные способности к свертыванию крови. Мы разработали новые эксперименты для подтверждения свертывания крови при гемостазе непрерывных капиллярных кровотечений, чтобы максимально точно смоделировать реальные клинические ситуации. В тесте in vitro динамического свертывания крови тромбы образовывались значительно быстрее, и общий объем крови, собирающейся через зазор между отверстиями и имплантатом до гемостаза, был значительно меньше в SA + VUV + BS, чем в SA + VUV. Тест in vivo также показал значительную разницу в общем весе кровотечения между чрезмерно подготовленным отверстием и имплантатом среди SA, SA + VUV и SA + VUV + BS. Это предполагает, что SA + VUV + BS может вызывать более быстрое образование тромба вокруг поверхности имплантата, что приводит к более эффективному взаимодействию интерфейса кость-имплантат для остеоинтеграции. С клинической точки зрения, эти особенности SA + VUV + BS важны для визуализации хирургического участка и одновременной направленной регенерации кости, что часто показано для адекватного количества и качества периимплантных тканей для более эстетических и функциональных результатов, поскольку быстрое свертывание крови тесно связано со стабилизацией трансплантата и барьерной мембраны. Наконец, SA + VUV может быть альтернативой SA + VUV + BS для SA с точки зрения потенциала образования тромба на поверхностях имплантатов.
Во время сверления имплантата в кости, что создает слабо кислую среду, буфер pH может помочь поддерживать постоянный уровень pH. В качестве покрытия буферный агент pH, похоже, контролирует высвобождение воспалительных медиаторов и улучшает условия для активности остеобластов, поддерживая постоянный уровень pH или, по крайней мере, предотвращая значительные изменения. Активность тромбоцитов в процессе свертывания крови, а также активность остеобластов и уровень ALP для формирования кости также подавляются экстрацеллюлярным ацидозом. SA + VUV + BS могут максимизировать активность тромбоцитов, тромбообразование, активность остеобластов и уровень ALP на интерфейсе кость-имплантат за счет эффекта буферизации pH. Необходимы дальнейшие исследования для изучения SA + VUV + BS в отношении его безопасности и эффективности в клинических условиях. Также следует провести рандомизированные контролируемые испытания, чтобы подтвердить его целесообразность в различных клинических условиях, таких как установка имплантата сразу после удаления зуба или с одновременным увеличением объема кости.
Чан-Джу Пак, Дже Хён Лим, Марко Талларико, Кюн-Гюн Хванг, Хюк Чой, Гю-Джанг Чо, Чан Ким, Иль-Сок Чан, Джу-Донг Сонг, Эми М. Квон, Сан Хо Чон и Хён-Кюн Пак
Ссылки
- Özcan, M.; Hämmerle, C. Титан как материал для реконструкции и имплантации в стоматологии: преимущества и недостатки. Materials 2012, 5, 1528–1545. [CrossRef]
- Ehrenfest, D.M.D.; Coelho, P.G.; Kang, B.S.; Sul, Y.T.; Albrektsson, T. Классификация оссеоинтегрированных поверхностей имплантатов: материалы, химия и топография. Trends Biotechnol. 2010, 28, 198–206. [CrossRef]
- Milošev, I.; Metikoš-Hukovic´, M.; Strehblow, H.H. Пассивная пленка на ортопедическом сплаве TiAlV, образованная в физиологическом растворе, исследованная с помощью рентгеновской фотоэлектронной спектроскопии. Biomaterials 2000, 21, 2103–2113. [CrossRef]
- Lee, J.H.; Ogawa, T. Биологическое старение титановыми имплантатами. Implant Dent. 2012, 21, 415–421. [CrossRef]
- Hori, N.; Att, W.; Ueno, T.; Sato, N.; Yamada, M.; Saruwatari, L.; Suzuki, T.; Ogawa, T. Возрастная зависимость деградации способности адсорбции белка титана. J. Dent. Res. 2009, 88, 663–667. [CrossRef]
- Hori, N.; Ueno, T.; Suzuki, T.; Iwasa, F.; Yamada, M.; Att, W.; Okada, S.; Ohno, A.; Aita, H.; Kimoto, K. Обработка ультрафиолетовым светом для восстановления деградации биологической активности титана, связанной с возрастом. Int. J. Oral Maxillofac. Implant. 2010, 25, 49–62.
- Ogawa, T. Ультрафиолетовая фотофункционализация титановыми имплантатами. Int. J. Oral Maxillofac. Implant. 2014, 29, e95–e102. [CrossRef] [PubMed]
- Rosales-Leal, J.; Rodríguez-Valverde, M.; Mazzaglia, G.; Ramón-Torregrosa, P.; Díaz-Rodríguez, L.; García-Martínez, O.; Vallecillo-Capilla, M.; Ruiz, C.; Cabrerizo-Vílchez, M. Влияние шероховатости, смачиваемости и морфологии инженерных титанов на адгезию остеобластоподобных клеток. Colloids Surf. Physicochem. Eng. Aspects 2010, 365, 222–229. [CrossRef]
- Cicciù, M.; Fiorillo, L.; Herford, A.S.; Crimi, S.; Bianchi, A.; D’Amico, C.; Laino, L.; Cervino, G. Биологически активные титановыми поверхности: взаимодействия эукариотических и прокариотических клеток нано-устройств, применяемых в стоматологической практике. Biomedicines 2019, 7, 12. [CrossRef]
- Li, D.; Ferguson, S.J.; Beutler, T.; Cochran, D.L.; Sittig, C.; Hirt, H.P.; Buser, D. Биомеханическое сравнение пескоструйной и кислотно-этчированной и механически обработанной и кислотно-этчированной титановыми поверхностями для стоматологических имплантатов. J. Biomed. Mater. Res. 2002, 60, 325–332. [CrossRef]
- Kaysinger, K.K.; Ramp, W.K. Внеклеточный pH модулирует активность культивируемых человеческих остеобластов. J. Cell. Biochem. 1998, 68, 83–89. [CrossRef]
- Marumo, M.; Suehiro, A.; Kakishita, E.; Groschner, K.; Wakabayashi, I. Внеклеточный pH влияет на агрегацию тромбоцитов, связанную с модуляцией входа Ca2+, управляемого запасом. Thromb. Res. 2001, 104, 353–360. [CrossRef]
- Hong, J.; Kurt, S.; Thor, A. Гидрофильная поверхность стоматологического имплантата проявляет тромбообразующие свойства in vitro. Clin. Implant Dent. Relat. Res. 2013, 15, 105–112. [CrossRef]
- Di Iorio, D.; Traini, T.; Degidi, M.; Caputi, S.; Neugebauer, J.; Piattelli, A. Количественная оценка расширения фибринового сгустка на различных поверхностях имплантатов: исследование in vitro. J. Biomed. Mater. Res. 2005, 74, 636–642. [CrossRef]
- Pae, H.C.; Kim, S.K.; Park, J.Y.; Song, Y.W.; Cha, J.K.; Paik, J.W.; Choi, S.H. Биологически активные характеристики поверхности имплантата, покрытой буферным агентом pH: исследование in vitro. J. Periodontal Implant. Sci. 2019, 49, 366–381. [CrossRef]
- Cho, Y.S.; Hwang, K.G.; Jun, S.H.; Tallarico, M.; Kwon, A.M.; Park, C.J. Радиологический сравнительный анализ между заполнением физиологическим раствором и фибриновым гелем, обогащенным тромбоцитами, после гидравлического транс-крестцового поднятия синуса без дополнительной костной пересадки: рандомизированное контролируемое испытание. Clin. Oral Implant. Res. 2020. [CrossRef] [PubMed]
- Att, W.; Hori, N.; Iwasa, F.; Yamada, M.; Ueno, T.; Ogawa, T. Влияние UV-фотофункционализации на временную биологическую активность титана и сплавов хрома-кобальта. Biomaterials 2009, 30, 4268–4276. [CrossRef]
- Shie, J.L.; Lee, C.H.; Chiou, C.S.; Chang, C.T.; Chang, C.C.; Chang, C.Y. Кинетика фотодеградации формальдегида с использованием источников света UVA, UVC и UVLED в присутствии составленного фотокатализатора оксида титана с серебром. J. Hazard. Mater. 2008, 155, 164–172. [CrossRef]
- McGivney, E.; Carlsson, M.; Gustafsson, J.P.; Gorokhova, E. Влияние процессов продвинутого окисления TiO2 с UV-C и вакуумным UV на острую смертность микроводорослей. Photochem. Photobiol. 2015, 91, 1142–1149. [CrossRef]
- Westall, J.; Hohl, H. Сравнение электростатических моделей для интерфейса оксидного раствора. Adv. Colloid Interface Sci. 1980, 12, 265–294. [CrossRef]
- Tang, L.; Thevenot, P.; Hu, W. Химия поверхности влияет на биосовместимость имплантатов. Curr. Top. Med. Chem. 2008, 8, 270–280. [CrossRef]
- Coelho, P.G.; Granjeiro, J.M.; Romanos, G.E.; Suzuki, M.; Silva, N.R.; Cardaropoli, G.; Thompson, V.P.; Lemons, J.E. Основные методы исследования и современные тенденции поверхностей стоматологических имплантатов. J. Biomed. Mater. Res. 2009, 88, 579–596. [CrossRef]
- Puleo, D.; Nanci, A. Понимание и контроль интерфейса кость-имплантат. Biomaterials 1999, 20, 2311–2321. [CrossRef]
- Morra, M.; Cassinelli, C.; Cascardo, G.; Mazzucco, L.; Borzini, P.; Fini, M.; Giavaresi, G.; Giardino, R. Поверхности титана, покрытые коллагеном I: адгезия мезенхимальных клеток и in vivo оценка в имплантатах из трабекулярной кости. J. Biomed. Mater. Res. 2006, 78, 449–458. [CrossRef] [PubMed]
- Morra, M. Биохимическая модификация титановыми поверхностями: пептиды и белки внеклеточного матрикса. Eur. Cell. Mater. 2006, 12, 15. [CrossRef]
- Makowiecki, A.; Hadzik, J.; Błaszczyszyn, A.; Gedrange, T.; Dominiak, M. Оценка супергидрофильных поверхностей стоматологических имплантатов - систематический обзор и мета-анализ. BMC Oral Health 2019, 19, 79. [CrossRef]
- Khandelwal, N.; Oates, T.W.; Vargas, A.; Alexander, P.P.; Schoolfield, J.D.; Alex McMahan, C. Обычные SLA и химически модифицированные SLA имплантаты у пациентов с плохо контролируемым диабетом 2 типа — рандомизированное контролируемое испытание. Clin. Oral Implant. Res. 2013, 24, 13–19. [CrossRef]
- Kokovic, V.; Jung, R.; Feloutzis, A.; Todorovic, V.S.; Jurisic, M.; Hämmerle, C.H. Немедленная и ранняя нагрузка имплантатов SLA в задней части нижней челюсти: 5-летние результаты рандомизированного контролируемого клинического испытания. Clin. Oral Implant. Res. 2014, 25, e114–e119. [CrossRef]
- Cesaretti, G.; Botticelli, D.; Renzi, A.; Rossi, M.; Rossi, R.; Lang, N.P. Радиографическая оценка немедленно загруженных имплантатов, поддерживающих 2–3 единицы фиксированных мостов в задней части верхней челюсти: 3-летнее наблюдение в рамках проспективного рандомизированного контролируемого многоцентрового клинического исследования. Clin. Oral Implant. Res. 2016, 27, 399–405. [CrossRef]
- Buser, D.; Broggini, N.; Wieland, M.; Schenk, R.; Denzer, A.; Cochran, D.; Hoffmann, B.; Lussi, A.; Steinemann, S. Увеличенная остеоинтеграция к химически модифицированной поверхности титана SLA. J. Dent. Res. 2004, 83, 529–533. [CrossRef]
- Lang, N.P.; Salvi, G.E.; Huynh-Ba, G.; Ivanovski, S.; Donos, N.; Bosshardt, D.D. Ранняя оссеоинтеграция к гидрофильным и гидрофобным поверхностям имплантатов у людей. Clin. Oral Implant. Res. 2011, 22, 349–356. [CrossRef] [PubMed]
- Gittens, R.A.; Scheideler, L.; Rupp, F.; Hyzy, S.L.; Geis-Gerstorfer, J.; Schwartz, Z.; Boyan, B.D. Обзор смачиваемости поверхностей стоматологических имплантатов II: биологические и клинические аспекты. Acta Biomater. 2014, 10, 2907–2918. [CrossRef]
- Shiu, H.T.; Goss, B.; Lutton, C.; Crawford, R.; Xiao, Y. Формирование кровяного сгустка на биоматериальных имплантатах влияет на заживление кости. Tissue Eng. Part B Rev. 2014, 20, 697–712. [CrossRef]
- Yang, J.; Zhou, Y.; Wei, F.; Xiao, Y. Кровяной сгусток, образованный на шероховатой титановыми поверхности, вызывает ранний набор клеток. Clin. Oral Implant. Res. 2016, 27, 1031–1038. [CrossRef]
- Gassling, V.; Hedderich, J.; Açil, Y.; Purcz, N.; Wiltfang, J.; Douglas, T. Сравнение фибрина, обогащенного тромбоцитами, и коллагена в качестве каркасов, заселенных остеобластами, для применения в инженерии костной ткани. Clin. Oral Implant. Res. 2013, 24, 320–328. [CrossRef]
