Сравнение платформенной смены и обычных одноимплантатов: 5-летние результаты после нагрузки из рандомизированного контролируемого исследования
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Цель: Сравнить клинические и рентгенографические результаты имплантатов с переключением платформы (PS) и обычной платформой (RP).
Материалы и методы: Это исследование было спроектировано как рандомизированное контролируемое испытание с разделением челюсти. В исследование последовательно были включены восемнадцать пациентов с двусторонне отсутствующими одиночными премолярами или молярами, которые подлежали восстановлению с помощью одиночных коронок на имплантатах. Места для имплантации были случайным образом распределены для лечения в соответствии с концепцией PS (группа PS) или с совпадающими диаметрами имплантата и абатмента (группа RP). Всего было установлено 36 имплантатов в зажившей кости с крутящим моментом вставки от 35 до 45 Нсм в соответствии с одноэтапным протоколом. Все имплантаты были нагружены временной коронкой с винтовым креплением через 3 месяца после установки имплантата. Окончательные одиночные коронки с винтовым креплением были установлены через 2 месяца. Показателями результатов были выживаемость имплантатов и протезов, биологические и протезные осложнения, изменения уровня маргинальной кости (MBL), глубина зондирования кармана (PPD) и кровотечение при зондировании (BOP). Клинические данные были собраны при установке имплантата (базовый уровень), нагружении имплантата (через 3 месяца) и через 9, 36 и 60 месяцев после нагружения.
Результаты: Один пациент выбыл из исследования после 4 лет наблюдения. Ни один имплантат не потерпел неудачу, и в течение периода исследования не было зафиксировано протезных осложнений. Один пациент испытал воспаление слизистой оболочки с положительным BOP (группа RP) через 3 месяца, и у трех пациентов было двустороннее воспаление слизистой оболочки вокруг имплантатов с положительным BOP на 6, 24 и 36 месяцах соответственно. Других биологических осложнений не было зафиксировано до 60 месяцев наблюдения. Статистически значимых различий между группами по осложнениям не наблюдалось (3/18 против 4/18; P = 1.0). Девять месяцев после нагрузки средний MBL составил 0.93 ± 0.26 мм (95% CI 0.81 до 1.05) для имплантатов RP и 0.84 ± 0.2 мм (95% CI 0.73 до 0.95) для имплантатов PS. Статистически значимых различий между группами не наблюдалось (P = 0.18). Тридцать шесть месяцев после нагрузки средний MBL составил 1.09 ± 0.3 мм (95% CI 0.95 до 1.24) в группе RP и 1.06 0.24 мм (95% CI 0.94 до 1.17) в группе PS, при этом статистически значимых различий между группами не наблюдалось (P = 0.70). Шестьдесят месяцев после нагрузки средний MBL составил 1.24 ± 0.39 мм (95% CI 1.05 до 1.43) в группе RP и 1.20 ± 0.21 мм (95% CI 1.01 до 1.39) в группе PS, при этом статистически значимых различий между группами не наблюдалось (P = 0.85). Средний PPD составил 2.58 0.58 мм (95% CI 2.32 до 2.84) в группе RP и 2.40 ± 0.72 мм (95% CI 2.21 до 2.59) в группе PS на 60 месяцах наблюдения, при этом статистически значимых различий между группами не наблюдалось (P = 0.49). Средний BOP составил 0.90 ± 0.88 (95% CI 0.58 до 1.22) в группе RP и 0.93 ± 0.97 (95% CI 0.51 до 1.35) в группе PS на 60 месяцах наблюдения, при этом статистически значимых различий между группами не наблюдалось (P = 0.85)
Выводы: Имплантаты, восстановленные в соответствии с концепцией PS и соответствующие диаметрам имплантата и абатмента, показали сопоставимые клинические и рентгенографические результаты до 5 лет после нагрузки.
Введение
Периимплантаторная потеря краевой кости неизбежна и, как предполагается, связана с установлением патогенной микрофлоры, вызывающей воспаление слизистой оболочки и прогрессирующую резорбцию кости. Большое количество исследований, посвященных имплантатам с соответствующими абатментами, сообщают о первоначальной ремоделировании кости до 2 мм в течение первого года нагрузки. Кажется, что несколько факторов способствуют этому физиологическому событию, включая, но не ограничиваясь, дизайном имплантата, соединением имплантата и абатмента и установлением биологической ширины. Кроме того, биомеханический стресс, положение платформы имплантата и несоответствие каркаса могут негативно влиять на этот процесс и в конечном итоге затрагивать физиологическое ремоделирование периимплантной кости.
Некоторые клинические испытания показали, что имплантаты с переключением платформы (PS) имели значительно меньшую резорбцию кости по сравнению с традиционным соединением имплантата и абатмента с соответствующим диаметром. Обоснование этого подхода заключается в том, чтобы расположить микротрещину соединения имплантата и абатмента вдали от области контакта кости и имплантата, что предполагает, что переключенная платформа может предотвратить или уменьшить потерю краевой кости. Несмотря на первоначальные сомнительные доказательства положительного эффекта концепции PS на стабильность краевой кости, другие исследования сообщили о схожих результатах по сравнению с традиционной процедурой.
Промежуточный отчет через 9 месяцев после нагрузки из предыдущего испытания, проведенного авторами, показал, что имплантаты PS и регулярные платформенные (RP) имплантаты имеют схожие клинические и рентгенографические результаты при замене одного зуба. Эти данные были подтверждены результатами через 3 года после нагрузки.
В настоящем исследовании была протестирована нулевая гипотеза о том, что нет различий в клинических и рентгенографических результатах между имплантатами PS и RP при замене одного зуба, против альтернативной гипотезы о наличии различий, до 5 лет после нагрузки. Это испытание описано в соответствии с заявлением CONSORT (http://www.consort-state ment.org) для улучшения качества отчетности параллельных рандомизированных испытаний.
Материалы и методы
Дизайн исследования и отбор пациентов
Это исследование было спроектировано как проспективное рандомизированное контролируемое испытание с разделением челюсти. Пациенты были набраны в трех различных центрах с ноября 2011 года по февраль 2013 года. Исследование проводилось в соответствии с руководящими принципами Хельсинкской декларации, и все участники предоставили письменное информированное согласие перед включением. Пациенты лечились одним и тем же стоматологом (SM). Данные были проанализированы в стоматологическом отделении Университетской больницы Сассари, Италия.
Пациенты были отобраны в соответствии со следующими критериями включения и исключения.
Критерии включения:
- возраст ≥ 18 лет
- необходимость в одном двустороннем коронке, поддерживаемой имплантатом, в задней области
- стабильные интерокклюзионные отношения
- остаточная высота кости ≥ 10
- остаточная ширина кости ≥ 6 мм с как минимум 5 мм кератинизации десны по краю
- предоставлено письменное информированное согласие.
Критерии исключения:
- общие противопоказания для имплантации
- отсутствие окклюдирующей зубной дуги в области, предназначенной для установки имплантата
- периодонтит
- тяжелый бруксизм
- иммунодефицит
- предыдущая история облучения области головы и шеи
- неконтролируемый диабет
- сильный курильщик (> 10 сигарет/день)
- глубина кармана при зондировании (PPD) и/или кровотечение при зондировании (BOP) 25%
- текущая или прошлая терапия бисфосфонатами
- злоупотребление веществами
- психическое расстройство
- неспособность пройти наблюдение в течение 5 лет после нагрузки
- лактация
- крутящий момент при установке имплантата менее 35 Нсм при установке имплантата.
Клинические процедуры
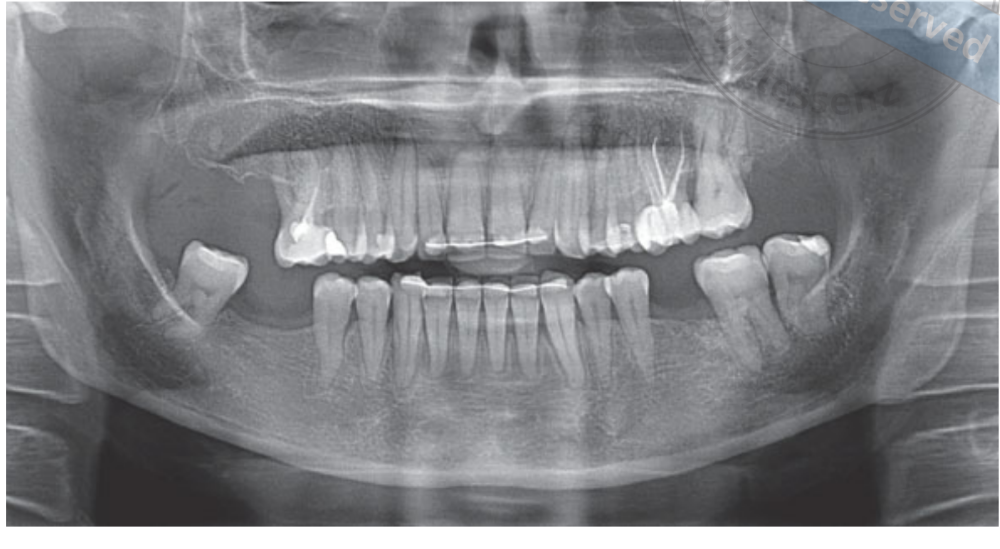
Все пациенты были клинически оценены, и их медицинская история была зафиксирована. Проведены предварительный скрининг и рентгенографические исследования (Рис. 1) для оценки потенциальной пригодности пациентов. Пациенты, соответствующие критериям отбора, получили лечение по гигиене полости рта и сканирование с использованием конусно-лучевой компьютерной томографии (КЛКТ, Imaging Sciences International, Hatfield, PA, USA).
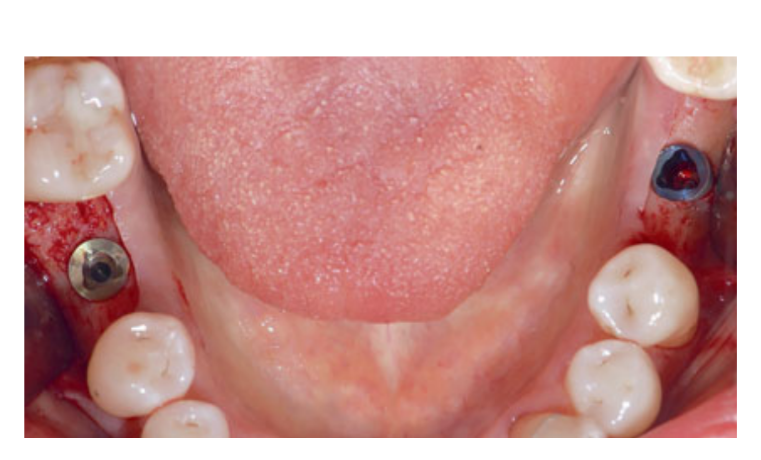
875/125 мг амоксициллина/клавулановой кислоты (Аугментин, GlaxoSmithKline, Верона, Италия) вводили дважды в день с 1 часа до установки имплантата и в течение 6 дней после операции. Перед установкой имплантата пациенты полоскали рот в течение 1 минуты 0,2% раствором хлоргексидина (Curasept, Curaden Healthcare, Саронно, Варезе, Италия). Местная анестезия проводилась с использованием артикаина с адреналином (1:100,000; Pierrel, Милан, Италия) непосредственно перед операцией. Минимально инвазивный лоскут был спроектирован с интрасулкулярным и кристальным разрезом, без освобождающих разрезов. Установочные сверла использовались для подготовки места имплантации в соответствии с плотностью кости и инструкциями производителя. Как только место имплантации было подготовлено для установки имплантата диаметром 4,3 или 5,0 мм, конверт с кодом рандомизации для назначения места PS и RP был открыт слепым независимым врачом. Имплантаты (NobelReplace Tapered Groovy, Nobel Biocare, Гётеборг, Швеция) с анодированным покрытием были установлены с крутящим моментом между > 35 и < 45 Нсм. Одно место получило имплантаты NobelReplace Platform Shift длиной 8 или 10 мм, с диаметром тела 4,3 мм и интерфейсом имплантат-абатмент 3,5 мм (узкая платформа [NP], фуксия), или с диаметром тела 5,0 мм и интерфейсом имплантат-абатмент 4,3 мм (RP, желтый). Контралатеральное место получило идентичные имплантаты (группа RP) с совпадающими диаметрами имплантат-абатмент (4,3 мм, желтый; или 5,0 мм, синий; Рис. 2). Абатменты для заживления были подключены к имплантатам во время операции. Лоскуты были зашиты швами Vicryl 4.0 (Vicryl, Ethicon J&J International, Синт-Стивенс-Волюв, Бельгия).
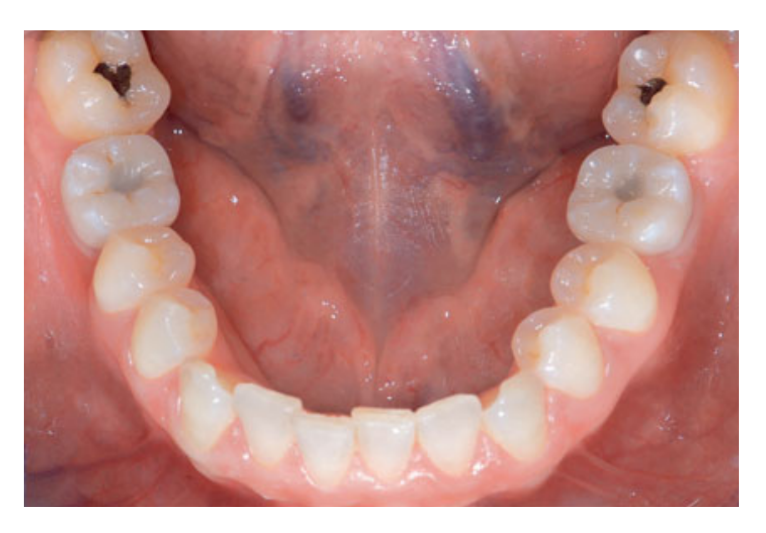
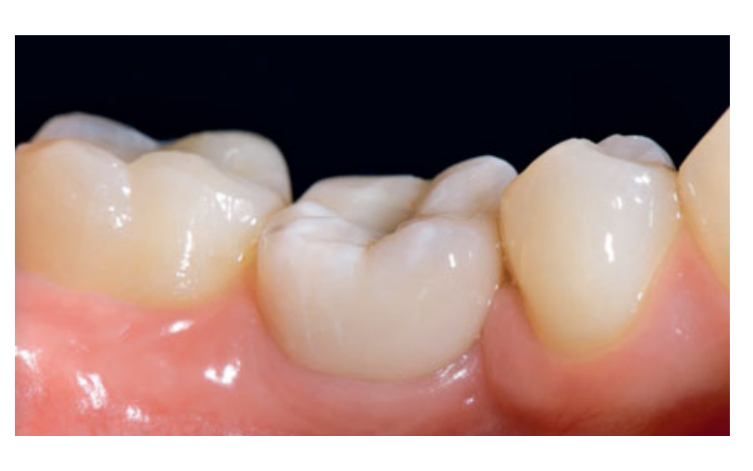
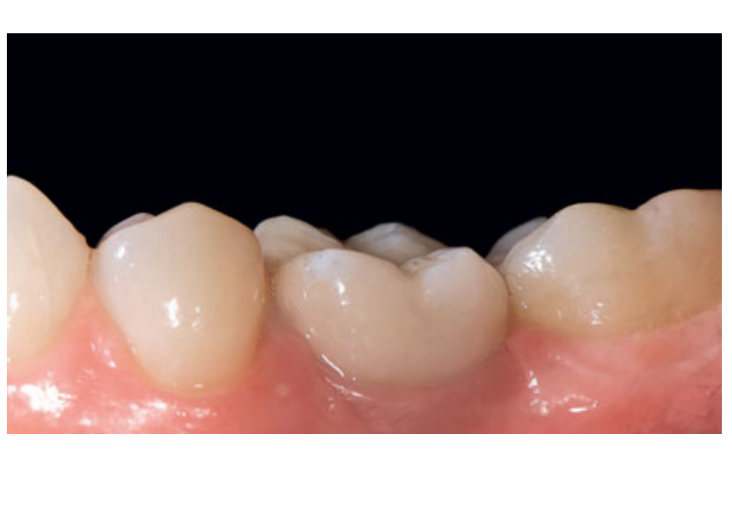
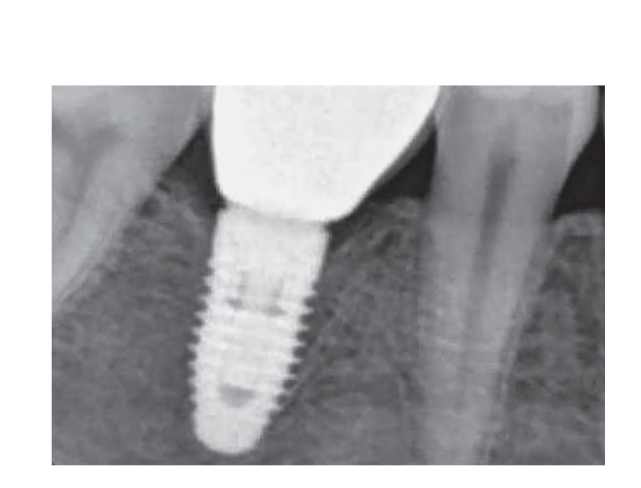
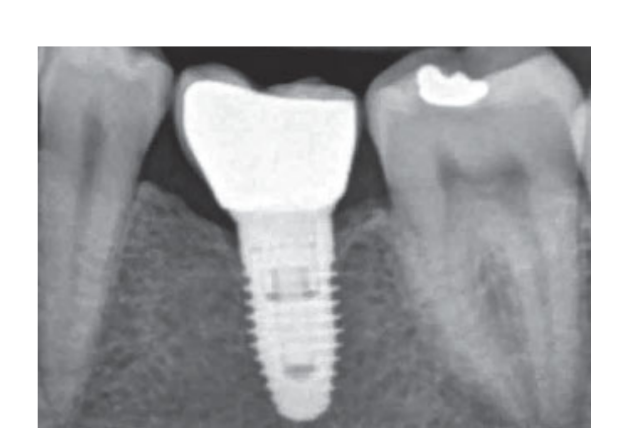
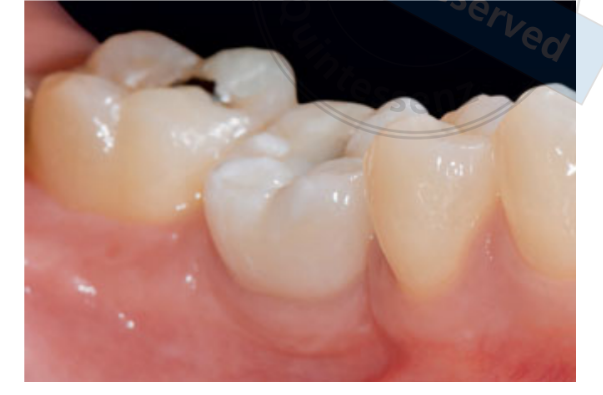
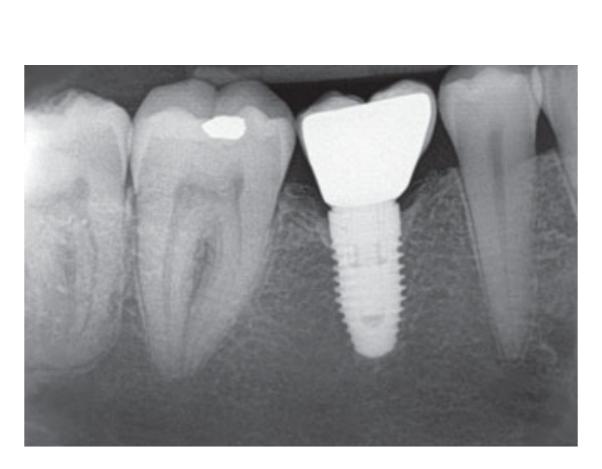
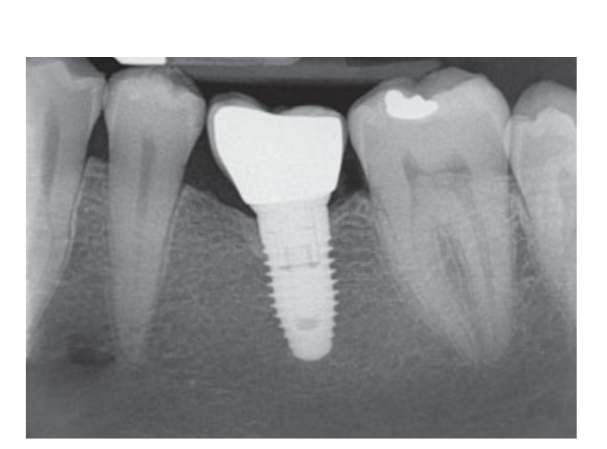
80 мг кетопрофена (Оки, Домпе, Милан, Италия) назначали два или три раза в день на необходимый срок. Пациентам было рекомендовано полоскать рот 0,2% хлоргексидином (Курасепт) в течение 2 недель и соблюдать мягкую диету в течение 10 дней. Швы удаляли через 2 недели. Через 3 месяца после установки проверяли стабильность имплантата вручную, и снимали окончательные слепки. Через 1 неделю были установлены временные смоляные коронки на винтах, основанные на временных титановый абатментах. Через 6 месяцев после установки имплантатов были установлены окончательные металлические или циркониевые керамические коронки на винтах (Рис. 3-5). Клиническое наблюдение и интраоральные рентгенограммы были запланированы на момент установки имплантата (базовый уровень), загрузки имплантата (через 3 месяца) и через 9, 36 и 60 месяцев после загрузки (Рис. 6-11). Затем пациенты были включены в программу гигиены полости рта с повторными визитами каждые 3 месяца в течение первого года, а затем дважды в год.
Были зарегистрированы следующие показатели результатов.
- Неудача имплантата/протеза: Удаление имплантатов, вызванное подвижностью имплантата, прогрессирующей потерей краевой кости, инфекцией или переломом имплантата. Стабильность отдельных имплантатов измерялась протезистом (PM) в момент доставки временной и окончательной коронки (через 3 и 6 месяцев после установки имплантата) с применением крутящего момента на удаление 35 Нсм. Через год после установки имплантата стабильность имплантата проверялась вручную тем же протезистом с помощью двух ручек стоматологического зеркала.
- Осложнения: Переломы или сколы временной или окончательной керамической коронки, подвижность абатмента и биологические осложнения, такие как рана или инфекция имплантата, мукозит, абсцессы или периимплантит, регистрировались на протяжении всего периода наблюдения.
- Уровни краевой кости (MBLs): Периимплантные MBLs оценивались на интраоральных цифровых рентгеновских снимках, сделанных с параллельной техникой в момент установки имплантата, а также через 3, 9, 36 и 60 месяцев после нагрузки. Рентгеновские снимки принимались или отклонялись для оценки на основе четкости резьбы имплантата. Все рентгеновские снимки оценивались радиологом, который ранее не участвовал в исследовании. Расстояния от мезиальной и дистальной межзубной кости до горизонтального интерфейса между имплантатом и абатментом (опорная точка) измерялись с помощью программного инструмента измерения (Digora for Windows 2.8, Soredex, Туусула, Финляндия), который был откалиброван для каждого отдельного изображения относительно пространства между двумя резьбами до ближайших 0,1 мм. Мезиальные и дистальные измерения фиксировались относительно оси имплантата и усреднялись.
- Параметры пародонта: PPD и BOP измерялись слепым оператором, который ранее не участвовал в исследовании, с помощью пародонтального зонда (PCP-UNC 15, Hu-Friedy Manufacturing, Чикаго, IL, США) через 3, 9, 36 и 60 месяцев после нагрузки. Для каждого имплантата собирались три вестибулярных и три язычных значения.
Размер выборки и рандомизация
Поскольку это исследование изначально планировалось как предварительное к более крупному клиническому испытанию, расчет размера выборки заранее не проводился. У каждого пациента правый или левый моляр или премоляр случайным образом распределялись для получения либо имплантатов PS, либо RP. Код рандомизации был создан с использованием компьютерного программного обеспечения (Excel, Microsoft, Redmond, WA, USA) путем комбинирования последовательности случайных непоследовательных чисел, соответствующих двум различным процедурам (имплантаты PS и RP), с правым или левым зубом, и был назначен независимым оператором, не участвующим в испытании, а номера были помещены в непрозрачные конверты. Левый участок был выделен в соответствии с указанием в конверте, а контралатеральный участок был обработан в течение той же сессии в соответствии с другой интервенцией. Данные собирались в электронных таблицах (Microsoft Office Excel) независимым врачом в стоматологическом отделении Университета Сассари, Италия.
Статистический анализ
Статистические анализы проводились с использованием программного обеспечения QI Macros SPC (версия 2010, KnowWare International, Денвер, Колорадо, США) для Microsoft Office Excel. Все значения представлены в виде среднего значения и разницы средних, с стандартным отклонением (SD) и 95% доверительными интервалами (CI). Различия в пропорции пациентов с неудачами протезирования, неудачами имплантации и осложнениями (дихотомические исходы) сравнивались между группами с использованием теста МакНемара. Отношение шансов (OR) использовалось для оценки возможной ассоциации между вмешательствами и осложнениями. Средние различия непрерывных исходов (MBL, PPD и BOP) между группами сравнивались с использованием парных t тестов, проведенных на уровне значимости 95%. Множественное тестирование было скорректировано по методу Бонферрони.
Результаты
Всего 25 пациентов были отобраны для проверки соответствия критериям, но семеро пациентов не соответствовали критериям отбора по следующим причинам: трое отказались соблюдать строгий клинический и радиологический контроль, трое имели недостаточную высоту кости, и один имел недостаточную ширину кости. Восемнадцать пациентов (8 мужчин, 10 женщин) со средним возрастом 48 лет (в диапазоне от 28 до 70) были признаны подходящими и последовательно лечились. Всего было установлено 36 имплантатов в заживленных участках с крутящим моментом установки от 35 до 45 Нсм. Один пациент выбыл из исследования через 4 года. Отклонений от первоначального протокола не произошло. Данные были собраны на начальном этапе (установка имплантата) и через 3 (нагрузка имплантата), 9, 36 и 60 месяцев.
Не было зафиксировано подвижности имплантатов, инфекций или переломов. Все имплантаты были стабильны к концу исследования. Протезные осложнения не наблюдались. В обеих группах лечения не было зарегистрировано серьезных биологических осложнений. Один пациент испытал воспаление слизистой оболочки с положительным BOP (группа RP) через 3 месяца. У одного пациента было двустороннее воспаление слизистой оболочки вокруг имплантатов с положительным BOP через 6 месяцев. У еще двух пациентов наблюдалось двустороннее воспаление слизистой оболочки через 24 и 30 месяцев после нагрузки, с положительным BOP. Все эти пациенты поддерживали хорошую гигиену полости рта, используя программы по улучшению здоровья полости рта. После этого воспаление вокруг имплантатов прошло, и до 60 месяцев наблюдения не было зарегистрировано других осложнений. В целом, статистически значимой разницы между группами не было (3/18 против 4/18; P = 1.0; OR 1.333; 95% CI 0.3467 до 5.1272).
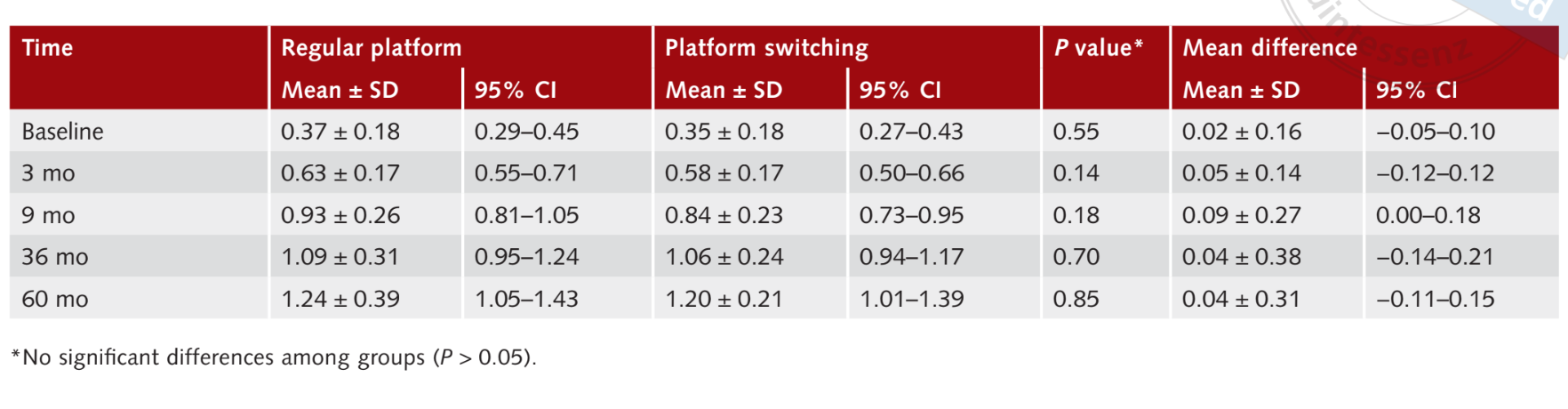
Средний MBL через 3 месяца после нагрузки составил 0.6 ± 0.17 мм (95% CI 0.55 до 0.71 мм) для имплантатов RP и 0.58 ± 0.17 мм (95% CI 0.50 до 0.66 мм) для имплантатов PS. Статистически значимой разницы между группами не наблюдалось (P = 0.14). Через девять месяцев после нагрузки средний MBL составил 0.9 ± 0.26 мм (95% CI 0.81 до 1.05 мм) для имплантатов RP и 0.84 ± 0.2 (95% CI 0.73 до 0.95 мм) для имплантатов PS. Статистически значимой разницы между группами не наблюдалось (P = 0.18). Через тридцать шесть месяцев после нагрузки средний MBL составил 1.09 ± 0.3 (95% CI 0.95 до 1.24 мм) в группе RP и 1.06 ± 0.24 мм (95% CI 0.94 до 1.17 мм) в группе PS, без статистически значимой разницы между группами (P = 0.70). Через шестьдесят месяцев после нагрузки средний MBL составил 1.24 ± 0.39 мм (95% CI 1.05 до 1.43 мм) в группе RP и 1.20 ± 0.2 мм (95% CI 1.01 до 1.39 мм) в группе PS, без статистически значимой разницы между группами (P = 0.85). Результаты обобщены в таблице 1.
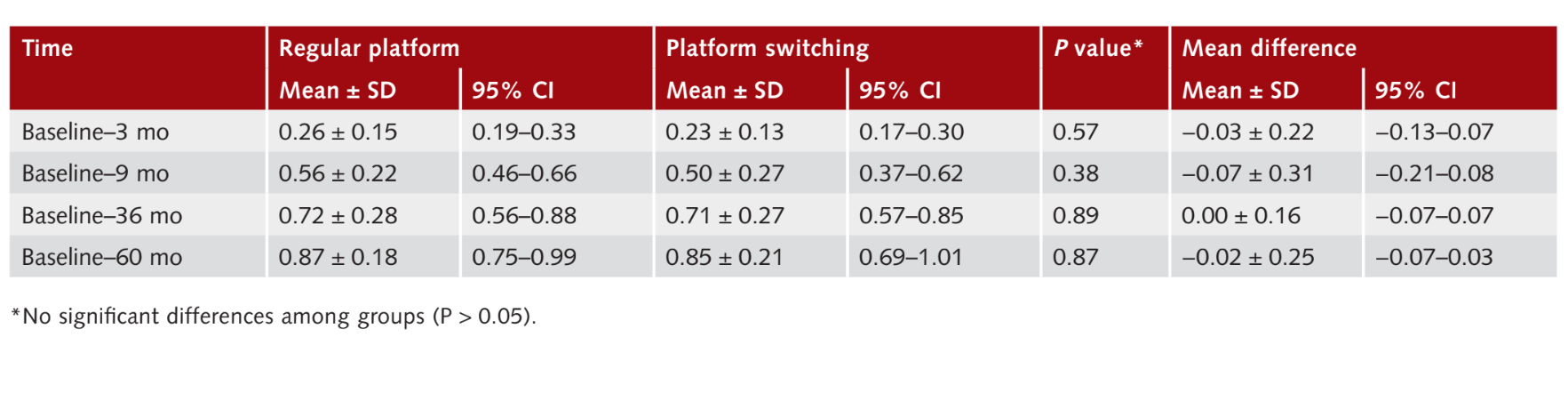
Среднее изменение межзубного MBL было проанализировано для каждого имплантата. Три месяца после нагрузки изменение MBL составило 0.26 ± 0.15 мм (95% ДИ 0.19 до 0.33 мм) для RP имплантатов и 0.2 ± 0.1 мм (95% ДИ 0.17 до 0.30 мм) для PS имплантатов. Статистически значимой разницы между группами не наблюдалось (P = 0.57). Девять месяцев после нагрузки изменение MBL от базового уровня составило 0.56 ± 0.22 мм (95% ДИ 0.46 до 0.66 мм) для RP имплантатов и 0.50 ± 0.27 мм (95% ДИ 0.37 до 0.62 мм) для PS имплантатов. Статистически значимой разницы между группами не наблюдалось (P = 0.38). Изменение MBL между 36 месяцами после нагрузки и базовым уровнем составило 0.72 ± 0.28 мм (95% ДИ 0.56 до 0.88) в группе RP и 0.71 0.27 мм (95% ДИ 0.57 до 0.85), без статистически значимой разницы между группами (P 0.89). Шестьдесят месяцев после нагрузки изменение MBL составило 0.87 0.18 мм (95% ДИ 0.75 до 0.99 мм) для RP имплантатов и 0.85 ± 0.21 мм (95% ДИ 0.69 до 1.01 мм) для PS имплантатов. Статистически значимой разницы между группами не наблюдалось (P = 0.87). Результаты суммированы в Таблице 2.
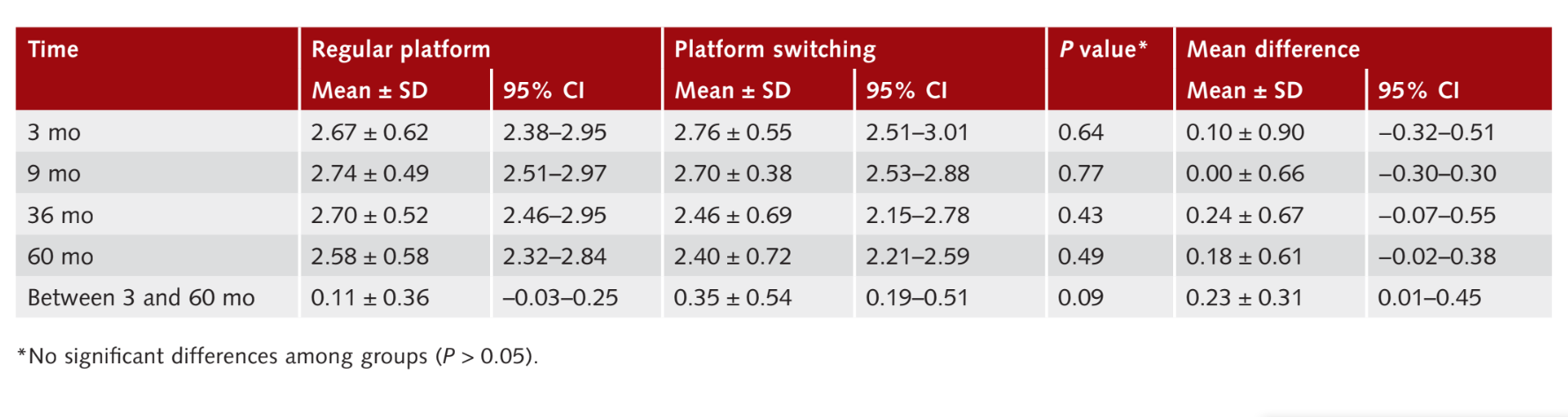
Измерение глубины карманов
Девять месяцев после нагрузки (1 год после установки имплантата) средние значения PPD составили 2.74 ± 0.49 мм (95% ДИ 2.51 до 2.97 мм) для RP имплантатов и 2.70 ± 0.38 мм (95% ДИ 2.53 до 2.88 мм) для PS имплантатов, без статистически значимой разницы между группами (P = 0.77). Тридцать шесть месяцев после нагрузки средние значения PPD составили 2.70 ± 0.52 мм (95% ДИ 2.46 до 2.95 мм) для группы RP и 2.46 ± 0.69 мм (95% ДИ 2.15 до 2.78 мм) для группы PS, без статистической разницы между группами (P = 0.43). Шестьдесят месяцев после нагрузки средние значения PPD составили 2.58 ± 0.58 мм (95% ДИ 2.32 до 2.84 мм) для группы RP и 2.40 ± 0.72 мм (95% ДИ 2.21 до 2.59 мм) для группы PS, без статистической разницы между группами (P 0.49). В течение всего периода наблюдения изменения значений PPD составили 0.1 ± 0.36 мм (95% ДИ −0.03 до 0.25 мм) в группе RP и 0.35 ± 0.54 мм (95% ДИ 0.19 до 0.51 мм) в группе PS (P = 0.09). Результаты суммированы в Таблице 3.
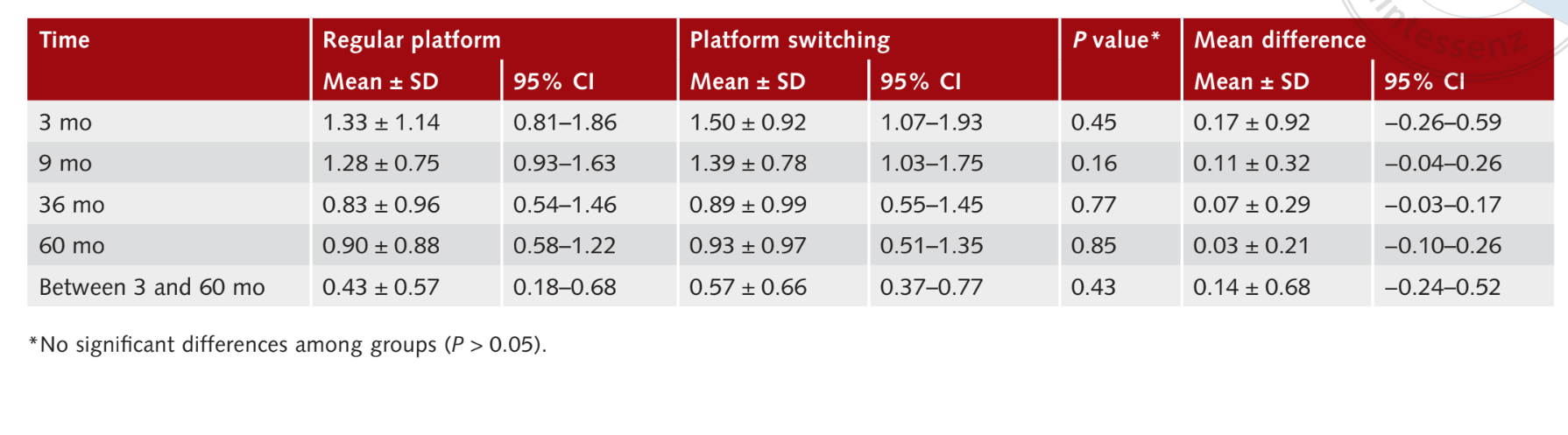
Кровоточивость при зондировании
Средние значения BOP, измеренные через 9 месяцев после нагрузки имплантами, составили 1.28 ± 0.75 (95% ДИ 0.93 до 1.63) для RP имплантов и 1.39 ± 0.78 (95% ДИ 1.03 до 1.75) для PS имплантов, без статистически значимой разницы между группами (P = 0.16). Через 60 месяцев после нагрузки средние значения BOP составили 0.90 ± 0.88 (95% ДИ 0.58 до 1.22) в группе RP и 0.93 ± 0.97 (95% ДИ 0.51 до 1.35) в группе PS, без статистической разницы (P = 0.85). В течение всего периода наблюдения изменения значений BOP составили 0.4 ± 0.57 (95% ДИ 0.18 до 0.68) в группе RP и 0.57 ± 0.66 (95% ДИ 0.37 до 0.77) в группе PS (P = 0.43). Результаты суммированы в Таблице 4.
Обсуждение
Целью данного исследования было сравнить клинические и радиографические результаты имплантов PS и RP. Нулевая гипотеза о том, что нет различий в клинических и радиографических результатах между имплантами PS и RP при замене одного зуба, была проверена против альтернативной гипотезы о наличии различий. В целом, результаты через 60 месяцев после нагрузки подтвердили два предварительных отчета через 9 и 36 месяцев после нагрузки14,15, демонстрируя, что импланты, восстановленные в соответствии с концепцией PS, показали аналогичные результаты с имплантами с совпадающими диаметрами импланта и абатмента (RP) при сравнении у одних и тех же пациентов.
Основным ограничением данного исследования было отсутствие сокрытия распределения. Конверт с кодом рандомизации был открыт до установки импланта, тогда как его следовало открыть при соединении с абатментом заживления. Однако это исследование было спланировано как рандомизированное контролируемое испытание с разделением рта, что позволило избежать возможного влияния биотипа пациента, плотности кости и/или образа жизни, и средний срок наблюдения (5 лет) был достигнут почти всеми участниками (один пациент выбыл). Другими ограничениями были то, что расчет размера выборки a priori не был выполнен, таким образом, небольшой размер выборки мог скрыть некоторые различия между группами.
Потеря краевой кости вокруг различных типов имплантатов происходит независимо от любых усилий, предпринятых для ее предотвращения. За последнее десятилетие было выдвинуто несколько теорий, поддерживающих идею о том, что резорбция кости вокруг имплантатов опосредована воспалительной реакцией кости, но эта тема все еще остается спорной. Недавно Эспозито и др. в рандомизированном клиническом испытании с постнагрузкой на 5 лет, сравнивающем имплантаты с внутренним соединением и переключенной платформой, а также внешними соединениями и без переключенной платформы, не обнаружили статистически значимых различий между двумя различными типами соединений и дизайна шейки. Батели и др. предложили, что для сохранения краевой кости вокруг зубных имплантатов необходим многофакторный подход. Другие результаты клинических исследований и систематических обзоров предполагают, что резорбция кости вокруг имплантатов может быть снижена путем смещения соединения имплантат–абатмент медиально от гребня кости. Атиех и др. в систематическом обзоре пришли к выводу, что имплантаты с переключенной платформой демонстрируют меньшую резорбцию кости по сравнению с имплантатами RP, и что степень краевой резорбции кости обратно коррелирует с несоответствием имплантат–абатмент. Некоторые недавние систематические обзоры показали менее оптимистичные результаты, предлагая осторожно интерпретировать эти результаты из-за гетерогенности включенных исследований. Соответственно, результаты настоящего рандомизированного контролируемого испытания подтвердили первые результаты на 9 и 36 месяцев после нагрузки, что имплантаты с PS, похоже, не сохраняют гребневую кость лучше по сравнению с имплантатами с традиционным соединением имплантат–абатмент.
Следует отметить, что большинство сравнительных исследований тестировали имплантаты широкого диаметра по сравнению с имплантатами обычного диаметра, оба восстановленные с использованием одинакового абатмента. В отличие от этого, в настоящем исследовании использовались имплантаты с идентичными диаметрами в дизайне split-mouth.
В первом предварительном отчете предполагалось, что имплантаты с одинаковым диаметром, установленные у каждого пациента, будут иметь схожие результаты; это было подтверждено в среднесрочном отчете и поддерживается дополнительными доказательствами в настоящем отчете, через 60 месяцев после нагрузки. Однако из-за ограничений исследования, а также благоприятных критериев включения, некоторые результаты не могли быть получены, такие как данные о ширине кости менее 6 мм и минимальном количестве кератинизированной десны в 5 мм. Еще одной причиной сопоставимых результатов между подходами может быть регулярное проведение процедур по уходу, что приводит к здоровым периимплантным тканям. Наконец, исследование было сосредоточено только на одиночных зубах, и соседние зубы могли способствовать сохранению периимплантных тканей. Таким образом, эффект концепции PS остается спорным.
Выводы
Клинические и радиографические результаты имплантатов, восстановленных согласно концепции PS, по сравнению с имплантатами, восстановленными с совпадающими диаметрами имплантата и абатмента, сопоставимы до 5 лет после нагрузки.
Ссылки
- Albrektsson T, Zarb G, Worthington P, Eriksson AR. Долгосрочная эффективность современных стоматологических имплантатов: обзор и предложенные критерии успеха. Int J Oral Maxillofac Implants 1986;1:11–12.
- Pozzi A, Agliardi EL, Tallarico M, Barlattani A. Клинические и радиологические результаты двух имплантатов с различными протезными интерфейсами и конфигурациями шейки: рандомизированное контролируемое клиническое исследование. Clin Implant Dent Relat Res 2014;16:96–106.
- Lindhe J, Meyle J; Группа D Европейского семинара по пародонтологии. Периимплантные заболевания: Консенсусный отчет Шестого Европейского семинара по пародонтологии. J Clin Periodontol 2008;35(8 Suppl):282–285.
- Lang NP, Berglundh T, от имени Рабочей группы 4 Седьмого Европейского семинара по пародонтологии. Периимплантные заболевания: где мы сейчас? Консенсус Седьмого Европейского семинара по пародонтологии. J Clin Periodontol 2011;38(Suppl 11):178–181.
- Rungsiyakull C, Rungsiyakull P, Li Q, Li W, Swain M. Влияние окклюзионного наклона и нагрузки на ремоделирование костной ткани нижней челюсти: исследование методом конечных элементов. Int J Oral Maxillofac Implants 2011;26:527–537.
- Grunder U, Gracis S, Capelli M. Влияние 3-D соотношения кости и имплантата на эстетику. Int J Periodontics Restorative Dent 2005;25:113–119.
- Assunção WG, Gomes EA, Rocha EP, Delben JA. Трехмерный анализ методом конечных элементов вертикального и углового несоответствия в фиксированных протезах на имплантатах. Int J Oral Maxillofac Implants 2011;26:788–896.
- Canullo L, Fedele GR, Iannello G, Jepsen S. Платформенное переключение и изменения уровня костной ткани: результаты рандомизированного контролируемого испытания. Clin Oral Implants Res 2010;21:115–121.
- Strietzel FP, Neumann K, Hertel M. Влияние платформенного переключения на изменения уровня костной ткани вокруг имплантатов. Систематический обзор и мета-анализ. Clin Oral Implants Res 2015;26:342–358.
- Lazzara RJ, Porter SS. Платформенное переключение: новая концепция в имплантной стоматологии для контроля уровней костной ткани после восстановления. Int J Periodontics Restorative Dent 2006;26:9–17.
- Gardner DM. Платформенное переключение как средство достижения эстетики имплантатов. N Y State Dent J 2005;71:34–37.
- Broggini N, McManus LM, Hermann JS и др. Периимплантное воспаление, определяемое интерфейсом имплант-абатмент. J Dent Res 2006;85:473–478.
- Al-Nsour MM, Chan H-L, Wang H-L. Влияние техники платформенного переключения на сохранение периимплантной костной ткани: систематический обзор. Int J Oral Maxillofac Implants 2012;27:138–145.
- Meloni SM, Jovanovic SA, Lolli FM и др. Платформенное переключение против обычных имплантатов: результаты через девять месяцев после нагрузки из рандомизированного контролируемого испытания. Eur J Oral Implantol 2014;7:257–265.
- Meloni SM, Jovanovic SA, Pisano M, Tallarico M. Платформенное переключение против обычных имплантатов: результаты через 3 года после нагрузки из рандомизированного контролируемого испытания. Eur J Oral Implantol 2016;9:381–390.
- Bragger U. Использование рентгеновских снимков для оценки успеха, стабильности и неудачи в имплантной стоматологии. Periodontolol 2000 1998;17:77–88.
- Pozzi A, Tallarico M, Moy PK. Результаты через три года после нагрузки рандомизированного контролируемого испытания, сравнивающего имплантаты с различными протезными интерфейсами и дизайном в частично беззубых задних челюстях. Eur J Oral Implantol 2000;7:47–61.
- Albrektsson T, Dahlin C, Jemt T, Sennerby L, Turri A, Wennerberg A. Является ли потеря костной ткани вокруг оральных имплантатов результатом вызванной реакции на инородное тело? Clin Implant Dent Relat Res 2014;16:155–165.
- Esposito M, Maghaireh H, Pistilli R и др. Стоматологические имплантаты с внутренними и внешними соединениями: результаты через 5 лет после нагрузки из прагматического многоцентрового рандомизированного контролируемого испытания. Eur J Oral Implantol 2016; 9: 129–141.
- Bateli M, Att W, Strub JR. Конфигурации шейки имплантата для сохранения уровня костной ткани: систематический обзор. Int J Oral Maxillofac Implants 2011;26:290–303.
- Enkling N, Jöhren P, Klimberg V, Bayer S, Mericske-Stern R, Jepsen S. Влияние платформенного переключения на уровни костной ткани вокруг имплантатов: рандомизированное клиническое испытание. Clin Oral Implants Res 2011;22:1185–1192.
- Atieh MA, Ibrahim HM, Atieh AH. Платформенное переключение для сохранения костной ткани вокруг стоматологических имплантатов: систематический обзор и мета-анализ. J Periodontol 2010;81:1350–1366.
