Роль новых гидрофильных поверхностей на раннюю частоту успеха и стабильность имплантатов: результаты через 1 год после нагрузки многоцентрового, сплит-майт, рандомизированного контролируемого испытания
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Цель: Сравнить ранние неудачи имплантации и стабильность имплантов одноэтапных имплантов Hiossen ET III с новой гидрофильной (NH) поверхностью по сравнению с имплантами Hiossen ET III с пескоструйной и кислотно-этидированной (SA) поверхностью через 1 год наблюдения.
Материалы и методы: Это исследование было спроектировано как сплит-майл, многоцентровое рандомизированное контролируемое испытание, направленное на сравнение имплантов с SA поверхностью (группа SA) и NH поверхностью (группа NH). Результаты включали выживаемость имплантов и протезов, осложнения, крутящий момент при установке импланта и значения коэффициента стабильности импланта (ISQ).
Результаты: Двадцать девять пациентов (средний возраст 59.9 ± 11.3 лет) были лечены и наблюдались в течение 1 года после нагрузки. Ни один пациент не выбыл. Пятьдесят восемь имплантов (29 группа SA и 29 группа NH) были установлены. Ни один имплант или протез не потерпели неудачу, и никаких осложнений не было зафиксировано в ходе наблюдения. Средний крутящий момент при установке составил 40.5 ± 3.23 (38.17–41.83) Ncm в группе SA и 40.48 ± 3.49 (38.02–41.98) Ncm в группе NH (p = 0.981). На второй неделе (T2) была статистически значимая разница с более высокими значениями в группе NH (p = 0.041). Аналогичные результаты были получены в верхней челюсти (p = 0.045), но не в нижней челюсти (p = 0.362). Была найдена положительная корреляция между начальным крутящим моментом и ISQ с более высоким значением в группе NH (0.73 против 0.66).
Выводы: Имплантаты NH являются жизнеспособной альтернативой поверхности SA, так как, похоже, они избегают снижения ISQ в период ремоделирования кости.
Введение
Современная стоматология предлагает отличное решение для устранения эдентулизма у пациентов с помощью зубных имплантатов. Показано, что зубные имплантаты имеют долгосрочные успешные результаты, представляя собой жизнеспособный вариант для клиницистов, чтобы реабилитировать полностью или частично беззубых пациентов как с фиксированными, так и с съемными решениями. Альбректссон и др. ввели концепцию равновесия инородного тела, применяемую к остеоинтеграции титановый зубных имплантатов. Это равновесие представляет собой баланс иммунно-опосредованной реакции на инородное тело во время биологической интеграции зубных имплантатов в кость. Когда это равновесие смещается в неблагоприятную сторону, может произойти потеря перимплантной кости. Тем не менее, неудачи имплантатов все же могут происходить у ограниченного числа компрометированных пациентов из-за недостатка понимания связанных факторов риска.
Причины потери костной ткани вокруг зубных имплантатов и последующего отказа имплантата могут быть различными и связаны с макро-/микродизайном имплантата и химическим составом поверхности, биологическими проблемами, качеством кости, хирургической техникой, факторами, связанными с хозяином, и иатрогенными факторами. Отказ зубного имплантата классифицируется как ранний или поздний в зависимости от времени его возникновения. Ранние отказы зубных имплантатов происходят до подключения абатмента, в результате недостатка интеграции с костью, а поздние отказы происходят после протезирования, в результате перипротезного воспаления, вызванного налетом, и/или из-за перегрузки прикуса. Оссеоинтеграция вокруг титановый имплантатов является сложным биологическим феноменом, который еще не полностью понят. Тем не менее, модификации поверхности титановый зубных имплантатов играют важную роль в улучшении оссеоинтеграции. С целью ускорения и улучшения процесса оссеоинтеграции было предложено множество обработок поверхности имплантатов. Модификация поверхности в основном направлена на химическое улучшение шероховатости зубных имплантатов для увеличения адекватного биологического ответа между живыми тканями и зубными имплантатами. Более того, помимо улучшения оссеоинтеграции, эти модификации поверхности имплантатов показали увеличение жизнеспособности клеток и биосовместимости.
Это топографическое изменение достигается с помощью кислотных обработок, пескоструйной обработки или различных механизмов окисления.
Зубные имплантаты с пескоструйной кислотно-этидированной поверхностью (SA) имеют макрошероховатость, достигнутую с помощью абразивных частиц (пескоструйная обработка), и микропоры, полученные путем кислотного травления, для улучшения остеоинтеграции. Поверхность SA обеспечивает подходящее пространство для адгезии, пролиферации и дифференцировки остеобластов. Этот результат можно дополнительно улучшить, используя процесс двойного травления, увеличивающий поверхность, доступную для нового роста кости, что значительно улучшает механическую фиксацию. Чем больше зубных имплантатов используется в повседневной стоматологической практике, тем больше клинический интерес к быстрой интеграции имплантатов с костью для их функциональности. В последнее десятилетие было постоянное стремление улучшить поверхность имплантата, чтобы ускорить процесс остеоинтеграции и улучшить его качество. Сегодня цель состоит в том, чтобы сократить период заживления с 6-8 недель до 3-4 недель во всех показаниях. Эти усилия сосредоточены на улучшении интерфейса кости и имплантата химически (путем внедрения неорганических фаз на или в слой оксида титана) или физически (путем увеличения уровня шероховатости). Хотя более короткий период заживления был представлен во многих экспериментальных и клинических исследованиях с использованием пескоструйных, крупнозернистых и кислотно-этидированных (SLA) поверхностей, модификация этой поверхности, похоже, демонстрирует более сильный ответ кости, чем ее предшественник.
Целью этого рандомизированного контролируемого испытания с разделением челюсти было сравнить ранние неудачи имплантации и стабильность имплантов одноэтапных имплантов Hiossen ET III с новой гидрофильной (NH) поверхностью по сравнению с имплантами Hiossen ET III с хорошо известной SA поверхностью через 1 год наблюдения. Нулевая гипотеза заключалась в том, что между группами нет различий. Нулевая гипотеза была проверена по сравнению с альтернативной гипотезой о различиях между ними. Предварительный отчет из одного центра был опубликован. Следующее испытание было зарегистрировано в соответствии с руководящими принципами заявления CONSORT (http://www.consort-statement.org/).
Материалы и методы
Это исследование было спроектировано как рандомизированное контролируемое испытание с разделением челюсти, параллельных групп с двумя группами и независимой оценкой результатов, когда это возможно, проведенное в четырех центрах с ноября 2017 года по май 2018 года. Протокол был зарегистрирован в clinicaltrial.gov (NCT03649100). Соблюдалась декларация Хельсинки 2013 года. Исследование было проведено после получения одобрения от Институционального наблюдательного совета Университета Альдент, Тирана, Албания (март 2018 года). Все хирургические и протезные процедуры выполнялись одним опытным клиницистом в каждом центре.
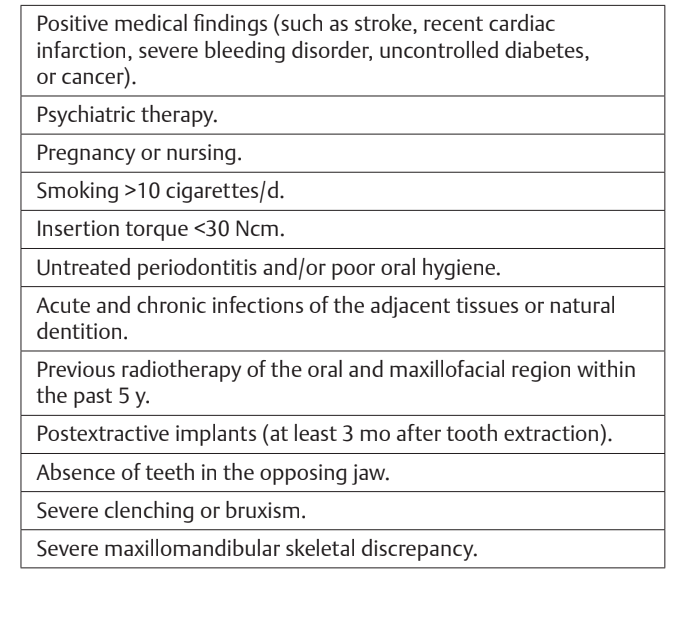
В исследование были включены все здоровые пациенты в возрасте 18 лет и старше, которым требовалось как минимум два импланта для восстановления с фиксированной реставрацией на имплантах, с индексом кровоточивости и индексом налета в полости рта ≤25%, с достаточным количеством костной ткани для установки имплантов длиной не менее 11,5 мм и шириной кости не менее 6-8 мм для установки импланта Hiossen ET III с обычной платформой (Deutsche Osstem GmbH, Эшборн, Германия). Критерии исключения приведены в таблице 1.
Пациенты были проинформированы о клинических процедурах, материалах, которые будут использоваться, преимуществах, потенциальных рисках и возможных осложнениях, а также о любых последующих оценках, необходимых для клинического исследования. Пациенты должны были подписать информированное согласие перед включением в исследование.
Однократная доза антибиотика (2 г амоксициллина и клавулановой кислоты или 600 мг клиндамицина, если пациенты были аллергичны к пенициллину) была введена профилактически за 1 час до операции. Пациенты полоскали рот 0,2% хлоргексидином в течение 1 минуты. Местная анестезия будет проведена с использованием 4% раствора артикаина с эпинефрином 1:100,000 (Ubistesin; 3M Italia, Милан, Италия). Имплантаты были установлены в запланированные анатомические участки с использованием безфлапного или мини-флапного подхода. Плотность кости оценивалась в соответствии с классификацией Лекхолма и Зарба в ходе сверления, основываясь на опыте и суждении клинициста. Место для имплантации готовилось одновременно, в соответствии с протоколом сверления, рекомендованным производителем (устанавливались на 0,5 мм подкресельном уровне или глубже в зависимости от качества кости и толщины мягких тканей). Имплантаты с SA поверхностью (группа SA) или имплантаты с SA поверхностью с новоразработанным биоразлагаемым апатитным нанопокрытием (группа NH) были рандомизированы после подготовки места для имплантации, незадолго до установки имплантата. Имплантаты, используемые в каждой группе, были идентичны, за исключением обработки поверхности. Имплантаты были установлены в соответствии с одностадийным протоколом.
Послеоперационное обезболивание проводилось с использованием ибупрофена 600 мг, который назначался дважды в день в течение 2 дней после операции, а затем при необходимости. Периапикальные рентгенограммы были сделаны с помощью индивидуального держателя при установке имплантата, при доставке окончательного протеза (Рис. 1 и 2), а затем ежегодно (Рис. 3 и 4). Через два-три месяца после установки имплантатов пациенты получают одиночные реставрации на винтовом креплении.
Критериями оценки были показатели выживаемости имплантов и протезов, любые биологические или механические осложнения на имплантах, которые произошли в течение всего периода наблюдения, крутящий момент при установке импланта и коэффициент стабильности имплантата (ISQ).
Уровень успеха имплантатов и протезов оценивался независимым оценщиком (E.X.). Имплантат считался неудачным, если он проявлял подвижность, оцененную после периода остеоинтеграции путем постукивания или покачивания головки имплантата металлическими ручками двух инструментов, прогрессирующей маргинальной потерей костной ткани или инфекцией, или любыми механическими осложнениями, делающими имплантат непригодным для использования, хотя он все еще оставался механически стабильным в кости. Протез считался неудачным, если его нужно было заменить другим протезом.
Биологические (боль, отек, гнойные выделения и т.д.) и/или механические (ослабление винта, перелом каркаса, облицовочного материала и т.д.) осложнения возникали в течение периода наблюдения. Осложнения оценивались и лечились тем же хирургом (M.T.).
Крутящий момент вставки фиксировался при установке имплантата тем же хирургом (M.T.) с использованием хирургического блока iChiropro (Bien-Air, Bienne, Switzerland).
Значения крутящего момента вставки имплантатов измерялись и фиксировались при установке имплантата, с использованием того же хирургического блока, который использовался для установки имплантатов.
ISQ измерялся и записывался с использованием умного пега (Тип 47 код 100478, Osstell, Гетеборг, Швеция), подключенного к имплантатам, и устройства Osstell Mentor (Osstell). Измерения проводились при установке имплантата и каждую неделю в течение 8 недель после установки имплантата. В случае значения ISQ <55 или при подвижности имплантата, заживляющий абатмент заменялся на крышечный винт, и имплантат оставлялся для заживления под десной как минимум на 6 недель.
Слепой оценщик результатов собрал данные (E.X.) в соответствии с ранее опубликованным исследованием.
Была создана заранее сгенерированная случайная таблица, состоящая из рандомизированной последовательности последовательных номеров, соответствующих двум различным процедурам в группе A или группе B, с использованием генератора случайных чисел pro 1.91 для Windows (Segobit Software; www.segobit.com). Непрозрачные конверты, содержащие коды рандомизации, были пронумерованы последовательно и запечатаны. В соответствии с заранее сгенерированным списком независимый консультант, не участвовавший ранее в испытании, подготовил все конверты, которые затем были открыты сразу после подготовки мест для имплантации. Место одно определялось как место с меньшим номером секстанта и наиболее мезиально. Пациенты и статистик были слепы, в то время как доктор нет из-за различной непрозрачности поверхности имплантата. Данные пациентов собирались в таблице Excel (Microsoft), которая отражала параметры в записях пациентов. Данные были экспортированы в программное обеспечение SPSS для Mac OS X (версия 22.0; SPSS, Чикаго, Иллинойс, Соединенные Штаты) для статистического анализа. Описательный анализ проводился для числовых параметров с использованием средних значений и стандартных отклонений (95% доверительный интервал). Осложнения и неудачи сравнивались с использованием точного теста Фишера. Сравнения между группами (SA против NH) и между челюстями (верхняя челюсть против нижней челюсти) проводились с помощью непарного t-теста, в то время как сравнение между исходным уровнем (T0) и последним наблюдением (T8) проводилось с помощью парных t-тестов для выявления любых изменений в ходе наблюдения. Коэффициент корреляции Пирсона использовался для оценки корреляции между крутящим моментом при установке имплантата и значением ISQ через 8 недель после установки имплантата. Все статистические сравнения были двусторонними и проводились на уровне значимости 0.05. Пациент использовался в качестве статистической единицы анализа.
Результаты
Только три из четырех центров смогли набрать и лечить пациентов в соответствии с протоколом исследования. Изначально было отобрано 39 пациентов, но шесть пациентов не были включены, потому что у них не было достаточного объема костной ткани для установки имплантатов длиной 11,5 мм и диаметром 4 мм; двое пациентов не были включены, потому что не хотели участвовать в исследовании; а еще двое пациентов были заядлыми курильщиками. В итоге 29 пациентов (22 женщины и 7 мужчин, со средним возрастом при установке имплантатов 59,9 ± 11,3 года) были лечены в соответствии с назначенными вмешательствами и наблюдались до 1 года после нагрузки. Ни один пациент не выбыл. Всего было установлено 58 имплантатов (29 с SA-поверхностью и 29 с SA-поверхностью с новоразработанным биоразлагаемым апатитным нанопокрытием). Восемнадцать пациентов были реабилитированы в верхней челюсти и 11 в нижней челюсти. Через год после нагрузки ни один имплантат и ни одна протез не потерпели неудачу. Две недели после установки имплантатов два имплантата Hiossen ET III SA показали небольшую подвижность с значениями ISQ ниже 55 (49 и 51 соответственно). Восстанавливающие абатменты были заменены на крышечные винты, и имплантаты оставили заживать без вмешательства до 8 недель после их установки. Тем не менее, статистически значимой разницы не было достигнуто (p = 0.491). В обоих имплантатах восстанавливающие абатменты были заменены на крышечный винт, и имплантаты оставили заживать подводно в течение 6 недель (до 8 недель после установки имплантатов).
Средний крутящий момент вставки варьировался от 35.0 до 45.0 Нсм (среднее значение 40.5 ± 3.23 [38.17–41.83] Нсм в группе SA и 40.48 ± 3.49 [38.02–41.98] Нсм в группе NH). Разница между группами не была статистически значимой (p = 0.981).
Сравнение значений ISQ представлено в Таблице 2 и на рис. 5–7.
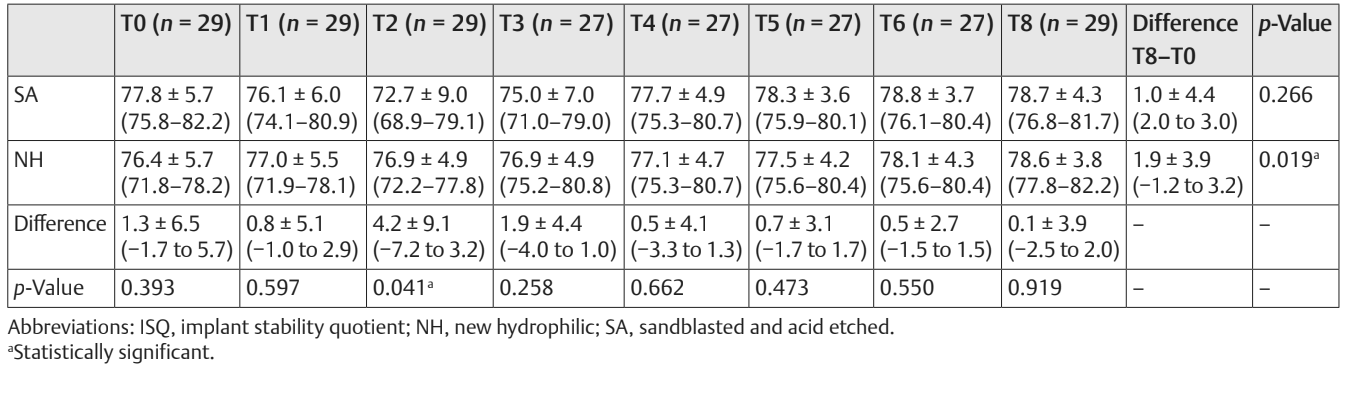
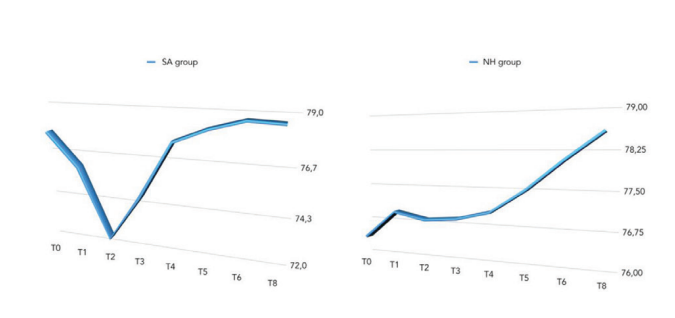
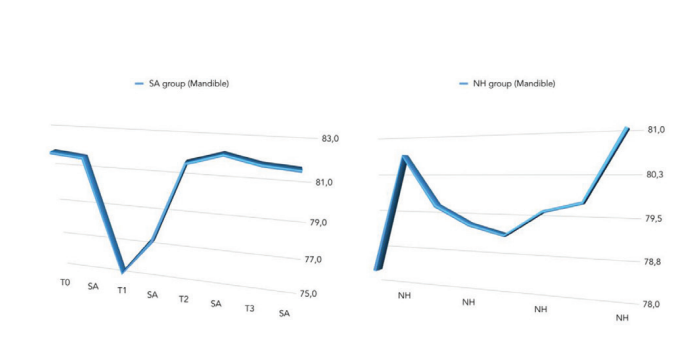
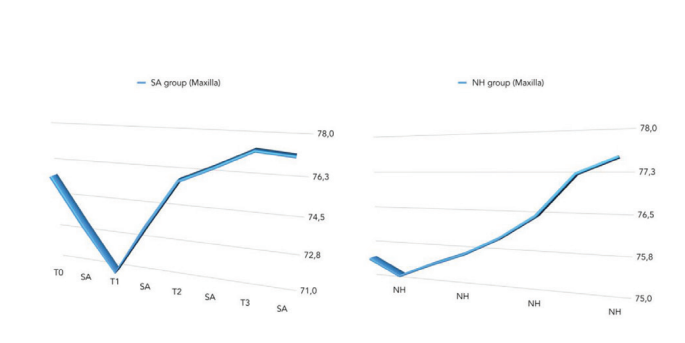
На второй неделе после установки имплантата (T2) была обнаружена статистически значимая разница между группами с более высокими значениями в группе NH (p = 0.041). Подобные результаты были получены в верхней челюсти (p = 0.045), но не в нижней челюсти (p = 0.362). В целом, значения ISQ улучшились в обеих группах на протяжении всего периода наблюдения (8 недель), с статистически значимой разницей в группе NH (p = 0.019), но не в группе SA (p = 0.266). Была обнаружена положительная корреляция между начальным крутящим моментом вставки и ISQ с более высоким значением в группе NH (0.73 против 0.66). Корреляция была сильнее в нижней челюсти (SA = 0.71; NH = 0.86) по сравнению с верхней челюстью (SA = 0.52; NH = 0.55).
Обсуждение
В настоящее время прилагаются значительные усилия для улучшения интерфейса кости и импланта, модифицируя поверхность зубных имплантов для улучшения интеграции кости и сокращения времени этого процесса, чтобы помочь клиницистам в лечении беззубых пациентов. Именно в этом контексте было ориентировано наше исследование, фактически это рандомизированное контролируемое исследование с использованием метода "разделенного рта" было направлено на сравнение раннего отказа импланта и стабильности импланта одноэтапных имплантов Hiossen ET III с их NH поверхностью, по сравнению с имплантами Hiossen ET III с хорошо известной SA поверхностью в течение 1 года наблюдения. Нулевая гипотеза о отсутствии различий была частично отвергнута в пользу альтернативной гипотезы о различиях между группами.
В целом, средний ISQ улучшился в обеих группах в течение 8 недель наблюдения, но значения были статистически значимо различны только в группе NH (p = 0.019). Причиной этого отчасти было то, что через 2 недели после установки имплантов среднее значение ISQ было статистически значимо выше в группе NH по сравнению с группой SA (p = 0.041). Возможным объяснением могут быть неожиданные значения ISQ в группе имплантов SA, вызванные двумя имплантами, которые показали значения <55 с незначительной подвижностью импланта. В результате импланты были оставлены для заживления под водой в течение следующих 6 недель. Тем не менее, можно предположить, что импланты с гидрофильной поверхностью (NH) кажутся уменьшающими осложнения, избегая падения ISQ во время фазы ремоделирования, что соответственно позволяет получить преимущества при немедленной нагрузке, плохом качестве кости, послеэкстракционной ситуации и в области верхней челюсти. Основные ограничения настоящего рандомизированного контролируемого исследования - это небольшой размер выборки и краткосрочное наблюдение. К сожалению, один центр не участвовал в исследовании, что способствовало небольшому размеру выборки.
Постоянные усилия стоматологических компаний по улучшению интерфейса между костью и поверхностью имплантата для ускорения процесса остеоинтеграции были предложены исследователями и компаниями по производству зубных имплантатов, и данные, изложенные в этой статье, особенно для поверхности NH, подтверждают возможность сокращения времени в имплантационной терапии. Сегодня первичная стабильность имплантата и отсутствие микродвижений по-прежнему остаются двумя основными предпосылками для достижения стабильной остеоинтеграции и достижения высоких долгосрочных показателей успеха. Напротив, если в течение первого периода заживления имплантата первичная стабильность недостаточна, может произойти ранний отказ имплантата.
В настоящем исследовании была обнаружена аналогичная статистическая значимость в верхней челюсти (p = 0.045), но не в нижней челюсти (p = 0.362). Чтобы минимизировать риск раннего отказа имплантата, в последние десятилетия было предложено держать имплантаты без нагрузки в течение периода заживления от 3 до 4 месяцев в нижних челюстях и от 6 до 8 месяцев в верхних челюстях. В настоящее время, чем больше имплантаты используются в клинической практике, тем больше клинический интерес к быстрому интегрированию имплантатов с костью для их функциональности. Постоянные усилия по улучшению интерфейса между костью и поверхностью имплантата для ускорения процесса остеоинтеграции были предложены исследователями и компаниями по производству зубных имплантатов, модифицируя шероховатость и топографию поверхности имплантата. Чтобы лучше понять шероховатость зубного имплантата, ее обычно делят, в зависимости от размеров измеряемых поверхностных характеристик, на макро-, микро- и нано-шероховатость. Все эти виды шероховатости и топографии имеют прямые последствия для реакции кости в течение периода заживления тканей вокруг зубных имплантатов. В настоящее время хорошо известно, что шероховатость имплантата улучшает остеоинтеграцию, и большинство типов имплантатов подвергаются пескоструйной обработке и/или кислотному травлению для увеличения текстуры их поверхности. Более того, нано-шероховатость играет основную роль в адсорбции белков, адгезии остеобластических клеток и, таким образом, в скорости остеоинтеграции. Кроме того, Шварц и др. показали, что гидрофильные поверхности усиливают процесс ангиогенеза, когда происходят ранние стадии остеоинтеграции. На самом деле, быстрая васкуляризация, похоже, полезна для формирования кости, поскольку было замечено, что остеогенные клетки возникают из перицитов, прилегающих к мелким кровеносным сосудам. В обзоре Веннерберга и др. было найдено немного клинических данных, чтобы четко указать на предпочтение SLActive перед имплантатом SLA. На 1-летнем наблюдении была высокая выживаемость (100% для SLActive против 96% для имплантатов SLA) и низкая потеря кости на гребне <0.4 мм в обеих группах без значительной разницы.
Недавняя литература предполагает, что оптимальный крутящий момент при установке может составлять около 30 Нсм для достижения успешной и долговечной остеоинтеграции, что также достаточно для обеспечения как традиционной, так и немедленной окклюзионной нагрузки на зубные имплантаты. Причина, по которой компании по производству зубных имплантатов и исследователи сосредоточены на улучшении дизайна имплантатов и модификации поверхности, заключается в том, чтобы помочь как клиницистам, так и пациентам ускорить время имплантации и протезирования. По тем же причинам исследователи сосредоточены на цифровой стоматологии и разработке рекомендаций в области имплантологии.
В настоящем исследовании была обнаружена положительная корреляция между начальным крутящим моментом при установке и ISQ с более высоким значением в группе NH (0.73 против 0.66). Корреляция была сильнее в нижней челюсти (SA = 0.71; NH = 0.86) по сравнению с верхней челюстью (SA = 0.52; NH = 0.55). Клиническое значение этого рандомизированного контролируемого испытания может заключаться в том, что имплантаты с модификацией поверхности NH могут быть важным вариантом при лечении пациентов, особенно когда время нагрузки имеет решающее значение. Учитывая положительную корреляцию между высоким крутящим моментом при установке и увеличенным уровнем ISQ, а также лучшие результаты в верхней челюсти, эта обработка поверхности может быть жизнеспособным вариантом лечения в случае немедленной нагрузки, плохого качества кости (например, задняя верхняя челюсть), постэкстракционных имплантатов или пациентов с высоким риском, таких как иммунокомпрометированные пациенты или тяжелые курильщики.
Выводы
Учитывая ограничения этого многоцентрового, сплит-методом, рандомизированного контролируемого исследования, имплантаты NH являются жизнеспособной альтернативой поверхности SA, так как они, похоже, избегают падения ISQ в процессе ремоделирования. Это может быть полезно при немедленной нагрузке, плохом качестве кости, постэкстракционных имплантатах, курении и иммуносупрессии. Необходимы дальнейшие исследования для увеличения числа пациентов и долгосрочного наблюдения.
Марко Талларико, Никола Балдини, Фульвио Гатти, Маттео Мартинолли, Эрта Ханари, Сильвио Марио Мелони, Червино Габриэле, Лумбау Ауреа Иммаколата
Ссылки
- Албректссон Т, Хрцанович Б, Остман П-О, Сеннерби Л. Начальные и долгосрочные реакции кортикальной кости на современные зубные имплантаты. Периодонтология 2000 2017;73(1):41–50
- Триндаде Р, Албректссон Т, Тенгвалл П, Веннерберг А. Реакция на инородное тело к биоматериалам: механизмы накопления и разрушения остеоинтеграции. Клинические имплантные зубные исследования 2016;18(1):192–203
- Албректссон Т, Канулло Л, Кокран Д, Де Бруйн Х. «Периимплантит»: осложнение инородного тела или искусственная «болезнь». Факты и вымысел. Клинические имплантные зубные исследования 2016;18(4):840–849
- Албректссон Т, Дахлин С, Емт Т, Сеннерби Л, Турри А, Веннерберг А. Является ли потеря краевой кости вокруг зубных имплантатов результатом провоцированной реакции на инородное тело? Клинические имплантные зубные исследования 2014;16(2):155–165
- Албректссон Т, Донос Н; Рабочая группа 1. Выживаемость имплантатов и осложнения. Третья конференция консенсуса EAO 2012. Клинические исследования зубных имплантатов 2012;23(доп. 6):63–65
- Чиччу М, Браманти Э, Матачена Г, Гуглиельмино Э, Ризитано Г. Оценка FEM цементированных и винтовых зубных имплантатов с одиночной коронкой. Международный журнал клинической и экспериментальной медицины 2014;7(4):817–825
- Браманти Э, Червино Г, Лауритано Ф и др. Анализ FEM и Вона Мизеса структурных элементов протезов: оценка различных применяемых материалов. ScientificWorldJournal 2017;2017:1029574
- Анил С, Ананд ПС, Альгхамди Х, Янсен ЯА, Повышение поверхности зубных имплантатов и остеоинтеграция. В: Туркйилмез И, ред. Имплантология — быстро развивающаяся практика. Риека, Хорватия: InTech; 2011 83–87
- Чиччу М, Ризитано Г, Майорана К, Франческини Г. Параметрический анализ прочности в системе «Торонто» остеосно-протезирования. Минерва стоматол 2009;58(1-2):9–23
- Талларико М, Балдини Н, Мартинолли М и др. Влияет ли новая гидрофильная поверхность на раннюю частоту успеха и стабильность имплантата в период остеоинтеграции? Предварительные результаты через четыре месяца из сплит-метода, рандомизированного контролируемого испытания. Eur J Dent 2019;13(1):95–101
- Талларико М, Ваккарелла А, Марци ГК. Клинические и радиологические результаты одностадийной и двухстадийной установки имплантатов: результаты через 1 год рандомизированного клинического испытания. Eur J Oral Implantology 2011;4(1):13–20
- Ле Гюэнек Л, Соуэидан А, Лайроль П, Амурик Y. Обработка поверхностей титановыми зубными имплантатами для быстрой остеоинтеграции. Зубные материалы 2007;23(7):844–854
- Хрцанович БР, Албректссон Т, Веннерберг А. Причины неудач зубных имплантатов. Журнал оральной реабилитации 2014;41(6):443–476
- Ренверт С, Полизойс И, Клаффи Н. Как характеристики поверхности имплантата влияют на периимплантные заболевания? Журнал клинической периодонтологии 2011;38(доп. 11):214–222
- Дохан Эренфест ДМ, Коэльо ПГ, Кан БС, Сул ЙТ, Албректссон Т. Классификация остеоинтегрированных поверхностей имплантатов: материалы, химия и топография. Тенденции биотехнологий 2010;28(4):198–206
- Ксереуб М, Камилери Дж, Аттард НД. Систематический обзор современных материалов покрытия зубных имплантатов и новых технологий покрытия. Международный журнал протезирования 2015;28(1):51–59
- Пиаттелли А, Коси Ф, Скарану А, Триси П. Локализованная хроническая гнойная инфекция кости как следствие периимплантита на зубном имплантате с покрытием гидроксиапатитом. Биоматериалы 1995;16(12):917–920
- Пейн АГ, Тос-Смит А, Дункан УД, Кумара Р. Обычная и ранняя нагрузка несоединенных имплантатов ITI, поддерживающих нижние съемные протезы. Клинические исследования зубных имплантатов 2002;13(6):603–609
- Кокран ДЛ, Шенк РК, Лусси А, Хиггинботтом ФЛ, Бусер Д. Реакция кости на разгруженные и нагруженные титановыми имплантатами с пескоструйной и кислотно-этчированной поверхностью: гистометрическое исследование на собачьей челюсти. Журнал биомедицинских материалов 1998;40(1):1–11
- Кхандельвал Н, Оутс ТВ, Варгас А. Александр ПП, Скулфилд ДжД, Алекс МакМахан С. Обычные SLA и химически модифицированные SLA имплантаты у пациентов с плохо контролируемым диабетом 2 типа — рандомизированное контролируемое испытание. Клинические исследования зубных имплантатов 2013;24(1):13–19
- Бране Марк ПИ, Ханссон БО, Аделл Р и др. Остеоинтегрированные имплантаты в лечении беззубой челюсти. Опыт за 10 лет. Скандинавский журнал пластической реконструктивной хирургии Дополнение 1977;16:1–132
- Макари К, Ребауди А, Саммартино Г, Нааман Н. Первичная стабильность имплантата, определяемая анализом резонансной частоты: корреляция с моментом вставки, гистологическим объемом кости и торсионной стабильностью через 6 недель. Имплантология 2012;21(6):474–480
- Смуклер-Монклер С, Салама Х, Рейнгеуиртц Й, Дюбруиль ЖХ. Время нагрузки и влияние микродвижения на интерфейс кость-зубной имплантат: обзор экспериментальной литературы. Журнал биомедицинских материалов 1998;43(2):192–203
- Лиубавина-Хак Н, Ланг НП, Карринг Т. Значение первичной стабильности для остеоинтеграции зубных имплантатов. Клинические исследования зубных имплантатов 2006;17(3):244–250
- Бране Марк ПИ, Аделл Р, Брейне У, Ханссон БО, Линдстром Й, Ольссон А. Внутрикостная анкеровка зубных протезов. I. Экспериментальные исследования. Скандинавский журнал пластической реконструктивной хирургии 1969;3(2):81–100
- Талларико М, Ваккарелла А, Марци ГК, Альвьяни А, Кампана В. Проспективное клиническое испытание с контролем, сравнивающее 1- и 2-стадийные имплантаты Nobel Biocare TiUnite: анализ резонансной частоты, оцененный с помощью Osstell Mentor во время интеграции. Квинтэссенция Интернационал 2011;42(8):635–644
- Юнкер Р, Димакос А, Тонейк М, Янсен ЯА. Влияние покрытий и состава поверхности имплантата на интеграцию кости: систематический обзор. Клинические исследования зубных имплантатов 2009;20(доп. 4):185–206
- Рупп Ф, Лян Л, Гейс-Герсторфер Дж. Шейделер Л, Хюттиг Ф. Характеристики поверхности зубных имплантатов: обзор. Зубные материалы 2018;34(1):40–57
- Хейтц-Мейфилд ЛДж. Периимплантные заболевания: диагностика и индикаторы риска. Журнал клинической периодонтологии 2008;35(доп. 8):292–304
- Брасерес И, Алава И, Оñате И и др. Улучшенная остеоинтеграция в зубных имплантатах, обработанных ионной имплантацией. Технология покрытия поверхности 2002;158–159:28–32
- Шварц Ф, Хертен М, Загер М, Виланд М, Дард М, Беккер Дж. Гистологический и иммуногистохимический анализ начальной и ранней остеоинтеграции на химически модифицированных и обычных SLA титановыми имплантатами: предварительные результаты пилотного исследования на собаках. Клинические исследования зубных имплантатов 2007;18(4):481–488
- Лонг МВ, Робинсон ДЖ, Эшкрафт ЭА, Манн КГ. Регуляция остеопроникаторных клеток, полученных из человеческого костного мозга, остеогенными факторами роста. Журнал клинических исследований 1995;95(2):881–887
- Рейли ТМ, Селдес Р, Лучетти В, Брайтон КТ. Сходства в фенотипическом выражении перицитов и костных клеток. Клинические ортопедические и связанные исследования 1998;(346):95–103
- Мерфи М, Вальчак МС, Томас АГ, Силикас Н, Бернер С, Линдсей Р. Оптимизация производительности зубных имплантатов: характеристика поверхности материалов Ti и TiZr. Зубные материалы 2017;33(1):43–53
- Веннерберг А, Галли С, Албректссон Т. Текущие знания о гидрофильной и наноструктурированной поверхности SLActive. Клинические косметические исследования в стоматологии 2011;3:59–67
- Смитс Р, Штадлингер Б, Шварц Ф и др. Влияние модификаций поверхности зубных имплантатов на остеоинтеграцию. BioMed Res Int 2016;2016:6285620
- Фаот Ф, Биеманн АМ, Шустер АД и др. Влияние момента вставки на клинические и биологические результаты до и после нагрузки нижних имплантатов, удерживаемых протезами, в атрофических беззубых челюстях. BioMed Res Int 2019;2019:8132520
- Херфорд АС, Миллер М, Лауритано Ф, Червино Г, Сигнорино Ф, Майорана К. Использование виртуального хирургического планирования и навигации в лечении травм орбиты. Китайский журнал травматологии 2017;20(1):9–13
- Стачи Ч, Ломбарди Т, Кусимано П и др. Костные скребки против пьезоэлектрической хирургии в боковой антростомии для повышения уровня синуса. Журнал черепно-лицевой хирургии 2017;28(5):1191–1196
- Ло Джудиче Г, Чиччу М, Червино Г, Лизио А, Виско АМ. Текучая смола и краевой зазор на медиальной трети зуба, затрагивающей эмаль и корневой цемент: SEM-оценка двух техник реставрации. Индийский журнал стоматологических исследований 2012;23(6):763–769
- Червино Г, Терранова А, Бригуджоли Ф и др. Диабет: качество жизни, связанное со здоровьем полости рта, и оральные изменения. BioMed Res Int 2019;2019:5907195
- Ло Джудиче Г, Липари Ф, Лизио А, Червино Г, Чиччу М. Техника повторного прикрепления фрагмента зуба на многократно травмированном зубе. Журнал консервативной стоматологии 2012;15(1):80–83
- Червино Г, Фиорилло Л, Херфорд АС и др. Молекулярные биомаркеры, связанные с оральной карциномой: оценка результатов клинических испытаний в литературном обзоре. Маркеры заболеваний 2019;2019:8040361
- Поззи А, Талларико М, Мой ПК. Немедленная нагрузка с использованием нового имплантата с переменной резьбой, внутренним конусным соединением и смещением платформы: трехлетние результаты проспективного когортного исследования. Eur J Oral Implantol 2015;8(1):51–63
- Червино Г, Фиорилло Л, Арзуканиян АВ, Спагнуоло Г, Чиччу М. Цифровой рабочий процесс реставрации зубов: цифровой дизайн улыбки от эстетики до функции. Журнал стоматологии (Базель) 2019;7(2):28
- Лаворна Л, Червино Г, Фиорилло Л и др. Надежность виртуального протезирования, реализованного с помощью 2D и 3D фотосъемки: экспериментальное исследование точности различных цифровых систем. Международный журнал экологических исследований и общественного здоровья 2019;16(24):5139
- Лайно Л, Чиччу М, Фиорилло Л и др. Хирургический риск у пациентов с коагулопатиями: рекомендации для гемофиликов при оро-мандибулярной хирургии. Международный журнал экологических исследований и общественного здоровья 2019;16(8):1386
