Пятилетнее проспективное исследование неудач имплантации и ремоделирования краевой кости с использованием имплантатов уровня кости с пескоструйной/кислотно-этчированной поверхностью и конусным соединением
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Цель: Целью данного проспективного исследования серии случаев было сообщить о выживаемости имплантатов и ремоделировании краевой кости, ожидаемом через 5 лет после нагрузки с использованием зубных имплантатов, установленных в повседневной практике.
Материалы и методы: Это исследование было спроектировано как открытая когорта, проспективная оценка серии случаев. Любой частично или полностью беззубый пациент, запланированный на получение как минимум одного имплантата на уровне кости, считался подходящим для этого исследования. Основными исходными показателями были: кумулятивная выживаемость имплантатов и протезов, а также любые осложнения, возникшие до 5-летнего наблюдения. Вторичными исходными показателями были: толщина биотипа десны, крутящий момент при установке имплантата, коэффициент стабильности имплантата и краевая потеря кости (КПК).
Результаты: Девяносто последовательных пациентов (34 мужчины и 56 женщин, в возрасте от 24 до 81 года [в среднем: 53.2 ± 15.4]) с 243 установленными имплантатами наблюдались в течение как минимум 5 лет после нагрузки (в среднем: 65.4 ± 3.1 месяца; диапазон от 60 до 72). На 1-летнем наблюдении не было зарегистрировано ни одного выбытия, но 17 пациентов (18.9%) с 18 реставрациями (12.6%), выполненными на 34 имплантатах (14%), были потеряны на 5-летнем обследовании. На 5-летнем обследовании шесть имплантатов потеряли остеоинтеграцию (97.5%). В тот же период четыре протеза потерпели неудачу (97.2%). Пять осложнений было зарегистрировано у пяти разных пациентов (процент успеха протезирования составил 96.5% на уровне пациента). Через пять лет после нагрузки средняя КПК составила 0.41 ± 0.30 мм. Разница с данными за 1 год составила 0.04 ± 0.19 мм. Статистически значимо более высокая КПК была обнаружена у курильщиков и пациентов с тонким биотипом десны. Средний крутящий момент при установке имплантата составил 42.9 ± 4.8 Нсм (диапазон от 15 до 45 Нсм). Двести три имплантата (83.5%) были установлены с крутящим моментом ≥35 и ≤45 Нсм.
Выводы: Высокая выживаемость и успех имплантатов могут быть ожидаемы при стабильной ремоделировании краевой кости до 5 лет после нагрузки. Курение и тонкий биотип тканей были наиболее важными переменными, связанными с более высоким MBL. Необходимы дальнейшие исследования для подтверждения этих результатов.
Введение
Ремоделирование кости вокруг зубных имплантатов на ранних стадиях является одним из самых критических факторов в прогнозировании успеха имплантата. Ранее считалось, что физиологическая потеря краевой кости (MBL) в 1.5 до 2.0 мм ожидается вокруг зубного имплантата в течение первого года функционирования. После этого наблюдалась бы минимальная потеря кости. Несколько факторов могут увеличить физиологическую MBL, включая, но не ограничиваясь, установлением биологической ширины, хирургической травмой, типом соединения имплантата и абатмента, толщиной и качеством мягких тканей, а также дизайном имплантата. Чтобы сделать ситуацию еще более сложной, несколько патологических сопутствующих факторов, включая генетическую предрасположенность, историю пародонтита, курение, диабет, плохой контроль за налетом, а также некоторые iatrogenic факторы, могут способствовать увеличению потери кости вокруг имплантата.
Современная имплантология изменила подход к определению успеха имплантации. Папаспиридакас и его коллеги предложили некоторые параметры, связанные со стабильностью мягких и твердых тканей вокруг имплантатов. Позже Галиндо-Морено и его коллеги продемонстрировали, что имплантаты с увеличенной физиологической MBL могут компрометировать их конечные результаты. Поэтому MBL более 0.44 мм/год является сильным показателем прогрессирования потери костной ткани вокруг импланта. В 2013 году Американская академия пародонтологии определила «перипротезит» как «воспалительную реакцию, связанную с потерей поддерживающей кости за пределами первоначальной биологической ремоделирования кости вокруг функционирующего импланта». Наконец, Талларико и его коллеги предложили, в рамках консенсусной конференции по перипротезиту, классификацию, основанную на этиологии, чтобы помочь клиницисту в выявлении и классификации перипротезита, основанного на этиологии. Однако до сих пор существует путаница относительно того, являются ли физиологическое и патологическое ремоделирование кости связанными с хозяином, с протезом и/или с имплантом, а также зависимыми от нагрузки.
Чтобы поддерживать физиологическое ремоделирование краевой кости на как можно более низком уровне, клиницисты должны хорошо понимать биологические и механические процессы, происходящие на соединении имплант–абатмент, а также особенности используемых имплантатов. Это необходимо для понимания ожидаемого физиологического ремоделирования краевой кости и любой связи между объясняющими переменными и патологической MBL, предотвращая ранние и дальнейшие неудачи имплантации.
Целью настоящей перспективной оценки серии случаев было проанализировать выживаемость и показатели успеха восстановлений на имплантатах, выполненных в повседневной практике, а также ремоделирование краевой кости, ожидаемое после установки имплантата и в течение 5 лет после нагрузки. Намерение заключалось в том, чтобы понять возможные вариации, связанные с неудачами имплантатов и периимплантитом. Это исследование было написано в соответствии с заявлением STROBE.
Материалы и методы
Это исследование представляет собой 5-летнее наблюдение за предыдущим предварительным отчетом. Изначально это исследование было спроектировано как открытая когорта, перспективная оценка серии случаев. Хирургические и протезные процедуры проводились с сентября 2014 года по декабрь 2016 года сертифицированным клиницистом (М.Т.). Зачисленные пациенты лечились последовательно, как часть рутинного лечения, после получения их письменного согласия. Пациенты были проинформированы о природе исследования, включая клинические процедуры, материалы, преимущества, потенциальные риски и осложнения предлагаемых методов лечения. Это исследование проводилось в соответствии с принципами, изложенными в Хельсинкской декларации 1975 года, с поправками 2008 года. Публикация настоящего исследования была одобрена Этическим комитетом Университета Альдент, Тирана, Албания (2/2021).
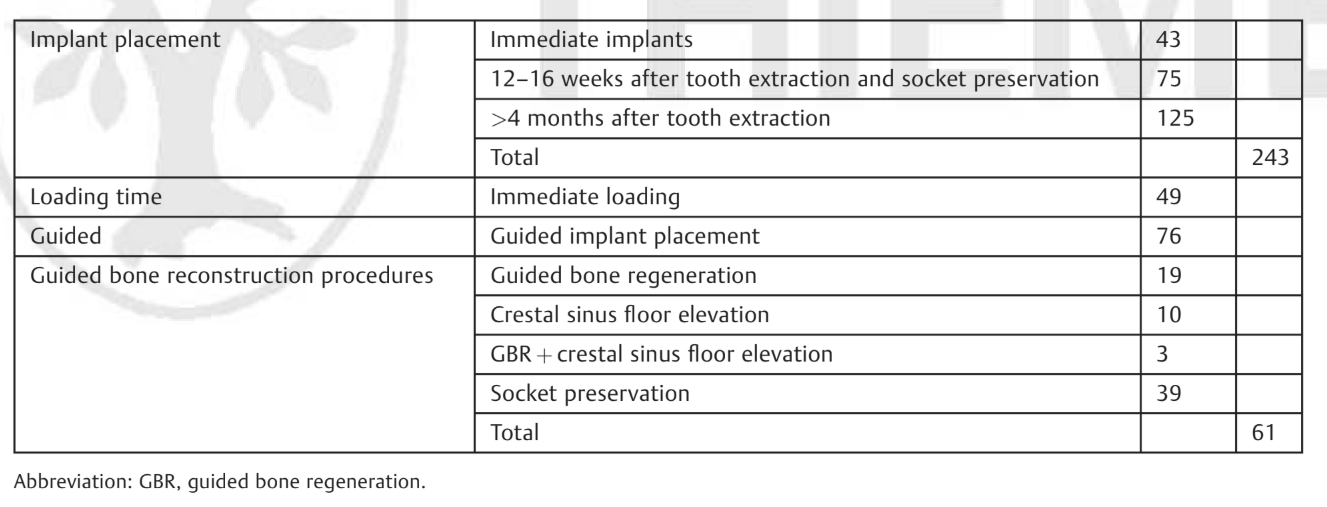
Любой частично или полностью беззубый пациент, который был запланирован на получение как минимум одного имплантата уровня кости (Osstem TSIII, Osstem Implant Co. Ltd., Сеул, Южная Корея), с пескоструйной и кислотно-этчированной поверхностью (шероховатая поверхность [Ra] 2.5–3.0 μm) и внутренним конусным соединением 11°, считался подходящим для этого исследования. Поскольку это исследование было разработано как открытая когортная проспективная оценка, учитывались любые места/дизайны имплантатов и протезов, а также любые хирургические и нагрузочные протоколы. Критерии исключения представлены в Таблице 1.

Первичный скрининг и оценка случая были выполнены, как показано в Таблице 2.
Хирургические и протезные протоколы
Полные хирургические и протезные процедуры были описаны в предыдущей публикации. Вкратце, пациенты получали антибиотик (2 г амоксициллина или 600 мг клиндамицина в случае аллергии на пенициллин) за 1 час до операции. Имплантаты (Osstem TSIII, Osstem Implant Co. Ltd.) устанавливались на уровне кости или немного ниже с использованием либо традиционной свободной хирургии, либо компьютерного наведения/шаблонного имплантирования. В случае немедленных постэкстракционных имплантатов, фиксаторы устанавливались на 1,5 мм ниже бугровой костной пластины. Все имплантаты устанавливались в соответствии с протоколом сверления, рекомендованным производителем. Плоский подход был запланирован в случае постэкстракционных имплантатов или на заживленном участке, в зависимости от ширины доступной кератинизации слизистой. В случаях атрофии гребня (высота кости < 7,0 мм и/или ширина кости < 4,5 мм) установка имплантатов проводилась одновременно с направленной регенерацией кости (GBR). Тем не менее, в случаях тяжелой атрофии гребня, включая повреждение остаточного альвеолярного лунки, установка имплантатов проводилась через 4-6 месяцев после процедур регенерации кости/сохранения лунки. Подъем синуса проводился с использованием бокового подхода в случае остаточной высоты кости ниже 3 мм или менее инвазивным транс-крестцовым подъемом дна синуса (Crestal Approach Sinus KIT, CAS-KIT, Osstem Implant Co. Ltd.), если остаточный альвеолярный гребень был не менее 3 мм, как измерено на предоперационном КТ. Протокол нагрузки изначально планировался в зависимости от индивидуальных требований случая, но в конечном итоге выполнялся в соответствии с первичной стабильностью имплантата. Таким образом, одноэтапный подход и немедленная нагрузка проводились при первичной стабильности имплантата не менее 35 Ncm. В случае немедленной нагрузки, предварительно изготовленные реставрации обрабатывались и полировались на месте, и доставлялись в той же хирургической сессии. Неконтактные временные реставрации были предоставлены частично беззубым пациентам, в то время как полностью беззубые пациенты получили скрепленные, металлически усиленные временные реставрации с центровым контактом и групповой функцией, без каких-либо консольных частей. Все пациенты получили устные и письменные рекомендации по медикаментам, поддержанию гигиены полости рта и диете. В случае немедленных имплантатов, регенерации кости и/или процедур синуса, послеоперационная антибиотикотерапия (1 г амоксициллина или 300 мг клиндамицина) продолжалась каждые 12 часов в течение 6-8 дней. Обезболивающие препараты назначались по мере необходимости.
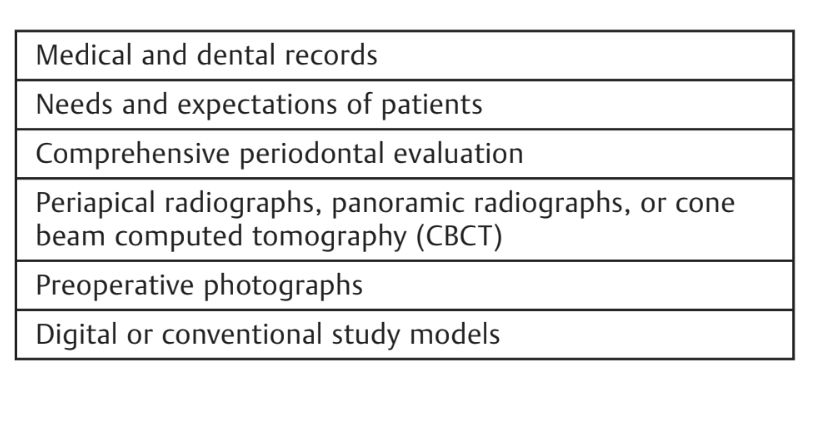
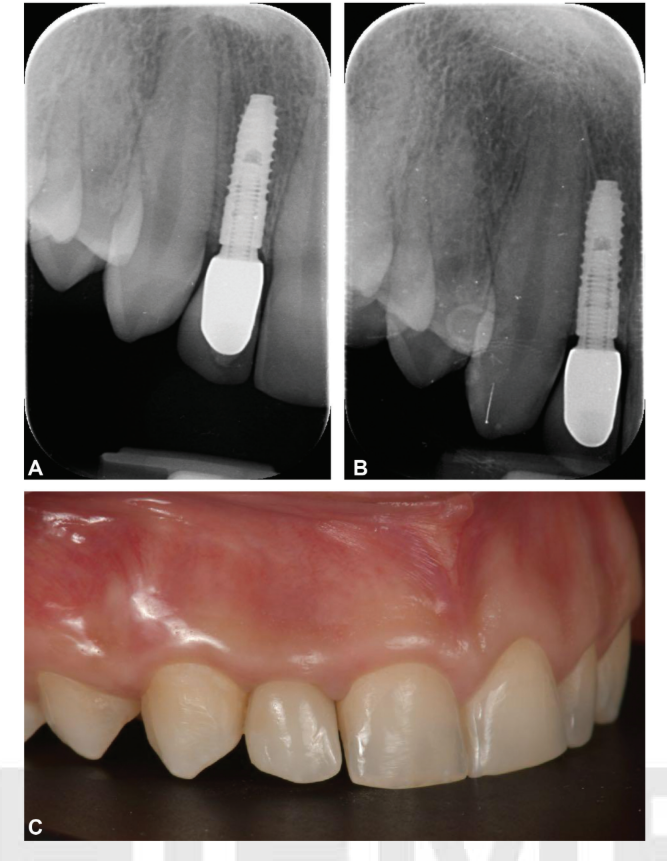
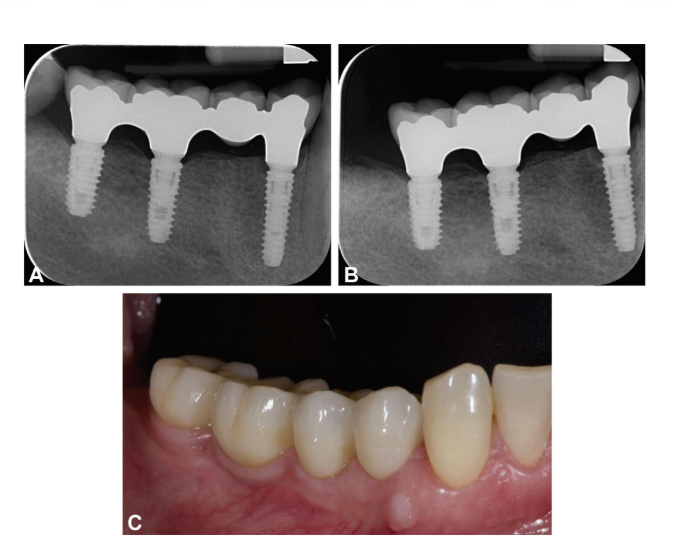
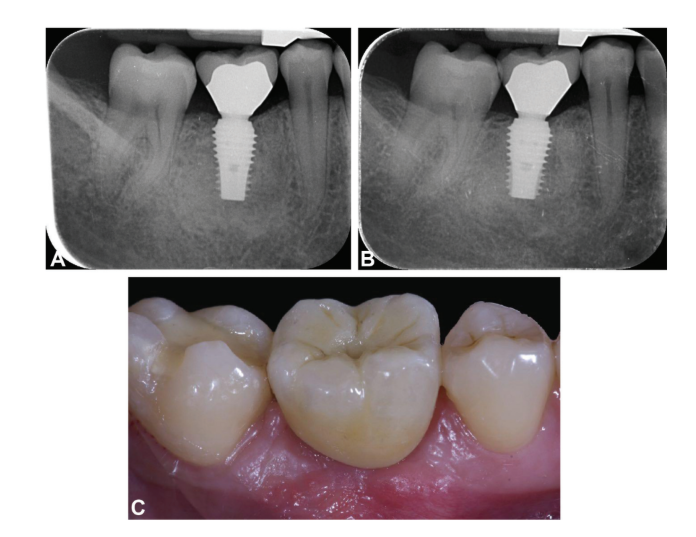
Надежные протезы и окончательные одиночные и частичные коронки были установлены через 8 недель после установки имплантатов в соответствии с протоколом ранней нагрузки; полные реставрации челюсти были установлены через 20 недель. В случае процедур по увеличению объема кости или немедленных имплантатов окончательные реставрации были установлены через 4-6 месяцев после второго этапа или начальной нагрузки соответственно. Окончательные реставрации были либо цементированы, либо фиксированы винтами, установлены на стандартные или индивидуальные абатменты с компьютерным дизайном/компьютерным производством (CAD/CAM). Мульти-абатменты (Osstem Implant Co. Ltd.) или OT Equator (Rhein83, Болонья, Италия) использовались в качестве промежуточных абатментов в случае полных реставраций челюсти. После установки окончательных протезов всем пациентам была назначена стандартная программа по контролю гигиены. Периапикальные рентгенограммы были сделаны после установки окончательных протезов, а затем ежегодно. Окклюзия проверялась и корректировалась на каждом визите. Объяснительные случаи иллюстрированы на рис. 1-5.
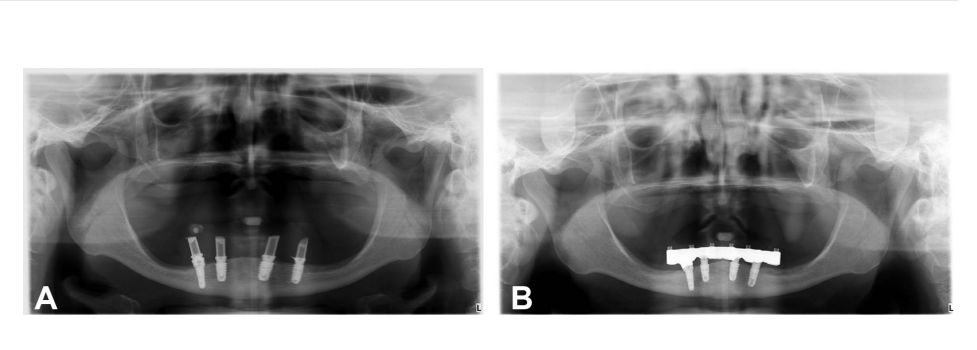
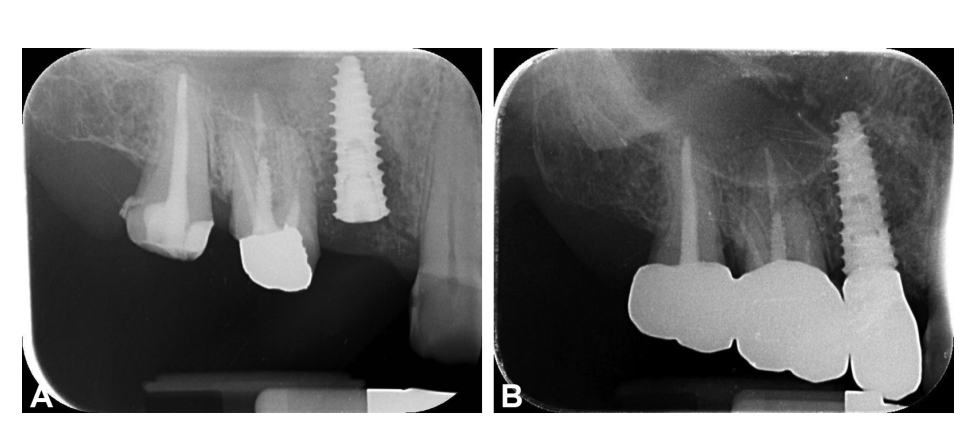
Показатели результатов
Основными показателями результатов были показатели успеха имплантатов и протезов, а также любые осложнения, возникшие в течение всего периода наблюдения. Результаты оценивались двумя операторами (E.X. и I.I.), которые ранее не участвовали в этом исследовании, на 1- (E.X.) и 5-летних (I.I.) контрольных обследованиях соответственно. Неудача имплантата определялась как подвижность, оцененная путем постукивания или покачивания головки имплантата металлическими ручками двух инструментов, прогрессирующая MBL или инфекция, а также любые осложнения, делающие имплантат непригодным для использования, хотя он все еще механически стабилен в кости (например, перелом имплантата). Неудача протеза определялась, если его необходимо было заменить другим протезом. Учитывались любые биологические (боль, отек, гной и т. д.) и/или механические (ослабление винта, перелом каркаса и/или облицовочного материала) осложнения.
Вторичными исходными показателями были уровни краевой кости, torque при установке, коэффициент стабильности имплантата (ISQ), качество остаточной альвеолярной кости и толщина мягких тканей.
- Уровни краевой кости оценивались при установке имплантата (базовый уровень), на операции второго этапа, при доставке окончательной коронки, а также через 1 и 5 лет после нагрузки, с использованием цифровых перiapical рентгенограмм, сделанных с параллельной техникой. Рентгенограммы оценивались с помощью программного обеспечения для анализа изображений (DfW 2.8, SOREDEX), откалиброванного на каждом измерении, с использованием известного диаметра или длины имплантата. Расстояние между платформой имплантата и самой корональной костью в контакте с имплантатом фиксировалось как на мезиальных, так и на дистальных границах. Среднее значение использовалось в статистических анализах.
- Torque при установке фиксировался при установке имплантата с использованием хирургического блока. Хирург (М.Т.) оценивал и фиксировал значения.
- Коэффициенты стабильности имплантата (ISQ) измерялись хирургом (М.Т.) с использованием устройства анализа резонансной частоты (устройство Osstell Mentor, Osstell, Гетеборг, Швеция) при установке имплантата и перед доставкой окончательной реставрации. Тот же клиницист, который выполнял хирургические и протезные процедуры (М.Т.), фиксировал значения ISQ.
- Качество остаточной альвеолярной кости оценивалось непосредственно во время подготовки места для имплантата хирургом (М.Т.) и сообщалось в соответствии с классификацией Лекхольма и Зарба.
- Толщина мягких тканей фиксировалась во время операции (М.Т.), измеряя толщину десны с помощью пародонтального зонда. Мягкие ткани считались тонкими, если их толщина составляла ≤1 мм, и толстыми, если она была >1 мм.
Статистический
Все данные были собраны и записаны в файл MS Excel. Статистик с опытом работы в стоматологии, не участвовавший ранее в исследовании, проанализировал данные и выполнил все анализы (SPSS V.26; IBM, Чикаго, Иллинойс, США). Непрерывные переменные были представлены как среднее стандартное отклонение или медиана и 95% доверительный интервал (CI). Ordinal и дихотомические переменные были представлены в процентах. Имплантаты и реставрации были рассмотрены как статистические единицы анализа. Различия в пропорции дихотомических исходов (неудача имплантата и протеза, а также осложнения) сравнивались с использованием точного теста Фишера. Различия в среднем для непрерывных исходов (MBL и ISQ) сравнивались с помощью независимого t-теста и однофакторного дисперсионного анализа соответственно. Сравнения между временными точками и базовыми значениями проводились с помощью непарных t-тестов. Статистические анализы проводились на уровне значимости 0.05.
Результаты
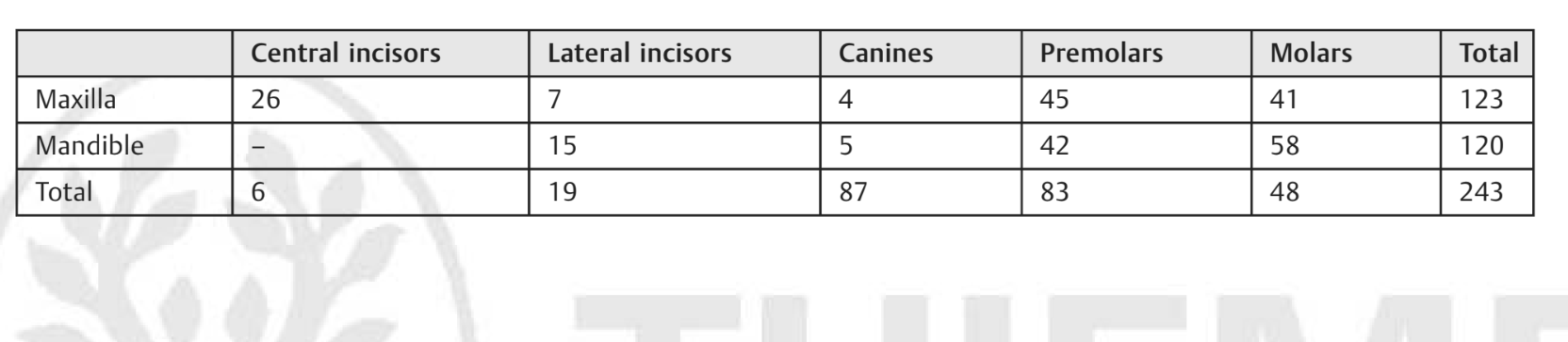
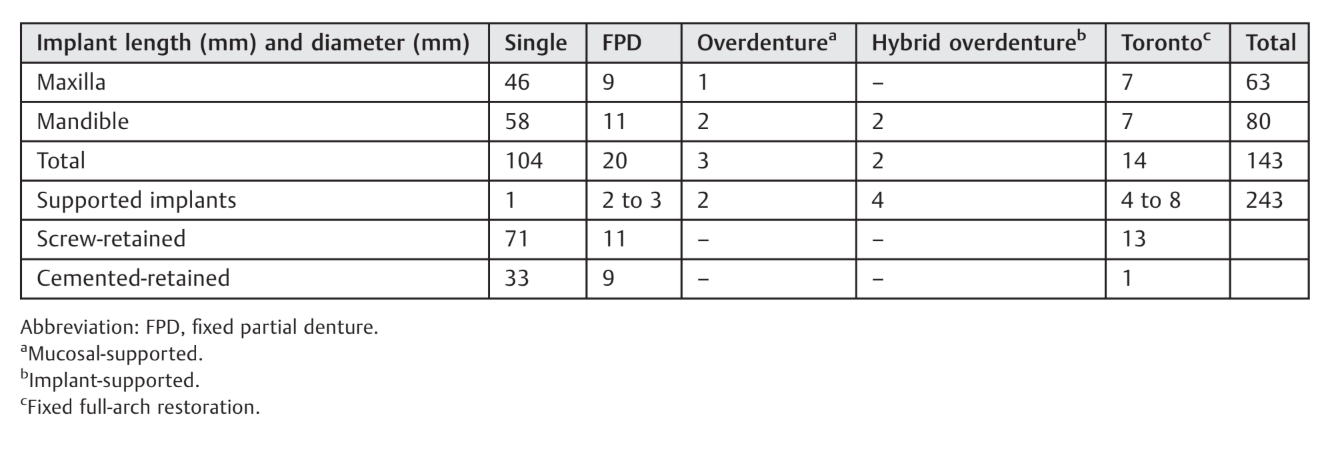
Всего в исследовании приняли участие 92 пациента. Из них только двое пациентов были исключены (пациенты отказались участвовать). В конечном итоге 90 последовательных пациентов (34 мужчины и 56 женщин; средний возраст: 53.2 ± 15.4 года; диапазон от 24 до 81) были окончательно лечены, и данные были проанализированы. В общей сложности было установлено 243 импланта, которые находились под наблюдением не менее 5 лет после нагрузки (в среднем 65.4 ± 3.1 месяцев; диапазон от 60 до 72). Двести восемь имплантов были установлены у некурящих пациентов; 20 имплантов у пациентов, курящих ≤10 сигарет в день; и 15 имплантов у пациентов, курящих >10 сигарет в день. Основные характеристики имплантов и их распределение показаны в таблицах 3-5.
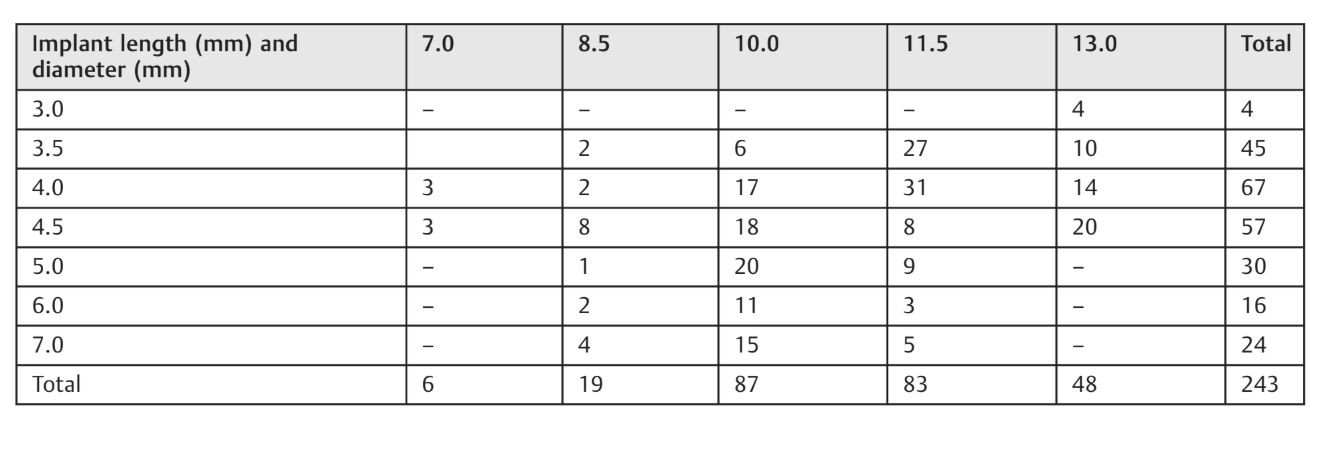
Крутящий момент вставки варьировался от ≥15 до ≤45 Нсм (в среднем 42.9 ± 4.8 Нсм). В целом 83.5% имплантатов (n = 203) были установлены с крутящим моментом вставки от ≥35 до ≤45 Нсм. Были доставлены сто сорок три окончательные протезы.
Сто шестьдесят восемь имплантатов были восстановлены с помощью протезов на винтах, в то время как оставшиеся 61 имплантат получили цементные реставрации. Более того, пять пациентов получили съемные протезы на двух имплантатах (всего 10 имплантатов), а два пациента получили гибридные фиксированные/съемные протезы, полностью поддерживаемые титановым баром CAD/CAM, прикрепленным к четырем имплантатам (всего восемь имплантатов). Данные обобщены в Таблице 6.
На обследовании через 1 год не было зарегистрировано ни одного отказа от участия, но 17 пациентов (18.9%) с 18 реставрациями (12.6%), выполненными на 34 имплантах (14%), были потеряны на 5-летнем визите. Два пациента скончались; четверо пациентов переехали в другую страну/город и отказались возвращаться для планового осмотра и обслуживания, предпочтя более близкую стоматологическую клинику; восемь пациентов не смогли посетить из-за пандемии COVID-19; а для трех пациентов причины были неизвестны, так как они не ответили на телефонные звонки.
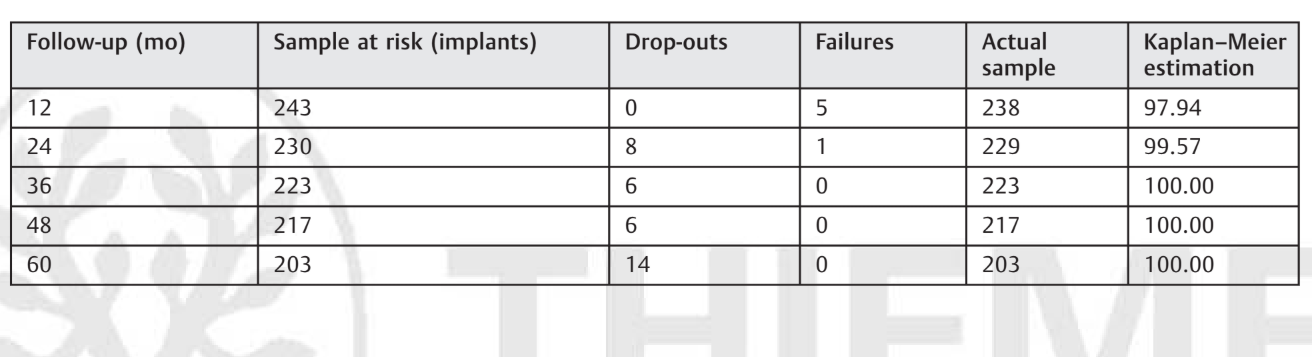
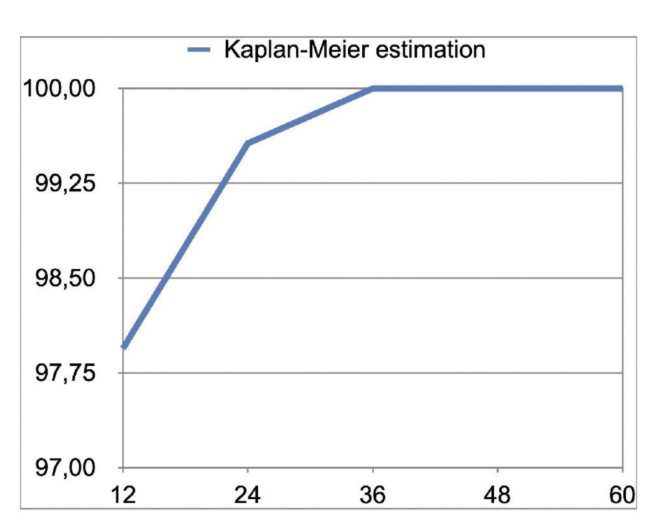
В целом, на 5-летнем обследовании шесть имплантов потерпели неудачу у шести пациентов, что привело к кумулятивной выживаемости имплантов 97.5%. Пять имплантов потерпели неудачу до окончательной нагрузки. Один имплант потерпел неудачу на 2-летнем контроле. Оценка по методу Каплана–Мейера представлена в Таблице 7 и Рисунке 6.
Статистически значимых различий не было найдено при сравнении неудач имплантации в подгруппах, за исключением значения крутящего момента при установке. Фактически, два неудачных импланта были установлены с крутящим моментом ниже 35 Нсм (неудачи 2/7 против 4/236; p = 0.010). Что касается других переменных, два неудачных импланта были установлены в сочетании с процедурами увеличения костной ткани (p = 0.6310); один имплант был немедленно нагружен (p = 1.000); два импланта были установлены сразу после удаления зуба (p = 0.2108). Последний неудачный имплант сломался через 2 года после доставки окончательного протеза (0.4%).
На пятилетнем контрольном осмотре четыре протеза потерпели неудачу (2,8%), что привело к кумулятивной выживаемости протезов 97,2%. Одна каркасная конструкция из циркония, установленная на полностью беззубом пациенте, леченном с помощью шести имплантов, показала несоответствие на самом дистальном импланте во время примерки. Каркас был переделан без дальнейших осложнений. Второе окончательное восстановление, выполненное из фарфора, сплавленного с каркасом из циркония и установленное на четырех имплантах, сломалось через 5 лет после нагрузки. Сломанный протез был заменен на новый. Два цементированных одиночных коронки, установленные в области нижних моляров, потерпели неудачу на пятилетнем осмотре из-за повреждения абатмента. Оба протеза были переделаны с новым восстановлением на винтах.
На пятилетнем осмотре у пяти пациентов были зафиксированы осложнения (по одному осложнению у каждого), что привело к кумулятивному уровню успеха протезирования 96,5% на уровне пациентов. У трех пациентов с одним восстановлением на винтах произошло ослабление винтов на годичном контроле. Винты были подтянуты на кресле после чистки протеза, без дальнейших осложнений, кроме одного пациента. У последнего пациента произошло новое ослабление винта на двухлетнем контроле. Окклюзия была скорректирована, и винт был заменен, без дальнейших осложнений. У двух пациентов наблюдались боли и отеки до 3 недель и 4 лет после установки имплантов соответственно, что привело к MBL более 2 мм по сравнению с предыдущим контролем. Оба пациента участвуют в строго поддерживающей программе, и дальнейшего прогрессирующего MBL не наблюдалось.
Все имплантаты были установлены на уровне гребня или немного ниже (0–1 мм, максимум 1,5 мм в случае немедленных постэкстракционных имплантатов). При доставке окончательного протеза (n = 243) средний MBL составил 0.26 ± 0.25 мм (95% ДИ: 0.23–0.29). Средний MBL между установкой имплантата и 1 годом после нагрузки (n = 243) составил 0.37 0.25 мм (95% ДИ: 0.33–0.41). Разница составила 0.11 ± 0.14 мм (95% ДИ: 0.09–0.13). Через пять лет после нагрузки (n = 203) средний MBL для установки имплантата составил 0.41 ± 0.30 мм (95% ДИ: 0.26–0.34). Разница с данными за 1 год составила 0.04 ± 0.19 мм (95% ДИ: 0.01–0.07).
В целом, 4.4% имплантатов (n = 9) показали нулевой MBL через пять лет после нагрузки, в то время как 78.8% имплантатов (n = 160) показали MBL ≥0.1 и ≤0.5 мм. Двадцать пять имплантатов (12.3%) показали MBL ≥0.5 и ≤1.00 мм. Только девять имплантатов (4.4%) показали MBL больше 1.0 мм (диапазон: 1.1–2.3 мм). Все эти пациенты были включены в строгую программу поддержания гигиены. У всех этих пациентов не потребовались хирургические процедуры. Сравнение MBL и исследуемых факторов риска проводилось на 1-летнем наблюдении. Было установлено статистически более высокий MBL у курильщиков, тонкого биотипа десен и GBR. Курильщики, тонкий биотип десен и предыдущий GBR были связаны с более высоким MBL. Различия были статистически значимыми (p < 0.05).
Среднее значение ISQ, зарегистрированное при установке имплантата, составило 71,6 ± 5,5 (минимум: 45; максимум: 88); при доставке окончательного протеза (через 6 месяцев после установки имплантата) среднее значение ISQ составило 76,7 ± 4,4 (минимум: 66; максимум: 89). Разница между временными точками была статистически значимой (p = 0.0001).
Сто шестьдесят шесть имплантатов были установлены в костях типа 1 и 2 (n = 18). Оставшиеся 77 имплантатов были установлены в костях типа 3 и 4.
Статистически значимой корреляции между моментом вставки и MBL не было найдено (p = 0.4216).
Обсуждение
Настоящее исследование было разработано как открытое когортное, проспективное, оценка серии случаев, направленная на изучение, в течение 5 лет после доставки окончательной реставрации, выживаемости и успеха имплантатов и протезов уровня кости, имеющих пескоструйную/кислотно-этичную поверхность и внутреннее конусное соединение 11°, установленных в частной практике. Кроме того, чтобы понять количество физиологического ремоделирования краевой кости, которое можно ожидать после установки имплантата, а затем, в среднесрочном наблюдении. Наконец, для оценки любых осложнений и возможных факторов риска с целью предотвращения осложнений и неудач, включая периимплантит. Основным ограничением настоящего исследования был небольшой размер выборки, особенно в отношении гетерогенности лечения. К сожалению, пандемия COVID-19 способствовала относительному увеличению числа отказов. Тем не менее, в конце исследования было установлено 203 одинаковых имплантата, и пациенты наблюдались не менее 5 лет после доставки окончательной реставрации. Авторы считают, что 5 лет функционирования может быть достаточно для оценки физиологического ремоделирования краевой кости, которое происходит после установления биологической ширины, а также для понимания тенденции годовой потери кости.
Шесть из 243 имплантатов потерпели неудачу в течение 5 лет после загрузки, что дало кумулятивную выживаемость имплантатов на уровне 97,5%. Эти результаты полностью согласуются с предыдущим систематическим обзором, в котором были представлены данные о 5-летнем наблюдении. Пьетурссон и его коллеги сообщили об оценочной выживаемости имплантатов на уровне 97,2% через 5 лет для имплантатов с шероховатой поверхностью. В настоящем исследовании пять из шести неудачных имплантатов не интегрировались и потерпели неудачу до окончательной загрузки. Оценка по методу Каплана-Мейера показала, что после первоначального рискованного периода (2,06%) кумулятивная выживаемость становится выше (100%). Возможное объяснение заключается в том, что MBL остается почти стабильным на протяжении времени. На 5-летнем контрольном обследовании только девять имплантатов (4,4%) показали MBL от 1,1 до 2,3 мм. Напротив, 91,1% имплантатов показали MBL ≥0,5 и ≤1,00 мм (из них 78,8% показали MBL ≥0,1 и ≤0,5 мм).
Согласно предварительному отчету за 1 год, анализ подгрупп показал, что предыдущая GBR, тонкий биотип мягких тканей и курение были связаны со статистически значимо большим потерей костной ткани вокруг имплантатов. Эти результаты согласуются с предыдущими исследованиями других авторов. Сголастра и его коллеги пришли к выводу, что курение связано с большей MBL, неудачами имплантатов, а также с риском биологических осложнений, таких как периимплантит. Более того, систематический обзор с мета-анализом заключил, что зубные имплантаты, установленные у пациентов с изначально толстыми периимплантными мягкими тканями, могут ожидать меньшую MBL в краткосрочном периоде.
В настоящем исследовании, даже если GBR ассоциируется с немного более высоким MBL, показатели выживаемости имплантатов, установленных в сочетании с процедурами GBR или после них, были высокими, без различий по сравнению с имплантатами, установленными в естественной кости. Эти данные согласуются с другими отчетами. С другой стороны, Раманаускайте и соавторы сообщили в систематическом обзоре о более низком MBL у имплантатов, установленных в пересаженные участки, по сравнению с непересаженными. Однако Раманаускайте и соавторы сообщили о среднем различии примерно 2 мм, в то время как в настоящем исследовании разница в MBL составила примерно 0,2 мм. Более того, согласно обоим исследованиям, имплантаты, установленные в предыдущих участках GBR, продемонстрировали высокий уровень выживаемости.
Протокол "один абатмент за один раз" и немедленная нагрузка были доказаны как способствующие снижению MBL. Возможное объяснение может заключаться в том, что в настоящем исследовании большинство немедленно нагруженных имплантатов были установлены без разрезов, с использованием направленной хирургии, и они получили окончательные абатменты в день операции, что минимизировало общее ремоделирование кости вокруг имплантата.
Хорошо известно, что первичная стабильность имплантата по-прежнему считается одним из самых важных критериев успеха имплантации. На самом деле, два из шести неудачных имплантатов имели крутящий момент при установке ниже 35 Нсм. Хотя до сих пор нет консенсуса, позволяющего нам предложить идеальное значение крутящего момента при установке для предотвращения осложнений и неудач имплантатов, авторы считают, что высокие значения крутящего момента следует избегать. В настоящем исследовании большинство имплантатов (83,5%) достигли крутящего момента при установке в диапазоне от 35 до 45 Нсм. В соответствии с протоколом производителей, места для имплантатов готовились в зависимости от плотности кости, оцененной на момент операции. Стандартная подготовка места для имплантата проводилась в заживленных участках с плотностью кости, классифицированной как тип 2 или 3. Горизонтальная и/или вертикальная недоподготовка проводилась в случае плохого качества кости (тип 4), поднятия синуса (с поэтапной установкой имплантата) и постэкстракционных имплантатов. Более того, в некоторых случаях в области верхней челюсти использовались остеотомы для выполнения расширения кости, что улучшало плотность кости и, следовательно, первичную стабильность имплантата.
Основной проблемой настоящего 5-летнего отчета было относительно высокое количество неудач протезирования и осложнений. Пять лет спустя после нагрузки четыре протеза потерпели неудачу, и три технических осложнения были зафиксированы. Все осложнения были решены на кресле, и все неудачные протезы были переделаны. Тем не менее, результаты представленного исследования согласуются с предыдущим систематическим обзором. Согласно Пьетурссону и его коллегам, уровень выживаемости металлокерамических фиксированных зубных протезов на имплантатах составил 96,4%, в то время как в настоящем исследовании абсолютное значение составило 97,2%. Однако основное отличие настоящего исследования заключается в том, что большинство реставраций были безметалловыми. Хотя зубные имплантаты все больше становятся золотым стандартом в замене утраченных/неудачных зубов, осложнения, связанные с ними, также постепенно возникают. Тем не менее, один протез потерпел неудачу во время пробного обследования. Это означает, что некоторые технические проблемы могли возникнуть во время лабораторных процедур. Второй каркас из циркония потерпел неудачу через 5 лет после обследования на нагрузку. По мнению авторов, материалы из циркония улучшались со временем. Более того, несколько лет назад соединение между протезом и имплантатами также было выполнено из циркония. Таким образом, сегодня, используя улучшенные материалы и титановое соединение, можно ожидать более длительного времени без осложнений. Последние два протеза были двумя одиночными коронками. В обоих случаях шестиугольник абатмента сломался у пяти пациентов после нагрузки. Оба имплантата были широкодиаметрическими (6,0 и 7,0 мм), установленные в области нижних моляров. Один из этих пациентов был явным бруксистом. Второй пациент не был зарегистрирован как бруксист, тем не менее, пациент пережил две утраты (мужа и сына) за несколько месяцев до протезного осложнения. Вероятно, появились некоторые парафункциональные привычки. Тем не менее, этот момент подчеркивает важность окклюзионного контроля наряду с обычным гигиеническим обслуживанием.
В конечном итоге, основным клиническим вкладом этого исследования было понимание физиологического ремоделирования костной ткани, ожидаемого в повседневной практике, как на биологическом уровне, так и в течение года. Это важно для понимания индикаторов риска для периимплантита. Однако крайне важно убедиться, что пациенты с кровотечением при зондировании и/или индексом налета ≥25% не были включены в это исследование. Более того, все леченные пациенты были включены в точную программу поддерживающего лечения с визитом каждые 4-6 месяцев, что способствовало снижению MBL и заболеваемости периимплантитом.
Через год после нагрузки средний MBL составил 0.37 мм. Это означает, что имплантаты могут быть установлены на уровне кости или немного ниже (0.5 мм). В некоторых клинических ситуациях, таких как GBR, курение и тонкие мягкие ткани, имплантаты следует устанавливать на 1 мм ниже костного гребня. Исключительно, клиницисты могут устанавливать имплантаты глубже до 1.5-2 мм в случае постэкстракционных имплантатов и очень тонкого биотипа. В этих случаях следует рассмотреть концепцию установки одного абатмента за раз или имплантаты на уровне тканей.
Выводы
Низкий уровень неудач имплантации и стабильная ремоделировка костной ткани вокруг имплантатов могут быть ожидаемы при использовании имплантатов с конусным соединением, обработанных пескоструйным методом и кислотным травлением, в повседневной практике, до 5 лет после нагрузки. Предыдущая GBR, курение и тонкий биотип мягких тканей были наиболее важными переменными, связанными с более высоким уровнем потери костной ткани. Могут возникать протезные неудачи и осложнения. Для последних необходимы улучшения свойств восстановительных материалов и постоянный контроль окклюзии, чтобы снизить эти осложнения.
Марко Талларико, Ауреа Мария Иммаколата Лумбау, Сильвио Марио Мелони, Ирен Иерия, Чанг-Жу Парк, Лукаш Задрожны, Эрта Ханари, Милена Писано
Ссылки
- Роос Дж., Сеннерби Л., Лекхольм У., Емт Т., Грёндаль К., Альбректссон Т. Качественный и количественный метод оценки успеха имплантации: 5-летний ретроспективный анализ имплантата Бранемарка. Int J Oral Maxillofac Implants 1997;12(04):504–514
- Альбректссон Т., Зарб Г., Уортингтон П., Эрикссон А.Р. Долгосрочная эффективность современных стоматологических имплантатов: обзор и предложенные критерии успеха. Int J Oral Maxillofac Implants 1986;1(01): 11–25
- Миш С.Е., Перел М.Л., Ванг Х.Л. и др. Успех, выживаемость и неудача имплантатов: Консенсусная конференция Международного конгресса оральных имплантологов (ICOI) в Пизе. Implant Dent 2008;17(01):5–15
- Папаспиридакос П., Чен Ч.Ж., Сингх М., Вебер Х.П., Галлукки Г.О. Критерии успеха в имплантологии: систематический обзор. J Dent Res 2012;91(03):242–248
- Невинс М., Невинс М.Л., Камело М., Бойесен Дж.Л., Ким Д.М. Человеческие гистологические доказательства соединительной ткани, прикрепленной к стоматологическому имплантату. Int J Periodontics Restorative Dent 2008;28(02): 111–121
- Кохран Д.Л., Обрехт М., Вебер К. и др. Биологическая ширина рядом с нагруженными имплантатами с обработанными и шероховатыми воротниками у собак. Int J Periodontics Restorative Dent 2014;34(06):773–779
- Юнг Й.С., Хан Ч.Х., Ли К.В. Радиографическая оценка краевой кости вокруг стоматологических имплантатов через 1 год. Int J Oral Maxillofac Implants 1996;11(06):811–818
- Галиндо-Морено П., Леон-Кано А., Ортега-Оллер И., Монье А., О Валье Ф., Катена А. Потеря краевой кости как критерий успеха в имплантологии: более 2 мм. Clin Oral Implants Res 2015;26(04): e28–e34
- Альфонси Ф., Борджиа В., Барбато Л. и др. Клинические эффекты крутящего момента при установке имплантатов в заживленные гребни: двухлетнее рандомизированное контролируемое клиническое исследование. J Oral Science Rehabilitation. 2016;2 (04):62–73
- Бахат О., Салливан Р.М. Параметры успешной интеграции имплантатов пересмотрены часть II: алгоритм для диагностических факторов немедленной нагрузки. Clin Implant Dent Relat Res 2010;12(Suppl 1):e13–e22
- Квиринен М., Наерт И., ван Стенберге Д. Дизайн фиксатора и перегрузка влияют на потерю краевой кости и успех фиксатора в системе Бранемарка. Clin Oral Implants Res 1992;3(03): 104–111
- Харрел С.К., Нанн М.Е. Влияние окклюзионных несоответствий на пародонтит. II. Связь окклюзионного лечения с прогрессированием пародонтального заболевания. J Periodontol 2001;72(04): 495–505
- Канулло Л., Талларико М., Радованович С., Делибасич Б., Ковани У., Ракич М. Различение предсказательных профилей для оценки риска на основе пациента и диагностики плаксоиндуцированного, хирургически и протезно вызванного периимплантита. Clin Oral Implants Res 2016;27(10):1243–1250
- Американская академия пародонтологии. Периимплантный мукозит и периимплантит: текущее понимание их диагностики и клинических последствий. J Periodontol 2013;84(04):436–443
- Талларико М., Канулло Л., Ванг Х.Л., Кохран Д.Л., Мелони С.М. Системы классификации для периимплантита: нарративный обзор с предложением новой кодировки этиологии на основе доказательств. Int J Oral Maxillofac Implants 2018;33(04):871–879
- Талларико М., Мелони С.М. Проспективное исследование открытой когорты о ранних неудачах имплантатов и физиологическом краевом ремоделировании, ожидаемом при использовании имплантатов уровня кости, обработанных пескоструйным методом и кислотным травлением, с соединением Морса 11° в течение одного года после нагрузки. Journal of Oral Science & Rehabilitation. 2017;3:68–79
- Пьетурссон Б.Е., Тома Д., Юнг Р., Цваален М., Зембик А. Систематический обзор выживаемости и частоты осложнений фиксированных стоматологических протезов на имплантатах (FDP) после среднего периода наблюдения не менее 5 лет. Clin Oral Implants Res 2012;23 (Suppl 6):22–38
- Сголастра Ф., Петруччи А., Северино М., Гатто Р., Монако А. Курение и риск периимплантита. Систематический обзор и мета-анализ. Clin Oral Implants Res 2015;26(04):e62–e67
- Суарес-Лопес Дель Амо Ф., Лин Г.Х., Монье А., Галиндо-Морено П., Ванг Х.Л. Влияние толщины мягких тканей на потерю краевой кости вокруг имплантатов: систематический обзор и мета-анализ. J Periodontol 2016;87(06):690–699
- Мелони С.М., Йованович С.А., Урбан И., Канулло Л., Писано М., Талларико М. Горизонтальное увеличение гребня с использованием GBR с мембраной из натурального коллагена и соотношением 1:1 частиц ксеногенного и аутологичного костного материала: 1-летнее проспективное клиническое исследование. Clin Implant Dent Relat Res 2017;19(01):38–45
- Талларико М., Парк Ч.Ж., Лумбау А.И. и др. Индивидуальная 3D-печатная титановая сетка, разработанная для регенерации сложного костного дефекта в эстетической зоне: случай из практики, выполненный с использованием полностью цифрового рабочего процесса. Materials (Basel) 2020;13(17):3874
- Мелони С.М., Лумбау А., Спано Г. и др. Увеличение синуса с использованием неорганической бычьей кости по сравнению с 50% аутологичной костью, смешанной с 50% неорганической бычьей костью: результаты через 5 лет после нагрузки из рандомизированного контролируемого испытания. Int J Oral Implantol (Berl) 2019;12(04):483–492
- Раманаускайте А., Боргес Т., Алмейда Б.Л., Коррея А. Результаты стоматологических имплантатов в пересаженных лунках: систематический обзор и мета-анализ. J Oral Maxillofac Res 2019;10(03):e8
- Энгельхардт С., Папакоста П., Рате Ф., Озень Дж., Янсен Я.А., Юнкер Р. Годовые показатели неудач и изменения уровня краевой кости при немедленной по сравнению с обычной нагрузкой стоматологических имплантатов. Систематический обзор литературы и мета-анализ. Clin Oral Implants Res 2015;26(06):671–687
- Канулло Л., Биньоззи И., Коккетто Р., Кристалли М.П., Яннелло Г. Немедленное позиционирование окончательного абатмента против повторных замен абатмента в постэкстракционных имплантатах: 3-летнее наблюдение рандомизированного многоцентрового клинического испытания. Eur J Oral Implantology 2010;3(04):285–296
- Мелони С.М., Талларико М., Писано М., Ханари Е., Канулло Л. Немедленная нагрузка фиксированного полного протеза, поддерживаемого 4-8 имплантатами, установленными с использованием направленной хирургии: 5-летнее проспективное исследование на 66 пациентах с 356 имплантатами. Clin Implant Dent Relat Res 2017;19(01):195–206
- Талларико М., Мелони С.М., Канулло Л., Канева М., Полицци Г. Пятилетние результаты рандомизированного контролируемого испытания, сравнивающего пациентов, реабилитированных с немедленно загруженным фиксированным стоматологическим протезом на верхней челюсти, поддерживаемым четырьмя или шестью имплантатами, установленными с использованием направленной хирургии. Clin Implant Dent Relat Res 2016;18(05): 965–972
- Мелони С.М., Де Риу Г., Писано М. и др. Компьютерно-ассистированная имплантологическая хирургия и немедленная нагрузка в беззубых гребнях с лунками после свежей экстракции зубов. Двухлетние результаты проспективного исследования серии случаев. Eur Rev Med Pharmacol Sci 2013;17(21): 2968–2973
- Мелони С.М., Де Риу Г., Писано М., Каттина Г., Туллио А. Программное обеспечение для планирования имплантного лечения и направленная безфлапная хирургия с немедленной доставкой временного протеза в полностью беззубой верхней челюсти. Ретроспективный анализ 15 последовательно леченных пациентов. Eur J Oral Implantology 2010;3(03):245–251
- Поззи А., Талларико М., Мой П.К. Немедленная нагрузка с новым имплантатом, имеющим переменную резьбу, внутреннее конусное соединение и смещение платформы: трехлетние результаты проспективного когортного исследования. Eur J Oral Implantology 2015;8(01): 51–63
- Мелони С.М., Лумбау А., Бальдони Э. и др. Смена платформы против обычных платформенных одиночных имплантатов: 5-летние результаты после нагрузки из рандомизированного контролируемого испытания. Int J Oral Implantol (Berl) 2020;13(01):43–52
- Ханиф А., Куреши С., Шейх З., Рашид Х. Осложнения в имплантологии. Eur J Dent 2017;11(01):135–140
- Рокая Д., Сриманипонг В., Виситрасамевон В., Хумагайн М., Тхунякитписал П. Обновление по периимплантиту: индикаторы риска, диагностика и лечение. Eur J Dent 2020;14(04):672–682
- Элемек Е., Аграли О.Б., Куро Б., Куро Л. Периимплантит и уровень тяжести. Eur J Dent 2020;14(01):24–30
- Пассариелло Ч., Ди Нардо Д., Тестарелли Л. Воспалительные периимплантные заболевания и вопрос о связи с пародонтитом. Eur J Dent 2019;13(01):119–123
- Талларико М., Канева М., Мелони С.М., Ханари Е., Ковани У., Канулло Л. Окончательные абатменты, установленные при имплантации и никогда не удаленные: является ли это эффективным подходом? Систематический обзор и мета-анализ рандомизированных контролируемых испытаний. J Oral Maxillofac Surg 2018;76(02):316–324
- Акампора Р., Монтанари М., Скрассия Р. и др. Оценка мостовых абатментов для немедленно загруженных фиксированных реставраций верхней челюсти через 1 год: многоцентровое исследование. Eur J Dent 2021;15(02):290–294
