Рандомизированное контролируемое исследование направленной регенерации кости при дефектах декомпрессии вокруг имплантатов с использованием двух неорганических бычьих костных материалов, покрытых титановыми сетками
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Цель данного исследования заключается в сравнении двух материалов из неорганической бычьей кости, синтерованных при низкой температуре (ABBMs), Bio-Oss (Geistlich, Вольхузен, Швейцария) и A-Oss (Osstem, Сеул, Корея), для GBR при дефектах с деhисценцией. Один имплантат был установлен одновременно с GBR в щечной или щечно-проксимальной костной дефекте путем двойного слоя внутреннего аллографта и внешнего ABBM, покрытого предварительно сформированной ультратонкой титановою сеткой и рассасывающейся коллагеновой мембраной. Изменения объема трансплантата оценивались с помощью конусно-лучевой компьютерной томографии, проведенной до операции (T0), сразу после хирургии имплантата (T1), после повторной операции (T2) и после установки окончательной реставрации (T3). Плотность регенерированной кости оценивалась путем измерения глубины зондирования в щечной средней части сетки после удаления сетки на T2. Также были зафиксированы послеоперационные последствия. Уменьшение объема трансплантата составило 46,0% (0,78 ± 0,37 cc) и 40,8% (0,79 ± 0,33 cc) в группе Bio-Oss (8 пациентов) и группе A-Oss (8 пациентов) соответственно, что было зафиксировано на T3 (p < 0.001). Значительных различий в изменениях объема трансплантата в зависимости от временных периодов или плотности кости между двумя группами не наблюдалось. Несмотря на послеоперационное обнажение сетки (3 пациента), преждевременное удаление этих обнаженных сеток и дополнительное трансплантирование не потребовалось, и все имплантаты функционировали в течение 1 года наблюдения. Оба ABBM с титановыми сетками не показали значительных различий в количестве и плотности регенерированной кости после GBR для периимплантных дефектов.
Введение
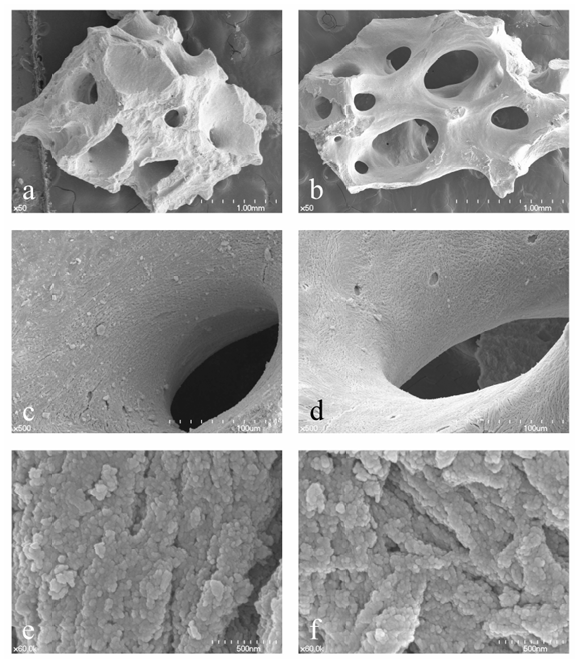
Инновационные устройства и технологии для снижения заболеваемости, биологических и хирургических временных затрат являются актуальной темой исследований в области имплантологии, а направленная регенерация костной ткани (GBR) - это хирургическая процедура увеличения объема кости для зубных имплантатов с использованием различных материалов для костной пластики и одновременно барьерных мембран. Неорганические бычьи костные материалы (ABBMs) широко используются в качестве остеокондуктивного материала для операций по поднятию синуса, сохранению альвеолярного отростка, имплантации сразу после удаления зуба и GBR. Уникальное преимущество ABBM заключается в его способности поддерживать объем с медленной заменой новой костью по сравнению с аутогенными и аллогенными материалами для костной пластики. Существуют и другие типы ABBMs, которые спечены при высокой температуре или основаны на свинине и лошади; однако, бычьи и низкотемпературно спеченные ABBMs, похоже, доминируют на стоматологическом рынке. Исторически Bio-Oss (Geistlich, Вольхузен, Швейцария) долгое время считался золотым стандартом благодаря сильным научным доказательствам; тем не менее, A-Oss (Osstem, Сеул, Корея) - это ABBM, произведенный химической обработкой с ароматическим и сильным щелочным растворителем, а затем низкотемпературным отжигом ниже 400°C с крайне низкой скоростью нагрева (<0.3°C в минуту). Физико-химическая характеристика A-Oss, которая может быть существенно эквивалентна характеристикам Bio-Oss с точки зрения как более высокой пористости, так и более низкой кристалличности, тесно связана с меньшей деградацией и активностью ремоделирования по сравнению с другими ксенографтами (Рисунок 1).
В области челюстно-лицевой хирургии титановая сетка широко используется в случаях, требующих значительной реконструкции кости благодаря своей биосовместимости и жесткости как легкого металла. В частности, недавнее введение предварительно сформированной ультратонкой титановый сетки, которая непосредственно соединяется и фиксируется на имплантате, увеличило ее популярность в GBR для костных дефектов вокруг имплантатов. Устойчивый к коллапсу на протяжении всего периода заживления GBR, этот ультратонкий титановая сетка имеет множество пор различного размера для оптимальных результатов GBR.
Целью этого рандомизированного контролируемого клинического испытания было сравнить два низкотемпературно спеченных ABBM, Bio-Oss и A-Oss, которые используются в GBR для реконструкции дефекта декомпенсации вокруг имплантата, в сочетании с ультратонкой титановой сеткой. Насколько нам известно, это первое исследование, в котором измеряются и сравниваются трехмерные объемные изменения ABBM для целей GBR. Нулевая гипотеза заключалась в том, что нет различий в изменениях в объеме трансплантата (количество кости), плотности (качество кости) регенерированной кости и послеоперационных последствиях между группами.
Материалы и методы
Это исследование было спроектировано как рандомизированное контролируемое испытание параллельного группового дизайна и проводилось в Отделении челюстно-лицевой хирургии, кафедре стоматологии, больницы Ханянгского университета, с июня 2018 года по июль 2019 года. Исследование было одобрено Институтом этики Ханянгского университета (IRB No. 2018-03-006) и зарегистрировано в международной платформе регистрации клинических испытаний ВОЗ (KCT0004906). Оно проводилось в соответствии с Декларациями Хельсинки и международно принятыми руководящими принципами для РКИ, включая заявление CONSORT (доступ к которому был получен 2 марта 2018 года). Все хирургические и протезные процедуры выполнялись одним экспертом-имплантологом (C.-J.P.).
Выбор пациентов
После предоперационных клинических и рентгенологических обследований, включая конусно-лучевую компьютерную томографию (КЛКТ), любой здоровый пациент в возрасте 18 лет и старше, которому требовалось установить один имплантат в заживленном альвеолярном гребне с GBR для дефекта периимплантата, когда имплантат был смоделирован в позиции, ориентированной на протезирование (OneGuide, Osstem, Сеул, Корея), был включен в это исследование после получения информированного согласия. В частности, костные дефекты должны были ограничиваться только щечной и/или проксимальной стороной и не затрагивать поверхность соседнего зуба или язычную сторону. Критерии исключения включали необходимость в более чем двух последовательных имплантатах и наличие системных или местных противопоказаний для установки имплантатов, включая историю неконтролируемых метаболических расстройств, курение, бруксизм или неконтролируемую пародонтальную болезнь. Зачисленные пациенты были проинформированы о хирургических процедурах, материалах, которые будут использоваться, преимуществах и потенциальных рисках и осложнениях этого клинического исследования, и было получено письменное информированное согласие.
Хирургическая процедура
Все процедуры проводились под местной анестезией и умеренной внутривенной седацией. Был поднят полнослойный лоскут, и вся грануляционная ткань была тщательно удалена. Первоначальное сверление с маркировкой кортикальной кости выполнялось направляющим сверлом. Последовательные конусные сверла использовались для подготовки места для имплантата (набор OneGuide или набор 122 Taper, Osstem), и особое внимание уделялось получению правильного трехмерного положения имплантата. Дентальный имплантат (TS III SOI, Osstem, или T01 SA, Toplan, Сеул, Корея) был установлен на 1 мм субкрестально от языкового или небного альвеолярного гребня, и вокруг верхней части имплантата возник дефект декалцинации, обнажающий щечные и/или проксимальные резьбы имплантата.
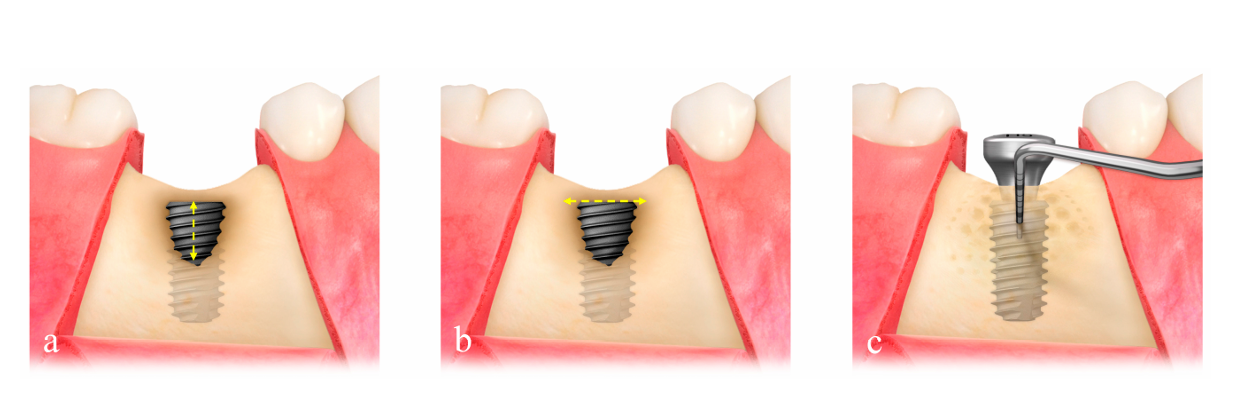
Размер дефекта (мм) состоял из высоты дефекта, которая измерялась от верхней части имплантата до первого контакта кости с имплантатом, и ширины дефекта, которая измерялась от мезиального до дистального альвеолярного гребня на уровне верхней части имплантата (Рисунок 2a,b). Предварительно сформированная ультратонкая титановая сетка (OssBuilder, Osstem), которая была наиболее подходящей для измеренного размера дефекта, была выбрана из различных моделей типа I для дефекта щечной декалцинации и типа II для комбинированного дефекта щечно-проксимальной декалцинации (Рисунок 3). При необходимости проводилось незначительное подравнивание и контурирование титановая сетки для лучшего удержания материала для пересадки. Были выполнены множественные отверстия в костном мозге для индукции остеогенных клеток для более быстрого и лучшего восстановления кости.
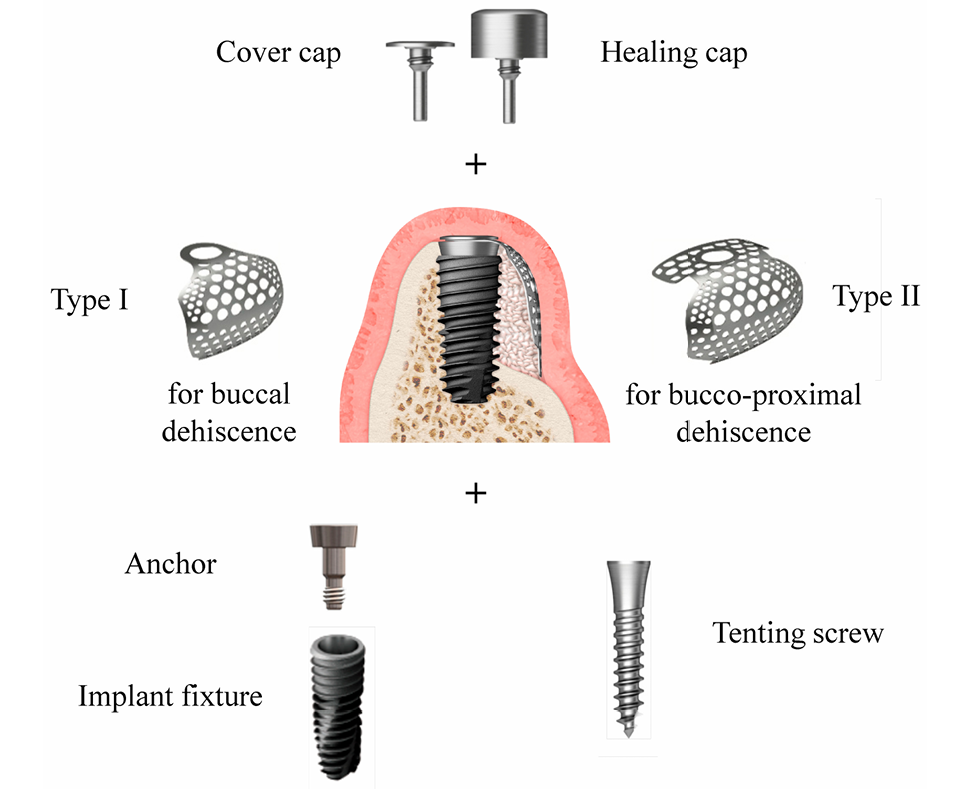
Согласно конверту рандомизации, пациенты были распределены на две группы: группа Bio-Oss и группа A-Oss. Открытые резьбы импланта были покрыты лиофилизированным костным аллографтом (FDBA; SureOss, HansBiomed, Сеул, Корея) и накрыты ABBM, Bio-Oss или A-Oss в соотношении 1:1 по объему для поддержания контура. Закрепляющая часть, которая соединяет имплант и предварительно сформированную ультратонкую титановой сеткой, была вручную затянута на импланте, и выбранная ультратонкая титанова сетка была применена на этот якорь для удержания всего материала для пересадки (Рисунок 3). Если имплант был установлен с крутящим моментом
≤30 Ncm или значение коэффициента стабильности имплантата ≤70, крышка была соединена с титановой сеткой согласно погруженному подходу. Если нет, то заживляющая крышка была немедленно соединена согласно непогруженному подходу. На титановую сетку была адаптирована рассасывающаяся коллагеновая мембрана (OssGuide, SK Bioland, Чхонан, Корея) или OssMem hard (Osstem), чтобы минимизировать риск истончения надлежащей десны, что может привести к раннему обнажению титановый сетки. Периост полнослойного лоскута был освобожден для бесстрессового первичного закрытия раны. Пациенты получали анальгетики и антибиотики в течение 10 дней для контроля послеоперационной боли и инфекции. Полоскания рта хлоргексидином также назначались дважды в день. Швы были удалены через 10 дней после операции.
Через 8 месяцев после операции была проведена повторная операция с использованием аналогичного дизайна лоскута под местной анестезией. После удаления титановый сетки была оценена плотность кости по глубине зондирования, которая измерялась в регенерированной кости под центром титановый сетки, с использованием контролируемой силы 0,25 N (Рисунок 2c). Крышка или заживляющая крышка были заменены на заживляющий абатмент, а лоскуты были подкорректированы и зашиты. Швы были удалены через 10 дней после операции. После повторной операции мягкие ткани вокруг заживляющего абатмента были даны зажить перед снятием слепков. Одно временное восстановление было интегрировано с титановым индивидуальным абатментом для прогрессивной нагрузки, а окончательное восстановление было доставлено через 12 месяцев после операции. Любые послеоперационные последствия в процедурах GBR были зарегистрированы в соответствии с предыдущей классификацией осложнений GBR и лечились тем же хирургом (C.-J.P.).
Оценка объема трансплантата
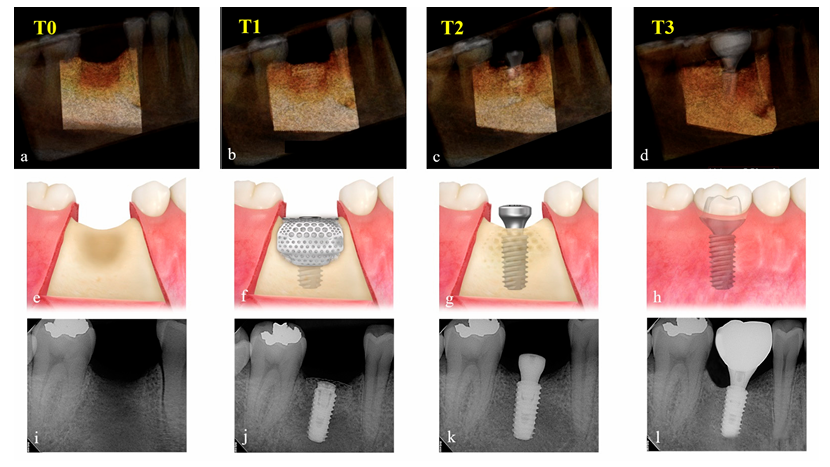
Изменения в увеличенном объеме материала для трансплантации оценивались путем сравнения данных КТ, полученных до операции (T0), сразу после операции по установке имплантата и GBR (T1), после повторного доступа (T2) и после доставки окончательной реставрации (T3). Параметры экспозиции для КТ-сканирования (поле зрения 35 × 50 мм; размер вокселя 0.2 мм; время 10.8 с; кВ 75; мА 10; дозовая площадь 240 мГр·см2) были установлены на минимально возможном уровне (ALARA). С помощью программного обеспечения Aquarium iNtuition (TeraRecon, Дерем, Северная Каролина, США) место установки имплантата было реконструировано в трехмерное изображение и сегментировано как область интереса (ROI) с использованием близлежащих анатомических структур, таких как соседние зубы, пол синуса и нижний альвеолярный канал. Отделы, которые радиологически однородны по плотности и размеру, такие как тело имплантата и абатмент для заживления, были вычтены, и объем (cc) в ROI был рассчитан в зависимости от временных периодов (Рисунок 4) независимым слепым экспертом (K.-G.H.). Поскольку это программное обеспечение широко используется в медицинской области для точного определения закрытой части крупных сосудов и точного измерения объема органа для трансплантации, оно было применено в этом исследовании для измерения объема ROI в дополнение к технологии КТ.
Статистический анализ
Размер выборки был определен для достижения 90% мощности теста при минимальном уровне α = 0,05 в соответствии с предположением о равенстве дисперсий на основе средних значений внутри субъектов и между субъектами из предыдущего рандомизированного контролируемого исследования, сравнивающего Bio-Oss и покрытый кальций-фосфатом ABBM при увеличении синуса. Исходя из этих результатов, минимальный размер выборки был оценен в 9 субъектов в каждой группе, учитывая возможный уровень выбытия 10% в течение периода исследования.
Модель смешанных эффектов использовалась для изучения различий в изменениях объема трансплантата между группами Bio-Oss и A-Oss с учетом ковариат, где изменения объема трансплантата измерялись в три последовательных периода времени, а также в исходный момент (T0). Значимость эффектов ковариат и предсказанных изменений объема трансплантата
тестировались при α = 0,05. Кроме того, описательная статистика о общей информации о пациентах в исходный момент была обобщена с указанием числа случаев и процента для категориальных переменных и со средним ± стандартным отклонением для непрерывных переменных.
Все статистические анализы были выполнены с использованием SAS, версии 9.4 (SAS Inc., Кэри, Северная Каролина, США). Статистическая значимость была установлена как p < 0.05.
Результаты
Всего было последовательно включено 18 пациентов, и двое пациентов выбыло (по одному в каждой группе) из-за потери наблюдения. В конечном итоге данные 16 пациентов (7 мужчин и 9 женщин) со средним возрастом 54.3 ± 11.7 лет (в диапазоне от 28 до 72 лет) были собраны и оценены в этом исследовании (Таблица 1). Демографическое сравнение между двумя группами показано в Таблице 2. Существенная разница между группами Bio-Oss и A-Oss была обнаружена только по длине имплантата (p < 0.01).
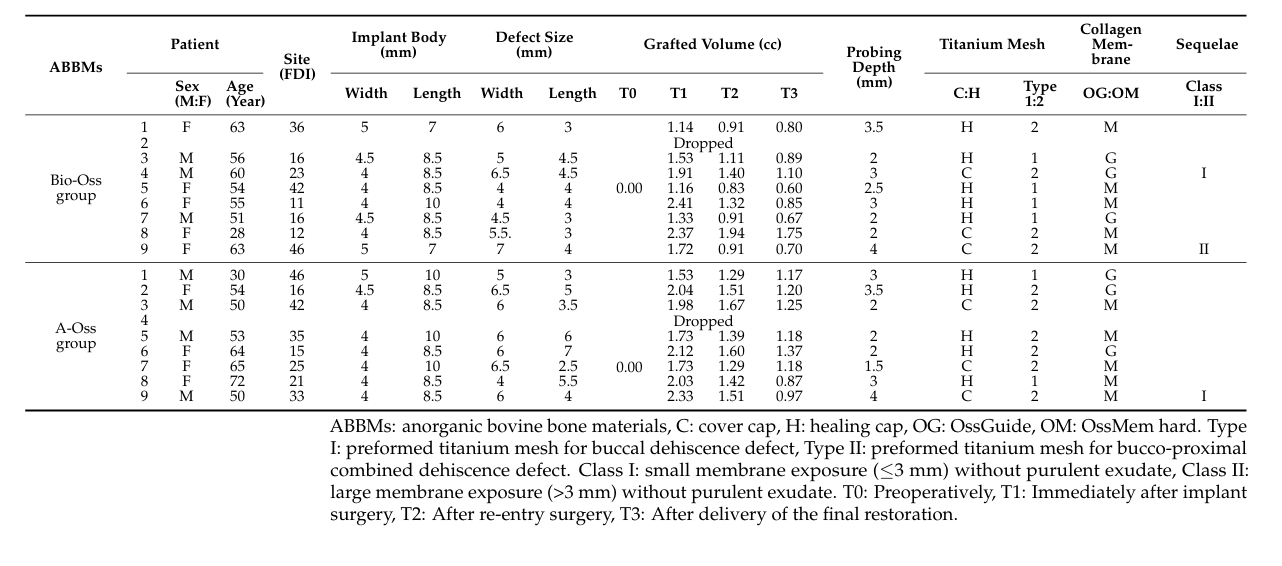
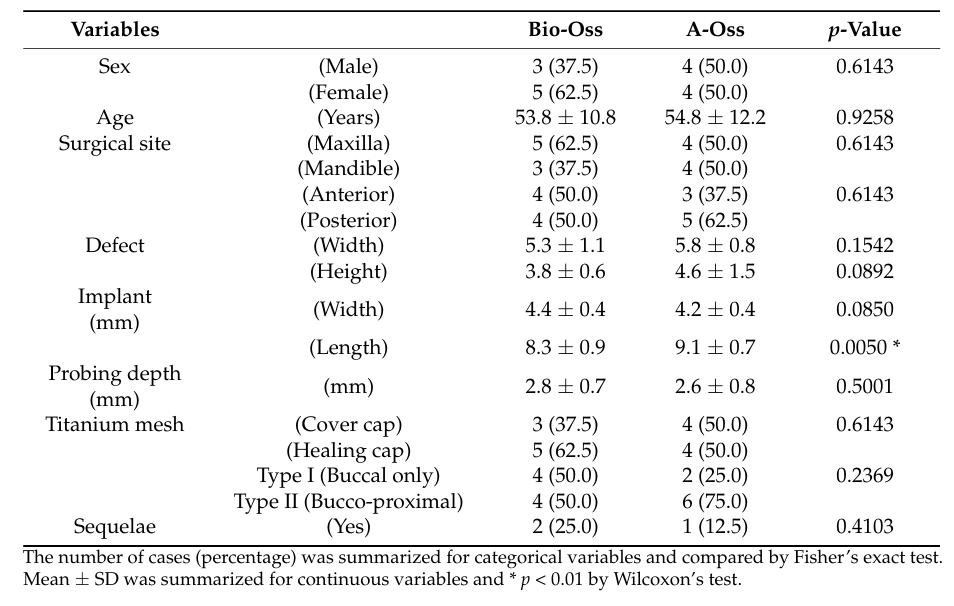
В обеих группах объем трансплантата, который достиг максимума в 1.70 ± 0.50 cc в группе Bio-Oss и 1.94 ± 0.26 cc в группе A-Oss на T1, продолжал уменьшаться до T3. Объемы трансплантатов сократились до 1.17 ± 0.38 cc в группе Bio-Oss и 1.46 ± 0.14 cc в группе A-Oss на T2 и 0.92 ± 0.37 cc в группе Bio-Oss и 1.15 ± 0.16 cc в группе A-Oss на T3; была значительная разница в объемах трансплантатов между временными периодами (p < 0.001, Таблица 3). Однако не было значительной разницы между двумя группами на всех временных периодах (p > 0.05, Рисунок 5). Более того, не было значительной разницы в плотности регенерированной кости на T3 между группами (p > 0.05).

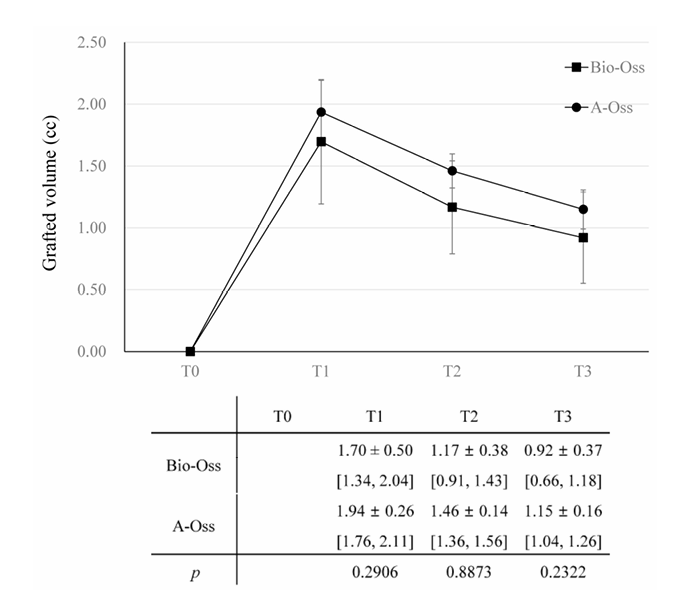
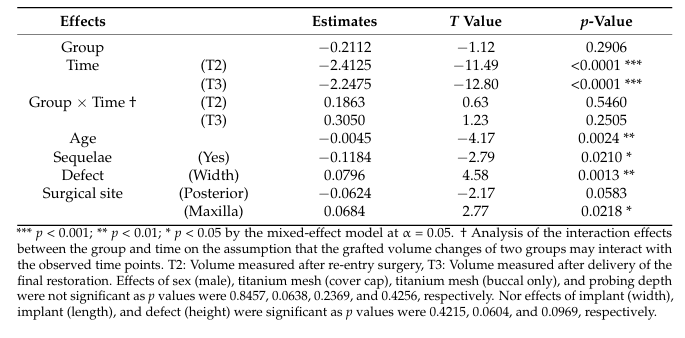
В анализе модели смешанных эффектов T2 и T3 как временные периоды (p < 0.001), более старший возраст (p < 0.01) и наличие последствий (p < 0.05) указывали на значительные уменьшения в объеме трансплантата; наоборот, более широкий дефект (p < 0.01) и верхняя челюсть как хирургический участок (p < 0.05) приводили к меньшим уменьшениям в объеме трансплантата (Таблица 4). Послеоперационные последствия были отмечены у трех пациентов, из которых двое (Класс I и II на местах кристального шва) в группе Bio-Oss и один (Класс I на буко-мезиальном крае сетки) в группе A-Oss. Все послеоперационные последствия произошли в погруженных случаях с крышками, и значительной разницы между двумя группами не было. Пациентам было рекомендовано аккуратно и осторожно чистить сетку мягкой зубной щеткой, смоченной 1% гелем хлоргексидина, дважды в день. Несмотря на отсутствие реэпителизации, покрывающей обнаженную область сетки, преждевременное удаление этих обнаженных сеток не было необходимо, и повторное обнажение резьбы имплантата и значительная потеря материала для трансплантации с гнойным выделением не наблюдались на протяжении всего периода заживления; дополнительная трансплантация не была необходима на T2.
Обсуждение
Это рандомизированное контролируемое исследование было разработано для оценки потенциала A-Oss в поддержании количества и качества кости регенерированной кости с помощью GBR как низкотемпературно-синтерованного ABBM по сравнению с Bio-Oss, и нулевая гипотеза о отсутствии различий была принята. Несмотря на использование объемно-стабильных ABBM, в процессе замещения новым костным веществом было потеряно в общей сложности 46,0% (0,78 ± 0,37 см³) и 40,8% (0,79 ± 0,33 см³) графтированных объемов в группах Bio-Oss и A-Oss соответственно. Возможным объяснением большей резорбции, превышающей ожидания, является то, что графтированный объем, измеренный на T1, был четко обозначен тонкой радиопрозрачной титановой сеткой на CBCT-сканах, в то время как нечеткая радиологическая периферия между графтированными материалами и мягкими тканями привела к недооценке графтированного объема после удаления титановый сетки как на T2, так и на T3. По сравнению с потерей графтированного объема в 17,3~23,9% до 6 месяцев после операции по поднятию синуса, уменьшение графтированного объема после GBR предполагалось больше, поскольку общее давление накладываемых мягких тканей может быть выше, чем интра-синусное пневматическое давление. Были проведены только линейные измерения для оценки толщины увеличенной области с помощью GBR на ограниченных CBCT-сканах, и наши результаты не удивительны, учитывая, что линейное уменьшение составило от 20,2% до 42,8% на плечах имплантата после графтирования Bio-Oss. Однако мы должны признать, что существовал постоянный риск измерительных ошибок, вызванных металлическими артефактами, поскольку различные металлические компоненты, такие как тело имплантата и титановая сетка, существовали одновременно в CBCT.
Сосредоточив внимание на изменении объема трансплантата, влияние наличия последствий и хирургического участка показало статистически значимые различия (p < 0.05). Другими словами, если GBR имел послеоперационные осложнения или хирургический участок находился в задней части (по сравнению с передней, p = 0.0583) и не в верхней челюсти (по сравнению с нижней челюстью), то было более вероятно, что произойдет большая резорбция объема трансплантата. Задняя область нижней челюсти обычно состоит из плотной кости с более толстой кортикальной оболочкой, и результат увеличения кости менее предсказуем, даже если он комбинируется с обширными отверстиями в костном мозге. Кроме того, влияние возраста и ширины дефекта также показало значительные различия (p < 0.01), что означает, что у пожилых пациентов и при более узких дефектах декомпенсации будет более вероятно проявление большей резорбции объема трансплантата. Пожилые пациенты, как правило, имели более высокий риск неудачи имплантата с меньшими возможностями регенерации кости после GBR, и резорбция на участке GBR была меньше, так как больше материалов для костной трансплантации было упаковано в более широкие дефекты и надежно защищено титановой сеткой, максимизирующей свойство стабильного объема ABBMs. Предварительно сформированная ультратонкая титановая сетка была подходящей для идеального контура кости, особенно на уровне верхней части имплантата, предотвращая обрушение трансплантата. Предполагая, что дефект вокруг имплантата находится в пределах оригинального костного каркаса, дефекты типа фенестрации показали большее заполнение кости и меньше осложнений, чем дефекты типа декомпенсации. Таким образом, мы не можем найти значительное влияние высоты дефекта на изменение объема трансплантата.
В отличие от ABBM для сохранения объема, аллогенные материалы для костной трансплантации продемонстрировали активное образование костной ткани с островками новой кости, которые могут быть интерпретированы как доказательство индукции кости и, похоже, находились в более активном состоянии обмена и замены. Техника наложения слоев с использованием различных трансплантационных материалов обычно применяется для увеличения деhisced или недостаточной альвеолярной кости вокруг зубных имплантатов. Обычно аутогенная кость использовалась в качестве внутреннего слоя в непосредственном контакте с имплантатом; однако аллогенная кость также использовалась, когда объем забора аутогенной кости был недостаточен. В этом исследовании внешний слой ABBM был помещен на аллографт для сохранения и поддержания увеличенной кости, а третий слой абсорбируемой коллагеновой мембраны был помещен для предотвращения вторжения мягких тканей и неостеогенных клеток в трансплантированный участок. Учитывая необходимость барьерной мембраны, была использована титановая сетка для создания пространства и стабилизации кровяных сгустков, а наложенная абсорбируемая коллагеновая мембрана использовалась для клеточной окклюзии, чтобы предотвратить преждевременное истончение наложенной десны, полностью разделяя отсеки для костной и эпителиальной регенерации. Как неабсорбируемая барьерная мембрана, удаление титановый сетки неизбежно; однако повторная операция для ее удаления является отличной возможностью оценить количество и качество регенерированной кости для определения успеха GBR. Обычно, хотя количество кости можно оценить радиологически с помощью 3D-реконструкции CBCT-сканов на месте GBR, качество кости оценивалось гистологически или гистоморфометрически путем получения и анализа биопсии костного стержня из регенерированного гребня. Тем не менее, в нашем исследовании качество кости было грубо оценено путем оценки кортикализации места GBR с использованием глубины зондирования во время повторного входа, поскольку технически было сложно или часто невозможно получить образец кости из реконструированного периплантного участка. После удаления титановый сетки более тщательная проверка зажившего участка показала, что регенерированная твердая ткань поверхностно покрыта тонким слоем мягкой ткани толщиной 1–2 мм. Этот слой был описан как «псевдопериостеум», и клиническое значение этого гистологически соединительного и грануляционного слоя ткани неизвестно; однако этот тонкий слой, похоже, стабилен по размеру, и его удаление не было показано во время повторного входа. В нашем исследовании глубины зондирования 2.8 ± 0.7 мм и 2.6 ± 0.8 мм в группах Bio-Oss и A-Oss соответственно могут быть толщиной незрелой кости, включая «псевдопериостеум», в процессе кортикализации под титановый сеткой. Этот подход к оценке качества регенерированной кости предполагается как основное ограничение нашего исследования, и потребуется дальнейшее гистологическое и гистоморфометрическое исследование для детального анализа регенерированной кости.
Несмотря на то, что реэпителизация не произошла при небольших (2 пациента) и больших (1 пациент) экспозициях титановой сетки без гнойного экссудата в течение периода заживления, утечка материала для пересадки не наблюдалась, и не было показаний к преждевременному удалению открытой титановой сетки и дополнительной пересадке. Однако глубина зондирования увеличилась до 3~4 мм из-за компенсаторного присутствия более толстой "псевдопериостеума", который участвовал в надежном удержании материала для пересадки в случаях открытой титановой сетки. Предыдущее исследование также подтвердило, что экспозиция титановой сетки не оказала негативного влияния на клинический исход процедуры увеличения и успех процедуры костной пересадки. Особенно все послеоперационные последствия произошли в случаях, когда титановая сетка была зафиксирована и стабилизирована крышками, хотя это не было статистически значимо. Поскольку крышки были соединены с имплантатом с низкой первичной стабильностью в нашем исследовании, большее напряжение, возникающее из-за меньшего количества избыточной мягкой ткани, могло быть связано с более высокой частотой послеоперационного расхождения раны в погруженном подходе по сравнению с непогруженным подходом. Не было значительной разницы в послеоперационных последствиях между группами Bio-Oss и A-Oss.
Выводы
В рамках ограничений данного исследования можно сделать следующие выводы:
- Дефект декомпенсации вокруг имплантата был успешно восстановлен с помощью GBR с двойным слоем аллографта и ABBM, которые были покрыты предварительно сформированной ультратонкой титановою сеткой и абсорбируемой коллагеновой мембраной;
- Несмотря на эффект поддержания объема от ABBM, примерно 27,8% резорбции объема трансплантата было отмечено на T2, и не было значительной разницы между группами Bio-Oss и A-Oss, даже в качестве регенерированной кости;
- Потеря объема трансплантата (примерно 43,2%) продолжалась до T3 и не отличалась между группами Bio-Oss и A-Oss.
ДжеХюн Лим, СанХо Чун, Марко Талларико, Чун-Бом Пак, Дэ-Хо Пак, Кюн-Гюн Хван и Чан-Чжу Пак
Ссылки
- Пьетурссон, Б.Е.; Тома, Д.; Юнг, Р.; Цваhlen, М.; Зембик, А. Систематический обзор выживаемости и частоты осложнений фиксированных зубных протезов на имплантатах (FDP) после среднего периода наблюдения не менее 5 лет. Clin. Oral Implant. Res. 2012, 23, 22–38. [CrossRef] [PubMed]
- Урбан, И.; Капланис, Н.; Лозада, Ж.Л. Одновременная вертикальная направленная регенерация кости и направленная регенерация тканей в задней челюсти с использованием рекомбинантного человеческого фактора роста, производимого тромбоцитами: клинический случай. J. Oral Implantol. 2009, 35, 251–256. [CrossRef]
- Адеимо, У.; Рейтер, Т.; Блох, В.; Коркмаз, Y.; Фишер, Дж.Х.; Золлер, Дж.Е.; Кюблер, А.Ц. Заживление костных трансплантатов onlay, покрытых коллагеновой мембраной или заменителями костей крупного рогатого скота: Микроскопическое и иммуногистохимическое исследование на овцах. Int. J. Oral Maxillofac. Surg. 2008, 37, 651–659. [CrossRef] [PubMed]
- Блок, М.С.; Калим, А. Использование синтерованного ксенографта поверх аллографта для увеличения гребня: Примечание по технике. J. Oral Maxillofac. Surg. 2014, 72, 496–502. [CrossRef] [PubMed]
- Бусер, Д.; Шапюи, В.; Кухлер, У.; Борнштейн, М.; Виттнебен, Дж.; Бусер, Р.; Кавусоглу, Y.; Бельсер, У.Ц. Долговременная стабильность раннего размещения имплантатов с увеличением контура. J. Dent. Res. 2013, 92, 176S–182S. [CrossRef] [PubMed]
- Йенсен, С.С.; Босшардт, Д.Д.; Грубер, Р.; Бусер, Д. Долговременная стабильность увеличения контура в эстетической зоне: Гистологическая и гистоморфометрическая оценка 12 человеческих биопсий через 14–80 месяцев после увеличения. J. Periodontol. 2014, 85, 1549–1556. [CrossRef] [PubMed]
- Чо, Й.С.; Хванг, К.Г.; Чун, С.Х.; Талларико, М.; Квон, А.М.; Пак, Ч.Ж. Радиологический сравнительный анализ между заполнением физиологическим раствором и фибрином, богатым тромбоцитами, после гидравлического транс-крестцового поднятия синуса без дополнительного костного трансплантата: Рандомизированное контролируемое исследование. Clin. Oral Implant. Res. 2020, 31, 1087–1093. [CrossRef]
- Невинс, М.; Невинс, М.Л.; Ким, С.-В.; Шупбах, П.; Ким, Д.М. Использование коллагеновой матрицы мукографта для увеличения зоны кератинизации тканей вокруг зубов: Пилотное исследование. Int. J. Periodontics Restor. Dent. 2011, 31, 367–373.
- Ли, Дж.С.; Шин, Х.К.; Юн, Дж.Х.; Чо, К.С. Рандомизированное клиническое испытание по трансплантации синуса верхней челюсти с использованием депротеинизированного свиного и крупного рогатого скота костного минерала. Clin. Implant. Dent. Relat. Res. 2017, 19, 140–150. [CrossRef] [PubMed]
- Сусин, С.; Ли, Дж.; Фиорини, Т.; Ку, К.Т.; Шюпбах, П.; Ангст, П.Д.; Фингер Штедлер, А.; Вайксё, У.М. Скрининг кандидатных биоматериалов для альвеолярного увеличения с использованием модели критического размера дефекта черепа у крыс. J. Clin. Periodontol. 2018, 45, 884–893. [CrossRef]
- Амара, Х.Б.; Ли, Дж.-В.; Ким, Дж.-Дж.; Кан, Й.-М.; Кан, Е.-Дж.; Ку, К.-Т. Влияние rhBMP-2 на направленную регенерацию кости для размещения и функциональной нагрузки зубных имплантатов: Радиографическое и гистологическое исследование на собаках. Int. J. Oral Maxillofac. Implant. 2017, 32, e265–e276. [CrossRef] [PubMed]
- Чо, Дж.С.; Ким, Х.С.; Ум, С.Х.; Ри, С.Х. Подготовка нового неорганического ксенографта из костей крупного рогатого скота с улучшенной биоактивностью и остеокондуктивностью. J. Biomed. Mater. Res. Part B Appl. Biomater. 2013, 101, 855–869. [CrossRef] [PubMed]
- Хер, С.; Кан, Т.; Фиен, М.Й. Титановая сетка как альтернатива мембране для увеличения гребня. J. Oral Maxillofac. Surg. 2012, 70, 803–810. [CrossRef]
- Луис, П.Ж.; Гутта, Р.; Сайд-Ал-Наиеф, Н.; Бартолуцци, А.А. Реконструкция верхней и нижней челюсти с использованием частиц костного трансплантата и титановую сетку для размещения имплантатов. J. Oral Maxillofac. Surg. 2008, 66, 235–245. [CrossRef] [PubMed]
- Рахматия, Й.Д.; Аюкава, Й.; Фурухаши, А.; Кояно, К. Современные барьерные мембраны: Титановая сетка и другие мембраны для направленной регенерации кости в стоматологических приложениях. J. Prosthodont. Res. 2013, 57, 3–14. [CrossRef]
- Юнг, Г.-У.; Чон, Дж.-Й.; Хванг, К.-Г.; Пак, Ч.-Дж. Предварительная оценка трехмерной, индивидуализированной и предварительно сформированной титановою сетки в регенерации альвеолярной кости вокруг имплантата. J. Korean Assoc. Oral Maxillofac. Surg. 2014, 40, 181. [CrossRef]
- Ли, С.-Х.; Мун, Дж.-Х.; Чжонг, Ч.-М.; Бэ, Е.-Б.; Пак, Ч.-Е.; Чон, Г.-Р.; Ли, Дж.-Дж.; Чон, Й.-С.; Хух, Дж.-Б. Механические свойства и биометрический эффект 3D предварительно сформированной титановою мембраны для направленной регенерации кости на дефекте альвеолярной кости. BioMed Res. Int. 2017, 2017, 7102123. [CrossRef]
- Талларико, М.; Черузо, Ф.М.; Муззи, Л.; Мелони, С.М.; Ким, Й.-Дж.; Гаргари, М.; Мартинолли, М. Влияние одновременного немедленного размещения имплантата и направленной костной реконструкции с ультратонкими титановыми мембранами на радиографические и клинические параметры через 18 месяцев нагрузки. Materials 2019, 12, 1710. [CrossRef] [PubMed]
- Фонтана, Ф.; Машера, Е.; Роккьетта, И.; Симион, М. Клиническая классификация осложнений в процедурах направленной регенерации кости с использованием несорбируемой мембраны. Int. J. Periodontics Restor. Dent. 2011, 31, 265.
- Лиянаге, Л.; Ли, Н.Ж.; Кук, Т.; Херрманн, Х.Ц.; Джагася, Д.; Литт, Х.; Хан, Й. Влияние пола на кальцификацию сердечно-сосудистой системы у очень пожилых пациентов с тяжелым аортальным стенозом. Int. J. Cardiovasc. Imaging 2016, 32, 173–179. [CrossRef]
- Лодевик, Т.М.; Арнольдуссен, К.В.; Лахай, М.Ж.; ван Мирло, К.М.; Нойманн, У.П.; Беетс-Тан, Р.Г.; Дейонг, К.Х.; ван Дам, Р.М. Быстрая и точная волюметрия печени перед гепатэктомией. HPB 2016, 18, 764–772. [CrossRef] [PubMed]
- Панг, К.-М.; Ли, Дж.-К.; Чхой, С.-Х.; Ким, Й.-К.; Ким, Б.-Дж.; Ли, Дж.-Х. Увеличение синуса верхней челюсти с использованием анорганической костной ткани, покрытой двойным слоем кальций-фосфата: Сравнительное многоцентровое рандомизированное клиническое испытание с гистологической и радиографической оценкой. Implant. Dent. 2019, 28, 39–45. [CrossRef] [PubMed]
- Мир-Мари, Дж.; Вуи, Х.; Юнг, Р.Е.; Хаммерле, Ч.Х.; Беник, Г.И. Влияние закрытия раны на стабильность объема различных материалов GBR: Витро исследование с использованием конусно-лучевой компьютерной томографии. Clin. Oral Implant. Res. 2016, 27, 258–265. [CrossRef] [PubMed]
- Охе, Дж.Й.; Ким, Г.Т.; Ли, Дж.В.; Аль Навас, Б.; Юнг, Дж.; Квон, Й.Д. Стабильность объема гидроксиапатита и β-трикальцийфосфатного бифазного костного трансплантата при поднятии дна синуса верхней челюсти: Радиографическое исследование с использованием 3D конусно-лучевой компьютерной томографии. Clin. Oral Implant. Res. 2016, 27, 348–353. [CrossRef] [PubMed]
- Мир-Мари, Дж.; Беник, Г.И.; Вальмеседa-Кастельон, Е.; Хаммерле, Ч.Х.; Юнг, Р.Е. Влияние закрытия раны на стабильность объема частиц и непартикулярных материалов GBR: Витро исследование с использованием конусно-лучевой компьютерной томографии. Часть II. Clin. Oral Implant. Res. 2017, 28, 631–639. [CrossRef] [PubMed]
- Эспозито, М.; Магхайре, Х.; Груссовин, М.Г.; Зиунас, И.; Уортингтон, Х.В. Управление мягкими тканями для зубных имплантатов: Какие методы наиболее эффективны? Систематический обзор Кокрейна. Eur. J. Oral. Implant. 2012, 5, 221–238.
- Йемт, Т. Неудачи имплантатов и возраст на момент операции: Ретроспективное исследование имплантологического лечения у 2915 частично беззубых челюстей. Clin. Implant. Dent. Relat. Res. 2019, 21, 686–692. [CrossRef] [PubMed]
- Йенсен, С.С.; Терхейден, Х. Процедуры увеличения кости в локализованных дефектах альвеолярного гребня: Клинические результаты с различными костными трансплантатами и материалами-заменителями костей. Int. J. Oral Maxillofac. Implant. 2009, 24, 218–236.
- Шейер, Е.Т.; Херд, Р.; Янакиевски, Дж.; Манделарис, Г.; Невинс, М.Л.; Пикеринг, С.Р.; Ричардсон, С.Р.; Поуп, Б.; Тобак, Г.; Веласкес, Д.; и др. Рандомизированное контролируемое многоцентровое клиническое испытание по сохранению альвеолярного гребня после экстракции. J. Clin. Periodontol. 2016, 43, 1188–1199. [CrossRef]
- Ван, Х.-Л.; Миш, К.; Нейва, Р.Ф. Техника увеличения кости «сэндвич»: Обоснование и отчет о пилотных случаях. Int. J. Periodontics Restor. Dent. 2004, 24, 232–245.
- Сарначиаро, Г.О.; Чу, С.Й.; Сарначиаро, Е.; Готта, С.Л.; Тарнов, Д.П. Немедленное размещение имплантатов в экстракционных лунках с дефектами декомпенсации губной пластины: Серия клинических случаев. Clin. Implant. Dent. Relat. Res. 2016, 18, 821–829. [CrossRef]
- Мелони, С.М.; Йованович, С.А.; Урбан, И.; Бальдони, Е.; Пизано, М.; Талларико, М. Горизонтальное увеличение гребня с использованием GBR с естественной коллагеновой мембраной и соотношением 1:1 частиц ксенографта и аутологичной кости: Перспективное клиническое исследование через 3 года после окончательной нагрузки. Clin. Implant. Dent. Relat. Res. 2019, 21, 669–677. [CrossRef] [PubMed]
- Куччи, А.; Сартори, М.; Парилли, А.; Альдини, Н.Н.; Винуделли, Е.; Коринальдези, Г. Гистологический и гистоморфометрический анализ костной ткани после направленной регенерации кости с использованием несорбируемых мембран против рассасывающихся мембран и титановою сетки. Clin. Implant. Dent. Relat. Res. 2019, 21, 693–701. [CrossRef]
- Пруссаефс, П.; Лозада, Ж. Использование титановою сетки для поэтапного локализованного увеличения альвеолярного гребня: Клиническая и гистологическая-гистоморфометрическая оценка. J. Oral Implantol. 2006, 32, 237–247. [CrossRef]
- Сагхеб, К.; Шейгниц, Е.; Мёргель, М.; Уолтер, С.; Аль-Навас, Б.; Вагнер, В. Клинический результат увеличения альвеолярного гребня с индивидуально изготовленной титановою сеткой CAD-CAM. Int. J. Implant. Dent. 2017, 3, 1–7. [CrossRef] [PubMed]
