Гистоморфометрия кости после намеренно экспонированной нерассасывающейся d-PTFE мембраны или направленной регенерации кости для лечения постэкстракционных альвеолярных дефектов с имплант-supported восстановлением: пилотное рандомизированное контролир...
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Цель: Целью настоящего исследования было провести количественное гистологическое исследование костной ткани, реконструированной с использованием нерассасывающейся мембраны из политетрафторэтилена высокой плотности (d-PTFE), оставленной намеренно открытой в лунках после удаления зубов, заполненных анорганическим костным материалом, и удаленной через четыре недели, по сравнению с удалением зуба и направленной регенерацией кости (GBR), проведенной через два месяца.
Материалы и методы: Это исследование было спроектировано как многоцентровое рандомизированное контролируемое испытание с параллельными группами. Пациенты были отобраны и последовательно лечились в трех центрах в Италии. Пациенты случайным образом получали намеренно открытую нерассасывающуюся мембрану d-PTFE (группа A) или направленную регенерацию кости (группа B) для лечения постэкстракционных дефектов альвеолярной кости с имплантируемыми реставрациями. Результаты включали: неудачу импланта, любые механические и биологические осложнения, удовлетворенность пациентов, а также качественную и гистоморфометрическую оценку собранных образцов кости.
Результаты: В исследование последовательно были включены восемнадцать пациентов. Из них шесть из 18 пациентов были мужчинами. Все включенные пациенты были лечены в соответствии с назначенными вмешательствами, и не было случаев отказа от участия. Не было зафиксировано ни одной неудачи импланта и никаких осложнений, и все пациенты были полностью удовлетворены функцией и эстетикой своих восстановлений на имплантах, без различий между группами. Морфологический анализ не выявил признаков реакции тканей, таких как фиброз или некроз. Регенерированная кость была хорошо минерализована в обеих группах, но казалась более зрелой в группе B, чем в группе A. Три образца показали минимальное количество лимфоцитов. Несколько мелких кровеносных сосудов занимали медуллярные пространства, где ткань проявила большую зрелость, что указывает на активность ткани в процессе. Гистоморфометрическая оценка не показала статистически значительных различий в объемных долях тканей между двумя группами пациентов.
Выводы: С учетом ограничений настоящего исследования, реконструкция щечной пластины с намеренно открытой несоразбираемой мембраной является эффективной и простой процедурой для регенерации резорбированной щечной костной пластины, что снижает необходимость в направленной регенерации кости.
Введение
Потеря альвеолярной кости может быть вызвана различными факторами, такими как эндодонтическая патология, пародонтит, травмы лица и агрессивные маневры во время экстракций. Более того, после удаления зуба происходит каскад биологических событий, который, как правило, приводит к значительным местным анатомическим изменениям, включая уменьшение высоты и ширины остаточного гребня. Горизонтальная потеря кости, как правило, является наибольшей и чаще всего происходит на щечной стороне. Благоприятные показатели успеха имплантации и реакции периимплантных тканей могут быть достигнуты при установке имплантатов сразу после удаления зуба, однако наблюдалось продолжающееся отступление лицевой десневой ткани. Для улучшения эстетической предсказуемости постэкстракционных имплантатов было проведено несколько исследований и систематических обзоров для оценки эффективности различных подходов к заполнению лунки с использованием различных материалов для пересадки, с барьерными мембранами или без них. В этих исследованиях использовалось множество биоматериалов, включая аутологичную кость, заменители кости (аллографты, ксенографты и аллопласты), а также продукты, полученные из аутологичной крови, и биоактивные агенты. Однако недавние клинические испытания и систематические обзоры не смогли найти доказательства того, что какой-либо биоматериал и барьерная мембрана были бы превосходнее других. С учетом ограничений этого исследования, использование несоразбираемых мембран из политетрафторэтилена высокой плотности (d-PTFE) было безопасным и предсказуемым, особенно в отношении ширины кератинизированной ткани.
Те же исследования призывают к хорошо проведенным рандомизированным контролируемым испытаниям.
Элиан и др. предложили упрощенную классификацию лунок и неинвазивный подход к пересадке и управлению лунками, когда присутствует мягкая ткань, но бугристая пластинка повреждена (Тип II). Авторы использовали коллагеновую мембрану и материалы для пересадки для лечения лунок типа II. Недавний систематический обзор заключил, что мембраны PTFE защищают материал для пересадки и/или первоначальный сгусток от бактериального загрязнения, что приводит к успешной регенерации без значительного риска инфекции.
Целью настоящего рандомизированного контролируемого испытания было исследовать количественное гистологическое исследование кости, реконструированной с помощью мембраны d-PTFE, оставленной намеренно открытой в лунках после удаления зуба, пересаженных неорганическим костным материалом, и удаленной через четыре недели, по сравнению с удалением зуба и направленной регенерацией кости (GBR), проведенной через два месяца. Нулевая гипотеза заключалась в том, что нет статистических различий в качественной и гистоморфометрической оценке образцов между группами. Нулевая гипотеза была проверена по сравнению с альтернативной гипотезой о различии. Настоящее исследование было написано в соответствии с рекомендациями CONSORT.
Материалы и методы
Это исследование было разработано как пилотное, многоцентровое рандомизированное контролируемое испытание параллельной группы, направленное на оценку гистоморфометрии кости и клинических параметров пациентов с безнадежными зубами нижней и верхней челюсти, расположенными между премолярами, и требующими отсроченного восстановления одиночной коронки на имплантате. Пациенты были отобраны и последовательно лечены в трех центрах в Италии с ноября 2018 года по сентябрь 2020 года.
Три клинициста выполняли как хирургические, так и протезные процедуры. Калибровка хирургов обеспечила выполнение ими двух дополнительных клинических случаев, чтобы оценить и снизить потенциальные хирургические риски. Это исследование проводилось в соответствии с принципами, изложенными в Хельсинкской декларации 1964 года для биомедицинских исследований с участием людей, с поправками, внесенными на 64-й Генеральной Ассамблее ВМА, Форталеза, Бразилия, октябрь 2013 года, и получило этическое одобрение от «Этического комитета Лацио 1». Номер протокола 23/CE Лацио 1 от 7 января 2020 года. Пациенты были должным образом информированы о природе исследования. Письменная форма информированного согласия на хирургические и протезные процедуры, а также на использование клинических и радиологических данных была получена для каждого пациента до начала лечения.
Критерии включения и исключения
Любой субъект, требующий как минимум одной имплантированной одиночной реставрации между премолярами, для замены утраченного зуба с поврежденной бугристой костью, но с сохраненной архитектурой мягких тканей (Тип II по Elian et al.), будучи не моложе 18 лет и способным подписать форму информированного согласия, считался подходящим для этого исследования и последовательно включался. Безнадежные зубы оценивались следующим образом: вовлечение в разветвление > II; подвижность > II; PPD > 6 мм с процентом потери альвеолярной кости/длиной корня ≥70%; постоянная рентгенографическая патология и/или симптомы (например, боль, свищ, абсцесс) эндодонтического происхождения и неопределенный прогноз; возможность восстановления.
Каждый пациент участвовал только в одной процедуре. Выбранный участок должен был иметь соседние зубы/имплантаты. Критерии исключения были следующими:
- Общие противопоказания к оральной хирургии (такие как ASA III и IV);
- Курильщики с высоким уровнем потребления (≥ 10 сигарет в день);
- Зависимость от алкоголя или наркотиков;
- Острые и хронические инфекции в месте, предназначенном для установки имплантата;
- Плохая гигиена полости рта (индекс кровоточивости всего рта и индекс налета всего рта выше 25%);
- Беременность или кормление грудью;
- Психиатрическая терапия;
- Пациенты, получавшие или находящиеся на лечении внутривенными аминокислотными бисфосфонатами;
- Предыдущая радиотерапия области рта и челюстно-лицевой области в течение последних 5 лет;
- Пациенты, не способные соблюдать запланированные последующие визиты.
Клинические процедуры
Потенциально подходящие пациенты были клинически оценены, и их медицинские истории были записаны. Во время визита были получены предоперационные периапикальные рентгенограммы, учебные модели и фотографии, а также проведен периодонтальный скрининг.
Пациенты прошли профессиональную гигиену полости рта перед операцией и получили профилактическую антисептическую терапию (ополаскиватель для рта с 0,2% хлоргексидина за одну минуту до операции) и антибиотикотерапию (две грамма амоксициллина с клавулановой кислотой или клиндамицин 600 мг в случае аллергии на пенициллин за час до операции). Все пациенты были обработаны под местной анестезией с использованием гидрохлорида артикаина с адреналином 1:100,000 (Orabloc, Pierrel, Милан, Италия). Экстракции зубов проводились без разрезов, как можно менее травматично. Много корневые зубы были секционированы на уровне разветвления, и корни были извлечены индивидуально. Затем остаточная лунка экстракции была промыта физиологическим раствором и тщательно очищена от грануляционной ткани и остаточных волокон периодонтальной связки. Наконец, костная стенка была оценена с помощью периодонтального зонда (PCPUNC156, Hu-Friedy). После этого пациенты, которые соответствовали всем критериям включения, были окончательно зачислены, и запечатанный конверт с последовательным номером, соответствующим номеру набора пациентов, был открыт слепым независимым ассистентом для определения группы распределения.
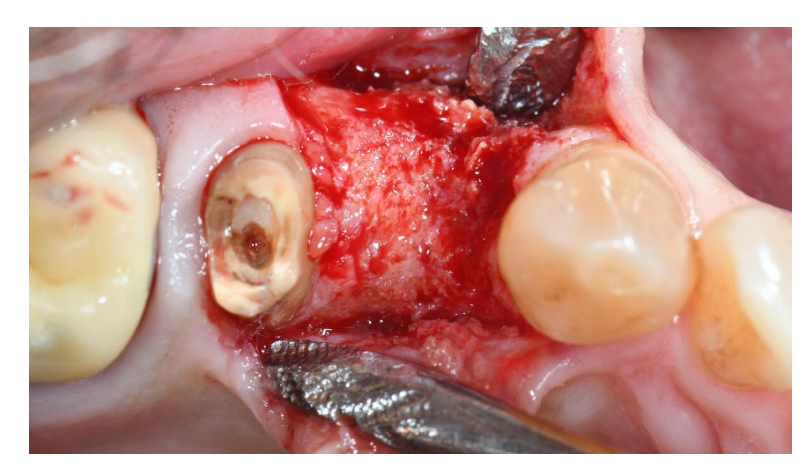
В группе A сохранение лунки с намеренно открытой нерассасывающейся мембраной d-PTFE (тестовая группа, Рисунки 1–4) остаточная альвеолярная лунка была пересажена поросенковым ксеногенным анорганическим костным материалом (частицы 0,25–1 мм, Zcore, DeOre s.r.l., Неграр [Vr], Италия). Затем нерассасывающаяся мембрана из плотного политетрафторэтилена (d-PTFE) (Cytoplast TXT1224, DeOre) была сформирована в соответствии с размерами остаточной лунки и вставлена в щечный и язычный карманы. Наконец, горизонтальный матрасный шов (Cytoplast PTFE Suture 4-0, DeOre) был наложен для закрепления мембраны и стабилизации ее к краям мягких тканей. Применение нерассасывающейся мембраны d-PTFE не требовало первичного закрытия с помощью продвижения щечного лоскута. Швы были удалены через 10–14 дней после операции, а нерассасывающаяся мембрана d-PTFE была удалена между четвертой и пятой неделями после операции. После этого рана была оставлена для заживления на примерно пять месяцев, что позволило процессу реэпителизации.
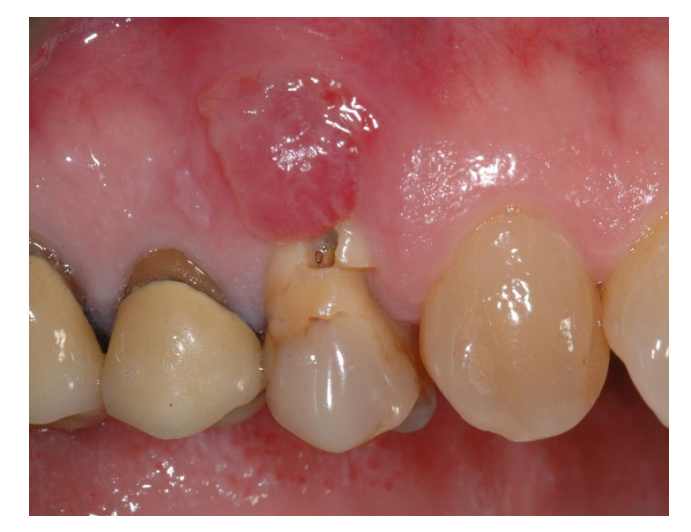
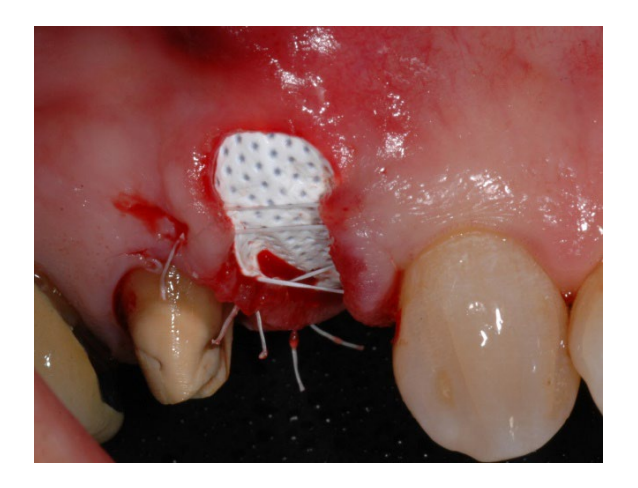
В группе B, GBR (контрольная группа, Рисунки 5–8), в лунку была вставлена только фибриновая губка для стабилизации кровяного сгустка.
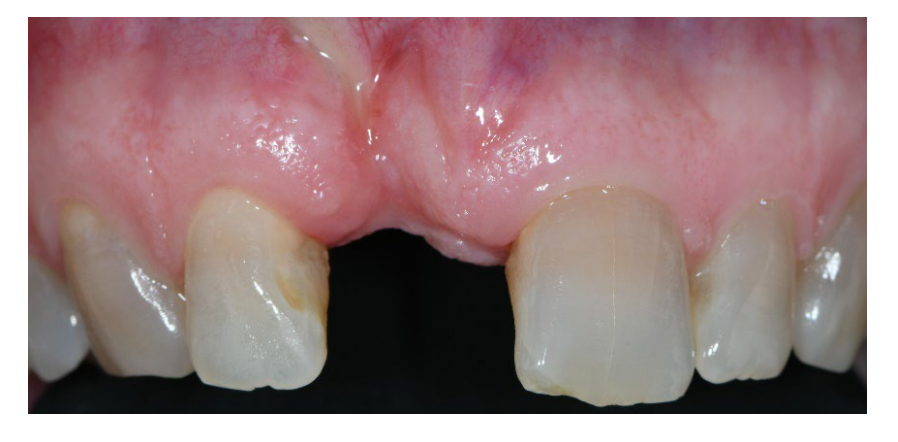
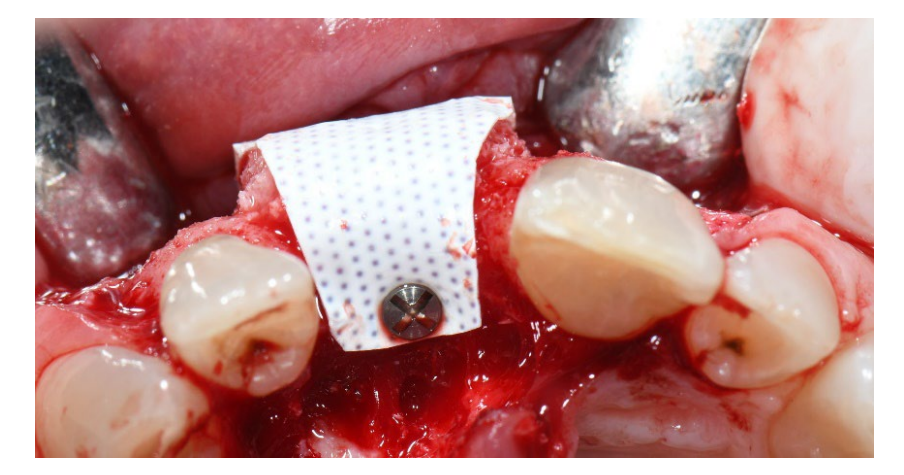
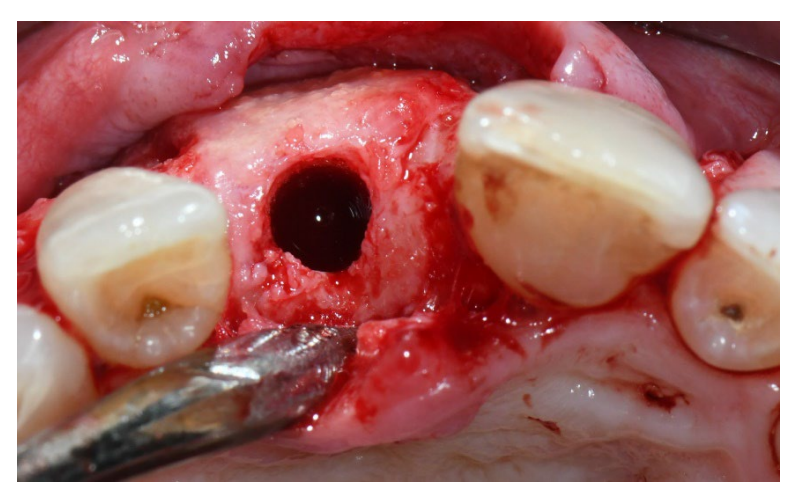
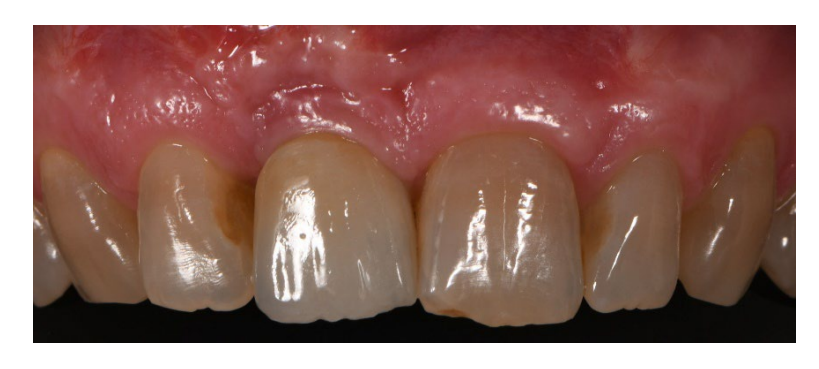
В обеих группах 1 г амоксициллина (или 300 мг клиндамицина) вводили каждые 12 часов в течение шести дней после удаления зуба и реконструкции кости. Парацетамол 500 мг плюс кодеин 30 мг назначались по мере необходимости. Пациентам было указано не принимать их в отсутствие боли. Спрей хлоргексидина 0,2% дважды в день в течение двух и пяти недель был назначен в группах A и B соответственно. Мягкая диета рекомендована на две недели после хирургических процедур в обеих группах.
В группе B, через восемь недель после удаления зуба, был выполнен интрасулкальный разрез с использованием лезвия Bard-Parker № 15C, и был поднят полнослойный лоскут за пределами мукогингивального соединения и как минимум на 5 мм за пределами костного дефекта. Два вертикальных разреза были выполнены как минимум на один зуб в стороне от области, подлежащей увеличению. Множественные декортикационные отверстия на месте рецепиента были выполнены круглым бором. Остаточная альвеолярная ячейка была пересажена частицами поросенкового анорганического костного материала (Zcore, DeOre). Затем коллагеновая мембрана (Cytoplast RTM Collagen, DeOre) была сформирована в соответствии с регенерированным костным дефектом и зафиксирована тремя-пятью титановыми штифтами (Supertack, MCbio s.r.l., Ломаззо, Италия) с боковой и язычной/небной стороны. Мембрана была обрезана до полного объема графта, на один-два миллиметра перед соседней зубной поверхностью. Периостальный разрез был выполнен между двумя вертикальными разрезами, чтобы обеспечить полностью бесстрессовое закрытие лоскута. Затем лоскуты были зашиты в два слоя, чтобы предотвратить обнажение мембраны (Cytoplast PTFE Suture 4-0). Горизонтальные матрасные швы сначала были наложены на расстоянии 4 мм от линии разреза; затем были наложены одиночные прерывающиеся швы для закрытия краев лоскута. Вертикальные разрезы были зашиты одиночными прерывающимися швами. Одиночные прерывающиеся швы были удалены через 10-14 дней после операции, а матрасные швы были удалены через две-три недели после операции. 1 г амоксициллина (или 300 мг клиндамицина) вводили каждые 12 часов в течение восьми дней после удаления зуба и реконструкции кости. Парацетамол 500 мг плюс кодеин 30 мг назначались по мере необходимости. Пациентам было указано не принимать их в отсутствие боли.
Спрей хлоргексидина 0,2% дважды в день в течение двух и пяти недель был назначен в группах A и B соответственно. Мягкая диета была рекомендована на 2 недели после хирургических процедур в обеих группах.
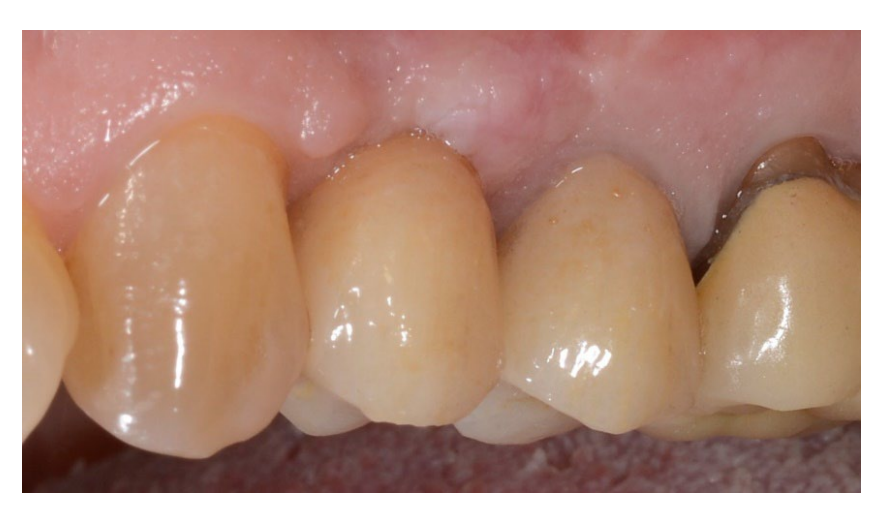
В обеих группах, через шесть-восемь месяцев после удаления зуба (группы A и B соответственно), были установлены зубные имплантаты (Premium, Швеция и Martina, Due Carrare, PD, Италия). В ни одном из случаев не было необходимости проводить дополнительную GBR. Объем кости был признан достаточным для установки имплантата диаметром 3,8 мм и длиной от 10 до 11,5 мм. Дизайн лоскута выполнялся в соответствии с клиническим сценарием и требованиями пациента. Перед подготовкой места для имплантата использовалась откалиброванная трефиновая бороздка с внешним диаметром 3,0 мм для забора образца для гистологического анализа. Имплантаты были погружены на три месяца. Через три месяца после установки имплантата была выполнена временная реставрация на винтовом креплении. Наконец, через два-три месяца после первоначальной нагрузки была выполнена окончательная, винтовая, CAD/CAM, безметалловая реставрация. Окклюзия была скорректирована, и плановые визиты были назначены каждые четыре месяца.
Показатели результатов
- Неудача имплантата определялась как подвижность имплантата и/или любая инфекция, требующая удаления имплантата, перелом имплантата или любая другая механическая осложнение, которое делает имплантат бесполезным. Кроме того, стабильность каждого имплантата измерялась вручную путем затягивания винта абатмента при установке окончательных коронок или путем оценки стабильности коронки на имплантате с использованием ручки двух металлических инструментов на каждом контрольном осмотре.
- Все механические и биологические осложнения фиксировались на протяжении всего периода наблюдения. Те же откалиброванные операторы, которые выполняли все хирургические и протезные процедуры, оценивали неудачи имплантатов и осложнения.
- Удовлетворенность пациентов оценивалась слепыми операторами в каждом центре, которые не были ранее вовлечены в исследование. При установке окончательных коронок независимый оценщик результатов задавал пациенту следующие вопросы (возможные ответы: "да" или "нет"):
- Вы удовлетворены функцией вашего зуба на имплантате?
- Вы удовлетворены эстетическим результатом вашего зуба на имплантате?
- Вы бы согласились на ту же терапию снова?
- Качественный и количественный анализы проводились на анонимизированных образцах слепым патологоанатомом. Качественная и гистоморфометрическая оценка. После сбора образцы костной ткани фиксировались в 10% формалине. Образцы обезвоживались с использованием увеличивающей шкалы этанола. После обезвоживания образцы инфильтровались метакрилатной смолой и затем встраивались в смолу (Technovit 7200, Bio Optica, Милан). Все образцы полимеризовались с использованием машины для полимеризации (Exakt 520, Exakt Norderstedt, Германия). Полученные блоки резались с помощью пилы с алмазным лезвием (Micromet, Remet, Болонья, Италия). Срезы монтировались на пластиковые слайды с использованием машины для склеивания (Exakt 402, Exakt Norderstedt, Германия) и клеевой смолы (Technovit 7210, Bio Optica, Милан, Италия), а затем шлифовались до толщины 100 мкм с использованием шлифовальной машины (LS2 Remet, Болонья, Италия). Для каждого образца были получены два представительных продольных среза, окрашенные толуидиновым синим и пиронином желтым для выделения различных фаз минерализации кости, и цифрово захвачены при общем увеличении 400× с использованием высокоразрешающего сканера (Nanozoomer S60, Hamamatsu).
- Качественная оценка была направлена на выявление количества воспалительного, фиброзного и жирового тканевого инфильтрата и возможных участков некроза в соответствии с указаниями, приведенными в стандарте ISO 10993. Гистоморфометрическая оценка объемных долей тканей проводилась с использованием стереологического метода. Цифровая сетка подсчета использовалась на каждом срезе для расчета точек пересечения, которые попадают на каждый вид ткани (ламеллярная кость, волокнистая кость, остеоидная матрица, биоматериал и мозговые пространства), и процентные доли объемов были получены путем соотношения между точками пересечения, которые попадают на каждый тип ткани, и общими точками пересечения сетки.
Статистический анализ
Размер выборки не был рассчитан. Было решено набрать 30 пациентов, так как это число соответствовало возможностям настоящих исследовательских групп. Три списка рандомизации были созданы онлайн на сайте Random Sequence Generator (https://www.random.org). Только один из исследователей (FMC), не участвующий в отборе и лечении пациентов, знал о случайной последовательности и имел доступ к спискам рандомизации, хранящимся на защищенном паролем портативном компьютере. Случайные коды были помещены в последовательно пронумерованные, идентичные, непрозрачные, запечатанные конверты. Конверты открывались последовательно после того, как подходящие пациенты подписали информированное согласие; таким образом, распределение лечения было скрыто от исследователей, отвечающих за набор и лечение пациентов. Из-за природы исследования, после распределения групп, хирурги не были ослеплены. Тем не менее, образцы были анонимизированы, и гистологическая лаборатория была ослеплена во время анализов.
Все анализы данных проводились в соответствии с заранее установленным планом анализа. Описательный анализ был выполнен с использованием среднего ± стандартного отклонения (SD) с использованием (Numbers for Mac V. 11.0 [7030.0.94], Apple Inc., Лос-Альтос, Калифорния, США). Дихотомические результаты сравнивались между группами. Сравнения между непрерывными переменными проводились с использованием независимого t-теста. Все статистические сравнения проводились на уровне значимости 0.05. Пациенты использовались в качестве статистической единицы.
Результаты
Схема потока леченных пациентов представлена на рисунке 9. Пациенты должны были быть набраны и лечены с использованием аналогичных процедур в трех различных центрах, и каждый центр должен был набрать и лечить 10 пациентов. Однако только один центр набрал всех запланированных пациентов, в то время как два других центра набрали по четыре пациента. Причинами не включения 12 пациентов стали: частые визиты на осмотры (10 пациентов) и отказ от направленной регенерации кости (два пациента). В конечном итоге 18 пациентов последовательно были включены в исследование из когорты из 30 пациентов, первоначально отобранных для соответствия критериям. Восемь пациентов были случайным образом распределены в группу A, в то время как 10 пациентов были случайным образом распределены в группу B. Из них шесть из 18 пациентов были мужчинами.
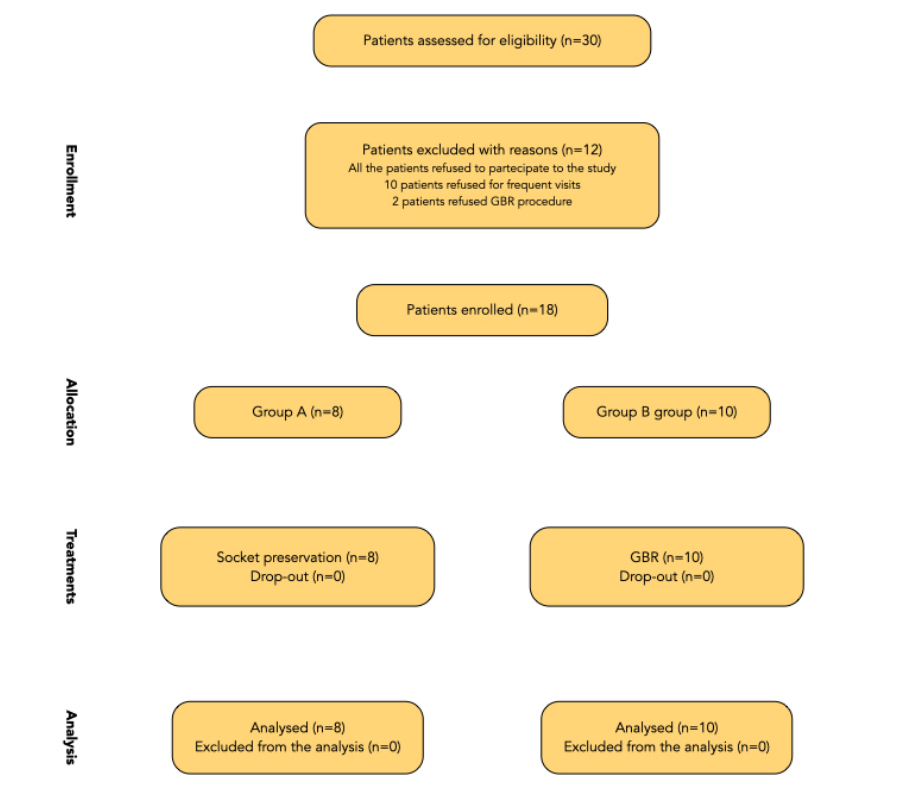
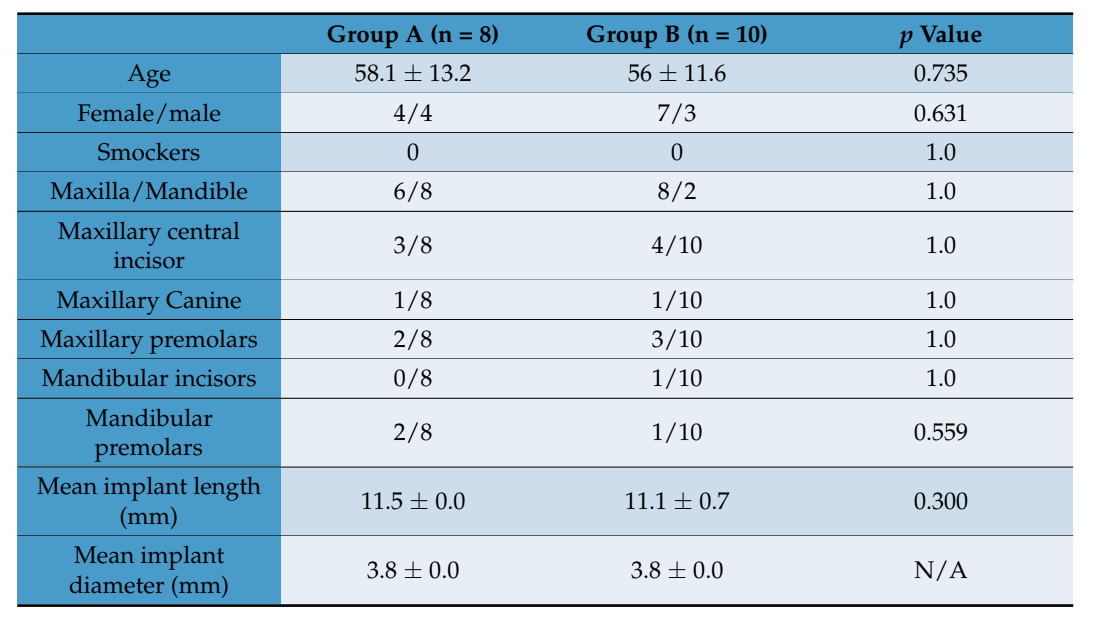
Все включенные пациенты были лечены в соответствии с назначенными вмешательствами. Первый пациент был лечен в ноябре 2018 года, в то время как последнее хирургическое лечение началось в сентябре 2020 года. Ни один пациент не выбыл из испытания, и отклонений от оригинального протокола не произошло; следовательно, все пациенты получили финальные коронки. Средний срок наблюдения после доставки протезов составил от 6 до 30 месяцев. Средний возраст пациентов составил 56,9 ± 11,9, ни один из которых не курил. Было установлено восемнадцать имплантатов, распределенных по восемь в тестовой группе (сохранение лунки, группа A) и 10 в контрольной группе (GBR, группа B). Данные всех включенных пациентов были оценены в статистическом анализе. При сравнении тестируемых групп нет дисбаланса между ними, включая положение и распределение зубов (Таблица 1).
Неудачи имплантации, осложнения и удовлетворенность пациентов
Не было зафиксировано ни одной неудачи имплантации и осложнений. Кроме того, все пациенты были полностью удовлетворены функцией и эстетикой своих восстановлений на имплантатах, и не было замечено различий в их восприятии терапии, поэтому все пациенты согласились бы на ту же терапию.
Гистоморфометрический анализ
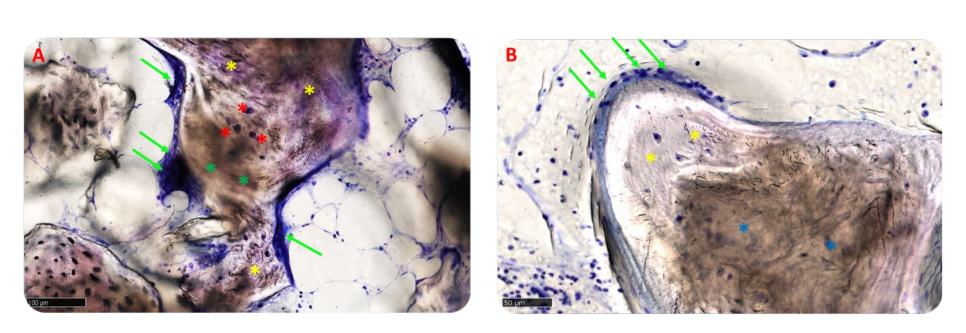
Морфологический анализ не выявил признаков реакции ткани, таких как фиброз или некроз. Регенерированная кость была хорошо минерализована в обеих группах, но казалась более зрелой в группе B, чем в группе A, как видно на рисунке 10A,B, который показывает обзоры представительных образцов.
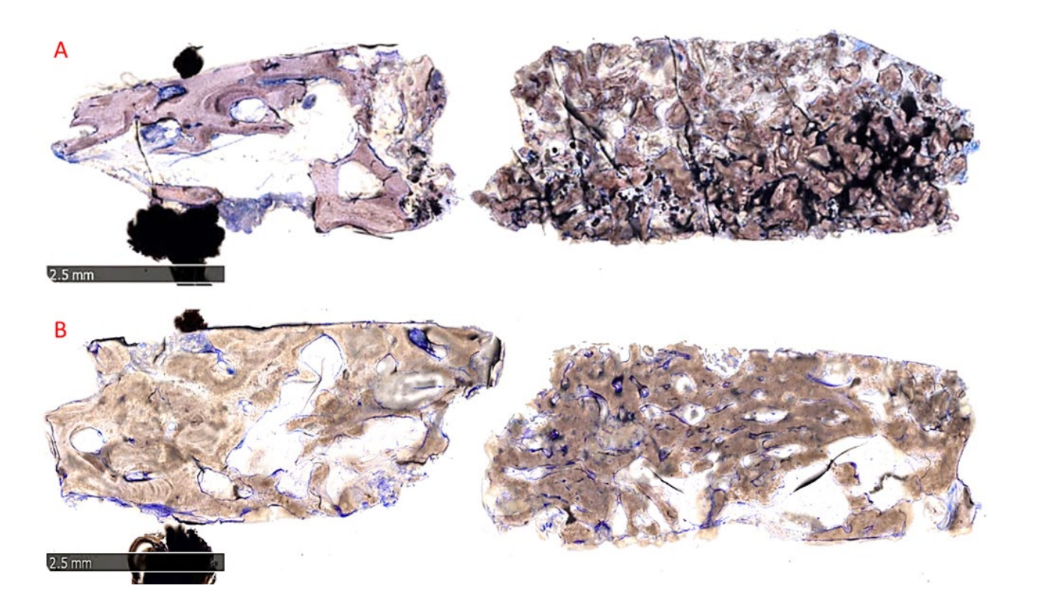
В группе A пересаженные частицы были полностью встроены в костную матрицу и, похоже, подвергались интенсивному ремоделированию с промежуточной степенью минерализации. На интерфейсе между остаточными блоками и вновь образованной костью не было видно зазоров (Рисунок 11A). В группе B костная матрица, окружающая частицы биоматериала, имела высокий уровень минерализации и остеоинтеграции с балансом образования кости (анаболическая фаза) и деградации кости (катаболическая фаза), что подтверждается наличием некоторых фронтов ремоделирования кости и несколькими остеокластами (Рисунок 11B).
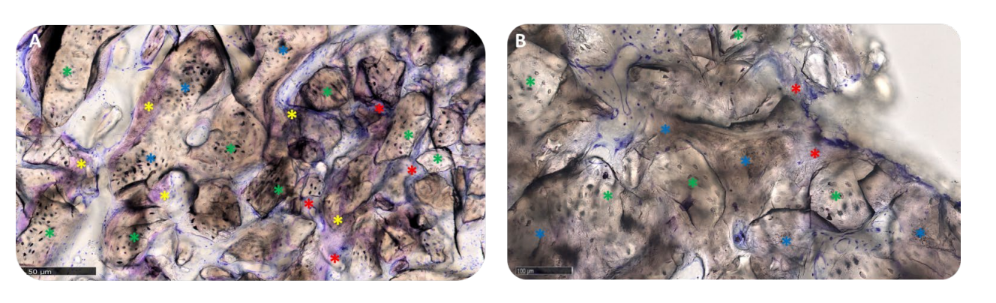
Матрица находилась в активной анаболической фазе: костные участки состояли из новообразованной ламеллярной, минерализованной кости, с остеоцитами в кальцифицированной матрице и фронтом ремоделирования, населённым активными остеобластами и несколькими остеокластами, особенно в группе A (Рисунок 12A,B).
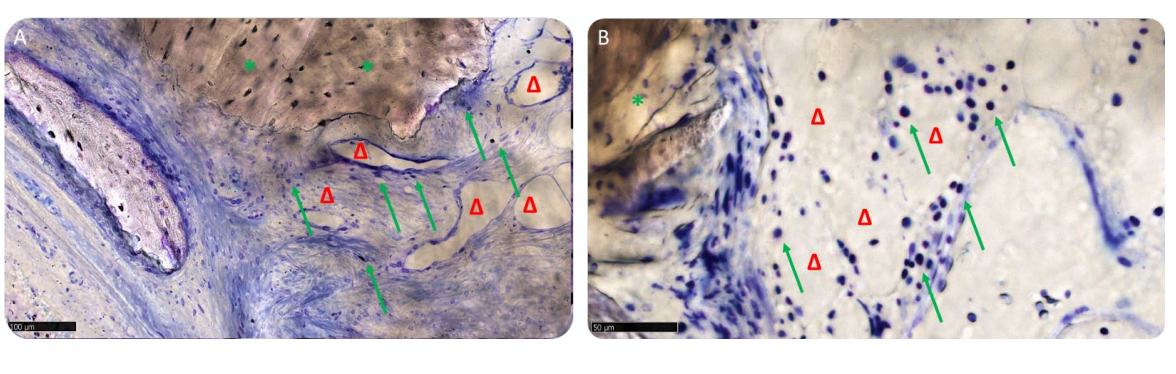
Три образца показали минимальное количество лимфоцитов, в то время как остальные образцы обеих групп имели только некоторые разбросанные воспалительные клетки (Рисунок 13A,B). Несколько мелких кровеносных сосудов занимали медуллярные пространства, где ткань проявила большую зрелость, что потенциально указывает на активность ткани в процессе.
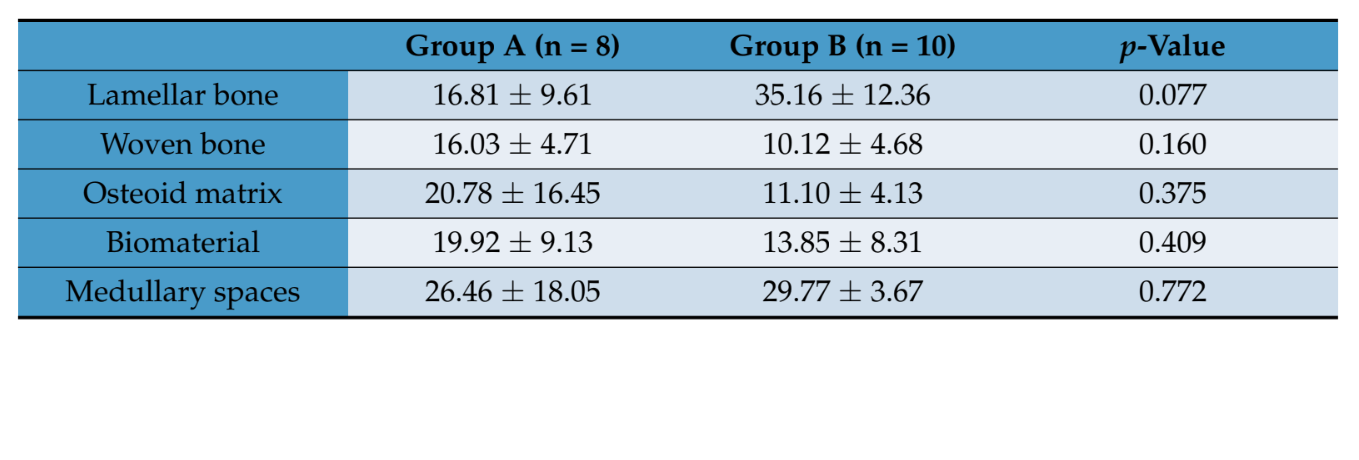
Гистоморфометрическая оценка не показала статистически значимых различий в объемных долях тканей между двумя группами пациентов (Таблица 2). Однако в группе B ламеллярная кость имела более высокое среднее значение, чем в группе A, где вновь образованная костная матрица в основном была представлена менее незрелой матрицей, такой как остеоид и волокнистая кость.
Обсуждение
Это исследование было разработано как рандомизированное контролируемое испытание, целью которого было ответить на следующий вопрос: какое лечение рекомендуется для имплантационной реабилитации остаточных лунок класса II Элиана между несорбируемой мембраной с высокой плотностью политетрафторэтилена (d-PTFE), оставленной намеренно открытой на 4 недели после удаления зуба, и сохранением лунки с использованием анорганического костного материала, а также удалением с последующей направленной регенерацией кости, проведенной через два месяца? Результаты настоящего исследования не выявили одного превосходного лечения над другим, следовательно, нулевая гипотеза о отсутствии статистически значимых различий между двумя протестированными процедурами была принята.
Хотя результаты настоящего исследования схожи между группами, основное преимущество предложенной техники сохранения лунки с несорбируемой мембраной может представлять собой действующий вариант, поскольку она позволяет сократить общее время лечения и затраты для пациента. Эти преимущества в основном связаны с тем, что она может снизить потребность в других регенеративных техниках, не ухудшая конечные результаты, предсказуемость имплантационного лечения и, что не менее важно, удовлетворенность пациента.
Нетронутая бугристая пластина (дефект класса 1 по Элиану) считается необходимым условием для стабильности мягких тканей в области, окружающей имплантат, и, следовательно, для долгосрочных эстетических результатов, особенно в случае высоких эстетических требований. Непрерывная резорбция тонкой бугристой костной пластины может привести к высокому риску резорбции десны со временем. Лечение передних дефектов часто требует второй операции, состоящей из дополнительных процедур регенерации кости, чтобы обеспечить протезируемую направленную установку имплантатов. Однако эти процедуры обычно не более приемлемы для пациентов из-за их инвазивности и стоимости. Предложенная техника использования несорбируемой мембраны для временного восстановления поврежденной бугристой стенки, намеренно оставленной открытой над пересаженным лункой, кажется многообещающей и простой, требующей меньшего количества хирургических процедур. В настоящем исследовании не было обнаружено различий в отношении гистологического количественного исследования. Фактически, реконструкция бугристой пластины с намеренно открытой несорбируемой мембраной кажется эффективной и простой процедурой для регенерации резорбированной бугристой костной пластины, потенциально уменьшая необходимость в направленной регенерации кости. Предложенная техника может быть высоко принята пациентами из-за своей сниженной инвазивности.
Биологическая причина ожидания от четырех до шести недель перед установкой мембраны d-PTFE заключается в том, чтобы дождаться окончания начальной фазы заживления, перед процессом ремоделирования кости. На этом этапе под мембраной d-PTFE можно ожидать полного закрытия мягких тканей. Мембрана d-PTFE может действовать как каркас, направляющий заживление новых мягких тканей, сохраняя выпуклую форму альвеолярного гребня. Напротив, в группе GBR рекомендуется период в восемь недель перед полным восстановлением мягких тканей, согласно Бусеру и соавторам.
Нерезорбируемая мембрана работает как барьер, позволяя отделить мягкие ткани от кости на 4-6 недель, время, необходимое для стабилизации кровяного сгустка. Удаление нерезорбируемой мембраны после этого периода, по-видимому, дает достаточно времени для дифференцировки мезенхимальных клеток в остеобласты внутри лунки, исключая фибробласты из десневого лоскута, и, в конечном итоге, приводит к образованию и созреванию новой кости. Для этой цели крайне важно, чтобы пациент поддерживал хирургическую рану в чистоте и дезинфекции. Тем не менее, аналогичные рекомендации были даны для обеих техник. По сравнению с поэтапной направленной регенерацией кости, представленная техника позволяет доставить окончательное восстановление за более короткое время, потенциально улучшая восприятие пациентов и также потенциально снижая общую стоимость.
В гистологическом исследовании у людей биопсия была проведена через 4 недели в момент удаления мембраны. Результаты этого гистологического исследования показали, что, даже если нерассасывающаяся мембрана d-PTFE была намеренно оставлена открытой, эпителиальная ткань над плотной соединительной тканевой матрицей не была обнаружена. Эта находка может указывать на то, что вновь образованная соединительная ткань, похоже, является хорошо васкуляризованной остеоидной матрицей. Тем не менее, требуется больше времени для завершения созревания и превращения в минерализованную ткань, что позволит установить имплантат. В целом необходимо от 3 до 5 месяцев. В основном это зависит от типа и размера дефекта и используемого биоматериала для пересадки в лунку. В другом гистологическом исследовании тестовая группа получила комбинацию 70% минерализованного и 30% деминерализованного кортикального аллографтного материала, использованного для пересадки в лунку после удаления зуба, покрытую намеренно открытой, нерассасывающейся мембраной d-PTFE. Полученные результаты оценивались по месту с контрольной группой, для которой использовался только минерализованный аллографтный материал. Биопсии продемонстрировали увеличение жизненно важной костной ткани (36,16%) с последующим уменьшением остаточного графта (18,24%) в тестовой группе по сравнению с контролируемыми случаями, где использовалась 100% минерализованная костная аллографтная группа (24,69% и 27,04% соответственно).
Результаты настоящего исследования согласуются с недавним систематическим обзором Cochrane, который пришел к выводу, что техники сохранения альвеолярного гребня могут минимизировать общие изменения в высоте и ширине остаточного гребня после удаления зубов. Тем не менее, доказательства очень неопределенные.
Из-за отсутствия расчета размера выборки основной ограничивающий фактор настоящего исследования заключался в меньшем размере выборки. Другим ограничением, которое может повлиять на внутреннюю и внешнюю валидность результатов, было отсутствие калибровки хирургов. Тем не менее, все хирурги, участвовавшие в этом исследовании, были обучены проведению двух объяснительных случаев перед началом испытания. Наконец, верхняя челюсть и нижняя челюсть имеют разные темпы и паттерны резорбции кости, что может повлиять на прогноз. Однако рандомизация позволила создать две сбалансированные группы, без статистических различий между ними. Таким образом, результаты настоящего предварительного отчета предоставляют количественные гистологические данные о кости, реконструированной с использованием нерассасывающейся мембраны d-PTFE или направленной регенерации кости для лечения постэкстракционных дефектов альвеолярной кости с опорными на имплант restorations. Хотя предложенная техника заживления открытой раны была сопоставлена с классической направленной реконструкцией кости, эти предварительные результаты поддерживают этот подход. Аналогично, существуют исследования, сравнивающие клеточную дермальную матрицу с мембраной политетрафторэтилена (PTFE), достигая аналогичных многообещающих результатов. Поэтому необходимы дальнейшие клинические и радиологические исследования с более длительным наблюдением, чтобы подтвердить эти многообещающие клинические результаты.
Выводы
С учетом ограничений настоящего пилотного исследования, реконструкция бугристой пластины с намеренно открытой несоразмерной мембраной кажется эффективной и простой процедурой для регенерации резорбированной бугристой костной пластины, что снижает необходимость в направленной регенерации кости. Необходимы дальнейшие исследования с большим размером выборки для подтверждения этого предварительного результата.
Роберто Луонго, Марко Талларико, Элена Канчиани, Даниэле Грациано, Клаудия Деллавиа, Марко Гаргари, Франческо Маттиа Черузо, Дарио Мелодия и Луиджи Канулло
Ссылки
- Маркус, С.; Дрюри, Т.; Браун, Л.; Зион, Г. Удержание зубов и потеря зубов в постоянном прикусе у взрослых: Соединенные Штаты, 1988–1991. J. Dent. Res. 1996, 75, 684–695.
- Мекалл, А.Р.; Розенфельд, А.Л. Влияние паттернов резорбции остаточного гребня на размещение имплантатов и положение зубов. Int. J. Periodontics Restor. Dent. 1991, 11, 8–23.
- Ван дер Вейден, Ф.; Делл’Аква, Ф.; Слот, Д.Е. Изменения размеров альвеолярной кости после экстракции у людей: систематический обзор. J. Clin. Periodontol. 2009, 36, 1048–1058.
- Мелони, С.М.; Йованович, С.А.; Пизано, М.; Де Риу, Г.; Бальдони, Е.; Талларико, М. Одностадийная горизонтальная направленная регенерация кости с использованием аутологичной кости, неорганической бычьей кости и коллагеновых мембран: наблюдение за перспективным исследованием через 30 месяцев после нагрузки. Eur. J. Oral Implant. 2018, 11, 89–95.
- Кан, Дж.Й.К.; Рунгчарассенг, К.; Лозада, Дж.Л.; Циммерман, Г. Стабильность лицевых десневых тканей после немедленного размещения и временной установки одиночных имплантатов в верхней челюсти: наблюдение через 2–8 лет. Int. J. Oral Maxillofac. Implant. 2011, 26, 179–187.
- Зубиллага, Г.; фон Хаген, С.; Симон, Б.И.; Дизи, М.Изменения высоты и ширины альвеолярной кости после увеличения гребня с использованием фиксированной биоразлагаемой мембраны и деминерализованного замороженного остеоиндуктивного графта. J. Periodontol. 2003, 74, 965–975.
- Дарби, И.; Чен, С.Т.; Бусер, Д. Техники сохранения гребня для имплантологической терапии. Int. J. Oral Maxillofac. Implant. 2009, 24, 260–271.
- Талларико, М.; Ханари, Е.; Пизано, М.; Гатти, Ф.; Мелони, С.М. Замена моляров имплантатами диаметром 7 мм: ставить имплантат немедленно или подождать 4 месяца после сохранения лунки? Результаты через 1 год после нагрузки из рандомизированного контролируемого испытания. Eur. J. Oral Implant. 2017, 10, 169–178.
- Канулло, Л.; Марин, Г.В.; Талларико, М.; Канчиани, Э.; Мусто, Ф.; Деллавиа, К. Гистологическая и гистоморфометрическая оценка постэкстракционных участков, пересаженных с использованием обогащенного магнием нано-гидроксиапатита: рандомизированное контролируемое испытание, сравнивающее 4 и 12 месяцев заживления. Clin. Implant. Dent. Relat. Res. 2015, 18, 973–983.
- Мелони, С.М.; Талларико, М.; Лолли, Ф.М.; Деледда, А.; Пизано, М.; Йованович, С.А. Сохранение лунки после экстракции с использованием эпителиального соединительнотканного графта против свиного коллагенового матрикса. Результаты через год рандомизированного контролируемого испытания. Eur. J. Oral Implant. 2015, 8, 39–48.
- Папи, П.; Ди Мурро, Б.; Тромба, М.; Пассарелли, П.Ц.; Д’Аддона, А.; Помпа, Г. Использование несоразмерной мембраны в качестве окклюзионного барьера для сохранения альвеолярного гребня: проспективное когортное исследование с наблюдением через год. Antibiotics 2020, 9, 110.
- Сун, Д.-Дж.; Лим, Х.-С.; Ли, Д.-В. Сохранение альвеолярного гребня с использованием открытого мембранного подхода для лунок с дефицитом кости: рандомизированное контролируемое клиническое испытание. Clin. Implant Dent. Relat. Res. 2018, 21, 175–182.
- Хацопулос, Г.С.; Койду, В.П.; Сонненбергер, М.; Джонсон, Д.; Чу, Х.; Вольф, Л.Ф. Сохранение гребня после экстракции с использованием плотных мембран PTFE: систематический обзор и мета-анализ. J. Prosthet. Dent. 2022.
- Карбонель, Дж.М.; Мартин, И.С.; Сантос, А.; Пухоль, А.; Санц-Молинер, Дж.Д.; Нарт, Дж. Мембраны из политетрафторэтилена высокой плотности в процедурах направленной регенерации кости и тканей: обзор литературы. Int. J. Oral Maxillofac. Surg. 2014, 43, 75–84.
- Атиех, М.А.; Альсабиха, Н.Х.М.; Пейн, А.Г.Т.; Дункан, У.; Фаджон, С.М.; Эспозито, М. Интервенции для замены отсутствующих зубов: техники сохранения альвеолярного гребня для разработки места для зубных имплантатов. Cochrane Database Syst. Rev. 2021, CD010176.
- Корбелла, С.; Таскьери, С.; Франчетти, Л.; Уайнштейн, Р.; Дель Фаббро, М. Гистоморфометрические результаты после заживления лунки после экстракции с использованием различных биоматериалов: систематический обзор литературы и мета-анализ. Int. J. Oral Maxillofac. Implant. 2017, 32, 1001–1017.
- Элиан, Н.; Чо, С.-С.; Фрум, С.; Смит, Р.Б.; Тарнов, Д.П. Упрощенная классификация лунок и техника ремонта. Pract. Proced. Aesthetic Dent. 2007, 19, 99–104.
- Бусер, Д.; Шапюи, В.; Бельсер, У.Ц.; Чен, С. Установка имплантатов после экстракции в эстетических участках одиночных зубов: когда немедленно, когда рано, когда поздно? Периодонтология 2000 2017, 73, 84–102.
- Канчиани, Э.; Рагоне, В.; Биффи, К.А.; Валенца, Ф.; Д’Амброси, Р.; Олимпо, М.; Кристофало, А.; Галльера, Э.; Деллавиа, К. Понимание роли модификации поверхности рандомизированных трабекулярных титанов в регенерации костной ткани: экспериментальное исследование. Medicina 2022, 58, 315.
- Кан, Дж.Й.К.; Рунгчарассенг, К.; Лозада, Дж.Л. Немедленное размещение и временная установка одиночных имплантатов в верхней челюсти: 1-летнее проспективное исследование. Int. J. Oral Maxillofac. Implant. 2003, 18, 31–39.
- Бамбини, Ф.; Орilisi, Г.; Куаранта, А.; Мемэ, Л. Биологически ориентированная немедленная нагрузка: новый математический протокол вертикальной установки имплантата, исследование с наблюдением через пять лет. Materials 2021, 14, 387.
- Чен, С.Т.; Бусер, Д. Эстетические результаты после немедленной и ранней установки имплантатов в передней верхней челюсти — систематический обзор. Int. J. Oral Maxillofac. Implant. 2014, 29, 186–215.
- Барти, Б.К. Упрощенная техника сохранения гребня после экстракции зуба. Dent. Today 1995, 14, 62–67.
- Лаурито, Д.; Кугнетто, Р.; Лоллобриджида, М.; Гуэрра, Ф.; Вестри, А.; Джиано, Ф.; Боско, С.; Ламазза, Л.; Де Биазе, А. Сохранение лунки с мембраной d-PTFE: гистологический анализ вновь образованной матрицы при удалении мембраны. Int. J. Periodontics Restor. Dent. 2016, 36, 877–883.
- Бек, Т.М.; Мили, Б.Л. Гистологический анализ заживления после экстракции зуба с сохранением гребня с использованием минерализованного человеческого костного аллографта. J. Periodontol. 2010, 81, 1765–1772.
- Борг, Т.Д.; Мили, Б.Л. Гистологическое заживление после экстракции зуба с сохранением гребня с использованием минерализованного и комбинированного минерализованного-деминерализованного замороженного костного аллографта: рандомизированное контролируемое клиническое испытание. J. Periodontol. 2015, 86, 348–355.
- Краузер, Дж.Т. Мембраны из PTFE высокой плотности: использование с имплантатами в форме корня. Dent. Implant. Update 1996, 7, 65–69.
- Фотек, П.Д.; Нейва, Р.Ф.; Ванг, Х.-Л. Сравнение дермального матрикса и мембраны политетрафторэтилена для увеличения костной лунки: клиническое и гистологическое исследование. J. Periodontol. 2009, 80, 776–785.
