Микрокомпьютерная томография для оценки зон с зазорами вдоль интерфейса гуттаперчи-герметика в овальных каналах
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Аннотация
Цель: Оценить интерфейсную адаптацию (области с зазорами) двух герметиков для корневых каналов (EndoSequence BC Sealer и AH Plus) к конусу из обычной гутаперчи (интерфейс гутаперча-герметик) в овальных каналах, заполненных с использованием техники одного конуса.
Методология: Шестнадцать зубов с овальными каналами были выбраны, отсканированы в микрокомпьютерном томографе и парно сопоставлены по объему, соотношению сторон и конфигурации корневых каналов. Корневые каналы затем последовательно обрабатывались инструментами WaveOne Gold Primary и Large, после чего заполнялись точками WaveOne Large GP, связанными либо с предварительно смешанным герметиком на основе кальций-силиката EndoSequence BC Sealer, либо с эпоксидным герметиком AH Plus (n = 8 на группу) с использованием техники одного конуса. После 7 дней хранения в фосфатно-солевом растворе при 37°C образцы были повторно отсканированы, а реконструированные изображения сегментированы для различения заполняющих материалов (герметик и конус GP) от дентину. Всего было оценено 453 поперечных среза и классифицировано в зависимости от наличия или отсутствия зазоров на интерфейсе гутаперча-герметик. Тест Манна-Уитни U подтвердил различия между группами и был признан значимым при альфа = 5%.
Результаты: Пробелы были неравномерно распределены на двумерных аксиальных срезах, и ни один из образцов не показал полностью свободных от пробелов участков вдоль всего интерфейса GP-герметика. Корневые каналы, заполненные EndoSequence BC Sealer и AH Plus, показали 171 (37.75%) и 136 (30.02%) срезов с пробелами в интерфейсе GP-герметика, и эти частоты были статистически значимыми (p = .000).
Выводы: Хотя ни один из образцов не имел свободного от пробелов участка вдоль всего интерфейса GP-герметика, овальные каналы, заполненные AH Plus, показали меньше пробелов, чем те, которые были заполнены EndoSequence BC Sealer.
Введение
Гидравлические цементы, такие как биоактивные керамики кальций-фосфата, широко используются для регенерации костной ткани благодаря своей высокой биосовместимости, остеоиндуктивным и остеокондуктивным свойствам как в ортопедии, так и в стоматологии (Daculsi et al., 1990; Demirkiran, 2012; LeGeros, 1988). В эндодонтии гидрофильные биоактивные герметики на основе кальций-силиката (CSS) привлекли значительное внимание с момента введения iRoot SP (Innovative BioCeramix Inc.) в 2007 году. Этот большой интерес основывался на предположении, что CSS были разработаны как производная версия цемента MTA, но с оптимизированными свойствами обработки, биологическими и вязкостными характеристиками (Candeiro et al., 2012; Silva et al., 2017; Silva-Almeida et al., 2017). Этот материал обычно представлен в виде готовой к использованию инъекционной пасты, хранящейся в герметичном шприце, что позволяет применять его непосредственно в пространство корневого канала. Внутренние характеристики и клиническая полезность CSS упростили процедуру заполнения корневого канала для стоматологов всех уровней квалификации. Поэтому он оказался очень популярным среди эндодонтического сообщества, даже без полного одобрения науки по некоторым критическим аспектам его in vitro свойств (Elyassi et al., 2019; Silva et al., 2021; Tanomaru-Filho et al., 2017; Torres et al., 2020; Zordan-Bronzel et al., 2019), а также отсутствием долгосрочных наблюдательных результатов из рандомизированных перспективных клинических испытаний.
Изначально CSS, как производная версия MTA, были разработаны для заполнения всего пространства канала в соответствии с концепцией «первичного моноблока», которая заключается в существовании только одного интерфейса, простирающегося по окружности между материалом и стенками корневого канала, чтобы улучшить долговременную герметичность (Tay & Pashley, 2007). Тем не менее, CSS не подходят для использования в качестве единственного наполнителя, учитывая возможность непроникновения после окончательной установки, что исключает повторное лечение при необходимости (Eymirli et al., 2019; Hess et al., 2011). Решением было использование другого материала — главного конуса из гутаперчи (GP) — для введения герметика в неровности канала и для служения в качестве мягкого сердечника, позволяющего повторное лечение корневого канала. Хотя эта техника была направлена на заполнение пространства корневого канала путем цементирования ранее установленного главного конуса GP с CSS, она также вводит дополнительный интерфейс в массу наполнителя. Идея корневого заполнения моноблоком с двумя окружными интерфейсами (GP-герметик и герметик-дентин), образующими единый связный блок, привлекла внимание с появлением герметиков на основе метакрилата почти два десятилетия назад. Согласно некоторым авторам, этот тип герметика был бы идеальным наполнителем для обеспечения надлежащей коронной герметичности и улучшения прочности зубов на перелом (Shipper et al., 2004, 2005; Teixeira et al., 2004). К сожалению, долгосрочные клинические результаты эндодонтических лечений показали высокую вероятность неудачи в корневых каналах, заполненных герметиками на основе метакрилата по сравнению с традиционными материалами (Barborka et al., 2017; Strange et al., 2019), что подтверждает результаты предыдущих лабораторных исследований (De-Deus et al., 2009, 2011; Hiraishi et al., 2007, 2008; Tay, Loushine, et al., 2005a; Tay Pashley, Williams, et al., 2005; Tay, Pashley, Yiu, et al., 2005; Tay et al., 2007).
Способность герметика прилипать как к дентиновым стенкам, так и к GP является желаемым свойством, поскольку это важное условие для достижения герметичного уплотнения по всей системе корневого канала. Адгезия CSS к корневому дентину уже была рассмотрена в нескольких исследованиях (Neelakantan et al., 2015; Oliveira et al., 2016; Sagsen et al., 2011; Silva et al., 2019). Однако существует недостаток доказательств по качеству интерфейсной адаптации между CSS и традиционным GP (Gandolfi et al., 2013; Kim et al., 2017, 2018; Moinzadeh et al., 2015; Pedullà et al., 2020; Viapiana et al., 2016; Zare et al., 2021). В идеале это важный аспект, поскольку герметик должен одновременно связываться как с дентином, так и с GP, чтобы улучшить общее качество пломбировки. В противном случае различное взаимодействие между ними может привести к образованию интерфейсных зазоров, небольших пустых областей, которые обычно невозможно идентифицировать радиографически. Такой интерфейсный сбой может повлиять на стабильность конуса GP и может служить путем для бактерий и их продуктов, что, в свою очередь, компрометирует общее качество лечения корневых каналов в долгосрочной перспективе.
Целью настоящего исследования было оценить качество интерфейсной адаптации (области с зазорами) между традиционными конусами GP и предварительно смешанным кальций-силикатным герметиком EndoSequence BC Sealer (Brasseler USA) с использованием микро-компьютерной томографии (микро-КТ) в качестве аналитического инструмента. Герметик AH Plus (Dentsply DeTrey GmbH) использовался в качестве эталона для сравнения. Нулевая гипотеза, которая была протестирована, заключалась в том, что качество адаптации интерфейса не зависит от типа герметика.
Материалы и методы
Рукопись этого лабораторного исследования была написана в соответствии с Руководящими принципами по предпочтительным отчетным элементам для лабораторных исследований в эндодонтии (PRILE) 2021 года (Nagendrababu et al., 2021). Этапы этого исследования изображены в блок-схеме PRILE (Рисунок 1).
Оценка размера выборки
Для оценки наличия пробелов в заполняющем материале по срезам микрокомпьютерной томографии использовалась оценка на основе баллов. Количество срезов, необходимых для проверки значительных различий между группами, было оценено на основе исследования Эльтаира и др. (2018), в котором размер эффекта 0.43 был введен вместе с ошибкой типа альфа 0.05 и мощностью бета 0.95 в независимую процедуру t-теста (G*Power 3.1 для Macintosh; Генрих Гейне, Университет Дюссельдорфа). Результат показал минимум 139 срезов на группу. Учитывая оценку 15–20 срезов на зуб (полученных с интервалом 0.5 мм), для настоящего исследования было установлено всего восемь зубов на группу.
Выбор и подготовка образцов
Местный этический комитет одобрил это исследование (CAAE 17561619.1.0000.5243). Образец из 237 нижних резцов, полученных из зубного банка, был рентгенографирован в мезио-дистальном и буколингвальном направлениях, чтобы исключить зубы с более чем одним корневым каналом, незавершенной формой корня или переломом. Из этого первоначального отбора было выбрано 196 зубов, которые были отсканированы в микрокомпьютерном томографе (SkyScan 1173; Bruker-microCT) при 70 кВ, 114 мА, 19.79 мкм (размер пикселя), 180° вращение вокруг вертикальной оси с шагами 0.7°, среднее значение кадров 5, с использованием алюминиевого фильтра толщиной 1.0 мм. Проекционные изображения были реконструированы (NRecon v.1.7.16; Bruker-microCT) с аналогичными параметрами для коррекции артефактов кольца (4), пределов контраста (0–0.05) и коррекции затвердевания пучка (40%), что привело к получению 800–900 серых поперечных срезов на зуб, простирающихся от цементно-эмалевого соединения до апекса. После исключения зубов с двумя или более каналами или значительной вспомогательной анатомией, поперечные изображения 146 образцов были сегментированы с использованием автоматической процедуры, реализованной в программном обеспечении ImageJ (Fiji v.1.51n; Fiji), чтобы создать трехмерные (3D) модели образцов, а также для расчета объема (в мм3) и соотношения сторон (AR) корневых каналов (CTAn v.1.6.6.0; Bruker-microCT; De-Deus et al., 2020). AR является математическим представлением круговидности канала и измерялось путем расчета соотношения между большими и малыми осями эллипса, подогнанного к реконструированным каналам в каждом поперечном сечении с использованием плагина дескрипторов формы программного обеспечения ImageJ. AR корневых каналов рассчитывался для каждого поперечного сечения и отображался на графике. Затем программное обеспечение CTAn v.1.6.6.0 (Bruker-microCT) использовалось для создания 3D моделей корневых каналов зубов, в то время как CTVol v.2.3.2.0 (Bruker-microCT) использовалось для качественного анализа конфигурации корневого канала (Рисунок 2).
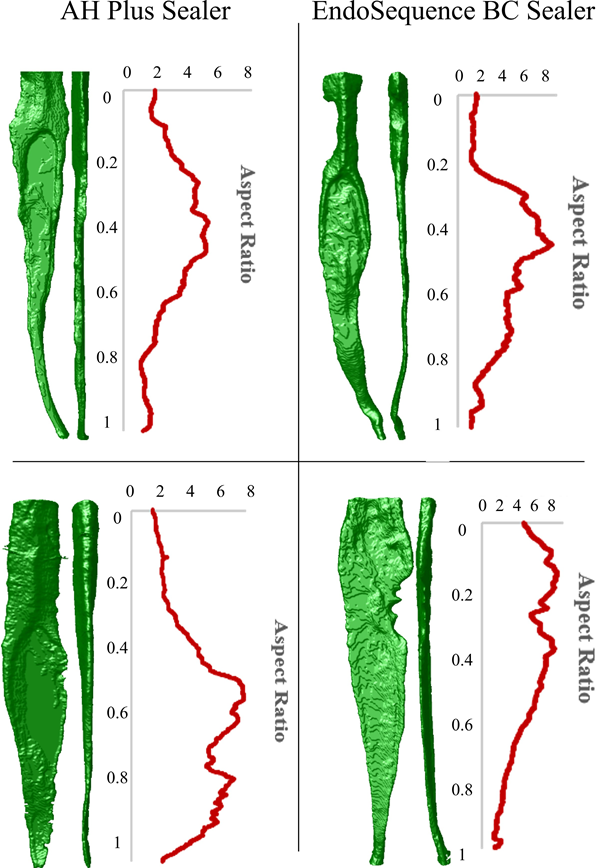
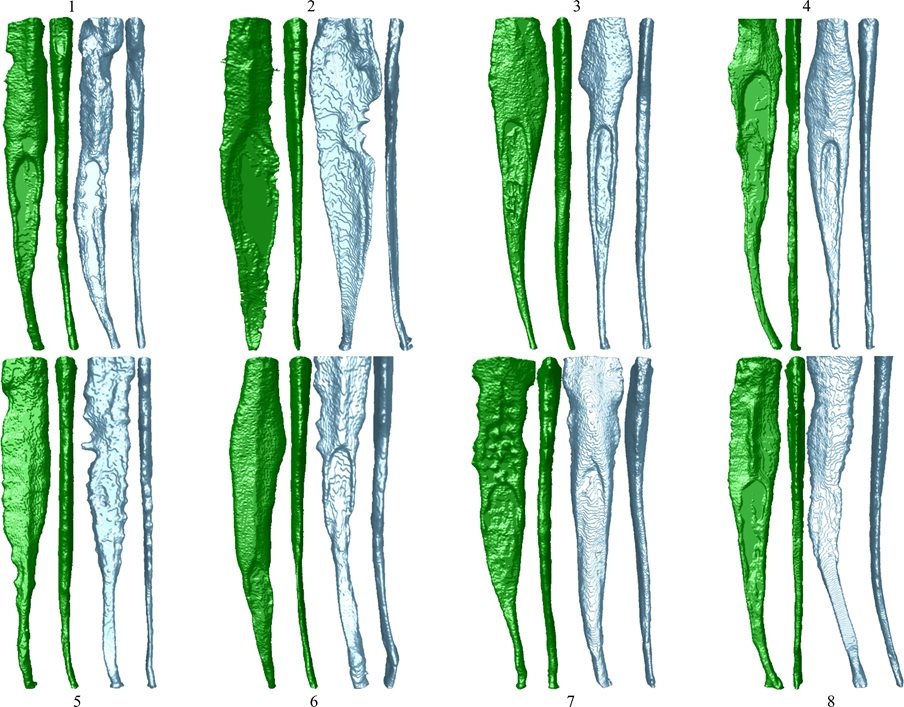
Процесс парного сопоставления был осуществлён путём первичной идентификации корневых каналов с аналогичным объемом (не более 2 мм3), аналогичными графическими кривыми AR и аналогичной конфигурацией канала. Выборка с использованием этих трёх параметров является попыткой изолировать переменные интереса, уменьшая предвзятость, создаваемую анатомическими вариациями, которые могут быть смешивающим фактором в исследовании такого рода. После этих строгих критериев отбора было парно сопоставлено 16 зубов с овальными каналами (графические кривые AR > 4) и максимальным объемом 5 мм3 (Рисунок 3), распределённых на две экспериментальные группы (n = 8), отсканированных и реконструированных с использованием вышеупомянутых параметров, за исключением размера пикселя (14.37 мкм) и вращения (360°) с шагами 0.5°.
Подготовка корневого канала
Каждый корень был обернут в Parafilm-M (Bemis NA) и помещен в поливинилсилоксан (Speedex; Coltene), чтобы смоделировать закрытую систему и стабилизировать образцы во время экспериментальных процедур. Подготовка и заполнение корневых каналов были выполнены одним специалистом в области эндодонтии с более чем 8-летним опытом.
После создания обычного доступа к полости, был использован K-файл размером 10 (Dentsply Sirona Endodontics) для подтверждения проходимости и установления рабочей длины на 1.0 мм короче апикального отверстия. Затем корневые каналы последовательно расширялись с использованием инструментов WaveOne Gold Primary и Large (Dentsply Tulsa Dental Specialties), работающих с мотором VDW Silver (VDW) в предустановленной программе «WAVEONE ALL». Сначала WaveOne Gold Primary использовался до рабочей длины в медленном движении вперед-назад с амплитудой 3 мм. После трех движений инструмент был удален из канала и очищен с помощью спирта. Рабочая длина была достигнута после трех волн инструментирования. Затем WaveOne Gold Large использовался до рабочей длины аналогично первичному инструменту. Апикальная проходимость была подтверждена K-файлом размером 15 (Dentsply Sirona Endodontics) на протяжении всех процедур инструментирования. После каждого этапа подготовки с реверсивными инструментами корневые каналы орошались 3 мл 2.5% гипохлорита натрия (NaOCl) с использованием иглы двойного порта 31-G NaviTip (Ultradent Inc.), введенной на 1 мм короче рабочей длины, в то время как после подтверждения проходимости было выдано 1 мл орошения. Удаление слоя налета выполнялось с использованием 3 мл 17% EDTA (5 мин), после чего проводился финальный промыв с 2 мл двукратной дистиллированной воды. Таким образом, в каждом корневом канале использовалось всего 20 мл раствора для орошения.
Заполнение корневых каналов
Корневые каналы были высушены бумажными точками (Dentsply Sirona Endodontics) и заполнены с использованием техники единственного конуса с точками WaveOne Large GP (Dentsply Sirona Endodontics), ассоциированными либо с EndoSequence BC Sealer (экспериментальная группа; n = 8), либо с AH Plus (контрольная группа, n = 8). Испытанные материалы были подготовлены на отдельных стеклянных пластинах в соответствии с конкретными рекомендациями каждого производителя. Для процедуры обтурации 80 μl герметика были получены с помощью микропипетки и введены в каждый корневой канал с помощью файла K размером 25 (Dentsply Sirona Endodontics) в противочасовой ротации. Затем конус WaveOne Large GP аккуратно вставлялся в пространство корневого канала до рабочей длины. Избыток GP конуса удалялся с помощью теплового носителя (B&L Biotech) на уровне устья канала, а оставшийся материал вертикально уплотнялся совместимым ручным плугом (B&L Biotech). Качество заполнения корней оценивалось с помощью цифровых рентгеновских снимков, сделанных с буколингвальных и мезио-дистальных направлений, и ни один образец не был отбраковлен. Доступные полости затем заполнялись Cavit G (3M ESPE), а образцы хранились при 37°C в фосфатно-солевом буферном растворе в течение 7 дней, чтобы обеспечить полное затвердевание герметиков. Все процедуры выполнял опытный оператор. После этого периода все образцы были отсканированы снова при 100 кВ, 80 мА, 14,37 μм, 360° ротации с шагами 0,3° и средним значением кадров 5, отфильтрованных с помощью алюминиевой фольги толщиной 0,5 мм.
Микро-КТ анализ
После реконструкции проекционных изображений с использованием контрастных границ для различения герметика, GP конуса и дентин, было выбрано примерно 25 срезов, в которых было возможно наблюдать интерфейс GP-конуса на зуб, всего 453 изображения. Два опытных оператора независимо выполнили анализ изображений, чтобы классифицировать срезы в зависимости от наличия (оценка 1) или отсутствия (оценка 0) зазоров на интерфейсе GP-герметика. Окончательный результат был достигнут путем согласия между ними.
Статистический анализ
Оценка, использованная для классификации возникновения интерфейсного зазора между GP конусами и протестированными герметиками, на каждом микро-КТ срезе, считалась единицей для статистического анализа, и был применен тест Манна-Уитни U-тест для проверки различий между группами на значимом уровне 5% (SPSS 21.0; SPSS Inc.).
Результаты
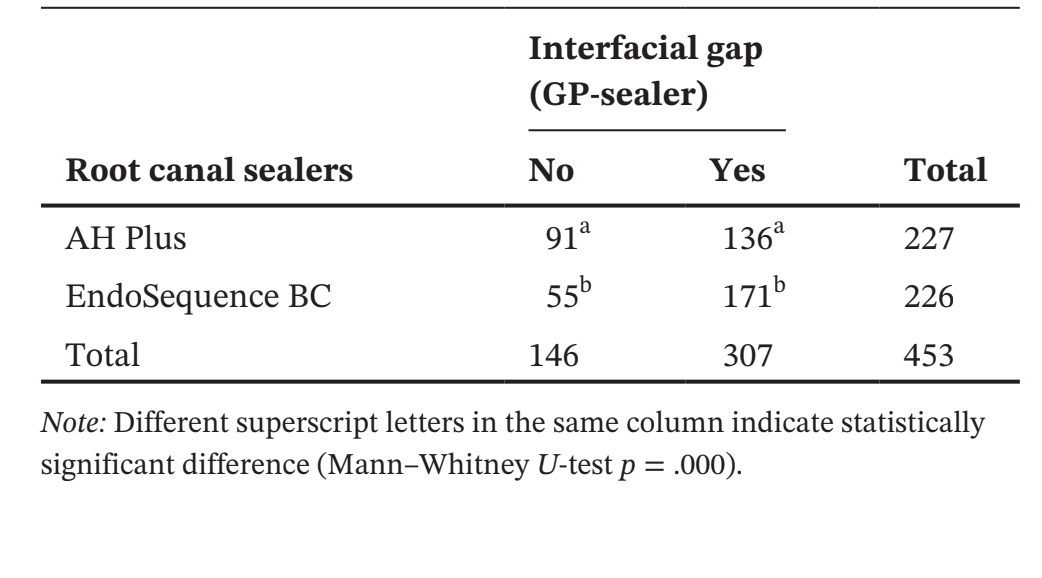
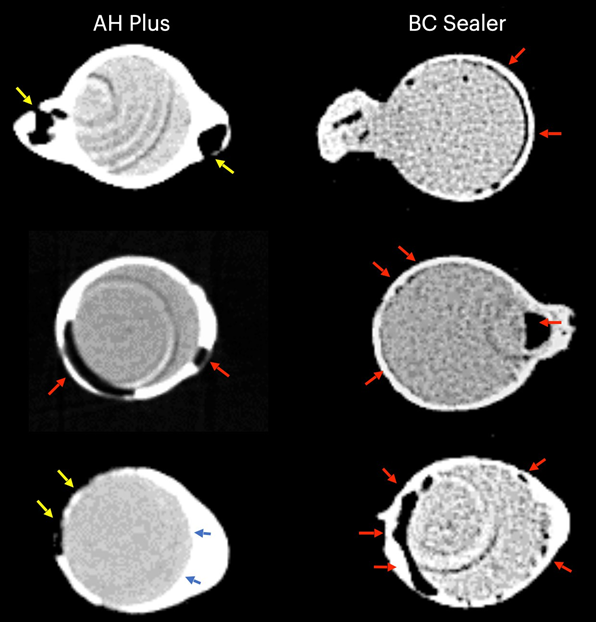
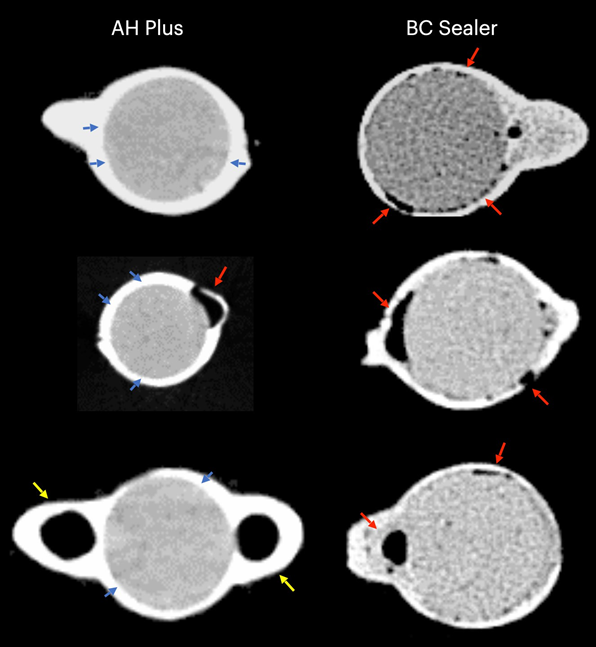
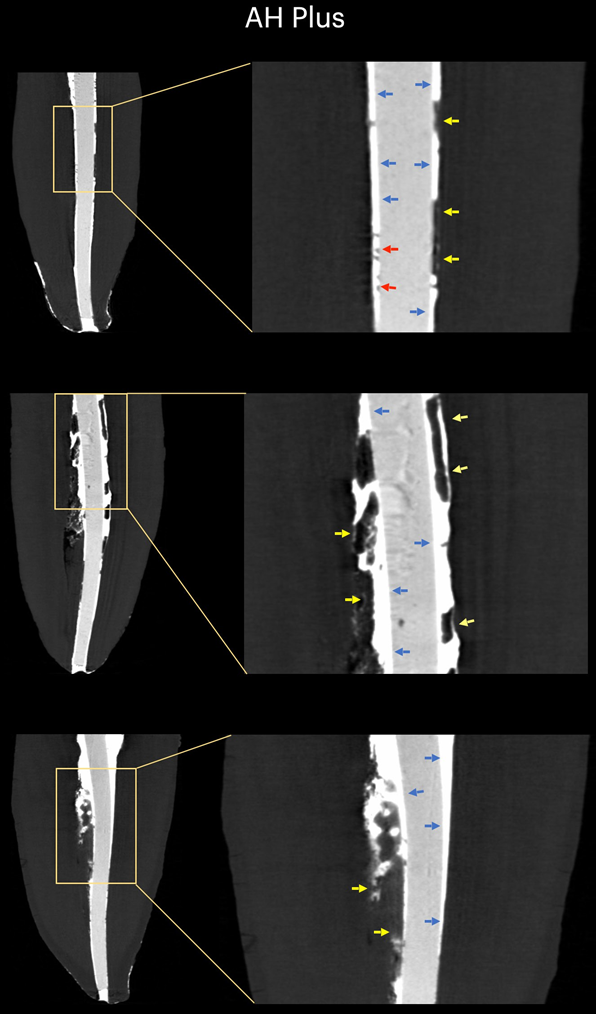
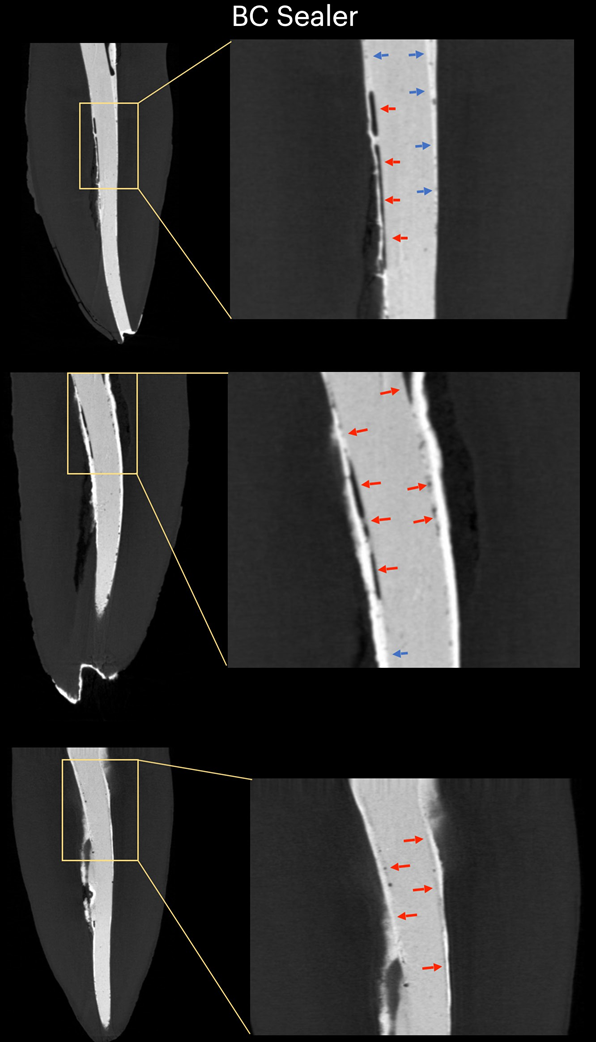
Таблица 1 представляет количество микрокомпьютерных томографических срезов, распределенных в зависимости от наличия интерфейсных зазоров между конусом GP и тестируемыми герметиками. Зазоры были неравномерно распределены на двумерных (2D) аксиальных срезах, и ни один из образцов не показал полностью свободные от зазоров области вдоль всего интерфейса GP-герметика. Корневые каналы, заполненные герметиком EndoSequence BC Sealer и AH Plus, показали интерфейсные зазоры в 171 (37,7%) и 136 (30,0%) срезах соответственно, и эта разница была статистически значимой (p = .000). Рисунки 4–7 показывают репрезентативные трансаксиальные и сагиттальные микрокомпьютерные томографические изображения корневых каналов нижних резцов, заполненных с использованием техники одиночного конуса с герметиками AH Plus и EndoSequence BC Sealer. В целом можно наблюдать хорошую адаптацию герметика AH Plus к конусу GP, в то время как в каналах, заполненных герметиком EndoSequence BC Sealer, присутствует больше интерфейсных зазоров. Во всех зубах также можно наблюдать области с зазорами на интерфейсе герметик-дентин.
Обсуждение
В настоящем исследовании использовался неразрушающий аналитический инструмент для оценки интерфейсной адаптации между обычными конусами GP и различными герметиками для корневых каналов (AH Plus и EndoSequence BC Sealer) в анатомически сопоставленных овальных каналах нижних резцов, заполненных с использованием техники одного конуса. Результаты показали, что зубы, заполненные EndoSequence BC Sealer, имели значительно более высокую частоту изображений поперечного сечения, показывающих зазоры в интерфейсе GP-герметика, чем зубы, заполненные AH Plus, и нулевая гипотеза была отвергнута.
В литературе несколько исследований, использующих различные методы анализа, сообщали противоречивые результаты о наличии зазоров и пустот в корневых каналах, заполненных CSS (Gandolfi et al., 2013; Kim et al., 2017, 2018; Moinzadeh et al., 2015; Pedullà et al., 2020; Viapiana et al., 2016; Zare et al., 2021). Используя технологию микро-КТ, Yanpiset et al. (2018) сообщили о минимальных зазорах и пустотах в зубах, заполненных герметиком CSS TotalFill BC Sealer (FKG Dentaire, La Chaux-de-Fonds, Швейцария) и покрытыми конусами GP. Аналогично, Eltair et al. (2018) не продемонстрировали значительной разницы в интерфейсных зазорах между TotalFill BC Sealer и AH Plus, в сочетании с покрытыми или обычными конусами GP, через описательный анализ с использованием сканирующей электронной микроскопии. Однако эти результаты противоречат предыдущим данным Zhang et al. (2010), которые продемонстрировали лучшую интерфейсную адаптацию герметика iRoot SP к GP по сравнению с AH Plus. Более того, в то время как Viapiana et al. (2016) показали, что BioRoot RCS (Septodont) был связан с большим процентом пустот, чем AH Plus, Gandolfi et al. (2013), Kim et al. (2017) и Zare et al. (2021) не сообщили о каких-либо различиях между AH Plus и различными марками CSS. Эти несоответствия могут быть в основном объяснены методологическими различиями, связанными с устройством микро-КТ (параметры сканирования и реконструкции), выбором образцов, качеством подготовки корневого канала, опытом операторов, техникой заполнения и физико-химическими свойствами тестируемых герметиков. Таким образом, обоснование для интерпретации этих различий по сравнению с настоящими результатами основано на том факте, что большинство исследований, использующих микро-КТ, сосредоточились на общем анализе процента пустот, рассчитанного путем оценки объема заполняющих материалов в отношении подготовленного пространства канала (Gandolfi et al., 2013; Kim et al., 2017, 2018; Moinzadeh et al., 2015; Pedullà et al., 2020; Viapiana et al., 2016). Этот подход, однако, не учитывает специфическое взаимодействие герметика и GP, как продемонстрировано в настоящем исследовании, с использованием специфического параметра на основе оценки, что помогает понять несоответствия, наблюдаемые в отношении предыдущих данных.
В этом исследовании овальные каналы, заполненные обычным GP и EndoSequence BC Sealer с использованием техники одного конуса, имели большее количество срезов с пробелами на интерфейсе GP-герметика, чем при использовании AH Plus (Таблица 1). Помимо некоторых технических аспектов заполнения корневого канала и различий в физико-химических свойствах герметиков, полученные результаты также можно объяснить вариациями в химических поверхностных полярностях между протестированными герметиками и основным материалом. В целом, GP точки содержат только около 20% химического состава, который составляет GP, в то время как 60%–75% состава — это наполнитель из оксида цинка. Оставшиеся компоненты — это воск или смола, чтобы сделать точку более гибкой и/или компактной, и металлические соли для придания радиопрозрачности. На органической и неорганической основе GP точки содержат только 23.1% органических веществ (GP и воск) и 76.4% неорганических наполнителей (оксид цинка и сульфат бария; Фридман и др., 1977). GP имеет химическую структуру, основанную на полимеризации стереоизомера изопрен, мономера, образующего натуральный каучук, что приводит к более высокой кристалличности с около 30%–40% гидрофобности. Другими словами, гидрофобные свойства GP являются следствием его алифатической химической природы (Ле Ферран и Бача, 2021). Другими двумя основными компонентами GP точек являются оксид цинка, воск и сульфат бария (неорганические наполнители), которые, в свою очередь, также имеют гидрофобные характеристики (Фридман и др., 1977; Мурер и Жене, 1982; Уилсон и др., 1973; Вольфмейер и др., 2002). Следовательно, возможно, что гидрофобная природа GP конуса больше отталкивает CSS, материал, известный своей гидрофильностью (Хегде и Арора, 2015), чем AH Plus, материал на основе эпоксидной смолы, который имеет гидрофобный радикал в своей молекуле (Ли и др., 2017), что частично объясняет наименьшее количество пробелов, наблюдаемых вдоль его интерфейса. Хотя величина поляризационных сил между гидрофильными и гидрофобными эндодонтическими материалами еще предстоит определить, возможно, что это слабые силы. Следовательно, маловероятно, что они могут оказать значительное влияние на их взаимодействие, особенно учитывая, что эти материалы заключены в жесткие дентинные стенки. Однако в анатомическом состоянии, в котором требуется большое количество герметика для заполнения пространства корневого канала, как при использовании техники одного конуса в овальных каналах, можно предположить, что доступное пространство между конусом GP и дентинными стенками может предоставить достаточно места для действия этих сил. Как показано на рисунках 4 по 7, пробелы на интерфейсе GP-герметика в основном наблюдались на щечной и язычной сторонах корневых каналов, то есть в самых больших областях между основным материалом и дентинными стенками, где находится наибольшее количество герметика. Можно утверждать, что полученные результаты являются следствием неправильного использования CSS с обычным GP вместо конусов с покрытием из кальцийсиликата. Однако до сих пор ни один производитель не сообщил, что CSS не может использоваться с обычными GP точками. На самом деле, недавний опрос показал, что только 22.1% пользователей CSS использовали предварительно покрытые GP в своих заполнениях корневых каналов (Гиварш и др., 2020), что подтверждает основную цель настоящего исследования.
Хотя технология микро-КТ позволяет проводить неразрушающие объемные эксперименты, высокая плотность материалов для заполнения обычно значительно влияет на качество выходных изображений, особенно в краевых областях, что делает оценку интерфейсов настоящей проблемой, особенно когда плотности между герметиком и GP конусами схожи, что напрямую влияет на их контрастность (Sun et al., 2009; Zeiger et al., 2009). Это означает, что даже изображения, полученные с использованием адекватных параметров сканирования и реконструкции на соответствующих устройствах микро-КТ, могут часто приводить к незначительным трудностям в идентификации и различении границ между стенками корневого канала и компонентами заполнения. Это критически важный методологический аспект, учитывая, что определение порога для сегментации изображения является субъективной процедурой, которая зависит от опыта оператора и, следовательно, может иметь прямое влияние на точность и надежность результатов. При работе с неоднородными структурами, такими как дентин, герметик и GP конусы, это довольно сложная задача и все еще не согласованный аспект оценки микро-КТ. Поэтому заблуждением является мнение, что только размер пикселя определяет качество изображений, полученных при сканировании микро-КТ. На самом деле, это взаимодействие между чувствительностью к контрасту и пространственным разрешением определяет, что можно достичь с помощью КТ-сканирования (Stock 2009). В то время как контрастное разрешение данного изображения является мерой того, насколько хорошо интересующая особенность может быть отличена от соседнего фона, пространственное разрешение описывает, насколько хорошо мелкие детали могут быть изображены или мелкие особенности могут быть локализованы относительно контрольной точки (Ketcham & Carlson, 2001). В настоящем исследовании, хотя образцы были отсканированы с использованием размера пикселя 14.37 мкм, общее контрастное разрешение полученных изображений было среднего качества и, следовательно, количественные объемные измерения зазоров не могли быть выполнены, что можно считать ограничением данного исследования. Тем не менее, качество выходных данных было достаточным для идентификации и оценки областей с зазорами вдоль интерфейса GP-герметика с использованием 2D трансаксиальных изображений. Хотя некоторые могут утверждать, что размер пикселя, использованный в этом исследовании, высок, Pinto et al. (2021) продемонстрировали, что визуальная и автоматическая сегментация могут быть применены к изображениям микро-КТ с размерами вокселей от 5 до 20 мкм для оценки заполнения герметиком с радиопрозрачностью, соответствующей стандарту ISO 6876:2012 (ISO, 2012), таким как AH Plus (Silva et al., 2013) и EndoSequence BC Sealer (Candeiro et al., 2012).
Как и в этом исследовании, недавнее исследование с использованием микро-КТ также использовало 2D изображения для оценки интерфейса GP-герметика в корневых каналах верхних передних зубов, заполненных техникой одного конуса с использованием обычного GP в сочетании с герметиками AH Plus или EndoSequence BC (Zare et al., 2021), но сканирование проводилось на устройстве с высоким разрешением с использованием меньшего размера пикселя (6 мкм). В отличие от настоящих результатов, группа AH Plus имела значительно более низкое соотношение интерфейса GP-герметика (контакт) по сравнению с EndoSequence BC, и это различие можно объяснить некоторыми методологическими различиями, связанными с морфологией корневого канала (которая была более круглой), методом нанесения герметика (техника «масляного» конуса), которая благоприятствует материалам с низкой вязкостью, таким как CSS. Кроме того, для улучшения общего качества анализа в настоящем исследовании два опытных оператора проводили процедуры сегментации и все анализы отдельно, и окончательный результат был достигнут путем согласия между ними. Также было уделено особое внимание обеспечению сопоставимости между экспериментальными группами путем уравнивания анатомического фактора. Хорошо сбалансированные экспериментальные группы были созданы путем выбора анатомически соответствующих корневых каналов в соответствии с AR, объемом и 3D геометрией канала после сканирования 237 нижних резцов (De-Deus et al., 2020). Этот подход позволяет лучше контролировать влияние смешивающих факторов, которые анатомические вариации в морфологии корневого канала могут оказать на результаты лабораторных исследований. Учитывая, что минимизация зазоров в интерфейсах GP-герметика и дентин-герметика имеет клиническое значение для предотвращения проникновения бактерий и/или их побочных продуктов (Yücel & Çiftçi, 2006), настоящие результаты должны способствовать разработке дальнейших исследований для проверки способности заполнения техникой одного конуса с CSS не только в различных морфологиях каналов, но и в зубах, подготовленных с минимально инвазивными подходами.
Выводы
В рамках экспериментального исследования текущего исследования можно сделать вывод, что AH Plus продемонстрировал лучшее качество адаптации на интерфейсе GP-герметика по сравнению с герметиком EndoSequence BC. Ни один из образцов не показал интерфейс без зазоров.
Авторы: Густаво Де-Деус, Густаво О. Сантос, Иара Замбони Монтейро, Даниэле М. Кавалканте, Марко Симойнс-Карвальо, Фелипе Г. Белладонна, Эммануэль Ж. Н. Л. Силва, Эрик М. Соуза, Рафаэль Лича, Карла Зогейб, Марко А. Версиани
Ссылки:
- Барборка, Б. Дж., Вудманси, К. Ф., Гликман, Г. Н., Шнайдерман, Е. & Хе, Дж. (2017) Долгосрочные клинические результаты лечения зубов, заполненных Resilon. Журнал эндодонтии, 43, 556–560.
- Кандейро, Г. Т., Коррея, Ф. К., Дуарте, М. А., Рибейро-Сикейра, Д. С. & Гавини, Г. (2012) Оценка радиopacity, pH, высвобождения ионов кальция и текучести биокерамического герметика для корневых каналов. Журнал эндодонтии, 38, 842–845.
- Дакульси, Г., Пассюти, Н., Мартин, С., Деудон, С., Легерос, Р. З. & Рахер, С. (1990) Макропористая керамика кальций-фосфата для хирургии длинных костей у людей и собак. Клиническое и гистологическое исследование. Журнал биомедицинских материалов, 24, 379–396.
- Де-Деус, Г., Ди Джорджи, К., Фидель, С., Фидель, Р. А. & Пасиорник, С. (2009) Прочность сцепления Resilon/Epiphany и Resilon/Epiphany self-etch к корневой дентине. Журнал эндодонтии, 35, 1048–1050.
- Де-Деус, Г., Рейс, К., Ди Джорджи, К., Брандан, М. С., Ауди, К. & Фидель, Р. А. (2011) Интерфейсная адаптация самоклеящегося герметика Epiphany к корневой дентине. Оральная хирургия, оральная медицина, оральная патология, оральная радиология и эндодонтия, 11, 381–386.
- Де-Деус, Г., Симойнс-Карвальо, М., Белладонна, Ф. Г., Версиани, М. А., Силва, Э. Ж. Н. Л., Кавалканте, Д. М. и др. (2020) Создание хорошо сбалансированных экспериментальных групп для сравнительных лабораторных исследований в эндодонтии: новое предложение на основе микро-КТ и in silico методов. Международный журнал эндодонтии, 53, 974–985.
- Демиркиран, Х. (2012) Биокерамика для остеогенеза, молекулярные и клеточные достижения. В: Джандиал, Р. & Чен, М. Й. (Ред.) Регенеративная биология позвоночника и спинного мозга. Достижения в экспериментальной медицине и биологии. Нью-Йорк, NY: Springer, с. 760. Эльтаир, М., Питчика, В., Хикель, Р., Кюниш, Й. & Дигритц, С. (2018)
- Оценка интерфейса между гуттаперчей и двумя типами герметиков с использованием сканирующей электронной микроскопии (SEM). Клинические оральные исследования, 22, 1631–1639.
- Элясси, Й., Моинзадех, А. Т. & Клевералан, С. Дж. (2019) Характеризация выщелачиваний из 6 герметиков для корневых каналов. Журнал эндодонтии, 45, 623–627.
- Эймирли, А., Сунгур, Д. Д., Уйяник, О., Пурали, Н., Нагас, Е. & Чехрели, З. Ц. (2019) Проникновение в дентинные канальцы и возможность повторного лечения герметика на основе кальций-силиката, протестированного в объеме или с различными основными материалами. Журнал эндодонтии, 45, 1036–1040.
- Фридман, С. Е., Сандрик, Дж. Л., Хеер, М. А. & Рапп, Г. В. (1977) Состав и физические свойства гуттаперчевых эндодонтических материалов для заполнения. Журнал эндодонтии, 3, 304–308.
- Гандольфи, М. Г., Парилли, А. П., Фини, М., Прати, К. & Даммер, П. М. (2013) 3D микро-КТ анализ интерфейсных пустот, связанных с корневыми пломбами Thermafil, использованными с AH Plus или текучим герметиком MTA. Международный журнал эндодонтии, 46, 253–263.
- Гиварш, М., Жанно, К., Жирауд, Т., Поммель, Л., Обут, И., Азим, А. А. и др. (2020) Международный опрос о применении герметиков на основе кальций-силиката в неоперативном эндодонтическом лечении. Клинические оральные исследования, 1, 417–424.
- Хегде, В. & Арора, С. (2015) Способность к герметизации нового гидрофильного и традиционного гидрофобного систем заполнения: исследование бактериальной утечки. Журнал консервативной стоматологии, 18, 62–65.
- Хесс, Д., Соломон, Е., Спирс, Р. & Хе, Дж. (2011) Возможность повторного лечения биокерамического герметика для корневых каналов. Журнал эндодонтии, 37, 1547–1549.
- Хираиши, Н., Садек, Ф. Т., Кинг, Н. М., Феррари, М., Пашли, Д. Х. & Тей, Ф. Р. (2008) Уязвимость материала для заполнения корневых каналов на основе полиэфирокапролактон к деградации с использованием диффузионного теста с агаром. Американский журнал стоматологии, 21, 119–123.
- Хираиши, Н., Яу, Дж. Й. Й., Лушайн, Р. Дж., Армстронг, С. Р., Уэллер, Р. Н., Кинг, Н. М. и др. (2007) Уязвимость материала для заполнения корневых каналов на основе полиэфирокапролактон к деградации. III. Турбидиметрическая оценка ферментативного гидролиза. Журнал эндодонтии, 33, 952–956.
- ISO. (2012) Международный стандарт ISO 6876:2012: стоматологические герметики для корневых каналов. Женева: Швейцария.
- Кетчам, Р. А. & Карлсон, В. Д. (2001) Приобретение, оптимизация и интерпретация рентгеновских компьютерных томографических изображений: применение в геонауках. Компьютеры и геонауки, 27, 381–400.
- Ким, Дж. А., Хванг, Й. С., Роса, В., Ю, М. К., Ли, К. В. & Мин, К. С. (2018) Качество заполнения корневого канала премиксированным герметиком на основе кальций-силиката, примененным с использованием ультразвуковой активации с конусом гуттаперчи. Журнал эндодонтии, 44, 133–138.
- Ким, С., Ким, С., Парк, Дж. В., Чунг, И. Й. & Шин, С. Дж. (2017) Сравнение процента пустот в заполнении канала герметиком на основе кальций-силиката и конусами гуттаперчи с использованием двух техник пломбирования. Материалы, 12(10), 1170.
- Ле Ферран, Х. & Бача, А. (2021) Открытие и повторное открытие гуттаперчи, натурального термопласта. MRS Bulletin, 46, 84–85.
- Ли, Дж. К., Квак, С. В., Ха, Дж. Х., Ли, В. С. & Ким, Х. С. (2017) Физико-химические свойства герметиков на основе эпоксидной смолы и биокерамики. Bioinorganic Chemistry and Applications, 2017, 1–8.
- ЛеГерос, Р. З. (1988) Материалы кальций-фосфата в восстановительной стоматологии: обзор. Advances in Dental Research, 2, 164–180.
- Моинзадех, А. Т., Цербст, В., Бутсиукис, К., Шемеш, Х. & Засланский, П. (2015) Распределение пористости в корневых каналах, заполненных гуттаперчей и цементом на основе кальций-силиката. Стоматологические материалы, 31, 1100–1108.
- Мурер, В. Р. & Жене, Ж. М. (1982) Антибактериальная активность конусов гуттаперчи, обусловленная компонентом оксида цинка. Оральная хирургия, оральная медицина и оральная патология, 53, 508–517.
- Нагендрабабу, В., Мюррей, П. Е., Ординола-Запата, Р., Питерс, О. А., Рокас, И. Н., Сикейра, Дж. Ф. мл. и др. (2021) Рекомендации PRILE 2021 для отчетности о лабораторных исследованиях в эндодонтии: объяснение и разъяснение. Международный журнал эндодонтии, 54, 1491–1515.
- Нилакантан, П., Нандагопал, М., Шемеш, Х. & Весселинк, П. (2015) Влияние протоколов кондиционирования корневой дентин на прочность сцепления трех герметиков на основе кальций-силиката. Международный журнал адгезии и адгезивов, 60, 104–108.
- Оливейра, Д. С., Кардозо, М. Л., Кейроз, Т. Ф., Силва, Э. Ж., Соуза, Э. М. & Де-Деус, Г. (2016) Подоптимальные прочности сцепления герметиков на основе кальций-силиката. Международный журнал эндодонтии, 49, 796–801.
- Педулла, Э., Абиад, Р. С., Конте, Г., Ла Роса, Г. Р. М., Раписарда, Э. & Нилакантан, П. (2020) Заполнение корней с использованием конуса с совпадающим сужением и двух герметиков на основе кальций-силиката: анализ пустот с использованием микро-компьютерной томографии. Клинические оральные исследования, 24, 4487–4492.
- Пинто, Дж. С., Торрес, Ф. Ф. Е., Лукас-Оливейра, Е., Бонагамба, Т. Дж., Гуэррейро-Таномару, Дж. М. & Таномуару-Фильо, М. (2021) Оценка изогнутых корневых каналов, заполненных новым биокерамическим герметиком: исследование микро-компьютерной томографии с использованием изображений с различными размерами вокселей и методами сегментации. Микроскопия, исследования и техника, 84, 2960–2967.
- Сагсен, Б., Устюн, Й., Демирбуга, С. & Пала, К. (2011) Прочность сцепления двух новых герметиков на основе кальций-силиката к дентину корневого канала. Международный журнал эндодонтии, 44, 1088–1091.
- Шиппер, Г., Øрставик, Д., Тейшейра, Ф. Б. & Тропе, М. (2004) Оценка микробной утечки в корнях, заполненных термопластичным синтетическим полимерным материалом для заполнения корневых каналов (Resilon). Журнал эндодонтии, 30, 342–347.
- Шиппер, Г., Тейшейра, Ф. Б., Арнольд, Р. Р. & Тропе, М. (2005) Перипикальная воспаление после коронального микробного инокулирования корней собак, заполненных гуттаперчей или Resilon. Журнал эндодонтии, 31, 91–96.
- Силва, Э. Ж. Н. Л., Канабарро, А., Андраде, М. Р. Т. С., Кавалканте, Д. М., фон Штеттен, О., Фидальго, Т. К. Д. С. и др. (2019) Сопротивление смещению биокерамических и эпоксидных герметиков: систематический обзор и мета-анализ. Журнал стоматологической практики на основе доказательств, 19, 221–235.
- Силва, Э. Ж. Н. Л., Эрхардт, И. Ц., Сампайо, Г. Ц., Кардозо, М. Л., Оливейра, Д. Д. С., Узеда, М. Дж. и др. (2021) Определение установки герметиков для корневых каналов с использованием in vivo экспериментальной модели на животных. Клинические оральные исследования, 25, 1899–1906.
- Силва, Э. Дж., Роса, Т. П., Эррера, Д. Р., Жасинто, Р. Ц., Гомес, Б. П. & Зайя, А. А. (2013) Оценка цитотоксичности и физико-химических свойств эндодонтического герметика на основе кальций-силиката MTA Fillapex. Журнал эндодонтии, 39, 274–277.
- Силва, Э. Ж. Н. Л., Зайя, А. А. & Питерс, О. А. (2017) Цитосовместимость герметиков на основе кальций-силиката в трехмерной модели клеточной культуры. Клинические оральные исследования, 21, 1531–1536.
- Силва-Альмейда, Л. Х., Мораес, Р. Р., Моргантал, Р. Д. & Паппен, Ф. Г. (2017) Сравнимы ли премиксированные герметики на основе кальций-силиката с традиционными материалами? Систематический обзор in vitro исследований. Журнал эндодонтии, 43, 527–535.
- Стрейндж, К. А., Тавил, П. З., Филлипс, С., Уалия, Х. Д. & Фуа, А. Ф. (2019) Долгосрочные результаты эндодонтического лечения, проведенного с использованием Resilon/Epiphany. Журнал эндодонтии, 45, 507–512.
- Сун, Дж., Эйделман, Н. & Лин-Гибсон, С. (2009) 3D картирование усадки полимеризации с использованием рентгеновской микро-компьютерной томографии для предсказания микротечи. Стоматологические материалы, 25, 314–320.
- Таномару-Фильо, М., Торрес, Ф. Ф. Е., Чавес-Андраде, Г. М., де Алмейда, М., Наварро, Л. Г., Штейер, Л. и др. (2017) Физико-химические свойства и объемные изменения силиконовых/биоактивных стеклянных и герметиков на основе кальций-силиката. Журнал эндодонтии, 43, 2097–2101.
- Тей, Ф. Р., Лушайн, Р. Дж., Ламбреchts, П., Уэллер, Р. Н. & Пашли, Д. Х. (2005a) Геометрические факторы, влияющие на сцепление дентин в корневых каналах: теоретический подход к моделированию. Журнал эндодонтии, 31, 584–589.
- Тей, Ф., Пашли, Д., Уильямс, М., Рейна, Р., Лушайн, Р., Уэллер, Р. и др. (2005b) Уязвимость материала для заполнения корневых каналов на основе полиэфирокапролактон к деградации. I. Щелочной гидролиз. Журнал эндодонтии, 31, 593–598.
- Тей, Ф. Р., Пашли, Д. Х., Юй, Ц. К. Й., Яу, Дж. Й. Й., Юй-фай, М., Лушайн, Р. Дж. и др. (2005c) Уязвимость материала для заполнения корневых каналов на основе полиэфирокапролактон к деградации. II. Гравиметрическая оценка ферментативного гидролиза. Журнал эндодонтии, 31, 737–741.
- Тей, Ф. Р. & Пашли, Д. Х. (2007) Моноблоки в корневых каналах: гипотетическая или осязаемая цель. Журнал эндодонтии, 33, 391–398.
- Тей, Ф. Р., Пашли, Д. Х., Лушайн, Р. Дж., Куттлер, С., Гарсия-Годой, Ф., Кинг, Н. М. и др. (2007) Уязвимость материала для заполнения корневых каналов на основе полиэфирокапролактон к деградации. Доказательства биодеградации из смоделированного полевого теста. Американский журнал стоматологии, 20, 365–369.
- Тейшейра, Ф. Б., Тейшейра, Е. Ц., Томпсон, Дж. Й. & Тропе, М. (2004) Устойчивость к разрушению корней, эндодонтически обработанных новым материалом для заполнения смолой. Журнал Американской стоматологической ассоциации, 135, 646–652.
- Торрес, Ф. Ф. Е., Зордан-Бронзель, К. Л., Гуэррейро-Таномару, Дж. М., Чавес-Андраде, Г. М., Пинто, Дж. С. & Таномуару-Фильо, М. (2020) Влияние погружения в дистиллированную воду или фосфатно-буферный раствор на растворимость, объемные изменения и наличие пустот в новых герметиках на основе кальций-силиката. Международный журнал эндодонтии, 53, 385–391.
- Виапиана, Р., Моинзадех, А. Т., Камилери, Л., Весселинк, П. Р., Таномуару Фильо, М. & Камилери, Дж. (2016) Пористость и способность к герметизации корневых пломб с использованием гуттаперчи и герметиков BioRoot RCS или AH Plus. Оценка тремя ex vivo методами. Международный журнал эндодонтии, 49, 774–782.
- Уилсон, А. Д., Клинтон, Д. Дж. & Миллер, Р. П. (1973) Цинк-оксид-эвгенольные цементы: IV. Микроструктура и гидролиз. Журнал стоматологических исследований, 52, 253–260.
- Вольфмейер, У., Шмидт, Х., Хайнрихс, Ф. Л., Михальчик, Г., Пайер, В., Дитше, В. и др. (2002) Воски. В: Энциклопедия промышленной химии Ульмана. Т. 39. Вейнхайм: Вайли:112–172.
- Янписет, К., Баномьонг, Д., Чотворрарак, К. & Срисатджалук, Р. Л. (2018) Бактериальная утечка и оценка микро-компьютерной томографии в круглых каналах, заполненных биокерамическим конусом и герметиком с использованием техники совпадающего одиночного конуса. Восстановительная стоматология и эндодонтия, 43, e30.
- Юджел, А. Ц. & Чифтчи, А. (2006) Влияние различных техник пломбирования корневых каналов на бактериальное проникновение. Оральная хирургия, оральная медицина, оральная патология, оральная радиология и эндодонтия, 102, e88–e92.
- Заре, С., Шен, И., Чжу, Ц., Аhn, C., Примус, С. & Комабаяши, Т. (2021) Оценка микро-компьютерной томографии одиночного конуса с тремя герметиками. Восстановительная стоматология и эндодонтия, 46, e25.
- Зайгер, Д. Н., Сун, Дж., Шумахер, Г. Е. & Лин-Гибсон, С. (2009) Оценка усадки стоматологического композита и утечки в извлеченных зубах с использованием рентгеновской микро-компьютерной томографии. Стоматологические материалы, 25, 1213–1220.
- Чжан, В., Ли, З. & Пэн, Б. (2010) Влияние iRoot SP на экспрессию генов, связанных с минерализацией, в клетках MG63. Журнал эндодонтии, 36, 1978–1982.
- Зордан-Бронзель, К. Л., Эстевес Торрес, Ф. Ф., Таномуару-Фильо, М., Чавес-Андраде, Г. М., Боссо-Мартело, Р. & Гуэррейро-Таномару, Дж. М. (2019) Оценка физико-химических свойств нового герметика на основе кальций-силиката, Bio-C sealer. Журнал эндодонтии, 45, 1248–1252.