Сравнительное исследование биосовместимости двух герметиков для корневых каналов, имплантированных в подкожную соединительную ткань крыс
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Цель. Оценить биосовместимость 2 герметиков для корневых каналов под кожей.
Дизайн исследования. Для тестирования герметиков для корневых каналов Endométhasone и EndoREZ использовалась подкожная имплантационная техника, рекомендованная Международной стоматологической федерацией (FDI). Эти материалы были помещены в тефлоновые трубки диаметром 1 мм и длиной 10 мм и имплантированы в 2 кармана, созданные на спине 40 Calomys callosus грызунов, по 20 для каждого материала. Биопсии тканей были собраны и гистологически исследованы через 15, 30, 60 и 90 дней после процедуры имплантации. Общий уровень воспалительной реакции тканей оценивался как отсутствующий, незначительный, умеренный или тяжелый на интерфейсе герметика и соединительной ткани на открывающихся концах трубок. Реакция соединительной ткани вдоль боковой стенки снаружи каждой трубки служила негативным контролем.
Результаты. Реакция ткани на Endométhasone уменьшалась с течением времени. Герметик EndoREZ был высокотоксичным на протяжении всех экспериментальных периодов.
Заключение. Эндометазоновый герметик для корневых каналов продемонстрировал биосовместимость в проанализированных периодах, в то время как EndoREZ не показал биосовместимого поведения и вызвал позднюю гиперчувствительную реакцию. (Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007;103:e88-e94)
Успешная эндодонтическая терапия зависит от правильной диагностики, эффективной очистки, устранения инфекции и адекватной обтурации корневых каналов. Реакция периапикальной ткани после лечения корневых каналов может зависеть от различных факторов, в зависимости от химической природы эндодонтического герметика. В клинической практике в настоящее время используются герметики на основе смол, оксида цинка-эвгенола, стеклоиономерные, силиконовые и на основе гидроксида кальция. Герметики на основе смол становятся все более популярными, но исследования показали, что некоторые из этих герметиков обладают токсичностью и мутагенностью. Несмотря на большое разнообразие доступных герметиков, герметик для корневых каналов, обладающий всеми желаемыми физическими и биологическими свойствами, еще не был найден. Биосовместимость является одним из самых важных свойств материалов для пломбирования корней8, поскольку выделение определенных веществ герметиками может вызывать различные реакции в периапикальных тканях. Реакции тканей, вызванные эндодонтическими материалами, обычно исследуются с помощью гистологических исследований после имплантации материала в ткань животного. Эндометазон (Spécialities Septodont, Сен-Мор-де-Фоссе, Франция) является герметиком на основе оксида цинка-эвгенола, который ранее оценивался в различных исследованиях относительно его биологических свойств. В последнее время был представлен новый эндодонтический герметик на основе метакрилата, EndoREZ (Ultradent Products Inc., Южный Джордан, Юта, США), и его биологические свойства были мало исследованы.
Целью данного исследования было оценить реакцию подкожной соединительной ткани на герметики для корневых каналов EndoREZ и Endométhasone в соответствии с требованиями, рекомендованными FDI.
Методы
Протокол данного эксперимента был одобрен Комитетом по этике исследований Университета Уберландии, и эксперимент проводился в соответствии с Политикой Службы общественного здравоохранения США по гуманному обращению и использованию лабораторных животных. Использовались сорок самцов Calomys callosus (Rodentia, Cricetidae), весом от 150 до 200 г. Образцы были разделены на 2 группы по 20 животных в каждой для герметиков Endométhasone и EndoREZ. Таблица I показывает материалы, производителей и основные компоненты.
Все материалы были подготовлены в соответствии с рекомендациями производителей для их клинического использования и загружены в автоклавированные тефлоновые носители (политетрафторэтилен, Du-Pont, Habia, Knivsta, Швеция), длиной 10 мм с одним просветом и внутренним диаметром 1 мм, что обеспечивало отсутствие захваченного воздуха.
Животные были анестезированы интраперитонеально с помощью 0,2 мл кетамина, содержащего ацеPROMAZINE в соотношении 1:1. Дорсальная кожа была выбрита, продезинфицирована 5% настойкой йода, и небольшие разрезы, примерно 15 мм в длину, были сделаны лезвием с обеих сторон спины. Два отдельных кармана были созданы с помощью тупой диссекции для имплантации трубок в подкожную ткань на глубину ~15 мм. Трубки, содержащие свежесмешанные герметики, были помещены в правый и левый карманы, подготовленные у каждого животного. Были приняты меры для предотвращения проливания материалов в ткань. После имплантации раны были зашиты.
Животные были убиты группами по 5 особей через 15, 30, 60 и 90 дней с помощью удушения углекислым газом, что обеспечивало минимальный дискомфорт и стресс. Трубки были иссечены вместе с кожей и соединительной тканью вокруг них. Образцы были погружены в 10% формалин в 0,1 моль/л фосфатно-буферном растворе на 24 часа, обезвожены в градиентных растворах этанола при комнатной температуре и вмонтированы в гликолеметакрилат (Historesin; Leica Microsystems, Nussloch GmbH, Германия). Для срезов блоки были ориентированы параллельно длинной оси трубки. Срезы были нарезаны толщиной 3 мкм и окрашены синим толуидином 1%. Гистологические срезы были проанализированы при различных увеличениях под световым микроскопом, отмечая реакции тканей на интерфейсе герметика и соединительной ткани на открытых концах трубок. Ответ соединительной ткани вдоль боковой стенки снаружи трубок служил негативным контролем.
Интерфейс на открытии чашки между материалом и костью был исследован и оценен по интенсивности воспаления. Оценка по критериям Fédération Dentaire International (FDI) является исключительно качественной, и индекс оценки не использовался. Таким образом, общий уровень реакции ткани оценивался как отсутствующий, незначительный, умеренный или тяжелый, в зависимости от наличия или отсутствия нейтрофильных лейкоцитов, макрофагов, лимфоцитов, плазматических клеток, гигантских клеток инородного тела, дисперсного материала, капсулы, вновь образованной здоровой кости, некротической ткани и резорбции. Общий уровень воспалительной реакции ткани оценивался следующим образом: 1) отсутствующий/незначительный: толщина зоны реакции аналогична или лишь немного шире толщины вдоль боковой трубки, с отсутствием или небольшим количеством воспалительных клеток; 2) умеренный: увеличенная зона реакции, в которой присутствуют макрофаги, плазматические клетки или оба; и 3) тяжелый: увеличенная зона реакции, в которой присутствуют макрофаги и плазматические клетки, а также случайные очаги нейтрофильных гранулоцитов, лимфоцитов или обоих.
Интерпретации результатов основывались на следующих критериях FDI: отсутствие или незначительная реакция как на 2, так и на 12 неделе является приемлемой; отсутствие или незначительная реакция на 2 неделе, которая увеличивается до умеренной или тяжелой реакции на 12 неделе, неприемлема; умеренная реакция на 2 и 12 неделях неприемлема; умеренная реакция на 2 неделе, которая уменьшается на 12 неделе, является приемлемой; и тяжелая реакция в любой период неприемлема.
Результаты
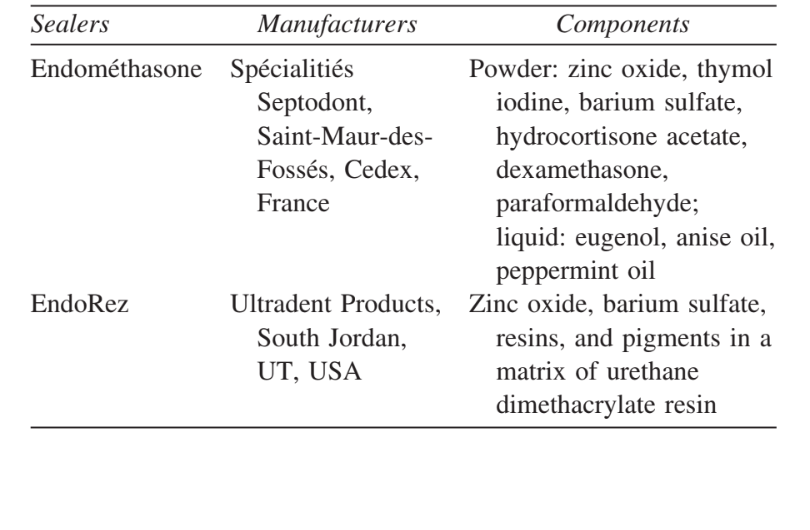
Интенсивность воспалительного ответа во всех экспериментальных периодах обоих герметиков была проанализирована. Ответ соединительной ткани вдоль боковой стенки вне тефлоновых трубок служил отрицательным контролем для техники и не показал воспалительной реакции во всех экспериментальных периодах (Рис. 1). Число образцов в каждой воспалительной категории в разные временные рамки для 2 типов герметиков представлено в Таблице II.
Эндометазон
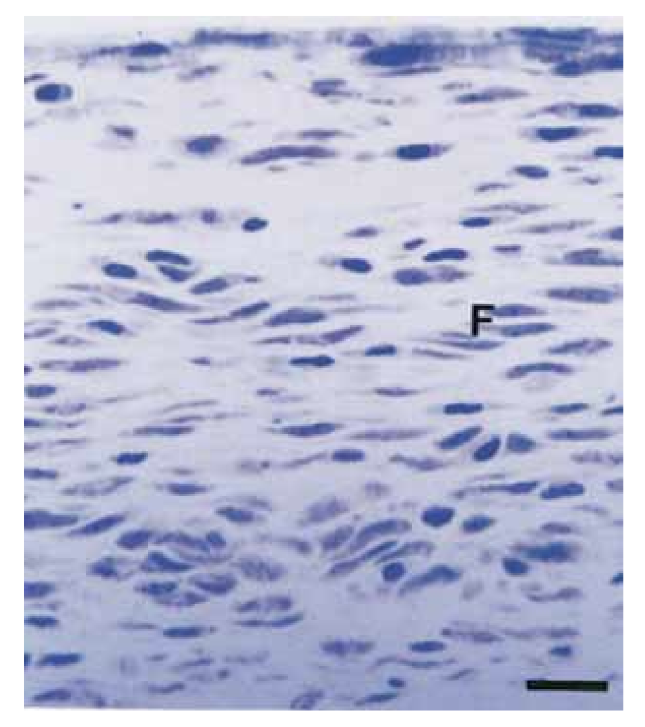
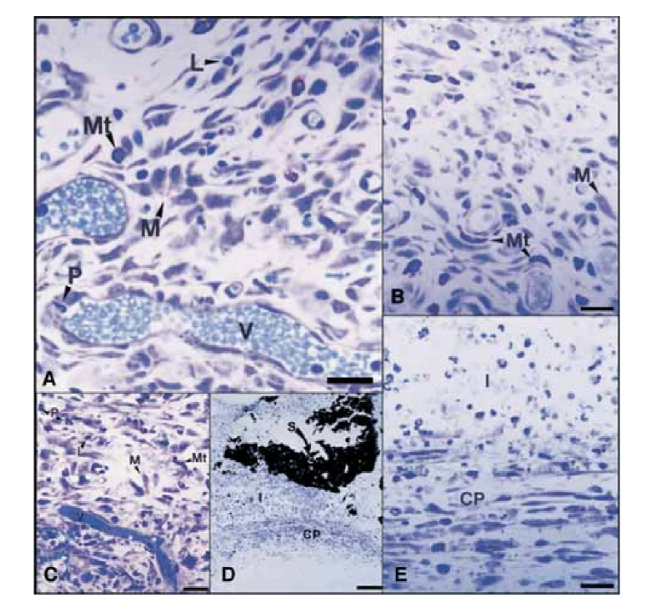
На 15-й день была отмечена умеренная до выраженной воспалительная реакция. Ткань была инфильтрирована преимущественно макрофагами и лимфоцитами. Также наблюдалось присутствие полиморфноядерных лейкоцитов, гиперемия и морфологически измененная внеклеточная матрица (Рис. 2, A). На 30-й, 60-й и 90-й дни соединительная ткань не показала воспалительной реакции (Рис. 2, B, C и D).
EndoREZ
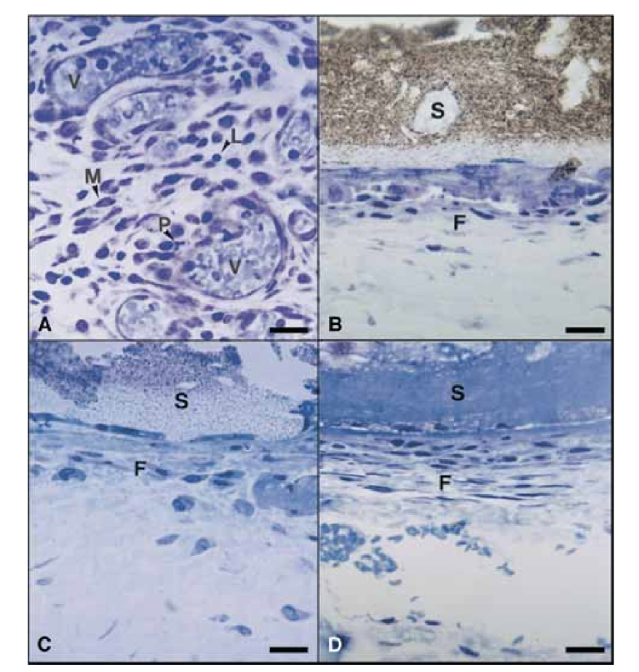
На 15-й день была отмечена умеренная до тяжелой воспалительная реакция. Ткань была инфильтрирована преимущественно макрофагами, несколькими полиморфноядерными лейкоцитами и лимфоцитами. Также была отмечена гиперемия сосудов и уменьшенная, морфологически измененная внеклеточная матрица (Рис. 3, A). С 30-го дня была зафиксирована тяжелая воспалительная реакция, и воспалительный инфильтрат, состоящий преимущественно из полиморфноядерных лейкоцитов, лимфоцитов и макрофагов, начал проникать в просвет тефлоновых трубок. Кроме того, на интерфейсе герметика и соединительной ткани были обнаружены кровеносные сосуды, окруженные тучными клетками (Рис. 3, B). На 60-й день сохранялась тяжелая воспалительная реакция с макрофагами, лимфоцитами и полиморфноядерными лейкоцитами. На открытии тефлоновых трубок герметик был заменен воспалительным инфильтратом с преобладанием макрофагов и лимфоцитов. Были обнаружены конгестированные кровеносные сосуды, окруженные тучными клетками (Рис. 3, C). Также была выявлена постоянная фибробластная пролиферация, окружающая воспалительную ткань. На 90-й день был зафиксирован тяжелый воспалительный инфильтрат, состоящий из макрофагов, лимфоцитов, полиморфноядерных лейкоцитов, эритроцитов и мертвых клеток, который инвагинировал в просвет тефлоновых трубок, заменяя герметик. На открытом конце трубок гранулематозная ткань была окружена фиброзной капсулой (Рис. 3, D и E).
Обсуждение
Когда новый материал вводится на рынок или существующий материал предлагается для другого применения, его свойства должны быть исследованы, а результаты сопоставлены с данными других авторов. В Соединенных Штатах ответственность за оценку и анализ биологических эффектов всех лекарств, материалов и устройств, используемых у людей, включая большинство стоматологических продуктов и устройств, несет Управление по контролю за продуктами и лекарствами (FDA). FDA также обеспечивает признание стандартов, установленных частными организациями, такими как ANSI/ADA. Пересмотр первых опубликованных Рекомендуемых стандартных практик для биологической оценки стоматологических материалов был отложен, чтобы включить основные рекомендации FDA. Этот новый документ не предназначен для того, чтобы препятствовать промышленному развитию новых и улучшенных стоматологических продуктов, требуя чрезмерных биологических испытаний, но в эту эпоху обеспокоенности химическими опасностями должен быть разработан профиль токсичности для всех новых и улучшенных материалов, чтобы получить соответствующие данные о безопасности и эффективности. Хотя ни одно количество экспериментальных исследований не может гарантировать абсолютную безопасность для любого вещества, токсикологические исследования предоставляют данные, на основе которых можно сделать разумные прогнозы и предсказания о условиях, при которых агент может быть безопасно использован.
Хотя многие тесты, такие как цитотоксичность, гемолиз, тест Амэ, трансформация клеток Стайла, подкожные и костные имплантации, сенсибилизация и эндодонтическое использование, перечислены для различных уровней тестирования, не все они требуются для каждого продукта. Необходимо принять решение о том, какие тесты являются актуальными. Первоначальные тесты предназначены для предоставления профиля токсичности в биологической системе, чтобы производитель имел общее представление о том, где находится продукт. Для FDA регулируемые устройства делятся на 3 класса, однако большинство стоматологических устройств и аппаратов не подлежат установлению стандартов для предварительного разрешения на рынок. Другими словами, иногда даже базовое тестирование безопасности не требуется, прежде чем продукты могут быть предложены для клинического использования.
Биосовместимость стоматологических материалов является важным требованием, поскольку токсичные компоненты, присутствующие в этих материалах, могут вызывать раздражение или даже дегенерацию окружающих тканей, особенно когда они случайно выбрасываются в перирадикулярные ткани. Подкожная имплантация соединительной ткани у животных является одним из самых надежных методов оценки биосовместимости стоматологических материалов, поскольку воспалительные реакции являются характерной особенностью всех соединительных тканей. Дикое грызун Calomys callosus обычно используется для исследования экспериментальной инфекции и гуморального иммунного ответа и был использован в настоящем исследовании благодаря своей воспроизводимости как установленной модели, широко принятой в литературе.
Образцы были внедрены в гликоль метакрилат из-за его преимуществ по сравнению с парафином, таким как меньшая деформация, получение тонких срезов, которые обеспечивают хорошую клеточную четкость, возможность подготовки срезов без удаления трубок и окрашивание с хорошим качеством и небольшим количеством технических артефактов, что способствует более точной оценке воспалительной реакции.
В данном исследовании соединительная ткань вдоль боковой стенки служила отрицательным контролем и не проявляла воспалительных реакций (Рис. 1), что демонстрирует биосовместимость тефлона и то, что воспалительная реакция на открытии трубки была связана с изучаемым материалом.
Биологические свойства эндометазона, корневого канала герметика на основе оксида цинка–эвгенола (ZOE), ранее изучались в отношении антибактериальной активности, цитотоксичности и биосовместимости тканей. Эвгенол (4-аллил-2-метоксифенол) является экстрактом гвоздичного масла, широко используемым в стоматологии в качестве терапевтического агента, чаще всего как компонент цемента на основе оксида цинка–эвгенола, применяемого в качестве основы или временной повязки на дентин или как герметик для корневого канала. Сообщалось о нескольких исследованиях, касающихся гистопатологического влияния герметиков для корневых каналов на основе ZOE на ткани. Эвгенол, который вымывается из герметиков для корневых каналов на основе ZOE, может участвовать в развитии периапикального воспаления или продолжении существующей периапикальнойLesion.
В настоящем исследовании воспалительные реакции подкожной ткани на Эндометазон уменьшались с течением времени, аналогично результатам, полученным Капланом и др., вероятно, благодаря нейтрализации эвгенола, высвобождаемого в начале, и местному высвобождению кортикостероидов, таких как дексаметазон и гидрокортизон. Многие исследователи предположили, что раздражающее действие герметиков на основе ZOE может быть в первую очередь связано с эвгенолом и вторично с ионами цинка. Эвгенол может ингибировать функцию макрофагов и может влиять на воспалительные реакции в периапикальных тканях. Параформальдегид, как было показано, вызывает аллергическую реакцию и некроз соединительной ткани. Однако, несмотря на высокую концентрацию параформальдегида в герметике Эндометазон, в настоящем исследовании такие результаты не были обнаружены.
Недавно был представлен новый эндодонтический герметик на основе метакрилата в качестве герметика для корневых каналов. EndoREZ - это гидрофильный, двухкомпонентный, химически затвердевающий материал, содержащий оксид цинка, сульфат бария, смолы и пигменты в матрице смолы уретан-метакрилата.
Биологические свойства EndoREZ ранее исследовались в отношении его цитотоксичности и биосовместимости с тканями. Исследования биосовместимости герметиков на основе смол показали умеренную до тяжелой воспалительную реакцию. В настоящем исследовании EndoREZ вызвал тяжелую воспалительную реакцию на всех экспериментальных периодах. Поскольку средняя продолжительность жизни нейтрофила вне кровеносного сосуда составляет 7 дней, наличие полиморфноядерных клеток на всех экспериментальных периодах указывает на токсичное поведение этого материала. С использованием культивируемых клеток было продемонстрировано, что EndoREZ становился более цитотоксичным с увеличением времени воздействия и представлял значительные цитотоксические риски при свежем смешивании. Реакция соединительной ткани на силиконовые трубки, заполненные EndoREZ, имплантированные в подкожную ткань крыс, показала тяжелую реакцию, которая значительно изменила свой профиль после 30 дней, с умеренной реакцией через 3 месяца и отсутствием воспаления через 4 месяца. Тем не менее, также сообщалось, что у некоторых животных воспалительная реакция сохранялась на всех экспериментальных периодах. Считалось, что после подкожной имплантации свежего EndoREZ компоненты, такие как цинк и барий, находились в прямом контакте с тканью и вызывали тяжелую первоначальную реакцию. В отличие от результатов настоящего исследования, Zmener и др. продемонстрировали удовлетворительный ответ костной ткани в 60-дневный период наблюдения за EndoREZ, имплантированным в большеберцовую кость крыс. Медленное разложение герметика EndoREZ, иллюстрируемое дисперсным материалом, и последующая эндоцитоз макрофагами могли быть причиной такой стойкой хронической воспаления. Кроме того, терапия корневых каналов, выполненная с использованием латерально конденсированных конусов гутаперчи в сочетании с EndoREZ, кажется, демонстрирует хороший общий уровень успеха после 14-24 месяцев оценки.
Кроме того, в настоящем исследовании было отмечено наличие множества тучных клеток в соединительной ткани, в основном в окружающей области кровеносных сосудов, на 30-й, 60-й и 90-й день, что указывает на позднюю гиперчувствительную реакцию на компоненты EndoREZ. Хотя поздняя гиперчувствительная реакция на эндодонтические материалы не часто сообщается, эти неблагоприятные системные реакции, которые происходят чаще, чем сообщается в литературе, не должны быть проигнорированы. Согласно Брателю и др., эндодонтические материалы могут вызывать позднюю гиперчувствительную реакцию даже в субтоксических концентрациях.
Заключение
Согласно критериям FDI, результаты, полученные в настоящем исследовании, позволили сделать вывод, что герметик корневого канала Endométhasone продемонстрировал биосовместимость в анализируемые периоды, в то время как EndoREZ не показал биосовместимого поведения и предположение о поздней гиперчувствительной реакции.
Авторы: Эдилсон Жозе Зафалон, Марко Aurélio Версини, Кассио Жозе Алвеш де Соуза, Камила Кристиан Гомес Мура, Паула Дечичи
Ссылки:
- Бернат М, Сабо Й. Реакция тканей, инициированная различными герметиками. Int Endod J 2003;36:256-61.
- Буййягуэт С, Ватаха Дж. К., Локвуд П. Э., Гальгано К., Голяй А., Крейчи И. Цитотоксичность и герметизирующие свойства четырех классов эндодонтических герметиков, оцененные по активности сукцинатдегидрогеназы и конфокальной лазерной сканирующей микроскопии. Eur J Oral Sci 2004; 112:182-7.
- Каплан А. Э., Ормаэчеа М. Ф., Пикка М., Канзобре М. С., Убиос А. М. Реологические свойства и биосовместимость эндодонтических герметиков. Int Endod J 2003;36:527-32.
- Хауман Ч. Х., Лав Р. М. Биосовместимость стоматологических материалов, используемых в современной эндодонтической терапии: обзор. Часть 2. Материалы для пломбирования корневых каналов. Int Endod J 2003;36:147-60.
- Генчоглу Н, Туркмен Ч, Ахискали Р. Новый силиконовый герметик для корневых каналов (Roekoseal-Automix). J Oral Rehabil 2003;30:753-7.
- Зменер О, Банегас Г, Памейер Ч. Реакция костной ткани на метакрилатный эндодонтический герметик: гистологическое и гистометрическое исследование. J Endod 2005;31:457-9.
- Хуан Т. Х., Ян Дж. Дж., Ли Х., Као Ч. Т. Оценка биосовместимости герметиков для корневых каналов на основе эпоксидной смолы in vitro. Biomaterials 2002;23:77-83.
- Озбас Х, Ялтырк М, Билгич Б, Иссевер Х. Реакции соединительной ткани на компомеры, композитные и амальгамные материалы для пломбирования корневых каналов. Int Endod J 2003;36:281-7.
- Хо Й.-С., Хуан Ф.-М., Чанг Й.-С. Механизмы цитотоксичности эвгенола в человеческих остеобластах in vitro. Int Endod J 2006;39:389-93.
- Хауман Ч. Х., Лав Р. М. Биосовместимость стоматологических материалов, используемых в современной эндодонтической терапии: обзор. Часть 1. Интраканальные препараты и вещества. Int Endod J 2003;36:75-85.
- Сауса К. Дж., Лойола А. М., Версиани М. А., Биффи Дж. С., Оливейра Р. П., Паскон Е. А. Сравнительная гистологическая оценка биосовместимости материалов, используемых в апикальной хирургии. Int Endod J 2004;37:738-48.
- Тепель Дж., Дарвиш эль Саваф М, Хоппе В. Реакция воспаленной периапикальной ткани на интраканальные медикаменты и герметики для корневых каналов. Endod Dent Traumatol 1994;10:233-8.
- Джероса Р, Менегаззи Г, Борин М, Кавалери Дж. Оценка цитотоксичности 6 герметиков для корневых каналов. J Endod 1995;21:446-8.
- Ваджрабхая Л, Ситисарн П. Многослойные и монослойные клеточные культуры в тесте на цитотоксичность герметиков для корневых каналов. Int Endod J 1997;30:141-4.
- Братель Дж., Йонтелл М., Дальгрен У., Бергенхольц Г. Влияние герметиков для корневых каналов на иммунокомпетентные клетки in vitro и in vivo. Int Endod J 1998;31:178-88.
- Серпер А, Уджер О, Онур Р, Этикиан И. Сравнительные нейротоксические эффекты материалов для пломбирования корневых каналов на седалищный нерв крыс. J Endod 1998;24:592-4.
- Эрсев Х, Шмальц Г, Байырлы Г, Швайкль Х. Цитотоксические и мутагенные свойства различных материалов для пломбирования корневых каналов в эукариотических и прокариотических клетках in vitro. J Endod 1999;25:359-63.
- Телли Ч, Серпер А, Доган А. Л., Гюч Д. Оценка цитотоксичности герметиков для корневых каналов на основе фосфата кальция с помощью теста MTT. J Endod 1999;25:811-3.
- Хуан Ф. М., Тай К. В., Чоу М. Й., Чанг Й. С. Цитотоксичность герметиков для корневых каналов на основе смолы, оксида цинка-эвгенола и гидроксида кальция на клетках периодонтальной связки человека и постоянных клетках V79. Int Endod J 2002;35:153-8.
- Шварце Т, Фидлер И, Лейхаузен Г, Гюрцен В. Клеточная совместимость пяти эндодонтических герметиков в период затвердевания. J Endod 2002;28:784-6.
- Шварце Т, Лейхаузен Г, Гюрцен В. Долговременная цитосовместимость различных эндодонтических герметиков с использованием новой модели корневого канала. J Endod 2002;28:749-53.
- Гомес Б. П., Педросо Ж. А., Жасинто Р. С., Вианна М. Е., Ферраз К. К., Заия А. А. и др. Оценка антимикробной активности 5 герметиков для корневых каналов in vitro. Braz Dent J 2004;15:30-5.
- Перасси Ф. Т., Фильо И. Б., Берберт Ф. Л., Карлос И. З., де Толедо Леонардо Р. Секреция фактора некроза опухоли-альфа макрофагами перитонеума мышей в присутствии стоматологических герметиков, Sealapex и эндометазона. J Endod 2004;30:534-7.
- Пиццо Г, Джиамманко Г. М., Кумбо Е, Николози Г, Галлина Г. Антибактериальная активность эндодонтических герметиков in vitro. J Dent 2006; 34:35-40.
- Зменер О. Реакция тканей на новый метакрилатный герметик для корневых каналов: предварительные наблюдения в подкожной соединительной ткани крыс. J Endod 2004;30:348-51.
- Зменер О, Памейер Ч. Клиническая и радиографическая оценка герметика для корневых каналов на основе смолы. Am J Dent 2004;17:19-22.
- Лоу Н. П., Памейер Ч, Норвал Г. Гистопатологическая оценка герметика для корневых каналов у человекоподобных приматов [аннотация]. J Dent Res 2001;80:654.
- Международная стоматологическая федерация, Комиссия стоматологических материалов, инструментов, оборудования и терапевтики. Рекомендуемые стандартные практики для биологической оценки стоматологических материалов. Int Dent J 1980;30:140-88.
- Национальные институты здоровья. Политика службы общественного здравоохранения по гуманному обращению и использованию лабораторных животных, 2006. Доступно по адресу: http://grants.nih.gov/grants/olaw/references/phspol.htm.
- Национальные институты здоровья. Политика службы общественного здравоохранения по гуманному обращению и использованию лабораторных животных, разъяснение по использованию углекислого газа для эвтаназии мелких лабораторных животных, 2006. Доступно по адресу: http://grants.nih.gov/grants/olaw/ Compilation_of_Guidance.doc.
- Стэнли Х. Р. Тестирование токсичности стоматологических материалов. 1-е изд. Майами: CRC Press; 1985.
- Сауса К. Дж., Монтес К. Р. М., Паскон Е. А., Лойола А. М., Версиани М. А. Сравнение интраоссальной биосовместимости герметиков для корневых каналов AH Plus, Endo-REZ и Epiphany. J Endod 2006;32:656-62.
- Хуан Ф. М., Цай Ч. Х., Ян С. Ф., Чанг Й. С. Индукция экспрессии генов интерлейкина-6 и интерлейкина-8 герметиками для корневых каналов в остеобластах человека. J Endod 2005;31:679-83.
- Олссон Б, Сливковски А, Лангеланд К. Подкожная имплантация для биологической оценки эндодонтических материалов. J Endod 1981;7:355-67.
- де Оливейра Л, Боргес М. М., Леал Р. С., Ассреуй Дж., Клоетцель Дж. К. Участие оксида азота в экспериментальной инфекции Trypanosoma cruzi у Calomys callosus и швейцарских мышей. Parasitol Res 1997;83:762-770.
- Танисаки М, Огава К, Лапа С. Р. С., Да Силва П. М. С., Ватанабе И. Морфометрическое и высокоразрешающее сканирующее электронное микроскопическое исследование Calomys callosus большого небного нерва. Int J Morphol 2005;23:13-8.
- Дост К. К., Сарайва Дж., Центаграф У., Монеси Н., Энгельс В., Албукерке С. Участвует ли оксид азота в толерантности Calomys callosus как резервуарного хозяина к инфекции Trypanosoma cruzi? J Infect 2006;52:49-55.
- Таниваки Н. Н., Андреоли В. К., Калабрезе К. С., да Силва С., Мортара Р. А. Разрушение миофибриллярных белков в сердечной мышце Calomys callosus, хронически инфицированной Trypanosoma cruzi и леченной иммуносупрессивным средством. Parasitol Res 2005;97:323-31.
- Мартинес М, Мильтон Ф. А., де Оливейра С. А., де Лима Н. Ф., Сегателли Т. М., Пинейро П. Ф. Ультраструктурные изменения на твердом небном слизистом слое Calomys callosus после 120 дней экспериментального хронического алкоголизма. J Submicrosc Cytol Pathol 2005;37:59-65.
- Кэрролл Д. С., Миллс Дж. Н., Монтгомери Дж. М., Бауш Д. Г., Блэр П. Дж., Буранас Дж. П. Синдром легочной hantavirus в центральной Боливии: взаимосвязи между резервуарными хозяевами, средами обитания и вирусными генотипами. Am J Trop Med Hyg 2005;72:42-6.
- Гомес-Фильо Дж. Е., Гомес Б. П., Заия А. А., Новаес П. Д., Соузa-Фильо Ф. Дж. Гликол метакрилат: альтернативный метод для встраивания подкожных имплантатов. J Endod 2001;27:266-8.
- Паскон Е. А., Леонардо М. Р., Сафави К., Лангеланд К. Реакция тканей на эндодонтические материалы: методы, критерии, оценка и наблюдения. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1991;72:222-37.
- Холланд Р, Отобони Фильо Дж. А., Бернабе П. Ф., Нери М. Дж., де Соуза В., Берберт А. Влияние состояния корневого канала на заживление периодонта после хирургической травмы у собак. Endod Dent Traumatol 1994;10:77-82.
- Хьюм У. Р. Влияние эвгенола на дыхание и деление клеток человеческой пульпы, фибробластов мыши и клеток печени in vitro. J Dent Res 1984;63:1262-5.
- Гулати Н, Чандра С, Аггарвал П. К., Джайсвал Дж. Н., Сингх М. Цитотоксичность эвгенола в герметике, содержащем оксид цинка. Endod Dent Traumatol 1991;7:181-5.
- Нефф Т, Лейман Д, Джиансонн Б. Оценка цитотоксичности герметиков для корневых каналов, подвергнутых нагреванию перед тестом. J Endod 2002;28:811-4.
- Иоаннис К, Николаос Е. Сравнение биосовместимости 2 герметиков для корневых каналов, имплантированных в подкожную соединительную ткань крыс in vivo. J Endod 1998;24:82-5.
- Николаос Е, Иоаннис К. Экспериментальное исследование биосовместимости четырех герметиков для корневых каналов и их влияние на содержание цинка и кальция в различных тканях. J Endod 1995;21:122-7.
- Сегура Дж. Дж., Хименес-Рубио А. Влияние эвгенола на адгезию макрофагов in vivo к пластиковым поверхностям. Endod Dent Traumatol 1998;14:72-4.
- де Оливейра Мендес С. Т., Рибейро Собриньо А. П., де Карвалью А. Т., де Соуза Кортес М. И., Виейра Л. К. Оценка цитотоксичности двух герметиков для корневых каналов на активности макрофагов in vitro. J Endod 2003;29:95-9.
- Ди Фелис Р, Ломбарди Т. Некроз десен и челюстной кости, вызванный пастой, содержащей параформальдегид. Endod Dent Traumatol 1998;14:196-198.
- Котран Р. С., Кумар В., Роббинс С. Л. Патологическая основа болезни: клеточные события. 5-е изд. Филадельфия: Saunders; 1994.
- эль Сайед Ф, Сейт-Беллеза Д, Санс Б, Байле-Лебей П, Маргери М. К., Базекс Ж. Контактная крапивница от формальдегида в стоматологической пасте для корневых каналов. Contact Dermatitis 1995;33:353.
- Эбнер Х, Крафт Д. Анафилаксия, вызванная формальдегидом, после стоматологического лечения? Contact Dermatitis 1991;24:307-9.
