El efecto del bloqueo del ganglio esfenopalatino con anestésico regional en el dolor autoinformado en pacientes con estatus migrañoso.
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления) .
Antecedentes. El estado migrainoso (SM) se define como un ataque de migraña debilitante que dura más de 72 horas en pacientes previamente conocidos por sufrir de dolor de cabeza migrañoso. Típicamente, estos ataques no responden a medicamentos de venta libre ni a medicamentos abortivos. El ganglio esfenopalatino (SPG) juega un papel crítico en la propagación tanto del dolor como de los síntomas autonómicos comúnmente asociados con las migrañas. El bloqueo del SPG a través de lidocaína transnasal es moderadamente efectivo para reducir los síntomas de migraña, pero este enfoque a menudo es mal tolerado y los resultados son inconsistentes. Proponemos que un bloqueo del SPG utilizando un enfoque de inyección suprazigomática sería una opción segura y efectiva para abortar o aliviar el dolor y los síntomas autonómicos del SM.
Métodos. A través de una revisión retrospectiva de registros, identificamos pacientes con un diagnóstico bien establecido de migraña basado en los criterios de la Sociedad Internacional de Cefaleas. Los pacientes seleccionados para la inclusión en el estudio fueron diagnosticados con SM, no respondieron a 2 o más medicamentos abortivos y recibieron un bloqueo del SPG suprazigomático. También se pidió a los pacientes que calificaran su dolor en una escala de Likert de 1 a 10, tanto antes como 30 minutos después de la inyección.
Resultados. Ochenta y ocho pacientes consecutivos (20 hombres y 68 mujeres) recibieron un total de 252 procedimientos de bloqueo del SPG suprazigomático en la clínica ambulatoria de cefaleas después de que los medicamentos tradicionales no lograron abortar su SM. A los 30 minutos después de las inyecciones, hubo una reducción del 67.2% (±26.6%) en la severidad del dolor con una reducción mediana de 5 puntos (IQR= −6 a −3) en la escala de Likert (que va de 1 a 10). En general, los pacientes experimentaron una reducción estadísticamente significativa en la severidad del dolor (P < .0001).
Conclusión. Se sabe que el SPG desempeña un papel integral en la fisiopatología del dolor facial y las cefaleas autonómicas trigeminales, aunque su papel exacto en la generación y mantenimiento de la cefalea migrañosa sigue siendo incierto. El bloqueo del SPG suprazigomático con anestésico regional es potencialmente efectivo para el alivio inmediato de la SM. Creemos que el procedimiento es simple de realizar y tiene un riesgo mínimo.
Introducción
Aproximadamente el 15% de la población general sufre de migraña. El estado migrainoso (SM) se define como un ataque de migraña debilitante que dura más de 72 horas en pacientes que previamente se sabe que sufren de migraña. Típicamente, estos ataques no responden a medicamentos de venta libre estándar, triptanes, esteroides intravenosos (IV), benzodiazepinas parenterales o medicamentos neurolépticos, que proporcionan alivio a corto plazo seguido típicamente de un dolor de cabeza recurrente dentro de las 24 horas. En los Estados Unidos, las visitas al departamento de emergencias (ED) por SM cuestan aproximadamente $700 millones al año. Estos pacientes son frecuentemente hospitalizados. En 2010, el costo de hospitalización por SM totalizó aproximadamente $375 millones. En un informe, la duración promedio de la estancia hospitalaria para un paciente con SM fue de 2.7 días.
El ganglio esfenopalatino (SPG) es el ganglio parasimpático extracraneal más grande del cuerpo y es parte del sistema nervioso autónomo que puede desempeñar un papel en el tratamiento terapéutico de la SM. Específicamente, el SPG se encuentra dentro de la fosa pterigopalatina, detrás del nasofaringe, posterior al cornete medio e inferior al seno esfenoides (Fig. 1). Dado que el SPG está anatómicamente ubicado adyacente a los nervios sensoriales faciales y las ramas del nervio trigémino, tiene un papel potencial en la fisiopatología del dolor de cabeza unilateral y el dolor facial idiopático mediado a través del complejo trigeminovascular.
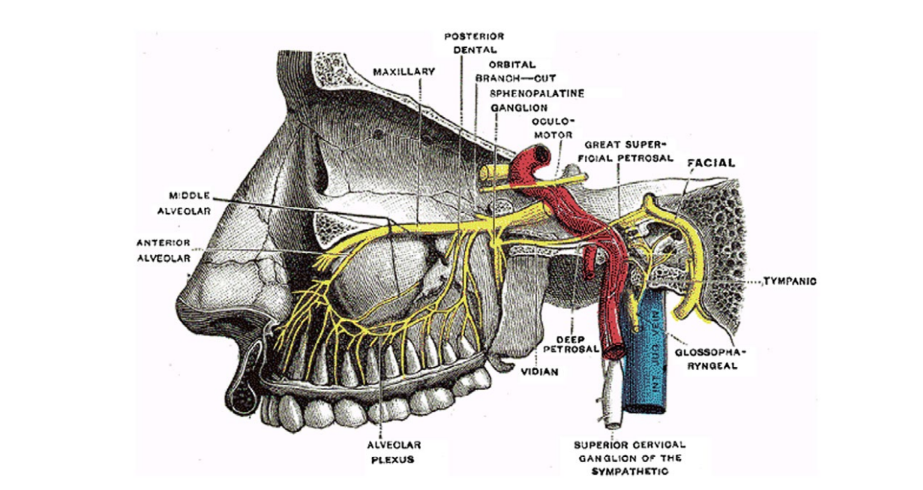
El bloqueo anestésico regional suprazigomático del ganglio esfenopalatino (SSPGB) probablemente afecta el flujo parasimpático hacia las estructuras vasculares craneales, aunque el mecanismo no se comprende completamente. Cuando se desencadena una migraña, se activa el reflejo trigémino-autonómico. Las neuronas trigéminas aferentes estimulan el núcleo salival superior a través del puente, aumentando la salida parasimpática del ganglio esfenopalatino a través del nervio facial. El flujo del ganglio esfenopalatino media la vasodilatación de los vasos sanguíneos cerebrales dentro de las meninges, lo que facilita la extravasación de mediadores inflamatorios, llevando al dolor experimentado por los pacientes. El dolor de cabeza por migraña se asocia comúnmente con síntomas autonómicos que incluyen fotofobia, fonofobia, náuseas y emesis, y ocasionalmente congestión nasal. Similar a la cefalea en racimos, se teoriza que el ganglio esfenopalatino juega un papel fundamental en facilitar estos síntomas autonómicos cuando se asocian con la migraña, y el bloqueo exitoso del ganglio esfenopalatino podría, por lo tanto, proporcionar un beneficio en el alivio de estos síntomas. Los bloqueos transnasales del ganglio esfenopalatino con pledgets empapados en lidocaína han demostrado ser efectivos en la reducción del dolor de migraña, pero a menudo son mal tolerados, y los resultados generales de reducción del dolor son poco impresionantes e inconsistentes. Recientemente, la administración transnasal de anestésico al proceso del pie del ganglio esfenopalatino a través del dispositivo TX360 ha mejorado considerablemente este enfoque, pero se ha estudiado solo en el contexto de la migraña crónica con aplicaciones repetidas durante 6 semanas. En este estudio, hipotetizamos que un SSPGB sería tolerable y efectivo para abortar el dolor de SM, una condición clínicamente más común en la población general que la migraña crónica.
Métodos
Realizamos un estudio retrospectivo para evaluar el efecto del SSPGB en pacientes con SM tratados en la clínica ambulatoria de cefaleas de un gran hospital de atención terciaria en el este de Pennsylvania. Se revisaron los registros de pacientes desde enero de 2008 hasta diciembre de 2016 para identificar a aquellos con un diagnóstico bien establecido de migraña y SM, utilizando los criterios de la Sociedad Internacional de Cefaleas. Nuestro algoritmo de tratamiento agudo de la clínica de cefaleas para SM incluye triptanes orales, intranasales o subcutáneos administrados de forma rutinaria como terapia de primera línea. En pacientes refractarios a triptanes, se utiliza ergotamina ya sea como spray nasal Migranal, Cafergot oral, o 1 mg de dihidroergotamina intramuscular 45 (DHE). Se instruye a los pacientes a tomar estos medicamentos al inicio de la evolución de su migraña. Para cefaleas que persisten 3 días o más, se prescribe un descenso de dexametasona durante 3 días que consiste en 12, 8 y 4 mg en días consecutivos. Esto se combina con metergina 0.2 mg cada 6 horas por vía oral durante 3 días. En pacientes que no pueden tolerar la terapia con triptanes o ergotamina, se prescribe isomethepteno/dicloralfenazona/acetaminofén como agente de primera línea, con codeína 30 mg administrada por vía oral cada 8 horas como rescate si la terapia inicial fue ineficaz. Los pacientes con SM no responsivos al algoritmo descrito anteriormente fueron referidos para bloqueo de SPG por todos los neurólogos de la práctica. Todos los pacientes fueron evaluados de manera consecutiva sin exclusiones del análisis. Se pidió a los pacientes que calificaran su dolor en una escala Likert de 1 a 10, tanto antes como 30 minutos después del procedimiento de inyección. Se explicó el procedimiento a los pacientes en detalle y se obtuvo un consentimiento informado por escrito antes del procedimiento.
Los criterios de exclusión incluyeron anticoagulación sistémica, cefalea tensional, cefalea en racimos, neuralgia del trigémino, cefalea post-conmocional, cefalea cervicogénica y cefalea persistente diaria nueva con características migrañosas. Los pacientes que tuvieron una respuesta inadecuada al bloqueo del ganglio esfenopalatino y permanecieron con dolor severo generalmente fueron admitidos para terapia intravenosa que incluía solución salina normal, DHE 45, terapia antiemética con metoclopramida, ondansetron o clorpromazina, y magnesio. La lidocaína intravenosa se usó raramente.
Este estudio no solicitó la aprobación de un comité de ética ya que este procedimiento se utiliza comúnmente en cirugía oral, y se ha demostrado que el bloqueo esfenopalatino transnasal e infrazigomático es efectivo en migrañas. Nuestro grupo siguió las pautas éticas descritas en la Declaración de Helsinki. Este estudio fue aprobado por nuestra junta de revisión institucional, que contiene algunos miembros de nuestro comité de ética.
El procedimiento: bloqueo anestésico regional del SPG
El SSPGB se realizó utilizando una mezcla de 5 mL de dexametasona (1 mL) y ropivacaína al 0.5% (4 mL). Con el paciente en posición de decúbito lateral, se avanzó una aguja de 25 calibres y 2 pulgadas en un ángulo de 45 grados hacia el cráneo, dirigiéndose posteriormente en un ángulo de 15 grados desde la línea meatal ocular hacia el cóndilo posterior del ramo de la mandíbula (Fig. 2).
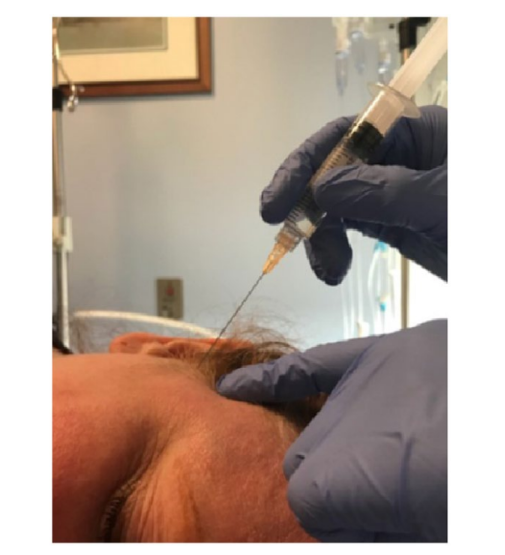
La precisión de este procedimiento se determinó por la presencia de entumecimiento en la porción posterior de la lengua, así como en la mejilla. Además, el alivio de la fotofobia y las náuseas fue otra medida para apoyar la precisión de la inyección.
Resultados y análisis estadístico
Se generaron estadísticas descriptivas para todas las variables. La media y la desviación estándar se presentan para las variables continuas. Si la distribución de las variables continuas estaba sesgada, se presentan la mediana y el rango intercuartílico (IQR) en su lugar. El sesgo se evaluó mediante la inspección visual de histogramas, así como la estadística de sesgo. Se utilizan frecuencias y porcentajes para describir las variables categóricas.
Hubo 2 unidades de análisis para este estudio: paciente y procedimiento, debido al hecho de que varios pacientes tuvieron más de un bloque de SPG realizado durante el período del estudio. Para probar la hipótesis, solo se utilizó el procedimiento inicial, ya que la prueba de rango con signo de Wilcoxon asume que todos los pares son independientes. Sin embargo, los procedimientos repetidos aún se analizaron descriptivamente. El cambio porcentual en las puntuaciones de dolor se calculó restando las puntuaciones pre y post procedimiento y dividiendo la diferencia por la puntuación de dolor basal.
Se utilizó la prueba de rangos con signo de Wilcoxon para probar nuestra hipótesis, debido a la asimetría de las distribuciones de las puntuaciones de dolor antes y después del procedimiento, así como a la naturaleza ordinal de las puntuaciones. Todas las pruebas estadísticas fueron de dos colas y se consideró que un valor de P de .05 era estadísticamente significativo. El análisis se realizó utilizando SAS versión 9.3 (SAS Institute, Cary, NC, EE. UU.).
Resultados
Un total de 88 pacientes caucásicos, 20 hombres y 68 mujeres, fueron incluidos en este estudio. Todos los pacientes tenían entre 24 y 76 años. Los pacientes se sometieron a un total de 252 procedimientos de SSPGB. El estudio incluyó pacientes que tuvieron 1 o más episodios de SM intratable en diferentes ocasiones.
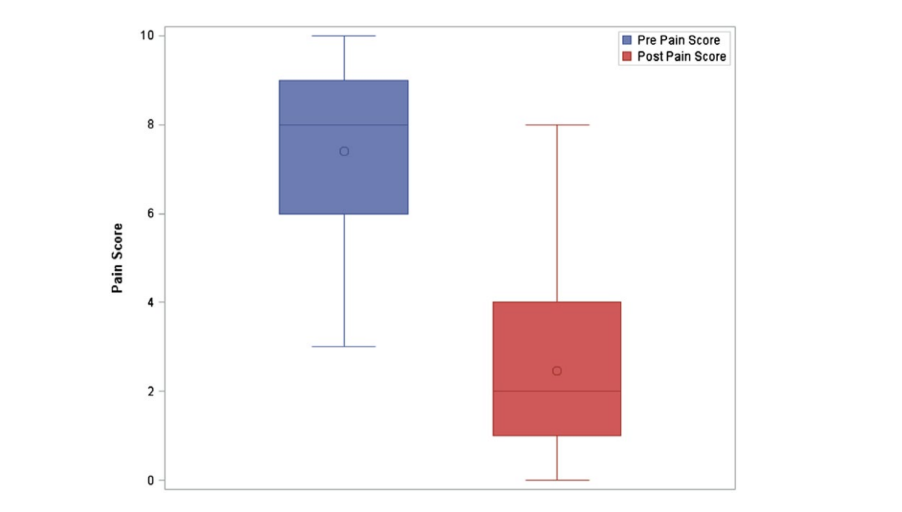
Al analizar solo el procedimiento inicial de cada paciente, la puntuación media de dolor en la escala de Likert antes del procedimiento fue de 8 (IQR = 6‐9). La puntuación media de dolor en la escala de Likert después del procedimiento fue de 2 (IQR = 1‐4), lo que equivale a una reducción promedio del 67.2% (±26.6%) en la severidad del dolor, en todos los pacientes para el procedimiento inicial de SPG. La mejora media en la escala de dolor de Likert fue de 5 puntos (IQR = 6‐3). A los 30 minutos después de la inyección, hubo una reducción estadísticamente significativa en la severidad del dolor (P < .0001). La Figura 3 muestra las distribuciones de las puntuaciones de dolor antes y después del procedimiento solo para los procedimientos iniciales. El diagrama de caja revela que las puntuaciones de dolor antes del procedimiento eran más altas que las puntuaciones de dolor después del procedimiento. Además, muestra que la distribución de las puntuaciones de dolor antes del procedimiento estaba sesgada a la izquierda, mientras que las puntuaciones de dolor después del procedimiento estaban sesgadas a la derecha.
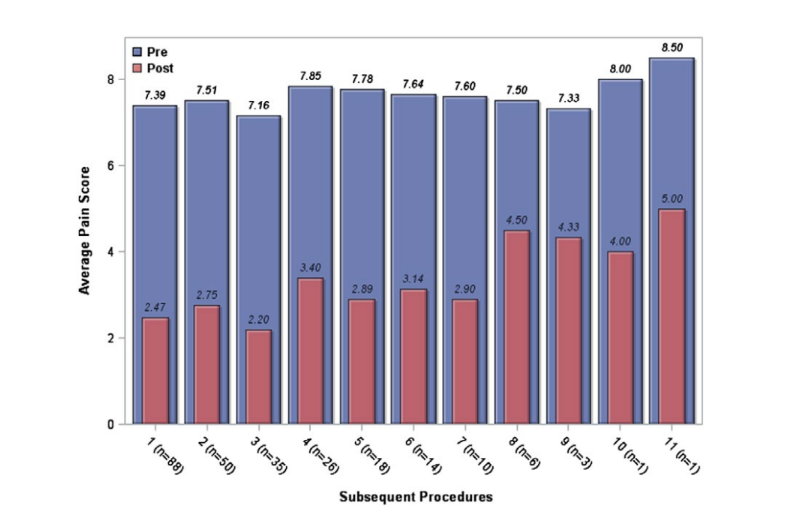
La mayoría de la muestra (57%) recibió al menos 2 bloqueos durante el período de estudio. Los SSPGB subsiguientes se analizaron por separado. Al analizar los resultados de los procedimientos subsiguientes, la puntuación media de dolor en la escala de Likert antes del procedimiento en este grupo fue de 8. La puntuación media de dolor después del procedimiento fue de 3 (IQR = 1‐4). La mejora media en la escala de dolor de Likert fue de 4 puntos (IQR = −6 a −3), lo que resultó en una mejora promedio del dolor del 64.1% (±27). La figura 4 muestra que la eficacia del bloqueo del SPG no disminuyó con inyecciones repetidas. Los pacientes tuvieron una reducción comparable en la severidad del dolor con inyecciones repetidas.
No hubo complicaciones significativas del procedimiento. Un paciente desarrolló una parálisis transitoria del nervio craneal VI que se resolvió completamente en aproximadamente 6 horas.
Discusión
El bloqueo anestésico regional del SPG utilizando el enfoque suprazygomático presenta una opción innovadora e importante para abortar la SM en pacientes que no responden a los medicamentos anti-migrañosos prescritos de forma estándar. Se sabe que el SPG juega un papel integral en la fisiopatología del dolor facial y las cefaleas autonómicas trigeminales, pero su papel exacto en las migrañas no se comprende bien. En este estudio, medimos los puntajes de dolor antes y después del procedimiento en pacientes con SM que recibieron un SSPGB. A los 30 minutos después del tratamiento, la reducción general del dolor entre los pacientes fue estadísticamente significativa. Cuando comenzamos a realizar el SSPGB en nuestra clínica de dolor de cabeza, nuestros especialistas en dolor de cabeza notaron que se convirtió inmediatamente en un tratamiento de elección en pacientes con SM, eliminando la necesidad de utilizar servicios de urgencias o de hospitalización. La mayoría de los pacientes experimentaron un alivio significativo del dolor de inmediato y, en episodios recurrentes de SM, regresaron a la clínica para repetir el tratamiento con SSPGB.
Cady et al demostraron que la estimulación repetida del SPG durante un período de 6 semanas conduce a una reducción en la gravedad y duración de la migraña en pacientes que sufren de migraña crónica, con una población de pacientes y un síndrome de dolor distintos a los de nuestro estudio. Sin embargo, seis semanas es un período prolongado para alcanzar un alivio terapéutico, particularmente en pacientes con dolor severo.
Con la identificación adecuada de los puntos de referencia, este procedimiento se puede realizar fácilmente en menos de 2 o 3 minutos. Este enfoque está bien establecido entre los cirujanos maxilofaciales orales y se utiliza en procedimientos orales. Además, Radder y colegas notaron un mayor beneficio al utilizar un enfoque suprazigomático para el bloqueo del nervio maxilar para extracciones dentales que al utilizar el enfoque infrazigomático. La mayoría de sus pacientes no experimentaron ninguna incomodidad significativa con este enfoque. Un enfoque transcoronoideo infrazigomático bajo fluoroscopia ha sido utilizado por Tepper y colegas al implantar estimuladores neuronales para la migraña; sin embargo, los pacientes experimentaron una incomodidad significativa y se consideró un enfoque alternativo. El método SSPGB utilizado en nuestro estudio proporcionó un bloqueo anestésico regional rápido, efectivo y seguro al SPG.
Schaffer et al. trataron a pacientes con migrañas con bloqueo intranasal del SPG en el ED. Aunque el estudio no mostró una reducción significativa del dolor en comparación con el placebo, hubo una reducción persistente del dolor 24 horas después del tratamiento. Esto demostró que el bloqueo anestésico del SPG continuó siendo efectivo en la reducción del dolor por un período más largo que la vida media del agente utilizado. En comparación, la reducción del dolor en nuestro estudio alcanzó significancia estadística.
IV‐DHE es actualmente aceptado por la comunidad como el estándar de oro para abortar SM. En el estudio original con IV‐DHE, 49 de 55 pacientes estaban completamente libres de dolor a las 48 horas posteriores al tratamiento. Aunque estos datos sugerirían que IV‐DHE es más efectivo, muchos pacientes en nuestra práctica no respondieron inicialmente a DHE, sino que respondieron al tratamiento solo si se administró durante 3 a 5 días. En otro estudio que utilizó IV‐DHE en el ED para SM, solo 3 de 32 pacientes experimentaron un alivio de los síntomas después del tratamiento y 15 pacientes informaron de un dolor de cabeza residual severo.
El costo promedio de una estancia hospitalaria para pacientes internados varía de $5000 a $7000 en pacientes pediátricos tratados con IV‐DHE, que se presume es comparable al de la población adulta. El costo de una inyección de SSPGB en nuestra clínica de dolor de cabeza es de aproximadamente $160. En pacientes con enfermedades vasculares, renales, hepáticas y cardíacas, DHE está fuertemente contraindicado, mientras que el SSPGB no tiene tales contraindicaciones.
Una limitación importante de nuestro estudio es la falta de datos de seguimiento a largo plazo sobre la puntuación del dolor. Nuestro estudio evaluó solo los efectos inmediatos (30 minutos después del procedimiento) del bloqueo del SPG. No evaluamos datos longitudinales sobre la duración del alivio del dolor y si estos pacientes experimentaron migraña recurrente en los días y semanas posteriores al procedimiento. Este estudio retrospectivo fue diseñado para analizar la seguridad y la eficacia inmediata en proporcionar alivio del dolor en el contexto de SM. Se justifica un estudio prospectivo para evaluar el efecto a largo plazo del bloqueo del SPG. El estudio actual no controló factores de confusión como los síntomas autonómicos previos al procedimiento.
La mayoría de los pacientes informaron alivio inmediato de los síntomas autonómicos después del procedimiento, incluso antes del control completo del dolor. Dado que el SPG juega un papel en la mediación del reflejo trigémino-autonómico, un bloqueo puede potencialmente aliviar los síntomas autonómicos, lo cual no fue evaluado sistemáticamente en nuestro estudio. Una tercera limitación es que nuestro estudio no fue controlado con placebo.
Los profesionales deben tener precaución al realizar un bloqueo del SPG, ya que existen varias complicaciones potenciales, incluyendo parálisis del nervio abducens o facial. No se observó lesión de la arteria maxilar, que se encuentra anatómicamente cerca del SPG, en nuestro estudio. Radder y colegas informaron que no hay riesgo de lesión de la arteria maxilar utilizando el enfoque suprazigomático.
En nuestro estudio, se reportó una reacción adversa de parálisis transitoria del nervio abducens. En nuestra clínica de cefaleas, se realizaron casi 1000 bloqueos del SPG en los últimos 8 años, pero los datos sobre los niveles de dolor antes y después del procedimiento en pacientes con SM estaban disponibles solo en el 25% de los casos, sin parálisis del nervio facial ni lesión de la arteria maxilar reportadas en ese subgrupo. Los efectos adversos se evaluaron inmediatamente después del procedimiento, a los 30 minutos y durante las visitas de seguimiento. También se pidió a los pacientes que contactaran al proveedor y reportaran cualquier reacción adversa después del alta.
No sentimos que este sea un procedimiento excesivamente agresivo o difícil. No es más difícil ni doloroso para los pacientes que un bloqueo del nervio occipital o auriculotemporal o el protocolo de inyección de toxina botulínica para la migraña crónica. En este estudio, la frecuencia de pacientes que se sometieron a bloqueos repetidos sugiere que este procedimiento es bien tolerado y produce un alivio del dolor significativo. La mayoría de los pacientes que experimentaron alivio inmediato del dolor después del procedimiento informaron un beneficio duradero.
Planeamos continuar evaluando esta técnica con un estudio prospectivo, aleatorizado y controlado con placebo para evaluar la respuesta al dolor a largo plazo al SSPGB.
Conclusión
Los pacientes con SM que recibieron un SSPGB en nuestra clínica de dolor de cabeza experimentaron una reducción estadísticamente significativa en el dolor autoinformado durante 30 minutos. El SSPGB puede proporcionar una terapia abortiva terapéutica relativamente económica en pacientes con SM, lo que a su vez reduciría el número de visitas de los pacientes a la sala de emergencias y la necesidad de hospitalización. La falta de reacciones adversas a este tratamiento también aumenta la relación beneficio-riesgo. Se justifican ensayos adicionales para respaldar estos hallazgos.
Dev Mehta, Megan C. Leary, Hussam A. Yacoub, Mohammed El‐Hunjul, Hope Kincaid, Vitaliy Koss, Katrina Wachter, Don Malizia, Barry Glassman, John E. Castaldo
Referencias
- Adelsmann A, Saccomani P, Dreyer E, da Costa AL. Tratamiento del estado migrainoso mediante anestesia general: Un informe de caso. Braz J Anesthesiol. 2015;65:407‐410.
- Insinga RP, Ng‐Mak DS, Hanson ME. Costos asociados con atención ambulatoria, en sala de emergencias y hospitalización por migraña en EE. UU. Cephalalgia. 2011;31:1570‐1575.
- Lucado J, Paez K, Elixhauser A. Agencia para la investigación y calidad en salud. Dolores de cabeza en hospitales y departamentos de emergencia de EE. UU., 2008. Bethesda, MD: Proyecto de Costo y Utilización de Atención Médica. Informe Estadístico #111. https://www.hcup-us. ahrq.gov/reports/statbriefs/sb111.pdf. Publicado en mayo de 2011. Accedido el 14 de marzo de 2018.
- Piagkou M, Demesticha T, Troupis T, et al. El ganglio pterigopalatino y su papel en varios síndromes de dolor: De la anatomía a la práctica clínica. PainPract. 2012;12:399‐412.
- Siéssere S, Vitti M, De Sousa LG, Semprini M, Iyomasa MM, Regalo SC. Variación anatómica de los ganglios parasimpáticos craneales. Braz Oral Res. 2008;22:101‐105.
- Yin W. Lesiones por radiofrecuencia del ganglio esfenopalatino en el tratamiento del dolor facial. Tech Reg Anest Pain Manag. 2004;8:25‐29.
- Yarnitsky D, Goor‐Aryeah I, Bajwa ZH, et al. Premio Wolff 2003: Posibles contribuciones parasimpáticas a la sensibilización periférica y central durante la migraña. Headache. 2003;43:704‐714.
- Goadsby PJ, Lipton RB, Ferrari MD. Migraña: comprensión y tratamiento actuales. N Engl J Med. 2002;346:257‐270.
- Goadsby PJ, Holland PR, Martins‐Oliviera M et al. Fisiopatología de la migraña: Un trastorno del procesamiento sensorial. Physiol Rev. 2017;97:553‐622.
- Maizels M, Geiger AM. Lidocaína intranasal para la migraña: Un ensayo aleatorizado y seguimiento abierto. Headache. 1999;39:543‐551.
- Cady R, Saper J, Dexter K, Manley H. Un estudio doble ciego, controlado con placebo de bloqueo repetitivo del ganglio esfenopalatino transnasal con Tx360® como tratamiento agudo para la migraña crónica. Headache. 2015;55:101‐116.
- GraphPad Software, Inc., Lista de verificación de análisis: Pares emparejados de Wilcoxon. Recuperado de: https://www.graphpad.com/guides/prism/7/statistics/index.htm?the_results_of_a_wilcoxon_matched_pairs_ test.htm. Publicado en 2017. Accedido el 14 de marzo de 2018.
- Chiono J, Raux O, Bringuier S, et al. Bloqueo bilateral del nervio maxilar suprazigomático para la reparación del paladar hendido en niños: Un estudio prospectivo, aleatorizado y doble ciego versus placebo. Anesthesiology. 2014;120:1362‐1369.
- Radder K, Shah A, Fatima S, Kothari C, Zakaullah S, Siddiqua A. Eficacia y viabilidad del enfoque del ángulo frontozigomático para el bloqueo del nervio maxilar extraoral en cirugía oral: Un ensayo clínico descriptivo. J Maxillofac Oral Surg. 2014;13:231‐237.
- Tepper S, Rezai A, Narouze S, Steiner C, Mohajer P, Ansarinia M. Tratamiento agudo de la migraña intratable con estimulación eléctrica del ganglio esfenopalatino. Headache. 2009;49:983‐989.
- Schaffer JT, Hunger BR, Ball KM, Weaver CS. Bloqueo no invasivo del ganglio esfenopalatino para dolor de cabeza agudo en el departamento de emergencia: Un ensayo aleatorizado controlado con placebo. Ann Emerg Med. 2015;65:503‐510.
- Neil R. Dihidroergotamina intravenosa repetitiva como terapia para la migraña intratable. Neurology. 1986;36:995‐997.
- Gallagher RM. Tratamiento de emergencia de la migraña intratable. Headache. 1986;26:74‐75.
- Nelson GR, Bale JF, Kerr LM. Resultado y costo de la hospitalización de pacientes internos para el tratamiento intravenoso de dihidroergotamina de dolores de cabeza pediátricos refractarios. Pediatr Neurol. 2017;66:76‐81.
