Контрастная микро-КТ для оценки удаления пульповой ткани в корневых каналах экстрагированных зубов: серия каскадных экспериментов для валидации метода
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления).
Аннотация
Цель: Подтвердить новый метод оценки удаления пульповой ткани в корневых каналах экстрагированных зубов с использованием протокола импрегнации, включающего трийодид калия, радиоконтрастный раствор, известный как раствор Люголя, в сочетании с микрокомпьютерной томографией (микро-КТ).
Методология: Влияние NaOCl на радиопрозрачность раствора Люголя оценивалось с использованием двухкратной серии разбавлений раствора Люголя в дистиллированной воде и 5,25% NaOCl, которые затем были отобраны в прозрачные чаши и рентгенографированы. Для проверки влияния раствора Люголя на протеолитический эффект NaOCl был проведен тест растворимости с использованием свежего говяжьего мяса. Десять срезов не подвергались никакой обработке тканей, в то время как двадцать срезов были зафиксированы в формальдегиде на 24 часа. После этого 10 из них были погружены в раствор Люголя на еще 24 часа. Затем все образцы были помещены в NaOCl, и время, необходимое для полного растворения ткани, было зафиксировано. Для последних экспериментов (гистологическая валидация и оценка микро-КТ) 8 экстрагированных нижних премоляров с ранее жизнеспособными пульпами были погружены в буферный формалин, отсканированы в устройстве микро-КТ, оценены, погружены в раствор Люголя на 7 дней и снова отсканированы. Затем корневые каналы 5 зубов были подготовлены и отсканированы, а объем оставшейся пульповой ткани был идентифицирован и количественно оценен, в то время как 3 зуба были обработаны гистологически. Те же образцы были подвергнуты гистологической оценке, и изображения гистологических срезов были зарегистрированы с соответствующими изображениями микро-КТ, чтобы проверить, совпадала ли пульповая ткань в гистологических срезах с ее аналогом в тканях, импрегнированных раствором Люголя, идентифицированных в срезах микро-КТ.
Результаты: Не было заметного эффекта на радиopacity, когда NaOCl смешивался с раствором Люголя. Обработка тканей не повлияла на время, необходимое для полного растворения свежего говяжьего мяса. Гистологическая оценка показала корреляцию между микро-КТ и гистологическими изображениями, подтверждающими идентификацию пропитанной Люголем пульпы на микро-КТ изображениях.
Выводы: Радиоконтрастный раствор Люголя не подвергался влиянию NaOCl и не мешал его способности растворять мягкие ткани. Протокол имплантации с использованием раствора Люголя позволил визуализировать пульповые ткани на микро-КТ изображениях и идентифицировать остатки пульпы после химико-механических процедур обработки каналов.
Введение
Обычный анализ гистологических срезов и использование рентгеновской микро-компьютерной томографии (микро-КТ) считаются золотым стандартом для оценки процедур очистки и формовки во время подготовки корневых каналов. Хотя микро-КТ позволяет идентифицировать и количественно оценивать минерализованные ткани корневого канала, удаленные механической подготовкой, количество оставшейся (неминерализованной) пульпы обычно оценивается на гистологических срезах. Таким образом, несмотря на полезность технологии микро-КТ, этот метод был ограничен оценкой изменений вдоль стенок канала, включая транспортировку и создание аберраций, таких как молнии и перфорации. Из-за проникающей способности рентгеновских лучей методы микро-КТ предоставляют 3D-карту плотности образцов и тканей, которые сильно поглощают это излучение (Alfaro и др. 2015, Cunha и др. 2015). Однако он не подходит для визуализации мягких тканей, таких как зубная пульпа, так как эти ткани поглощают рентгеновские лучи в очень ограниченной степени (Gignac & Kley 2014).
Недавно в двух исследованиях был использован корреляционный подход с использованием гистологии в качестве дополнительного метода для оценки микро-КТ, чтобы оценить различные химико-механические протоколы в корневых каналах (Lacerda и др. 2017, Siqueira и др. 2018). Оба исследования продемонстрировали гистологически наличие остатков пульповой ткани, прикрепленных к нетронутым стенкам канала, ранее идентифицированным с помощью анализа микро-КТ. Хотя этот корреляционный подход с использованием различных методов может позволить установить механизмы причинности, гистологический анализ обычно позволяет оценить лишь несколько срезов на корень, что предоставляет очень ограниченные данные и не соответствует объему информации в сотнях поперечных изображений, обычно получаемых при сканировании микро-КТ типичного корневого канала. Более того, гистологическое секционирование является трудоемкой и дорогостоящей процедурой, которая уничтожает образец.
Очевидно, что желательно разработать надежный недеструктивный экспериментальный метод, способный одновременно оценивать качество и количество мягких и твердых тканей в гетерогенном образце, таком как человеческий зуб. В других областях исследований это ограничение было преодолено с помощью различных контрастных агентов, таких как осмий, золото, сульфат бария и красители на основе йода (Metscher 2009a, b, Faulwetter и др. 2013, Pauwels и др. 2013). В целом было продемонстрировано, что водный раствор йода Люголя, также называемый йод-калий йодидом (I2KI), является одним из самых эффективных средств для быстрого различения разнообразных типов мягких тканей. Раствор Люголя является простым, экономически эффективным, нетоксичным и быстрым вариантом окрашивания для улучшения контраста мягких тканей. Тем не менее, его использование было ограничено анатомическими исследованиями широкого спектра биологических образцов с использованием широкого диапазона различных концентраций йода и продолжительности окрашивания, в зависимости от типа ткани (Heimel и др. 2019). В настоящее время, несмотря на то, что импрегнация Люголем является наиболее широко используемым контрастным агентом в анатомическом исследовании мягких тканей, до сих пор неясно, будет ли этот раствор подходящим для оценки микро-КТ пульповой ткани после деконтаминации корневого канала ex vivo. Одна из основных проблем при использовании Люголя касается гипохлорита натрия (NaOCl), основного эндодонтического ирриганта, используемого для растворения некротической пульповой ткани (Zehnder 2006), который реагирует с йодом (Vogel 1978) и, таким образом, может вмешиваться в его импрегнацию и видимость на рентгенографических изображениях.
Настоящее сообщение сообщает о серии каскадных экспериментов, направленных на введение и исследование потенциала визуализации пульпы зуба на микрокомпьютерных томограммах с использованием Люголя в качестве контрастирующего раствора. Целью каскадных экспериментов было подтверждение протокола имплантации и метода микрокомпьютерной томографии с контрастным усилением (CE-CT), а также выявление преимуществ и потенциальных ограничений этой новой методологии. Каскадные эксперименты были разработаны для:
- Оценки потенциала NaOCl для снижения степени радиографического контраста, связанного с Люголем (тест радиопрозрачности);
- Проверки возможности влияния раствора Люголя на протеолитический эффект NaOCl (тест растворения мягких тканей);
- Оценки способности раствора Люголя правильно имплантировать пульповую ткань с помощью корреляционной визуализации микрокомпьютерной томографии с усилением Люголем и традиционной гистологии (гистологическая валидация);
- Измерения оставшегося объема пульповой ткани, пропитанной Люголем (объемная оценка микрокомпьютерной томографии).
Материалы и методы
Влияние NaOCl на радиопрозрачность раствора Люголя
Раствор Люголя (I2KI), использованный для всех экспериментов, имел концентрацию 5% I2 и 10% KI. Для оценки влияния NaOCl на его радиопрозрачность была проведена серия разбавлений 1:1 в дистиллированной воде и 5.25% NaOCl (всего 1.5 мл). Чистый раствор и его разбавления были отмерены в круглые прозрачные посуды из полистирола (Semadeni, Остермундиген, Швейцария) с внутренним диаметром 23.4 мм и глубиной 3.5 мм. Радиопрозрачность определялась с использованием стандартной установки, как описано ранее (Hertig и др. 2017). Вкратце, электронные наборы данных генерировались с использованием фиксированного устройства (Trophy, Париж, Франция) при 65 кВ, 8 мА и 0.22 с с расстоянием фокус-пленка 25 см и электронными датчиками (Digora; Soredex, Туусула, Финляндия). Изображения анализировались с помощью ImageJ (Бетесда, МД, США). Серые значения были нормализованы в каждом изображении относительно алюминиевой ступенчатой призмы, с индивидуальной стандартной кривой для каждого изображения. Эксперименты проводились в тройных образцах. Относительная радиопрозрачность раствора Люголя и его разбавлений выражается как алюминиевый эквивалент (в мм) на мм раствора.
Тест на растворение мягких тканей
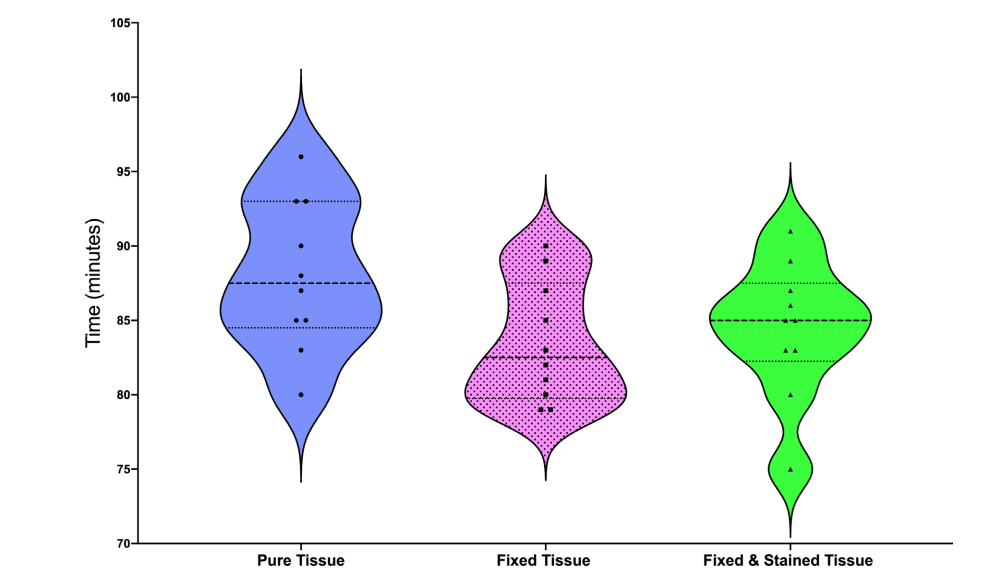
Тридцать кусочков свежего говядины были приведены к аналогичному весу (2 мг) и размерам (4 x 4 мм) с использованием хирургического лезвия № 15. Десять кусочков не подвергались никакой обработке тканей, в то время как остальные 20 были зафиксированы в формальдегиде на 24 часа. После этого 10 из зафиксированных кусочков были дополнительно погружены в раствор Люголя на еще 24 часа. Затем все образцы были помещены по отдельности в колбы, содержащие 40 мл 5,25% NaOCl, и общее время, необходимое для полного растворения пульповой ткани (в минутах), было зафиксировано. Все испытательные процедуры проводились при комнатной температуре. Это исследование не классифицировалось как исследование на животных, поскольку оно не оказало влияния на предсмертную судьбу или процесс забоя животных. Предварительный анализ сырых данных показал соблюдение гауссовского распределения (тест Шапиро–Уилка, P < 0.05). Данные сравнивались между группами с использованием однофакторного дисперсионного анализа (ANOVA), за которым следовал тест Тьюки HSD. Альфа-ошибка была принята за 5%.
Оценка остатков пульповой ткани с помощью микро-КТ
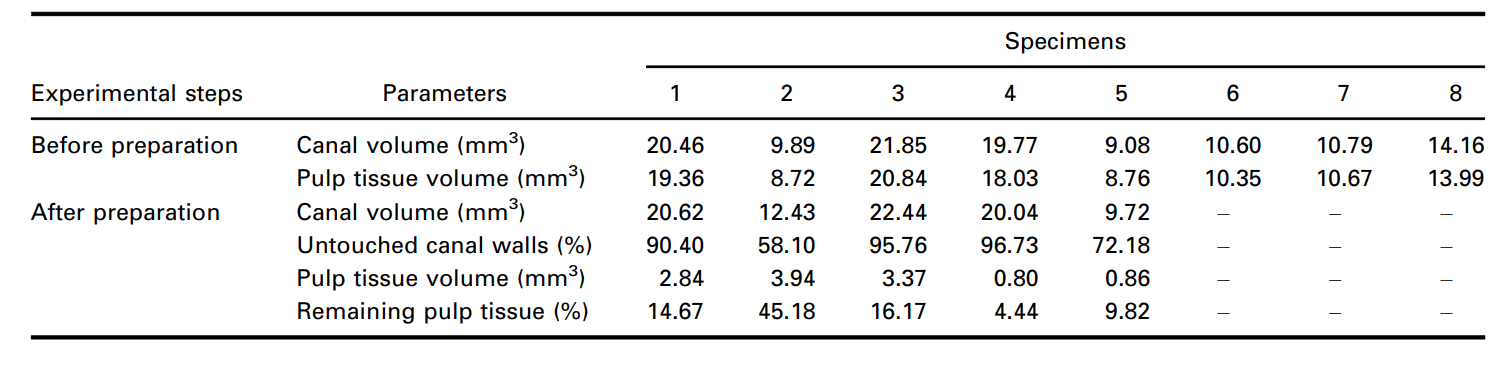
После одобрения местным этическим комитетом (протокол № 12127319.3.0000.5243) восемь некариозных однокорневых нижних премоляров и один нижний моляр с жизнеспособными пульпами, удаленные по ортодонтическим показаниям, были погружены в 10% буферный формалин и хранились до 30 дней при 15 °C. Затем зубы были отсканированы с размером пикселя 14.37 мкм с использованием устройства микро-КТ (SkyScan 1173; Bruker microCT, Контрих, Бельгия), настроенного на 70 кВ, 114 мА, 360° вращения вокруг вертикальной оси с шагом вращения 0.5°, средним значением кадров 5, с использованием алюминиевого фильтра толщиной 1.0 мм. Программное обеспечение NRecon v.1.7.16 (Bruker micro-CT) использовалось для реконструкции проекций микро-КТ в аксиальные сечения с использованием коррекции кольцевых артефактов 4, пределов контрастности от 0.006 до 0.05 и коррекции затвердевания пучка 40%, что привело к получению 800–900 изображений в градациях серого на зуб от соединения цемента и эмали до апекса. Для проверки морфологии канала поперечные изображения были сегментированы с использованием автоматической процедуры (De-Deus и др. 2020) в программном обеспечении FIJI/ImageJ (Fiji v.1.51n; Мэдисон, ВИ, США), и соотношение сторон корневого канала, определяемое как отношение больших и малых диаметров, измерялось в каждом срезе от отверстия до апикального отверстия. Затем объем канала (в мм3) был рассчитан как объем бинаризованного корневого канала в пределах интересующего объема.
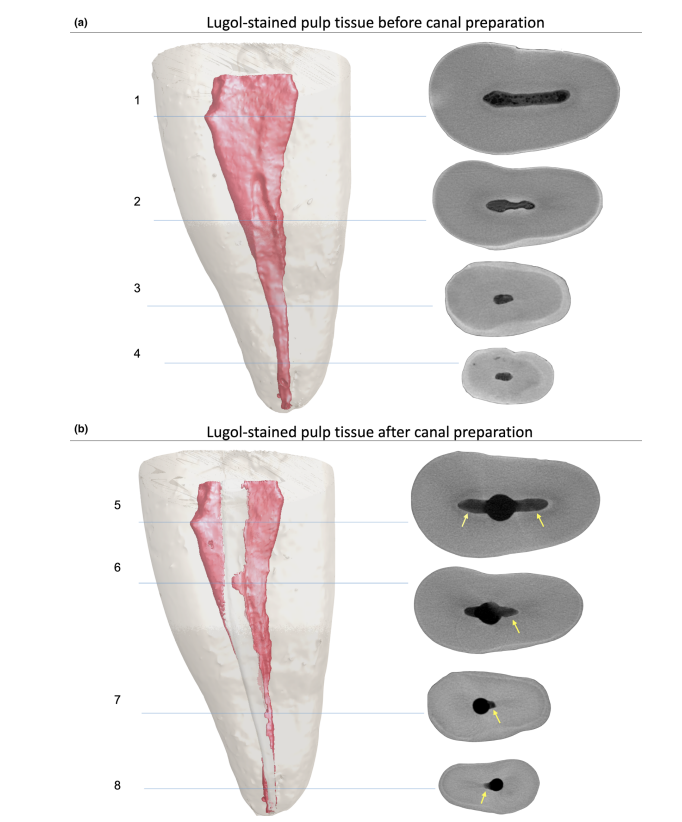
После подготовки обычной доступной полости каждый зуб был погружен в раствор Люголя на 7 дней и подвергнут новому сканированию и процедурам реконструкции с использованием ранее упомянутых параметров для оценки имплантации всей пульповой ткани контрастным раствором. Этот набор изображений был совместно зарегистрирован с неокрашенным набором данных с использованием аффинного алгоритма, реализованного в программном обеспечении 3D Slicer 4.6.0 (http://www.slicer.org) (Федоров и др. 2012), и корневая дентинная ткань зуба после погружения была удалена с помощью булевой операции, чтобы уменьшить шум, создаваемый сегментацией пульповой ткани. Таким образом, пульповая ткань, пропитанная раствором Люголя, была наблюдаема и количественно оценена (в мм3) с помощью процесса сегментации с использованием специфического порогового значения, с использованием инструмента Object Counter, доступного в программном обеспечении FIJI/ ImageJ. После этого корневые каналы 5 из 8 выбранных премоляров были химико-механически подготовлены, в то время как другие 4 здоровых зуба (3 премоляра и 1 моляр) были подготовлены для гистологического сечения, чтобы подтвердить наличие остатков пульповой ткани (контрольная группа).
Подготовка корневого канала
Корневые каналы были подготовлены до рабочей длины с помощью инструмента Reciproc R25 (VDW GmbH, Мюнхен, Германия), приводимого в действие мотором VDW Silver (VDW GmbH) в предустановленной программе «RECIPROC ALL», используя легкое апикальное давление с медленным движением вперед-назад с амплитудой 3 мм. После завершения трех движений инструмент был удален из канала, а его канавки очищены путем вставки в губку, смоченную спиртом. Рабочая длина была достигнута после 3 волн инструментирования. Апикальная проходимость была выполнена с помощью K-файла размером 15 (Dentsply Sirona Endodontics, Баллаиг, Швейцария) на протяжении всех процедур подготовки. Ирригация проводилась с использованием в общей сложности 12 мл 5,25% NaOCl, введенного в корневой канал с помощью иглы 31-G NaviTip с двойным боковым портом (Ultradent Inc., Южный Джордан, ЮТА, США), введенной на 1 мм короче рабочей длины на протяжении всех процедур подготовки. После подготовки корневого канала образцы были повторно отсканированы, реконструированы и совместно зарегистрированы с использованием вышеупомянутых параметров. Затем был рассчитан объем остатков пульповой ткани, пропитанной раствором Люголя (в мм3), и количественно оценен в процентном соотношении на основе начального объема пульповой ткани.
Гистологическая оценка
После экспериментальных процедур, описанных выше, образцы деминерализовали в 22,5% (об/об) формальдегидной кислоте плюс 10% (масс/об) растворе натриевого цитрата в течение 2–3 недель. Конечная точка контролировалась радиографически. Затем образцы промывали в течение 24 часов в водопроводной воде, дегидратировали и обрабатывали для рутинного гистологического исследования. Зубы были вмонтированы в парафиновые блоки, и серийные поперечные срезы толщиной 0,6 мкм получали каждые 1 мм от цементно-эмалевого соединения до верхушки, в результате чего получалось 8 срезов на зуб. Полученные срезы монтировались на стеклянные пластины и окрашивались гематоксилин-эозином. Гистологические изображения визуализировались с помощью полностью моторизованного светового микроскопа Axioplan 2 Imaging (Carl Zeiss Vision, Hallbergmoos, Германия).
Сопоставление микрокомпьютерной томографии с йодом и гистологических срезов
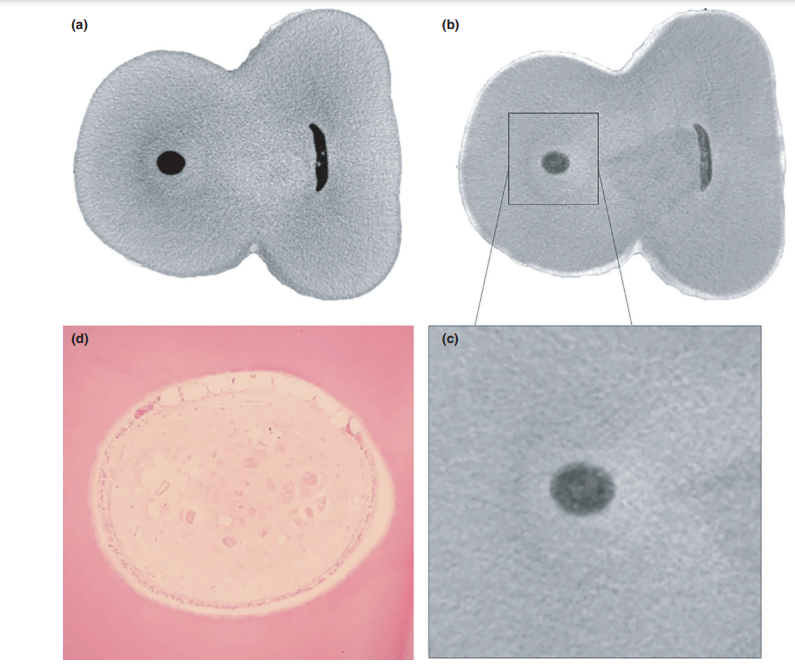
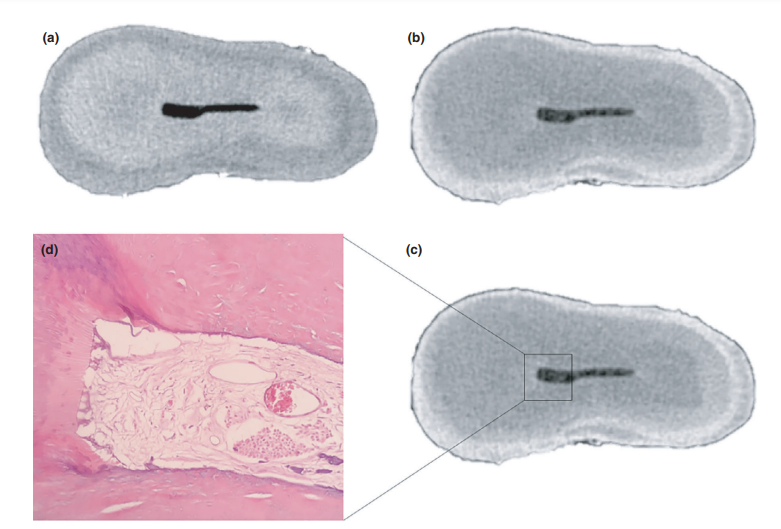
Полученные срезы микрокомпьютерной томографии, содержащие йодом пропитанные пульповые ткани, были исследованы вдоль оси z с использованием системы координат, основанной на алгоритме регистрации по ориентиру (программное обеспечение Analyze; Biomedical Imaging Resource, Mayo Clinic, Rochester, MN, США), чтобы выровнять их с микрорентгенографическими изображениями гистологических срезов. После выбора соответствующих изображений была проведена корректировка размерности, включая автоматическое увеличение, изменение размера и обрезку, с помощью компьютерной процедуры. Этот процедурный шаг позволил экзаменаторам надежно исследовать корни на одних и тех же уровнях и, таким образом, качественно проверить, совпадает ли пульповая ткань в гистологическом срезе с ее аналогом в йодом пропитанном срезе микрокомпьютерной томографии, подтверждая эффективность протокола пропитки и параметров сканирования. Два предварительно откалиброванных экзаменатора использовали форму с заранее определенными критериями для анализа степени совпадения между йодом пропитанными и гистологическими изображениями. Процедура анализа изображений проводилась на 34-дюймовом высококачественном компьютерном мониторе с возможностью увеличения изображений (до 109) и изменения цветового режима. Для валидации аналитического процесса анализы повторялись дважды с интервалом в 10 дней для оценки воспроизводимости.
Результаты
Влияние NaOCl на радиопрозрачность раствора Люголя
Чистый раствор Люголя имел радиопрозрачность 0.70 ± 0.09 мм Al мм—1. Разбавление в 5.25% NaOCl оказало аналогичное влияние на радиопрозрачность, как и контрольная процедура в воде, при этом более высокие разбавления NaOCl показали немного более высокую радиопрозрачность (Рис. 1), что основано на разнице в радиопрозрачности между чистым раствором 5.25% NaOCl и водой в 0.05 мм Al мм—1. Не было заметного эффекта на радиопрозрачность, вызванного химическим взаимодействием между NaOCl и раствором Люголя, что было видно по обесцвечиванию коричневого цвета в присутствии NaOCl.

Тест на растворение мягких тканей
Виолончельные графики иллюстрируют средние, минимальные и максимальные значения, а также распределение данных о растворении тканей среди образцов (Рис. 2). Обработка тканей формальдегидом и раствором Люголя не повлияла на время, необходимое для растворения свежего говядины (P > 0.05).
Гистологическая валидация
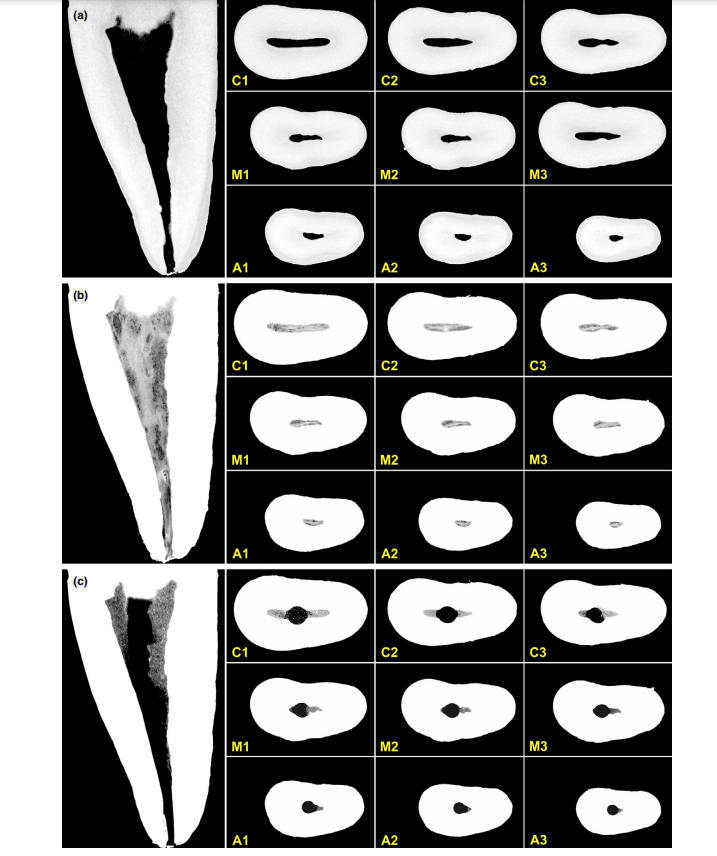
Общее качество используемого протокола окрашивания иллюстрируется на рисунке 3. Корреляционный анализ между микро-КТ и гистологическими изображениями подтвердил идентичность пульповой ткани, пропитанной Люголем, на изображениях микро-КТ. Результаты сопоставленных изображений микро-КТ и гистологических изображений показаны на рисунках 4 и 5, подтверждая качество протокола окрашивания.

Объемная микро-КТ оценка
Кроме того, сегментированные остатки пульпы после подготовки корневого канала были количественно оценены и выражены в процентном соотношении. Объем инструментированного корневого канала и неинструментированных участков канала, полученные методом микро-КТ, также были количественно оценены (Таблица 1) и проиллюстрированы на рисунках 6 и 7 и в дополнительном видео 1. Объем корневого канала и соотношение сторон непосредственно влияли на удаление пульповой ткани во время инструментирования. Зубы с соотношением сторон менее 3.5, выраженным графической кривой и высокими объемами, были связаны с меньшими объемами остатков пульповой ткани.
Обсуждение
Данное сообщение представляет собой новый метод окрашивания тканей зубной пульпы в контексте микро-КТ оценки удаления тканей из корневого канала с очевидными полезными применениями для будущих исследований в этой области. Предложенный неразрушающий метод способен предоставлять изображения высокого разрешения и 3D информацию о тканях пульпы и дентине одновременно, что позволяет проводить продольную и количественную объемную оценку процедур очистки и формовки корневого канала. С тех пор как Гиси и Розе (1894) опубликовали первые качественные фотомикрографии, изображающие детали сосудистых, лимфатических и нервных элементов комплекса пульпа-дентин нижнего моляра, и Кёлликер (1852) предоставил первое описание зубной пульпы, названной им Pulpa dentis, в своей классической книге о мельчайших структурах тканей и органов тела, многие исследования изучали зубы с использованием гистологических методов. Используя эту технику, Хаттон и др. (1928) первыми продемонстрировали, что канал был очищен только поверхностно, и большая часть ткани пульпы не была удалена после подготовки нержавеющими инструментами. Однако только после того, как Уолтон (1976) опубликовал основополагающее исследование, оценивающее количество оставшейся ткани пульпы после процедур очистки и формовки, гистологическое секционирование на основе парафина стало стандартным методом для определения эффективности процедур удаления тканей в пространстве корневого канала.
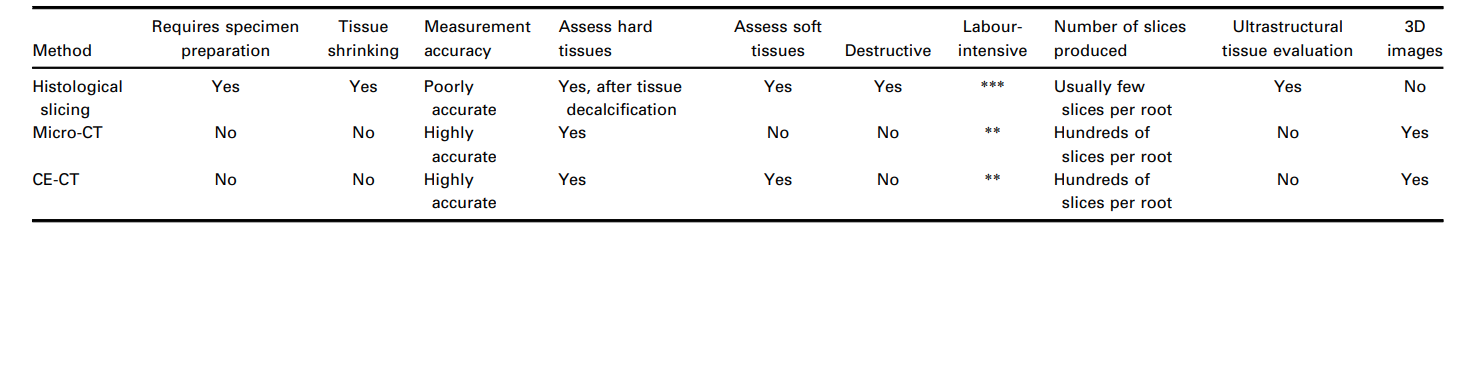
В неповрежденных зубах с жизнеспособными пульпами, которые обычно используются в качестве контроля в исследованиях гистологического сечения, пульповая ткань прикреплена ко всему периметру корневого канала (De-Deus и др. 2010, 2011), в то время как остатки ткани в экспериментальных группах подтверждают, какие участки вдоль стенок канала не были механически очищены или где протоколы ирригации были неэффективными. Поскольку остатки пульпы могут служить субстратом для бактерий и могут негативно повлиять на качество процедур заполнения канала (Ricucci и др. 2009, Ricucci & Siqueira 2011), это теоретически поддерживает эту экспериментальную переменную, оставшуюся пульповую ткань, как принятый суррогатный конечный пункт для оценки качества процедур дебридмента в пространстве корневого канала. Однако процессы и результирующая нагрузка по подготовке образцов, которые включают сечение, окрашивание, визуализацию и окончательную комплексную гистологическую оценку, остаются громоздкой и трудоемкой техникой. В частности, в контексте эндодонтических лабораторных исследований, декальцинация минерализованных зубных тканей является времязатратным и сложным этапом, и сложно получить высококачественные образцы без повреждения пульповой ткани. Это становится еще более важным, поскольку, в общем, гистологическое сечение декальцинированных твердых тканей склонно вызывать значительные искажения тканей, сбои в обработке и структурные артефакты. Например, усадка тканей до 3% происходит с костными тканями (Lane & Ráliš 1983, Henson и др. 1994), в то время как обезвоживание мягкой ткани может создать усадку до 11% (Rown и др. 2002). Таким образом, даже с полезными данными, доступными в литературе по этой теме, стоит отметить, что количественные данные микроскопии из гистологического сечения были получены из тканей, которые предположительно усохли во время подготовки образцов. Более того, техники гистологического сечения неизменно приводят к потере образцов, что делает невозможными продольные эксперименты с течением времени. Следовательно, гистология может рассматриваться как архаичный метод по сравнению с объемным и количественным подходом, достигнутым с помощью неразрушающих методов визуализации (Таблица 2), хотя на сегодняшний день это остается единственной доступной экспериментальной моделью, которая позволяет одновременно оценивать как минерализованные твердые, так и мягкие ткани зубов на их ультраструктурном уровне и, соответственно, может пролить свет на эту важную область исследований (De-Deus и др. 2008, 2010, 2011).
Несколько исследований с использованием неразрушающей технологии микро-КТ продемонстрировали, что подготовка стенок корневых каналов с помощью эндодонтических инструментов, активированных в ротационном или возвратно-поступательном движении, не является идеальной (Paqué и др. 2010, Paqué & Peters 2011, Versiani и др. 2013, De-Deus и др. 2015, Zuolo и др. 2018). Механическая подготовка с помощью этих инструментов ограничена, так как они, как правило, обрабатывают только центральные аспекты корневых каналов, создавая круглую форму, оставляя большинство щечных и язычных расширений этих сложных пространств нетронутыми, даже при попытках боковых движений, таких как использование движения щетки (Paqué и др. 2010, Paqué & Peters 2011, Versiani и др. 2013, De-Deus и др. 2015, Zuolo и др. 2018). Хотя микро-КТ может предоставить ценные и точные измерения относительно положения и объема удаленного дентита во время подготовки канала, он не предоставляет информации о пульповой ткани или микробных биопленках, которые могут оставаться прикрепленными к стенкам корневого канала, особенно в областях, недоступных для механического действия инструментов, таких как истмусы, плавники, анастомозы и дополнительные каналы (Versiani и др. 2013). Это означает, что микро-КТ в основном ограничен оценкой изменений в дентинных стенках, так как по своей сути микро-КТ не подходит для визуализации мягких тканей, так как они практически «прозрачны» для рентгеновских лучей. Это ограничение связано с неспособностью этого радиографического метода, основанного на исследовании костной ткани и предназначенного для изображения более плотных элементов, таких как кальций, обнаруживать нерадиолуксные мягкие ткани (Rüegsegger и др. 1996). Тем не менее, был достигнут значительный прогресс в исследованиях на основе микро-КТ в других биомедицинских областях, включая различные типы настольных сканеров, захват информации с фазовым контрастом, более быстрые и эффективные протоколы получения сканов и алгоритмы реконструкции. В совокупности такие разработки могут быть использованы для визуализации мягких (некальцифицированных) тканей, преодолевая их врожденное ограничение. Для этого можно достичь специфического улучшения визуализации мягких тканей с использованием радиопрозрачных контрастных агентов для достижения ослабления рентгеновских лучей, так называемой техники микро-КТ с контрастным усилением (CE-CT). Вкратце, CE-CT подходит для оценки гетерогенных тканей, таких как зубы.
Контрастные вещества состоят из специфических химических агентов с высокой молекулярной массой, способных естественным образом связываться с мягкими тканями для создания «контраста» эффективным образом. Контрастным веществом, использованным в настоящем исследовании, был неорганический йод Люголя (I2KI), который впервые был представлен Метшером (2009a), который протестировал несколько протоколов фиксации образцов и потенциал окрашивания нескольких коммерчески доступных соединений для различных типов мягких тканей. На сегодняшний день было продемонстрировано, что йод Люголя имеет высокую аффинность к гликогену (Феннерти 1999) и нацеливается на эпителиальные клетки и мягкие ткани мыши (Дегенхардт и др. 2010, Баверсток и др. 2013). Таким образом, потенциал йода Люголя для получения изображений пульповой ткани с помощью микро-КТ был протестирован в текущем исследовании. В ходе серии испытаний с различными протоколами импрегнации зубы с обычными доступными полостями, погруженные в раствор Люголя на 7 дней, позволили эффективно импрегнировать пульповую ткань (Рисунки 3 и 7). Однако два аспекта, касающиеся использования метода CE-CT для анализа остатков пульпы в течение времени после ирригации корневого канала раствором NaOCl, могут вызывать беспокойство. Первый аспект связан с тем, что NaOCl химически реагирует с йодом раствора Люголя. Несмотря на это взаимодействие, раствор Люголя не значительно снизил протеолитическую способность NaOCl в текущих условиях. Второе беспокойство заключалось в потенциале NaOCl снизить степень контраста, связанного с импрегнированной йодом Люголя пульповой тканью. Тест на радиопрозрачность показал, что раствор Люголя подходит для импрегнации пульповой ткани, так как NaOCl не мешал его радиопрозрачности. В совокупности эти результаты подтвердили, что раствор Люголя можно использовать в качестве контрастного вещества для тестирования пульповой ткани как субстрата для анализа протоколов ирригации на основе NaOCl. Дальнейший анализ был сосредоточен на валидации раствора Люголя для правильной идентификации пульповой ткани. Для этого использовалась парафиновая гистологическая секция, чтобы подтвердить, видна ли пульповая ткань, импрегнированная раствором Люголя, на сканах микро-КТ. Затем был разработан экспериментальный подход для сравнения гистологических срезов с соответствующими изображениями, полученными из стеков микро-КТ, преодолевая типичные проблемы выравнивания в этом типе корреляционного анализа. Результаты подтвердили правильную идентификацию пульповой ткани на изображениях микро-КТ, импрегнированных йодом Люголя, и тем самым доказали качество протокола импрегнации (Рисунки 4 и 5).
Стоит отметить, что, особенно для эндодонтических исследований с использованием оставшейся пульповой ткани в качестве параметра результата, метод CE-CT имеет явное преимущество, не сосредотачиваясь на ультраструктурной детальной оценке мягкой ткани. Вместо этого CE-CT легко позволяет количественно оценивать оставшуюся пульповую ткань в целом в продольных (со временем) экспериментах (Рисунки 6 и 7). С качественной точки зрения, сотни срезов, полученных для каждого зуба с помощью CE-CT, могут дать лучшее понимание тесной взаимосвязи между внутренней анатомией корневых каналов и механическими протоколами формования и ирригации. Это связано с тем, что CE-CT предоставляет 3D модели высокого разрешения, которые содержат достоверную информацию о размерах, структурной количественной оценке и анатомических особенностях гетерогенных тканей, например, дентине и пульповой ткани. В то же время этот метод позволяет оценивать предоперационное распределение пульповой ткани по всему пространству канала до экспериментальных процедур даже после 7 дней без какого-либо протокола фиксации. Это важный момент, поскольку количество и расположение пульповой ткани могут выступать в качестве смешивающего фактора, влияющего на результат эксперимента. Таким образом, использование метода CE-CT на зубах с жизнеспособными пульпами кажется действительным и воспроизводимым, поскольку пульповая ткань была распределена по всей системе корневых каналов во всех здоровых зубах. Будущие исследования с использованием этого инновационного метода должны включать сравнение различных ирригантов (инертные против активных растворов) с течением времени и протоколов подготовки по эффективности растворения/удаления пульповой ткани из систем корневых каналов. Дальнейшие улучшения этого метода также позволят применять его в in vivo исследованиях с использованием CBCT, например. В данный момент настоящая методология требует, чтобы контрастное вещество находилось в контакте с пульповой тканью как минимум 7 дней, а в in vivo подходе также потребуются пред- и постоперационные томографические изображения, которые явно должны соответствовать приемлемым этическим принципам исследований. Определенно, настоящий протокол должен быть валидирован in vivo с использованием CBCT. С другой стороны, его можно безопасно применять in vivo, используя некариозные и не восстановленные зубы с жизнеспособными пульпами, запланированными на удаление, без пред- или постоперационных сканирований. Например, после подтверждения жизнеспособного состояния пульпы с помощью обычных тестов, химико-механический протокол может быть применен in situ, и контрастный раствор введен в пространство пульпового канала, а корональная доступная полость восстановлена, чтобы обеспечить сохранение раствора Люголя внутри пространства корневого канала. Затем зуб может быть удален, сохранен и оценен с помощью микрокомпьютерной томографии через неделю.
В заключение, текущее исследование сосредоточено на предоставлении предварительных, но оригинальных доказательств в поддержку неразрушающих продольных исследований CE-CT с использованием оставшейся пульпы в качестве параметра результата. Было продемонстрировано, что CE-CT объединяет в одном методе основные преимущества технологии микрокомпьютерной томографии (оценка минерализованной ткани) и традиционных гистологических методов (оценка неминерализованной ткани) для изучения процедур дебридмента корневых каналов, включая возможность оценки, идентификации и измерения тех участков канала, которые не были затронуты ни механической подготовкой, ни протоколами ирригации. Стоит отметить, что CE-CT позволяет изучать механическую подготовку канала и протоколы ирригации независимо или комбинированный синергетический эффект химико-механических процедур.
Выводы
Раствор Люголя позволил визуализировать пульповую ткань на изображениях микрокомпьютерной томографии. Раствор Люголя не подвергался влиянию NaOCl в своей радиопрозрачности и не мешал растворению фиксированных и окрашенных мягких тканей. В практическом плане представленная техника контрастной микрокомпьютерной томографии с раствором Люголя позволяет оценивать эффект химического растворения и механического удаления пульповой ткани с помощью процедур очистки и формовки независимо или совместно, что делает ее очень полезной техникой в лабораторных исследованиях эндодонтии.
Авторы: G. De-Deus, F. G. Belladonna, D. M. Cavalcante, M. Simões-Carvalho, E. J. N. L. Silva, J. C. A. Carvalhal, R. Q. Zamolyi, R. T. Lopes, M. A. Versiani, P. M. H. Dummer, M. Zehnder
Ссылки:
- Alfaro DP, Ruse ND, Carvalho RM, Wyatt CC (2015) Оценка внутренней подгонки коронок из литиевого дисиликатa с использованием микро-КТ. Journal of Prosthodontics 24, 381–6.
- Baverstock H, Jeffery NS, Cobb SN (2013) Морфология жевательной мускулатуры мыши. Journal of Anatomy 223, 46–60.
- Cunha AC, Marquezan M, Lima I, Lopes RT, Nojima LI, Sant’Anna EF (2015) Влияние архитектуры кости на первичную стабильность различных дизайнов мини-имплантатов. American Journal of Orthodontics and Dentofacial Orthopedics 147, 45–51.
- De-Deus G, Reis C, Beznos D, Gruetzmacher-de-Abranches AM, Coutinho-Filho T, Pacionrik S (2008) Ограниченная способность трех широко используемых термопластических техник гуттаперчи для заполнения овальных каналов. Journal of Endodontics 34, 1401–5.
- De-Deus G, Barino B, Quintella Zamolyi R и др. (2010) Субоптимальное качество дебридмента, полученное с помощью техники одиночного файла F2 ProTaper в овальных каналах. Journal of Endodontics 36, 1897–900.
- De-Deus G, Souza EM, Barino B и др. (2011) Саморегулируемый файл оптимизирует качество дебридмента в овальных корневых каналах. Journal of Endodontics 37, 701–5.
- De-Deus G, Belladonna FG, Silva EJ и др. (2015) Оценка микро-КТ неинструментированных областей канала с различными увеличениями, выполненными системами NiTi. Brazilian Dental Journal 26, 624–9.
- De-Deus G, Simões-Carvalho M, Belladonna FG и др. (2020) Создание хорошо сбалансированных экспериментальных групп для сравнительных эндодонтических лабораторных исследований: новое предложение на основе микро-КТ и in silico методов. International Endodontic Journal 53, 974–85.
- Degenhardt K, Wright AC, Horng D, Padmanabhan A, Epstein JA (2010) Быстрая 3D фенотипизация сердечно-сосудистого развития у эмбрионов мыши с помощью микро-КТ с йодным окрашиванием. Circulation: Cardiovascular Imaging 3, 314–22.
- Faulwetter S, Vasileiadou A, Kouratoras M, Dailianis T, Arvanitidis C (2013) Микро-компьютерная томография: введение новых измерений в таксономию. ZooKeys 263, 1–45. Fedorov A, Beichel R, Kalpathy-Cramer J и др. (2012) 3D Slicer как платформа для вычислительной обработки изображений для количественной визуализации. Magnetic Resonance Imaging 30, 1323–41.
- Fennerty MB (1999) Окрашивание тканей. Gastrointestinal Endoscopy Clinics of North America 4, 297–311.
- Gignac PM, Kley NJ (2014) Микро-КТ с улучшением йодом: методологические усовершенствования для изучения анатомии мягких тканей постэмбриональных позвоночных. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution 322, 166–76.
- Gysi A, Röse C (1894) Сборник микрофотографий для иллюстрации микроскопической структуры зубов человека. Микрофотографии зубной гистологии. Цюрих: Швейцария.
- Hatton EH, Skillen WG, Moen OH (1928) Гистологические находки в зубах с обработанными и заполненными корневыми каналами. Journal of the American Dental Association 15, 56.
- Henson MM, Henson OW Jr, Gewalt SL, Wilson JL, Johnson GA (1994) Визуализация улитки с помощью магнитно-резонансной микроскопии. Hearing Research 75, 75–80.
- Heimel P, Swiadek NV, Slezak P и др. (2019) Микро-КТ с улучшением йодом мягких тканей на примере регенерации периферического нерва. Contrast Media G Molecular Imaging 2019, 1–15.
- Hertig G, Zehnder M, Woloszyk A, Mitsiadis T, Ivica A, Weber F (2017) Иодиксанол как контрастное вещество в фибриновом гидрогеле для эндодонтических приложений. Frontiers in Physiology 8, 152.
- Kölliker VA (1852) Руководство по тканевой анатомии человека, 1-е изд. Лейпциг: W. Engelmann, с. 405.
- Lacerda MFLS, Marceliano-Alves MF, Pérez AR и др. (2017) Очистка и формирование овальных каналов с помощью 3 систем инструментов: корреляционное микро-компьютерное томографическое и гистологическое исследование. Journal of Endodontics 43, 1878–84.
- Lane & Ráliš (1983) Изменения в размерах крупных образцов губчатой кости во время гистологической подготовки, измеренные на срезах из головок бедренной кости человека. Calcified Tissue International 35, 1–4.
- Metscher BD (2009a) Микро-КТ для сравнительной морфологии: простые методы окрашивания позволяют получать высококонтрастные 3D-изображения разнообразных неминерализованных тканей животных. BMC Physiology 9, 11.
- Metscher BD (2009b) Микро-КТ для эмбриональной биологии: универсальный инструмент для высококонтрастной 3D-визуализации на гистологическом уровне. Developmental Dynamics 238, 632–40.
- Paqué F, Balmer M, Attin T, Peters OA (2010) Подготовка овальных корневых каналов в нижних молярах с использованием никель-титановых ротационных инструментов: исследование с использованием микро-компьютерной томографии. Journal of Endodontics 36, 703–7.
- Paqu´e F, Peters OA (2011) Оценка микро-компьютерной томографии подготовки длинных овальных корневых каналов в нижних молярах с помощью саморегулируемого файла. Journal of Endodontics 37, 517–21.
- Pauwels E, Van Loo D, Cornillie P, Brabant L, Van Hoorebeke L (2013) Исследование контрастных веществ для визуализации мягких тканей с помощью высокоразрешающей рентгеновской компьютерной томографии. Journal of Microscopy 250, 21–31.
- Ricucci D, Siqueira JF Jr, Bate AL, Pitt Ford TR (2009) Гистологическое исследование зубов, обработанных корневым каналом, с апикальным периодонтитом: ретроспективное исследование двадцати четырех пациентов. Journal of Endodontics 35, 493–502.
- Ricucci D, Siqueira JF Jr (2011) Судьба ткани в боковых каналах и апикальных разветвлениях в ответ на патологические условия и процедуры лечения. Journal of Endodontics 36, 1–15.
- Rown MAB, Eed RBR, Enry RWH (2002) Влияние средств дегидратации и температуры на общее время дегидратации и усадку тканей. Journal of International Society for Plastination 17, 28–33.
- Rüegsegger P, Koller B, Mu€ller R (1996) Микротомографическая система для неразрушающей оценки архитектуры кости. Calcified Tissue International 58, 24–9.
- Siqueira JF Jr, Pérez AR, Marceliano-Alves MF и др. (2018) Что происходит с неподготовленными стенками корневого канала: корреляционный анализ с использованием микро-компьютерной томографии и гистологии/сканирующей электронной микроскопии. International Endodontic Journal 51, 501–8.
- Versiani MA, Leoni GB, Steier L и др. (2013) Исследование микро-компьютерной томографии овальных каналов, подготовленных с помощью саморегулируемого файла, Reciproc, WaveOne и Pro-Taper universal systems. Journal of Endodontics 39, 1060–6.
- Vogel AI (1978) Учебник по количественному неорганическому анализу, включая элементарный инструментальный анализ. 4-е изд. Лондон: Longmans, Green and Co., Ltd. с. 925.
- Walton RE (1976) Гистологическая оценка различных методов увеличения пространства пульпового канала. Journal of Endodontics 2, 304–11.
- Zehnder M (2006) Ирригаторы для корневых каналов. Journal of Endodontics 32, 389–98.
- Zuolo ML, Zaia AA, Belladonna FG и др. (2018) Оценка микро-КТ способности формообразования четырех систем инструментов корневого канала в овальных каналах. International Endodontic Journal 51, 564–71.

/social-network-service/media/default/6758/89a8282e.png)