Оценка физико-химических свойств четырех герметиков для корневых каналов
Машинный перевод
Оригинальная статья написана на языке EN (ссылка для ознакомления).
Аннотация
Цель: Оценить физико-химические свойства и морфологию поверхности герметиков корневых каналов AH Plus, GuttaFlow, RoekoSeal и Activ GP.
Методология: Пять образцов каждого материала были оценены по времени затвердевания, изменению размеров, растворимости и радиopacity тестам в соответствии со спецификацией ANSI/ADA 57. Всего 50 мл деионезированной дистиллированной воды из тестов на растворимость были использованы для измерения растворимости металлов методом атомно-абсорбционной спектрометрии. Морфологии внешней поверхности и среза образцов были проанализированы с помощью сканирующего электронного микроскопа (СЭМ). Статистический анализ был выполнен с использованием однофакторного ANOVA и post hoc тестов Тьюки-Крамера с нулевой гипотезой, установленной на уровне 5%.
Результаты: AH Plus имел самое длительное время затвердевания (580.6 ± 3.05 мин) (P< 0.05). Activ GP не имел среднего значения по тестам на радиopacity и растворимость (1.31 ± 0.35 мм и 11.8 ± 0.43%, соответственно) в соответствии с ANSI/ADA, значительно отличаясь от других материалов (P< 0.05), которые имели средние значения для этих тестов в соответствии с требованиями ADA. GuttaFlow был единственным герметиком, который соответствовал спецификации 57 по тесту на изменение размеров (0.44 ± 0.16%) (P< 0.05). Спектрометрический тест показал значительное высвобождение ионов Ca2+, K+, Zn2+ из герметика Activ GP (32.57 ± 5.0, 1.57 ± 0.22 и 8.20 ± 1.74 мкг мЛ–1, соответственно). В анализе СЭМ потеря матрицы была очевидна, и частицы наполнителя были более различимы во всех группах.
Выводы: Время затвердевания всех герметиков соответствовало требованиям ANSI/ADA. Activ GP не соответствовал протоколам ANSI/ADA по радиopacity, изменению размеров и растворимости. Gutta-Flow был единственным герметиком, который соответствовал Спецификации 57 во всех тестах. SEM-анализ показал, что поверхности всех герметиков имели микроморфологические изменения после теста на растворимость.
Введение
В лечении корневых каналов полное герметичное закрытие системы корневого канала после очистки и формовки критически важно для предотвращения колонизации оральными патогенами и повторного инфицирования корневых и периапикальных тканей. Хотя гуттаперча по-прежнему является наиболее часто используемым материалом для заполнения корневых каналов, было разработано множество новых техник и материалов с различными физико-химическими свойствами (Ørstavik 2005, Versiani и др. 2006, Resende и др. 2009).
Во время процедур заполнения канала эндодонтический герметик выполняет несколько функций, включая заполнение неровностей стенок корневого канала, таких как апикальные разветвления и дельты, а также пространства, где гуттаперча не смогла адаптироваться (Kontakiotis и др. 2007). Поскольку традиционные материалы для заполнения неэффективно герметизируют пространство корневого канала, были разработаны новые эндодонтические герметики (Bouillaguet и др. 2008).
Хотя AH Plus обладает адекватной долговременной размерной стабильностью, его способность к герметизации остается спорной, отчасти потому, что AH Plus не связывается с гуттаперчей (Ørstavik и др. 2001). RoekoSeal Automix (Coltène Whaledent, Лангенау, Германия) - это герметик, содержащий диметилполиорганосиликон, о физико-химических свойствах которого доступно ограниченное количество данных (Gençoglu и др. 2003). Несмотря на многообещающие клинические и лабораторные данные, сообщенные для герметика на основе силикона, RoekoSeal был протестирован в различных исследованиях с противоречивыми результатами (De-Deus и др. 2007). GuttaFlow (Coltène Whaledent, Альтштеттен, Швейцария) - это герметик на основе полиэтиленсилоксана, который был представлен с намерением уменьшить недостатки теплых техник гуттаперчи (Eldeniz & Ørstavik 2009). Утверждается, что GuttaFlow может улучшить герметизацию благодаря повышенной текучести и тому факту, что материал немного расширяется при затвердевании (Bouillaguet и др. 2008, Eldeniz & Ørstavik 2009, Roggendorf и др. 2010).
Стоматологические применения стеклоиономерных герметиков используют их связь с дентином, высвобождение фтора, антимикробную активность и биосовместимость (Ørstavik 2005). Однако некоторые лабораторные испытания показали склонность к утечкам и разрушению (Carvalho-Júnior et al. 2003, Schäfer & Zandbiglari 2003). Недавно система точной обтурации Activ GP (Brasseler USA, Savannah, GA, USA) была представлена как моноблочная система для заполнения корней, использующая традиционные конусы из гутаперчи, которые покрыты стеклоиономерными наполнителями (Roggendorf et al. 2010). Производитель утверждает, что продукт превосходит предыдущие системы на основе стеклоиономера по характеристикам обработки, времени работы, радиopacity (Fransen et al. 2008) и герметичности, благодаря повышенной текучести и тому факту, что материал немного расширяется при затвердевании (Kontakiotis et al. 2007).
Хотя были предложены различные виды эндодонтических герметиков в качестве инновационных материалов для заполнения, идеальный герметик для корневых каналов еще не найден (Ørstavik 1983, 2005, Ørstavik et al. 2001, Versiani et al. 2006, Resende et al. 2009). Поэтому целью данного лабораторного исследования было сравнить время затвердевания, радиopacity, изменения размеров и растворимость герметиков на основе силикона (GuttaFlow и RoekoSeal) и герметика на основе иономера (Activ GP) с хорошо зарекомендовавшим себя герметиком на основе эпоксидной смолы (AH Plus) в соответствии со стандартами ANSI/ADA (2000).
Материалы и методы
Время затвердевания, радиопрозрачность, изменения размеров и растворимость после затвердевания для герметиков корневых каналов AH Plus (группа I), GuttaFlow (группа II), RoekoSeal (группа III) и Activ GP (группа IV) были измерены в соответствии со стандартами ANSI/ADA (2000) для материалов для герметизации корневых каналов. Испытанные материалы (Таблица 1) были обработаны в соответствии с инструкциями производителя. Анализы проводились одним экспертом, который не знал о экспериментальных материалах. Для стандартизации и гомогенизации количества материала 0,3 г герметика было отмерено на смешивательной подложке и смешано в течение 15 секунд для каждого тестируемого образца. Для физико-химических испытаний была записана арифметическая средняя величина пяти повторений для каждого герметика и считалась результатом испытания.
Время затвердевания
Было подготовлено пять колец из гипса с внутренним диаметром 10 мм и толщиной 2 мм. Внешние границы форм были зафиксированы воском на стеклянной пластине (75 x 25 x 1 мм). Затем формы были заполнены материалом и перенесены в камеру с относительной влажностью 95% (RH) и температурой 37 °C. Через 150 ± 10 с с момента начала смешивания герметика игла типа Гилмора с массой 100 ± 0,5 г и плоским концом диаметром 2,0 ± 0,1 мм была осторожно опущена вертикально на горизонтальную поверхность каждого образца. Кончик иглы был очищен, и измерение повторялось до тех пор, пока вмятины не перестали быть видимыми. Если результаты отличались более чем на ±5%, испытание повторялось.
Тест на радиопрозрачность
Было подготовлено пять акриловых пластин (2,2 см x 4,5 см x 1 мм), содержащих четыре ячейки глубиной 1 мм и диаметром 5 мм, которые были размещены на стеклянной пластине, покрытой целлофановой пленкой. Каждая ячейка была заполнена одним из герметиков в последовательности в соответствии с временем затвердевания материала, от самого длинного до самого короткого, чтобы образцы были готовы к радиографической оценке после окончательного затвердевания всех материалов. Чтобы избежать образования пузырьков, свежесмешанный герметик вводился в ячейки с помощью шприца. На верхнюю часть была помещена другая стеклянная пластина, покрытая целлофановой пленкой, до полного затвердевания, и излишки герметика были удалены. Каждая пластина хранилась в инкубаторе (37°C, 95% RH) в течение времени, соответствующего тройному времени затвердевания.
Каждая из акриловых пластин, содержащих герметики, была расположена во время рентгеновского облучения рядом с другой акриловой пластиной (1,3 см x 4,5 см x 1 мм), содержащей алюминиевую ступенчатую призму, изготовленную из сплава 1100, с толщиной, варьирующей от 1 до 10 мм, в равномерных шагах по 1 мм (Margraf Dental MFG Inc., Jenkintown, PA, USA). Этот набор акриловых пластин был помещен перед фосфорной пластиной, рядом с алюминиевой ступенчатой призмой, и был сделан цифровой рентгеновский снимок (система Digora™; Soredex Orion Corporation, Хельсинки, Финляндия). Рентгеновские изображения были получены с использованием рентгеновского аппарата Spectro 70X (Dabi Atlante, Рибейран-Прету, SP, Бразилия) при 70 кВ и 8 мА. Расстояние от объекта до фокуса составляло 30 см, а время экспозиции — 0,2 с. Облученные изображения тестовых образцов были немедленно отсканированы после экспозиции (сканер Digora™) и проанализированы с использованием программного обеспечения Digora™ для Windows 5.1.
Изменение размеров
Пять форм Тефлона® (политетрафторэтилен, DuPont, HABIA, Книвста, Швеция), подготовленных для производства цилиндрических тестовых тел высотой 3,58 мм и диаметром 3 мм, были помещены на стеклянную пластину, обернутую тонкой целлофановой пленкой. Формы были заполнены небольшим избытком свежесмешанных герметиков, и на верхнюю поверхность формы была прижата предметное стекло, также обернутое целлофаном. Собранная группа была надежно зажата С-образным зажимом и перенесена в инкубатор (37 °C, 95% Влажность) и оставлена на время, соответствующее тройному времени затвердевания. После этого периода плоские концы форм, содержащие образцы, были отшлифованы наждачной бумагой с зернистостью 600. Образцы были извлечены из форм, измерены с помощью цифрового штангенциркуля, помещены в сосуд объемом 50 мл, содержащий 2,24 мл деионизированной дистиллированной воды, и хранились в инкубаторе (37 °C, 95% Влажность) в течение 30 дней. Затем образец был извлечен из контейнера, высушен на абсорбирующей бумаге и снова измерен по длине. Процент изменения размеров был рассчитан с использованием формулы:
((L30 — L )/ L) x 100
где L30 — это длина образца после 30 дней хранения, а L — начальная длина образца.
Растворимость
Цилиндрическая форма из тефлона® толщиной 1,5 мм и внутренним диаметром 7,75 мм была заполнена свежесмешанным герметиком. Форма поддерживалась более крупной стеклянной пластиной и накрыта целлофановой пленкой. Непроницаемая нейлоновая нить была помещена внутрь материала, и другая стеклянная пластина, также накрытая целлофановой пленкой, была расположена на форме и вручную прижата так, чтобы пластины касались всей формы равномерно. Сборка была помещена в инкубатор (37 °C, 95% RH) и оставлена на период, соответствующий тройному времени схватывания. Как только образцы были извлечены из формы, их взвешивали трижды (HM-200, A & D Engineering, Inc., Bradford, MA, USA), и фиксировалось среднее значение. Образцы были подвешены на нейлоновой нити и помещены парами в пластиковый сосуд с широким отверстием, содержащий 7,5 мл деионизированной дистиллированной воды, при этом следили за тем, чтобы избежать контакта между ними и внутренней поверхностью контейнера. Контейнеры были запечатаны и оставлены на 7 дней в инкубаторе (37 °C, 95% RH). После этого периода образцы были извлечены из контейнеров, промыты деионизированной дистиллированной водой, высушены с помощью абсорбирующей бумаги и помещены в осушитель на 24 часа. Затем их снова взвесили. Потеря веса каждого образца (начальная масса минус конечная масса), выраженная в процентах от оригинальной массы (m% = mi – mf), была принята за растворимость герметика.
Объем 7,5 мл дистиллированной воды из каждой пробы был вылит в очищенный и высушенный фарфоровый тигель. Каждый тигель был помещен в муфельную печь и сожжен при 550 °C. Золу растворили в 10 мл концентрированной азотной кислоты (Merck KGaA, Дармштадт, Германия) с помощью стеклянной палочки. После этого образцы были помещены в 50 мл мерные колбы, и объем доведен до отметки ультрачистой деонизированной водой (MilliQ, Millipore, Биллерика, MA, США). Полученные растворы были распылены в атомно-абсорбционном спектрофотометре (Perkin Elmer, Юберлинген, Германия) для проверки наличия ионов Ca2+, K+, Zn2+ и Ag+. Арифметическое среднее трех повторов для каждого образца было зафиксировано и принято за результат, выраженный в μg mL–1.
Исследование с помощью сканирующей электронной микроскопии
Для исследования с помощью сканирующей электронной микроскопии (SEM) цилиндрические формы из тефлона® (3 x 4 мм) были заполнены свежесмешанными герметиками. Формы поддерживались стеклянной пластиной, покрытой целлофановой пленкой, и помещались в камеру (37 °C, 95% Влажность) на период, соответствующий тройному времени схватывания. После этого образцы были нарезаны с помощью одноразового хирургического скальпеля номер 15, зафиксированы на металлическом подставке (10 x 5 мм) и покрыты золотом-палладием (Bal-Tec AG, Балцерс, Германия) при 20 мА. Морфологии внешней поверхности и сечения образцов были качественно проанализированы под полевым эмиссионным SEM (Jeol JSM 5410; Jeol Technic Co., Токио, Япония) при ускоряющем напряжении 15 кВ, рабочем расстоянии от 6 до 10 мм и при различных увеличениях.
Статистический анализ
Пять образцов из каждой группы были протестированы, и средние значения были статистически сопоставлены. Тест Колмогорова–Смирнова показал, что результаты соответствуют кривой нормального распределения, таким образом, была возможна параметрическая статистическая обработка (однофакторный дисперсионный анализ и пост хок тест Тьюки–Крамера), и нулевая гипотеза была установлена на уровне 5% (spss 17.0 для Windows; SPSS Inc., Чикаго, IL, США).
Результаты
Время схватывания
Спецификация ANSI/ADA (2000) требует, чтобы время схватывания герметика находилось в пределах 10% от указанного производителями. Согласно им, время схватывания AH Plus, RSA RoekoSeal и Gutta-Flow составляет 480, 50 и 30 минут соответственно. В то же время производитель Activ GP не предоставляет эту информацию и лишь указывает, что он был разработан с увеличенным рабочим временем в 15 минут.
Статистически значимая разница была обнаружена между группами AH Plus (580.6 ± 3.05 мин), GuttaFlow (24.0 ± 2.0 мин), RoekoSeal (40.0 ± 1.58 мин) и Activ GP (15.2 ± 1.30 мин) (P< 0.05). Тем не менее, средние значения показали соответствие стандартизации ANSI/ADA (Таблица 2).
Тест на радиопрозрачность
AH Plus (6.0 ± 0.12 mmAl), GuttaFlow (3.0 ± 0.04 mmAl) и RoekoSeal (4.17 ± 0.45 mmAl) имели радиопрозрачность выше 3 мм алюминия, как рекомендовано спецификацией ANSI/ADA 57, в то время как Activ GP (1.31 ± 0.35 mmAl) не соответствовал этому требованию. Статистический анализ показал разницу между экспериментальными группами (P < 0.05) (Таблица 2).
Изменение размеров
Стандартизация ANSI/ADA (2000) утверждает, что среднее линейное усадка герметика не должно превышать 1% или 0.1% в расширении. За исключением GuttaFlow (0.44 ± 0.16%), ни один герметик не соответствовал Спецификации 57 (ANSI/ADA 2000). Все группы показали расширение после установки, за исключением RoekoSeal, который показал усадку при установке (-1.33 ± 0.12%). Статистический анализ выявил значительную разницу между экспериментальными группами (P < 0.05) (Таблица 2).
Растворимость
Спецификация ANSI/ADA 57 (2000) утверждает, что герметик для корневых каналов не должен превышать 3% по массе, когда тестируется растворимость установленного материала. За исключением Activ GP (11.8 ± 0.43%), все герметики соответствовали стандартизации ANSI/ADA (P < 0.05) (Таблица 2). Деионизированная дистиллированная вода, использованная для теста на растворимость и подвергнутая атомно-абсорбционной спектрометрии, показала значительный уровень высвобождения ионов Ca2+, K+ и Zn2+ в группе Activ GP по сравнению с AH Plus, Gutta-Flow и RoekoSeal (P < 0.05). Значительные уровни высвобождения Ag+ не были обнаружены ни в одной группе (Таблица 3).

SEM исследование
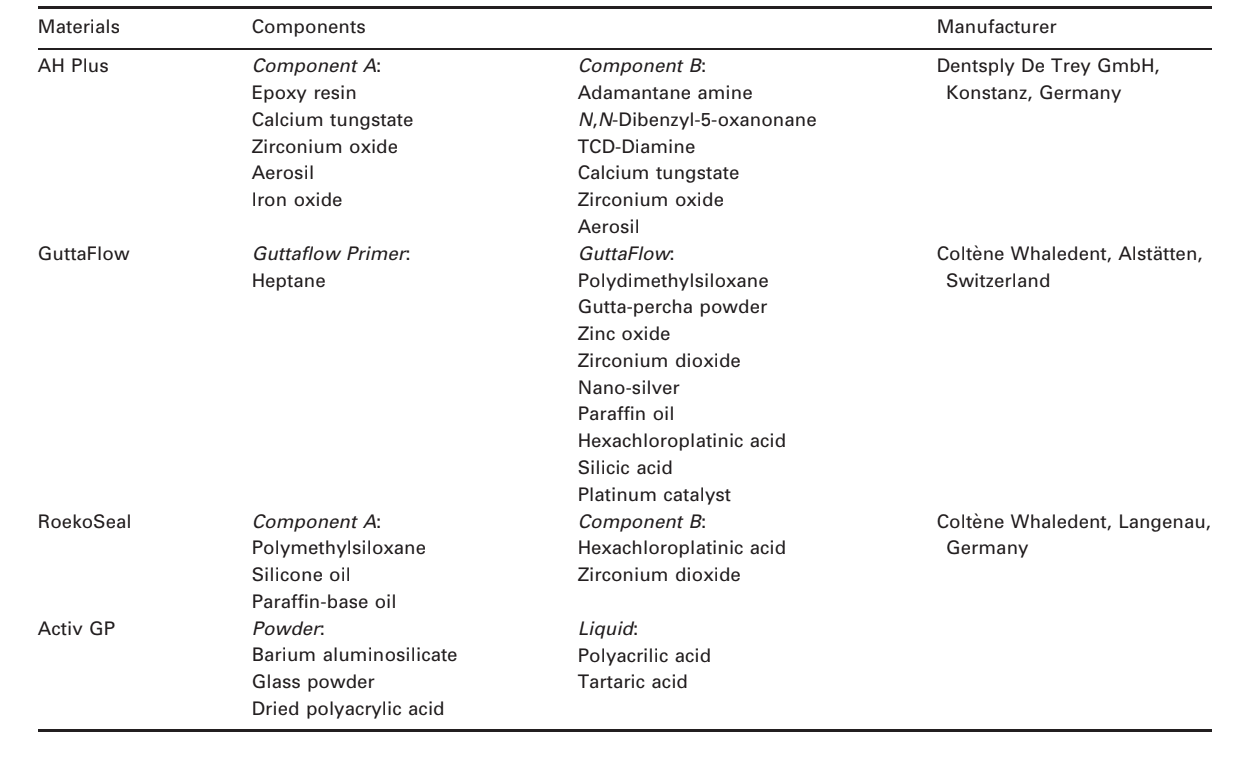
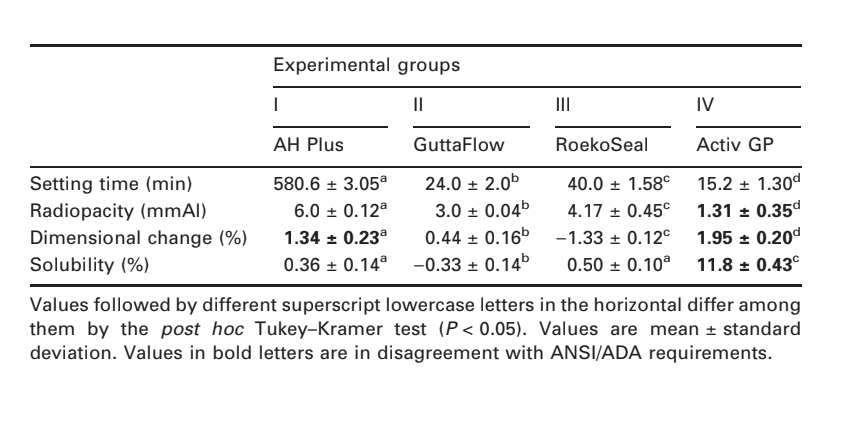
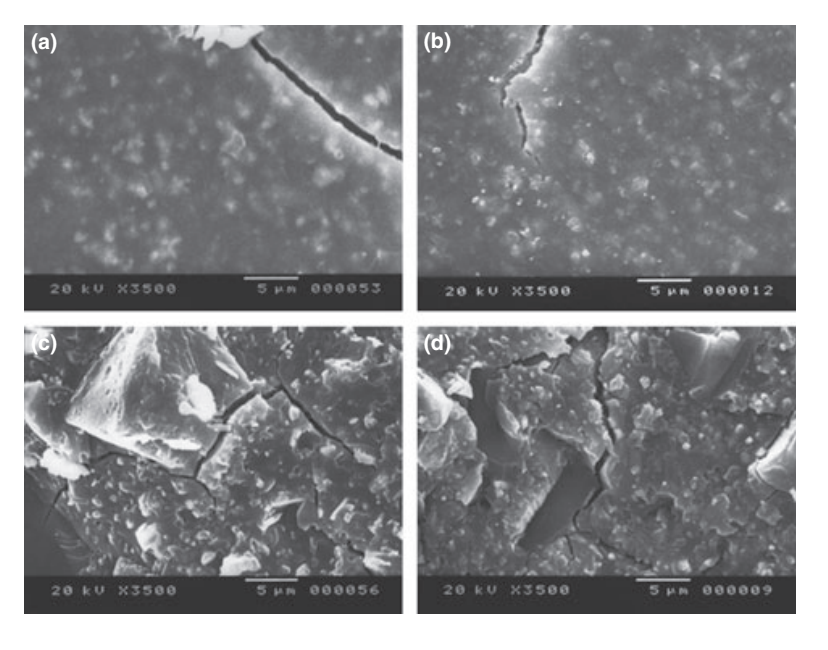
Выбранные фотомикрографии полимеризованных образцов, полученных до и после хранения в воде в течение 7 дней, представлены на рис. 1–4. В целом, было отмечено, что все поверхности имели микроморфологические изменения после теста на растворимость. Потеря матрицы была очевидна, и частицы наполнителя стали более различимыми. Группы AH Plus (рис. 1a,b), GuttaFlow (рис. 2a,b) и RoekoSeal (рис. 3a,b) имели внешнюю поверхность, которая казалась в основном однородной грубой поверхностью, которая уменьшалась в шероховатости после теста на растворимость с последующим увеличением шероховатости поверхности. Трещины не наблюдались в образцах, за исключением группы Activ GP. Поверхность образцов Activ GP была относительно грубее по сравнению с другими группами, и материал поверхности казался более поврежденным после теста на растворимость (рис. 4a,b).
Сканирующая электронная микроскопия среза образцов показала наличие полимеров в форме сфер различного размера, которые были неравномерно распределены. После теста на растворимость внутренняя поверхность образцов AH Plus (Рис. 1c,d), GuttaFlow (Рис. 2c,d) и Activ GP (Рис. 4c,d) оказалась гораздо более неровной и шероховатой. Несколько микротрещин наблюдались на интерфейсах наполнителя и полимерной матрицы в группе Activ GP до и после теста на растворимость (Рис. 4c,d). С другой стороны, группа RoekoSeal имела более однородный и компактный слой, состоящий из полимеров в форме сфер с большим количеством смолистой матрицы (Рис. 3c,d).

Обсуждение
Время затвердевания в первую очередь является контрольным тестом на стабильное поведение продукта и зависит от составных компонентов, их размера частиц, температуры окружающей среды и относительной влажности (Ørstavik 1983, 2005, Ørstavik и др. 2001). В настоящем исследовании все результаты соответствовали спецификации ANSI/ADA. Долгое время затвердевания AH Plus может быть объяснено тем, что этот герметик является двухкомпонентным пастообразным материалом, основанным на медленной полимеризации аминов эпоксидной смолы с высокой молекулярной массой (Бисфенол А и Бисфенол F), где превращение мономеров в полимеры происходит постепенно (Lin-Gibson и др. 2006, Resende и др. 2009). Эти результаты согласуются с предыдущими исследованиями (Versiani и др. 2006, Resende и др. 2009), однако, Garrido и др. (2010) сообщили о времени затвердевания AH Plus в 13 ч, что превышает допустимое отклонение в 10%, установленное Спецификацией номер 57 ADA.
Стандарты ANSI/ADA (2000) для радиоплотности материалов для герметизации корневых каналов были определены с использованием обычных стоматологических пленок, где радиографические изображения получаются химической обработкой (Taşdemir и др. 2008). Однако цифровая радиография становится все более распространенной в исследовании эндодонтических герметиков (Baksi Akdeniz и др. 2007, Carvalho-Júnior и др. 2007a, Rasimick и др. 2007, Taşdemir и др. 2008). Таким образом, в настоящем исследовании цифровые изображения материалов для заполнения корневых каналов и шагов алюминиевого клина были получены с использованием системы фосфорных пластин и цифровой системы сканирования, захвата и чтения.
Анализ состава протестированных материалов показал, что все они содержат радиопрозрачные агенты (Таблица 1), за исключением герметика Activ GP. Согласно Tanomaru-Filho и др. (2008), наличие порошка барий алюмосиликатного стекла в его составе не обеспечивает удовлетворительной радиопрозрачности. AH Plus содержит оксид циркония, оксид железа и кальциевый тугстат в качестве радиопрозрачных веществ (Tanomaru-Filho и др. 2007) и имел самое высокое среднее значение радиопрозрачности (6.0 ± 0.12 ммAl), как было сообщено ранее (Tagger & Katz 2003, Carvalho-Júnior и др. 2007a, Tanomaru-Filho и др. 2007, Taşdemir и др. 2008). Герметик RoekoSeal содержит диоксид циркония в качестве радиопрозрачного вещества (Baksi Akdeniz и др. 2007), и полученный результат (4.17 ± 0.45 ммAl) соответствовал предыдущим данным, которые показали его радиопрозрачность в диапазоне от 4.0 до 5.7 (Tagger & Katz 2003, Gambarini и др. 2006, Tanomaru-Filho и др. 2007, Rasimick и др. 2007). Более низкая радиопрозрачность GuttaFlow (3.0 ± 0.04 ммAl) по сравнению с RoekoSeal также была отмечена в предыдущих исследованиях (Tagger & Katz 2003, Gambarini и др. 2006, Rasimick и др. 2007, Tanomaru-Filho и др. 2007). Поскольку производитель не предоставляет химический тип и концентрацию нано-серебра в GuttaFlow, очевидно, что эти частицы не обладали радиопрозрачными характеристиками. Высокая растворимость герметиков для корневых каналов нежелательна, поскольку растворение может привести к высвобождению материалов, которые могут раздражать периапикальные ткани и также могут позволить образовываться зазорам между корневыми каналами и заполняющими материалами, что, вероятно, увеличит бактериальную утечку со временем (Donnelly и др. 2007). Несмотря на рекомендации ANSI/ADA, в настоящем исследовании была использована модификация, ранее предложенная для обоих тестов, которая достигла аналогичных результатов с уменьшением объема материала, необходимого для производства тестовых образцов (Carvalho-Júnior и др. 2007b). В настоящем исследовании AH Plus расширился в тесте на изменение размеров. Медленное увеличение массы со временем в основном было связано с энергией взаимодействия между водой и адсорбционными сайтами для системы (т.е. гидроксильная группа, аминогруппа, конец полимерной цепи и т.д.), заполняя зазоры между полимерными цепями (McDermott 1993). Возможно, это расширение компенсировало усадку, которую испытал герметик на основе смолы после полимеризации (Phillips & Skinner 1991, Carvalho-Júnior и др. 2007b, Resende и др. 2009, Garrido и др. 2010).
Полимеризация AH Plus достигается за счет полиаминов, входящих в его состав (1-адамантановый амин, N,N’-дибензил-5-окса-нонанди-амин-1,9, TCD-диамин). Когда диэпоксидные соединения и паста с полиаминами смешиваются, аминогруппы реагируют с эпоксидными группами, образуя ковалентную связь. Использование алифатических циклических аминогрупп способствует изменениям в скорости отверждения, плотности сшивки и морфологии эпоксидных смол. Каждая NH группа может реагировать с эпоксидной группой, так что полученный полимер сильно сшит, и, следовательно, является жестким и прочным (McDermott 1993, Case et al. 2005). Это может объяснить однородную и компактную шероховатую поверхность, выявленную в SEM-анализе, и низкие результаты растворимости AH Plus в данном исследовании. Шефер и Зандбиглари (2003) также измеряли растворимость эпоксидных смол (AH Plus, AH 26), на силиконовой основе (RoekoSeal), гидроксида кальция (Apexit, Sealapex), цинк-оксид-эвгенола (Aptal-Harz) и на основе стеклоиономеров (Ketac Endo) в воде и искусственной слюне. Согласно этим авторам, AH Plus имел наименьшую потерю веса среди всех протестированных герметиков, независимо от используемого растворителя.
Предыдущие исследования показали, что герметики на основе полидиметилсилоксана немного расширяются во время затвердевания и демонстрируют минимальное водопоглощение и растворимость (Donnelly и др. 2007, Monticelli и др. 2007). В соответствии с этим утверждением, в настоящем исследовании герметики GuttaFlow и RoekoSeal имели низкую растворимость с минимальным высвобождением ионов металлов. Учитывая тест на изменение размеров, GuttaFlow был единственным герметиком, который соответствовал Спецификации 57 (ANSI/ADA 2000), и подвергся расширению примерно на 0,44%. То же самое не наблюдалось у его предшественника, RoekoSeal, который продемонстрировал усадку (1,33%). Напротив, этот результат не согласуется с Ørstavik и др. (2001), который сообщил, что Roeko-Seal имел небольшое расширение около 0,2% в течение 4 недель и оставался стабильным после этого.
Наличие гутаперчи и наночастиц серебра в герметике GuttaFlow придает лучшую стабильность полимерной матрице благодаря силе притяжения между атомами серебра и молекулами гутаперчи в полимерной сшивке (Malynych и др. 2001). Эти взаимодействия могут объяснить низкое высвобождение ионов серебра из GuttaFlow, наблюдаемое в атомно-абсорбционной спектроскопии. Кроме того, наличие гутаперчи в полимерной сшивке GuttaFlow привело к более высокому водопоглощению, чем у RoekoSeal (Gong и др. 2008), что объясняет различия в результатах теста на изменение размеров и более однородный и компактный слой, наблюдаемый на поверхности RoekoSeal под СЭМ.
Наивысшие результаты растворимости и изменения размеров герметика Activ GP могут быть связаны с методологией ANSI/ADA, которая рекомендует погружать образец в воду после периода, равного трём временам затвердевания материала. Согласно Уилсону и МакЛину (1988), время затвердевания цемента-иономера завершается только через 24 часа после смешивания. В течение времени созревания цементов на основе стекло-иономера наличие влаги может вызвать растворение анионов и катионов, которые образуют матрицу для областей, окружающих цемент (Монтичелли и др. 2007). Это растворение ионов не позволяет воде, которая является частью состава цемента, гидратировать матрицу (Ca2+ и Al3+ образуют полисоли с группами COO- полиакриловой кислоты), что делает её нестабильной (Карвальо-Жуниор и др. 2003, Шефер и Зандбиглари 2003, Доннелли и др. 2007). Это может объяснить более грубую поверхность, наблюдаемую в СЭМ, и значительный уровень высвобождения ионов кальция, калия и цинка из Activ GP в данном исследовании. Поскольку структуры цементов на основе стекло-иономера, вероятно, подвержены влиянию наличия или отсутствия воды, они чувствительны к обезвоживанию на ранних этапах процесса затвердевания (Уилсон и МакЛин 1988). Для оценки СЭМ обезвоживание образца является важным процессом, что может объяснить микроразрывы, наблюдаемые на поверхности образцов Activ GP. Следовательно, результаты, полученные с Activ GP в данном исследовании, следует интерпретировать с осторожностью.
Выводы
Время затвердевания всех герметиков соответствовало требованиям ANSI/ADA. Activ GP не соответствовал протоколам ANSI/ADA по радиopacity, изменению размеров и растворимости. GuttaFlow был единственным герметиком, который соответствовал Спецификации 57 во всех тестах. SEM-анализ показал, что поверхности всех герметиков продемонстрировали микроморфологические изменения после теста на растворимость.
Авторы: D. S. H. Flores, F. J. A. Rached-Júnior, M. A. Versiani, D. F. C. Guedes, M. D. Sousa-Neto, J. D. Pécora
Ссылки:
- ANSI/ADA (2000) Спецификация n° 57 Материал для эндодонтической герметизации. Чикаго, США: Издательство ADA.
- Baksi Akdeniz BG, Eyuboglu TF, Sen BH, Erdilek N (2007) Влияние трех различных герметиков на радиopacity корневых пломб в смоделированных каналах. Оральная хирургия Оральная медицина Оральная патология Оральная радиология и эндодонтия 103, 138–41.
- Bouillaguet S, Shaw L, Barthelemy J, Krejci I, Wataha JC (2008) Долговременная герметизирующая способность Pulp Canal Sealer, AH-Plus, GuttaFlow и Epiphany. Международный эндодонтический журнал 41, 219–26.
- Carvalho-Júnior JR, Guimarães LF, Correr-Sobrinho L, Pécora JD, Sousa-Neto MD (2003) Оценка растворимости, диссоциации и изменений размеров стеклоиономерного герметика для корневых каналов. Бразильский стоматологический журнал 14, 114–8.
- Carvalho-Júnior JR, Correr-Sobrinho L, Correr AB, Sinhoreti MA, Consani S, Sousa-Neto MD (2007a) Радиopacity материалов для корневых пломб с использованием цифровой радиографии. Международный эндодонтический журнал 40, 514–20.
- Carvalho-Júnior JR, Correr-Sobrinho L, Correr AB, Sinhoreti MA, Consani S, Sousa-Neto MD (2007b) Растворимость и изменение размеров после затвердевания герметиков для корневых каналов: предложение для меньших размеров тестовых образцов. Журнал эндодонтии 33, 1110–6.
- Case SL, O’Brien EP, Ward TC (2005) Профили отверждения, плотность сшивания, остаточные напряжения и адгезия в модели эпоксидной смолы. Полимер 46, 10831–40.
- De-Deus G, Brandão MC, Fidel RA, Fidel SR (2007) Герметизирующая способность GuttaFlow в овальных каналах: экс-виво исследование с использованием полимикробной модели утечки. Международный эндодонтический журнал 40, 794–9.
- Donnelly A, Sword J, Nishitani Y и др. (2007) Водопоглощение и растворимость герметиков на основе метакрилатной смолы. Журнал эндодонтии 33, 990–4.
- Eldeniz AU, Ørstavik D (2009) Лабораторная оценка корональной бактериальной утечки в корневых каналах, заполненных новыми и традиционными герметиками. Международный эндодонтический журнал 42, 303–12.
- Fransen JN, He J, Glickman GN, Rios A, Shulman JD, Honeyman A (2008) Сравнительная оценка герметиков ActiV GP/стеклоиономер, Resilon/Epiphany и Gutta-Percha/AH Plus: исследование бактериальной утечки. Журнал эндодонтии 34, 725–7.
- Gambarini G, Testarelli L, Pongione G, Gerosa R, Gagliani M (2006) Радиографические и реологические свойства нового эндодонтического герметика. Австралийский эндодонтический журнал 32, 31–4.
- Garrido ADB, Lia RCC, França EC, da Silva JF, Astolfi-FIlho S, Sousa-Neto MD (2010) Лабораторная оценка физико-химических свойств нового герметика для корневых каналов на основе Copaifera multijuga масла-смолы. Международный эндодонтический журнал 43, 283–91.
- Gençoglu N, Türkmen C, Ahiskali R (2003) Новый силиконовый герметик для корневых каналов (Roekoseal-Automix). Журнал оральной реабилитации 30, 753–7.
- Gong W, Zeng K, Wang L, Zheng S (2008) Полигидроксиэфир бисфенола A-блок-полидиметилсилоксановый чередующийся блок-сополимер и его наноструктурированные смеси с эпоксидной смолой. Полимер 49, 3318–26.
- Kontakiotis EG, Tzanetakis GN, Loizides AL (2007) Сравнительное исследование углов контакта четырех различных герметиков для корневых каналов. Журнал эндодонтии 33, 299–302.
- Lin-Gibson S, Landis FA, Drzal PL (2006) Комбинаторное исследование структуры-свойств фотополимеризованных диметакрилатных сетей. Биоматериалы 27, 1711–7.
- Malynych S, Robuck H, Chumanov G (2001) Изготовление двумерных сборок наночастиц Ag и нано-полостей в полимерной смоле (поли(dimethylsiloxane)). Nano Letters 1, 647–9.
- McDermott J (1993) Структура индустрии передовых композитов: Справочник по передовым композитам. Кливленд: Advanstar Communications.
- Monticelli F, Sword J, Martin RL и др. (2007) Герметизирующие свойства двух современных систем одноразового заполнения. Международный эндодонтический журнал 40, 374–85.
- Ørstavik D (1983) Физические свойства герметиков для корневых каналов: измерение текучести, времени работы и прочности на сжатие. Международный эндодонтический журнал 16, 99–107.
- Ørstavik D (2005) Материалы, используемые для пломбирования корневых каналов: техническое, биологическое и клиническое тестирование. Темы эндодонтии 12, 25–38.
- Ørstavik D, Nordahl I, Tibballs JE (2001) Изменение размеров после затвердевания материалов герметиков для корневых каналов. Стоматологические материалы 17, 512–9.
- Phillips RW, Skinner EW (1991) Наука о стоматологических материалах Скиннера, 9-е изд. Филадельфия: Saunders.
- Rasimick BJ, Shah RP, Musikant BL, Deutsch AS (2007) Радиopacity эндодонтических материалов на пленке и цифровом сенсоре. Журнал эндодонтии 33, 1098–101.
- Resende LM, Rached-Junior FJ, Versiani MA и др. (2009) Сравнительное исследование физико-химических свойств герметиков для корневых каналов AH Plus, Epiphany и Epiphany SE. Международный эндодонтический журнал 42, 785–93.
- Roggendorf MJ, Legner M, Ebert J, Fillery E, Frankenberger R, Friedman S (2010) Оценка остаточного материала в каналах, заполненных Activ GP или GuttaFlow после удаления с помощью инструментов NiTi. Международный эндодонтический журнал 43, 200–9.
- Schäfer E, Zandbiglari T (2003) Растворимость герметиков для корневых каналов в воде и искусственной слюне. Международный эндодонтический журнал 36, 660–9.
- Tagger M, Katz A (2003) Радиopacity эндодонтических герметиков: разработка нового метода для прямого измерения. Журнал эндодонтии 29, 751–5.
- Tanomaru-Filho M, Jorge EG, Guerreiro Tanomaru JM, Goncalves M (2007) Оценка радиopacity новых материалов для заполнения корневых каналов с помощью цифровизации изображений. Журнал эндодонтии 33, 249–51.
- Tanomaru-Filho M, Jorge EG, Tanomaru JM, Goncalves M (2008) Оценка радиopacity герметиков для корневых каналов на основе гидроксида кальция и стеклоиономера. Международный эндодонтический журнал 41, 50–3.
- Tas¸demir T, Yesilyurt C, Yildirim T, Er K (2008) Оценка радиopacity новых паст/герметиков для корневых каналов с помощью цифровой радиографии. Журнал эндодонтии 34, 1388–90.
- Versiani MA, Carvalho-Junior JR, Padilha MI, Lacey S, Pascon EA, Sousa-Neto MD (2006) Сравнительное исследование физико-химических свойств герметиков AH Plus и Epiphany. Международный эндодонтический журнал 39, 464–71.
- Wilson AD, McLean JW (1988) Стекло-иономерный цемент. Чикаго: Издательство Quintessence.

/social-network-service/media/default/6758/89a8282e.png)